2. 中国工业防腐蚀技术协会海洋防腐防污专业委员会, 山东青岛 266071;
3. 山东科技大学化学与环境工程学院, 山东青岛 266590;
4. 青岛海洋科学与技术国家实验室, 山东青岛 266237;
5. 青岛东启机械设备有限公司, 山东青岛 266071
2. Marine Anticorrosion and Antifouling Society's Division of CIATA, Qingdao, Shandong, 266071, China;
3. College of Chemistry & Environmental Engineering, Shandong University of Science & Technology, Qingdao, Shandong, 266590, China;
4. Qingdao National Laboratory for Marine Science and Technology, Qingdao, Shandong, 266237, China;
5. Qingdao Tony Machinery and Equipment Co., Ltd, Qingdao, Shandong, 266071, China
海洋污损细菌系海洋污损生物群落食物链的基础,也是海洋腐蚀初期阶段的参与者[1],是构成港湾生态系统的重要组成部分。青岛港湾位居胶州湾东部,有人造的防波堤使其成为优良的避风港,因而港内的海水流动、交换较外海困难,港内海洋环境受人为因素影响较大,具有特殊的生态系统[2]。胶州湾地处温带,通常从12月到次年的3月海水温度均在10℃以下,最低温度可达1.7℃[2],大型污损生物均停止繁殖,只有细菌与微型污损生物繁衍,因而可形成较完整的微型生物膜,是研究微型生物膜的最好季节。20世纪中叶我国在胶州湾开展对防污涂料和不同金属材料污损细菌的基本定性研究[3-4]。随着科学技术的发展,21世纪我国开始系统地研究海洋污损微生物[5-8],而探究海洋污损微生物的附着过程及影响因素,对于深入研究生物污损、从根本上解决海洋生物污损问题、制定绿色防污措施具有重要的现实意义,也是海洋防腐防污的需要,世界各国对此项研究十分活跃[9-10]。目前,一些纯培养技术以及分子生物学技术,比如分离培养法、PCR-DGGE技术、荧光原位杂交(FISH)和16s rDNA扩增子测序技术,已经被广泛应用于海洋环境细菌多样性研究中。但是,纯培养技术中的分离培养基具有很强的选择作用,获得的海洋微生物物种数量仅占总数量的1%~5%,仅能获得极少数微生物的信息,不能充分反映海洋微生物的生态功能[11-12]。利用细菌系统分类中最常用的分子标记16s rDNA序列直接进行高通量扩增测序,不需要分离培养细菌,直接在分子层面分析特定环境中细菌的群体构成和多样性[13-14]。目前已经广泛应用于微型浮游生物尤其是超微型浮游生物的分析,并借此发现一些特定新型种群,如原绿球藻和最小的超微真核藻Ostreococcus等[15-18]。本试验使用常规海港挂片法对玻璃板进行处理,同时采用传统稀释涂布法、流式细胞仪计数法以及16s rDNA扩增子高通量测序3种方法对青岛中港的冬季微型生物膜中细菌群落进行初步的研究。通过揭示微型生物膜中的细菌群落特征,为污损生物学和海洋腐蚀学的微观研究提供参考和启示。
1 材料与方法 1.1 海港试验 1.1.1 材料试架:取玻璃片(2.5 cm×7.5 cm),清洗,除油,装架,然后备用。取样管:50 mL灭菌的离心管,内装有20 mL的灭菌海水。
1.1.2 试架投放与取样2017年12月16日将装有玻璃片的两个试架固定在尼龙绳上,绳子一端有金属链作重锤,沉入海底,使两个试架分别浸入表层海水1.0 m和海水底层。
2018年3月16日,将浸入海水的表层、底层玻璃片分别取出,放入盛有消毒过滤海水50 mL的离心管中,快速带回实验室进行分析。
1.2 室内试验 1.2.1 材料(1) 培养基:2216E培养基(5.0 g/L蛋白胨、1.0 g/L酵母粉,海水配制,pH值7.6~7.8,固体培养基含1.5%~2.0%琼脂),121℃灭菌20 min。
(2) 10 mmol/L磷酸缓冲盐溶液(PBS)缓冲液(pH值为7.2~7.5):取20 × PBS缓冲液干粉(索莱宝,中国),用2.0 L的ddH2O充分溶解稀释至10 mmol/L,121℃灭菌20 min,备用。
(3) 染料配制:取0.04 g的碘化丙啶(PI)染料(索莱宝,中国),用2.0 mL的二甲基亚砜溶液稀释至20 μg/mL;取0.04 g的核酸凝胶染液(SYBR Green Ⅰ)染料(索莱宝,中国),用2.0 mL的二甲基亚砜溶液稀释至20 μg/mL。
(4) 主要仪器:荧光计数微球绝对计数管(BD Trucount Absolute Count Tubes,美国BD公司),FACSAria Ⅱ流式细胞仪(美国BD公司)。
1.2.2 海水层细菌浓度的流式细胞仪检测分别取表层和底层海水的样品1 mL,然后分别加入10 μL的PI和SYBR Green Ⅰ染料,用移液器混合均匀,28℃下避光染色30 min。用100目的筛绢将菌液过滤后加入到荧光计数微球流式管中,在冰上充分混匀。流式细胞仪光源为气冷氩离子激光,具体使用方法请参照仪器使用说明。
用流式细胞仪方法计算不同海水层中的细菌浓度的方法如下:
海水中细菌浓度=实际加入微球数量×门中细菌数量/门中微球数量
1.2.3 玻璃板中细菌分离培养和浓度检测采用稀释涂布培养法对不同海水层中玻璃板的细菌进行分离计数,用涡旋振荡器将所装有玻璃片的离心管震荡均匀制备成菌悬液,用2216E液体培养基对菌悬液进行梯度稀释,分别制成10-3,10-4和10-5共3个梯度的菌悬液。每个梯度吸取100 μL悬液滴在2216E固体培养基上,用涂布棒涂匀,置于28℃培养箱培养3 d。观察并计算不同海水层中玻璃板中细菌菌落数及细菌浓度。
1.2.4 不同样品中细菌种类和丰度分析通过分离培养和16s rDNA测序来分析不同样品中细菌种类,将不同样品中的细菌进行分离后,挑取单菌落接种至2216E固体培养基,然后对这些菌落进行富集培养,用离心机12 000 r/min离心2 min后,去掉上清液。取剩余的菌体,利用TIANGEN细菌基因组提取试剂盒的方法提取目标细菌的DNA,根据16s rDNA通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′)对相关细菌的16s rDNA进行PCR扩增,PCR扩增条件:94℃预变性5 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min 30 s,共25个循环;延伸10 min。将PCR扩增产物进行琼脂糖凝胶电泳检测并测序。用NCBI blast对测序结果进行比对,鉴定菌种种属。
采用16s rDNA扩增子高通量测序的方法进一步分析不同海水层中海水和玻璃板细菌的种类和丰度。从获得的表层和底层海水(见1.1.2节)中量取100 mL,使用0.22 μm孔径的无菌滤膜进行过滤,然后将滤膜放入50 mL无菌的离心管中,备用。按照1.2.2节的方法处理玻璃板样品,然后分别取表层和底层载玻片样品30 mL,转移至50 mL无菌的离心管中,和无菌滤膜一起送至北京诺禾致源公司进行16s rDNA扩增子测序。
2 结果与分析 2.1 样品中细菌浓度分析首先利用流式细胞仪分析表层海水和底层海水中细菌的浓度(图 1),图 1中绿色的点分别表示为表层和底层海水细菌。经过计算后发现,表层海水细菌的浓度为3.0×108 CFU/L,底层海水中细菌的浓度为6.9×107 CFU/L。可以看到底层海水的细菌数量明显低于表层海水。利用稀释涂布培养法发现表层玻璃板微型生物膜中的细菌浓度为7.2×107 CFU/L,底层玻璃板微型生物膜中的细菌浓度为2.1×107 CFU/L,该结果表明底层玻璃板微型生物膜中的细菌浓度也明显低于表层。
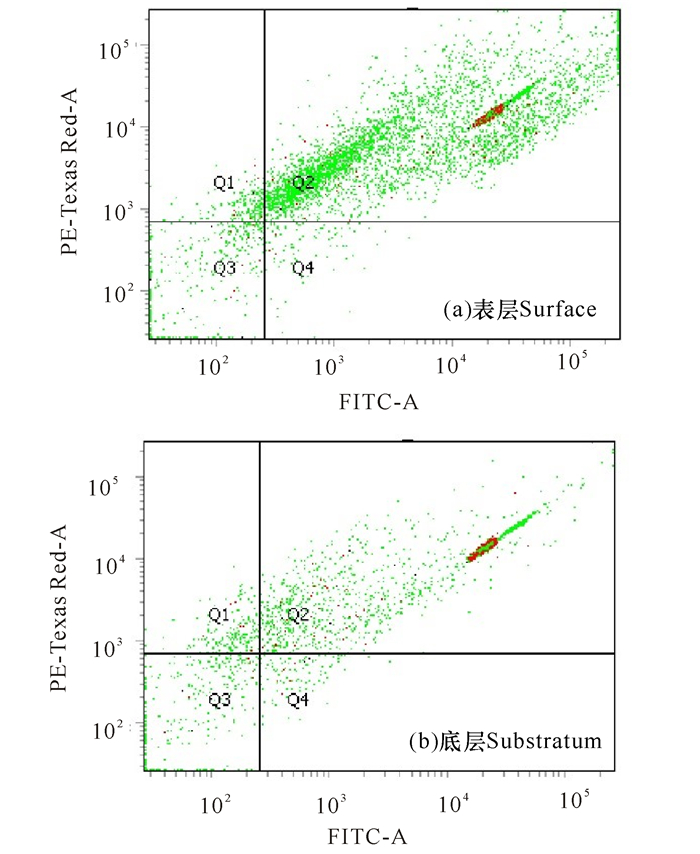
|
| 图 1 表层和底层海水细菌菌悬液的检测流式细胞散点图 Fig.1 Flow cell scatterplot of bacterial suspensions in surface and substratum seawater |
2.2 样品中细菌16s rDNA多样性分析
利用分离培养的方法分别对海水表层和底层海水进行分析后,发现表层海水的细菌主要属于革兰氏阴性菌中的交替假单胞菌属(Pseudoalteromonas),弧菌属(Vibrio),交替单胞菌属(Alteromonas)以及革兰氏阳性菌中的芽孢杆菌属(Bacillus)。而底层海水的细菌主要是革兰氏阴性菌中的交替假单胞菌属(Pseudoalteromonas),弧菌属(Vibrio)和革兰氏阳性菌中的芽孢杆菌属(Bacillus)。
同样利用分离培养的方法发现表层玻璃板微型生物膜中的细菌主要种类为革兰氏阴性菌中的交替假单胞菌属(Pseudoalteromonas)和海单胞菌属(Marinomonas)。底层玻璃板微型生物膜中的细菌主要为革兰氏阴性菌中的河豚毒素交替假单胞菌属(Pseudoalteromonas)和交替单胞菌属(Alteromonas)。值得注意的是,在表层和底层的玻璃板中均未发现革兰氏阳性菌。
2.3 16s rDNA扩增子测序分析不同样品细菌种类和丰度如图 2所示,对表层、底层海水以及表层、底层玻璃板微型生物膜中的细菌进行16s rDNA扩增子高通量测序分析后发现,微型生物膜中细菌的组成主要包括:软壁菌门(Tenericutes)、螺旋体门(Spirochaetes)、Gracilibacteria、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)。其中大多数的细菌属于革兰氏阴性菌,这与之前所报道的情况类似[1]。
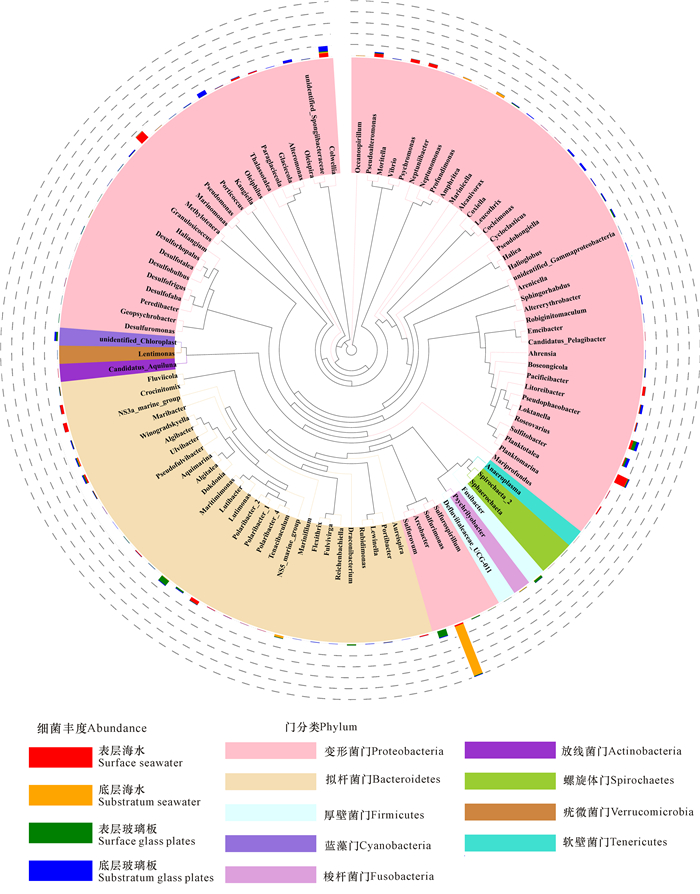
|
| 图 2 4种样品中细菌的种类分析 Fig.2 Species analysis of bacteria from four samples |
对不同样品的细菌种类分析可以发现,海水和玻璃板中细菌的种类具有比较高的相似性。而进一步分析不同样品中细菌的相对丰度发现,变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)的细菌在4种不同样品中细菌的所占比例最高,均超过细菌丰度的80%,特别是在表层海水中所占比例最高,超过95%(图 3)。说明在不同水层和玻璃板中,Proteobacteria和Bacteroidetes占据海洋细菌的大多数。相比于海水,玻璃板微型生物膜中的Bacteroidetes的比例明显减少,说明部分Bacteroidetes类细菌并不适合附着于玻璃板。
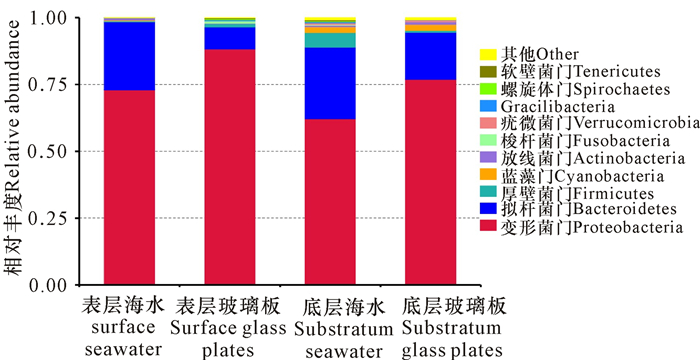
|
| 图 3 4种样品中不同细菌种类的相对丰度 Fig.3 Relative abundance of different bacterial species from four samples |
3 讨论
本实验中我们首先利用流式细胞仪对冬季青岛中港实验站中表层和底层海水中的细菌进行计数,其中细菌的浓度分别为3.0×108 CFU/L和6.9×107 CFU/L。采用稀释涂布培养法计数后发现,表层和底层玻璃板微型生物膜中的细菌浓度分别为7.2×107 CFU/L和2.1×107 CFU/L。而在2006年对青岛海域的细菌数量调查显示冬季细菌总菌数量为9.76×108~9.60×109 CFU/L[19],说明不同年份中细菌的数量有一定的差别。但是与该研究一致的是底层海水的细菌数量都明显低于表层海水,表明冬季表层海水更有利于细菌的繁殖,而且水的深度与细菌在海水中垂直分布有一定的关系。通常影响海洋异养浮游细菌数量的主要因素为生物因素和其他非生物性环境因素[20]。据报道,胶州湾冬季异养浮游细菌的水平分布与水温变化无明显关系,与近岸海域营养物质的外来输入使水体有机物浓度增高有关,其中营养盐可能是影响胶州湾异养浮游细菌水平分布的重要因素之一[21]。本实验也发现冬季海水浮游细菌数量的垂直分布和水温变化无明显关系,但是否与水体有机物浓度,特别是营养盐的分布有关,目前还需要进一步验证。
通过对不同样品进行16s rDNA扩增子高通量分析后发现,4种样品中细菌的主要包括Actinobacteri、Cyanobacteri、Firmicutes、Bacteroidetes和Proteobacteria等。于洋等[22]利用高通量测序对2011年11月份烟台海域中微生物膜污损细菌的结构进行分析,发现所含细菌有交替假交单胞菌(Pseudoalteromonas)、芽孢杆菌(Bacillus)、盐单胞菌(Halomonas)、嗜冷杆菌(Psychrobacter)、肠杆菌(Enterobacter)等,其中芽孢杆菌和交替假交单胞菌分别占67.9%和20.8%,为生物膜中的优势菌。而本实验中Proteobacteria和Bacteroidetes细菌相对丰度和种类在不同样品中占据80%以上。白洁等[21]研究发现冬季青岛海域站位海水沉积物样品的绝大部分细菌属于Proteobacteria,笔者[7]在三亚环境实验站发现污损细菌群落中主要的污损细菌为Alteromonas、Pseudomonas和Pseudoalteromonas,而这3种都是属于Proteobacteria。以上结果说明在不同海域中,微生物膜污损细菌的群落中Proteobacteria是主要的污损细菌之一。但是除Proteobacteria以外,其他菌属的细菌在污损细菌中所占的比例因为海域的不同而具有一定的差异。
4 结论本实验中使用稀释涂布培养法、流式细胞仪检测法和16s rDNA扩增子高通量测序3种方法较为全面地对微型生物膜中细菌群落进行分析。实验结果表明冬季表层海水中细菌的浓度为3.0×108 CFU/L,底层海水中细菌的浓度为6.9×107 CFU/L,可以看到底层海水的细菌数量明显低于表层海水。此外,表层和底层玻璃板微型生物膜中的细菌浓度分别为7.2×107 CFU/L和2.1×107 CFU/L,说明底层玻璃板微型生物膜中的细菌数量也明显低于表层。16s rDNA扩增子高通量测序发现在不同水层和玻璃板微型生物膜中Proteobacteria和Bacteroidetes占据污损细菌的大多数,而且海水和玻璃板微型细胞膜中细菌无论在种类还是相对丰度均具有比较高的相似性。该结果为今后微型生物膜中的细菌群落结构分析提供新的方法和实验思路,同时从微观角度为污损生物学和海洋腐蚀学的研究提供参考资料和启发。
| [1] |
马士德, 李伟华, 孙虎元, 等. 海洋腐蚀的生物控制[J]. 全面腐蚀控制, 2006, 20(3): 5-7, 10. DOI:10.3969/j.issn.1008-7818.2006.03.002 |
| [2] |
孙松, 孙晓霞. 海湾生态系统的理论与实践——以胶州湾为例[M]. 北京: 科学出版社, 2015.
|
| [3] |
王秋, 黄美君, 芦澄清, 等. 海洋微型污损性附着生物的初步研究[J]. 山东海洋学院学报, 1981, 11(1): 46-52. |
| [4] |
马士德.海洋微型生物与金属腐蚀的初步探讨[C]//1979年腐蚀与防护学术报告论文集.北京: 科学出版社, 1982: 376-380.
|
| [5] |
马士德, 李言涛, 谢肖勃, 等. 海洋细菌对钢铁的腐蚀[J]. 材料保护, 1995, 28(4): 23-24. |
| [6] |
陈永伟, 栾鑫, 段继周, 等. 青岛中港海水全浸初期不锈钢表面生物膜的细菌多样性分析[J]. 海洋与湖沼, 2014, 45(5): 1064-1070. |
| [7] |
马士德, 修鹏远, 马岩, 等. 三亚海洋环境试验站海洋细菌污损群落初探[J]. 中国涂料, 2017, 32(12): 54-58. |
| [8] |
焦念志. 海洋微型生物生态学[M]. 北京: 科学出版社, 2006.
|
| [9] |
苏艳.海洋生物附着过程与防污评价技术的研究[D].上海: 上海海洋大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000306.htm
|
| [10] |
尹衍升, 董丽华, 刘涛, 等. 海洋材料的微生物附着腐蚀[M]. 北京: 科学出版社, 2012.
|
| [11] |
AMANN R I, LUDWIG W, SCHLEIFER K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(1): 143-169. |
| [12] |
薛超波, 王国良, 金珊, 等. 海洋微生物多样性研究进展[J]. 海洋科学进展, 2004, 22(3): 377-384. DOI:10.3969/j.issn.1671-6647.2004.03.018 |
| [13] |
DESANTIS T Z, BRODIE E L, MOBERG J P, et al. High-density universal 16S rRNA microarray analysis reveals broader diversity than typical clone library when sampling the environment[J]. Microbial Ecology, 2007, 53(3): 371-383. DOI:10.1007/s00248-006-9134-9 |
| [14] |
HAAS B J, GEVERS D, EARL A M, et al. Chimeric 16S rRNA sequence formation and detection in Sanger and 454-pyrosequenced PCR amplicons[J]. Genome Research, 2011, 21(3): 494-504. DOI:10.1101/gr.112730.110 |
| [15] |
OLSON R J, VAULOT D, CHISHOLM S W, et al. Marine phytoplankton distributions measured using shipboard flow cytometry[J]. Deep Sea Research Part A.Oceanographic Research Papers, 1985, 32(10): 1273-1280. DOI:10.1016/0198-0149(85)90009-3 |
| [16] |
LEGENDRE L, COURTIES C, TROUSSELLIER M, et al. Flow cytometry in oceanography 1989—1999:Environmental challenges and research trends[J]. Cytometry, 2015, 44(3): 164-172. |
| [17] |
CHISHOLM S W, OLSON R J, ZETTLER E R, et al. A novel free-living prochlorophyte abundant in the oceanic euphotic zone[J]. Nature, 1988, 334(6180): 340-343. DOI:10.1038/334340a0 |
| [18] |
李胜男, 王秀娟, 周建, 等. 利用流式细胞仪计数微型浮游生物的方法[J]. 湖泊科学, 2015, 27(5): 757-766. |
| [19] |
王娜.山东青岛近岸海域浮游细菌的生态学研究[D].青岛: 中国海洋大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10423-2008176490.htm
|
| [20] |
白洁, 张昊飞, 李岿然, 等. 海洋异养浮游细菌生物量及生产力的制约因素[J]. 中国海洋大学学报, 2004, 34(4): 594-602. |
| [21] |
白洁, 张昊飞, 李岿然, 等. 胶州湾冬季异养细菌与营养盐分布特征及关系研究[J]. 海洋科学, 2004, 28(12): 31-34. DOI:10.3969/j.issn.1000-3096.2004.12.008 |
| [22] |
于洋, 王建华, 方圣涛, 等. 海洋污损细菌群落结构及其发酵液中化学成分的研究[J]. 海洋科学, 2014, 38(9): 27-32. |



