2. 河南师范大学生命科学学院, 河南新乡 453007;
3. 广西近海海洋环境科学重点实验室, 广西南宁 530007;
4. 广西民族大学海洋与生物技术学院, 广西南宁 530006;
5. 印度尼西亚亚齐大学, 班达亚齐 999006
2. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
3. Guangxi Key Laboratory of Marine Environmental Science, Nanning, Guangxi, 530007, China;
4. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530006, China;
5. Department of Aquaculture, Syiah Kuala University, Banda Aceh, 999006, Indonesia
我国是水产养殖大国,卵形鲳鲹(Trachinotus ovatus)是主要养殖品种之一,由于其肉质鲜美营养价值高深受人们喜爱。然而,随着城市化、工业化、养殖规模化进程的加快,水产养殖环境日益恶化,各种病害频繁爆发[1],不仅病害的种类日渐增多,发病时间也从以往的春夏、夏秋等季节交替之时,发展成全年不间断的爆发式发病,水产病害问题已严重威胁着华南地区水产养殖业的健康可持续发展[1-2]。溶藻弧菌(Vibrio alginolyticus)作为华南沿海地区海水养殖鱼类细菌性鱼病的主要致病菌之一,其导致的鱼病具有发病迅速、死亡率高、流行面广等特点,严重威胁着华南地区水产养殖业的健康可持续发展。弧菌病的防治一直是鱼病学研究的重点[3]。水产养殖过程中,使用抗生素等化学药物进行泼洒或者饲料拌喂是治疗细菌病的主要手段,但是抗生素的滥用加剧了耐药菌株的产生,导致生态环境不断恶化,还造成了水产品中有害药物残留等重大食品安全问题[4-6]。与抗生素等化学药物相比,中草药具有绿色低毒、无残留和不易产生耐药性等优点,而且中草药的抗菌、抗病毒、驱虫、提高动物免疫力和促进生长等作用也已被现代科学所证实[1, 7-8]。深入开展中草药在鱼病防治中的研究,是解决水产养殖中抗生素滥用所造成的耐药性和药物残留问题的关键,是实现水产养殖业绿色环保、高效生态的重要发展方向。已有的研究成果证实,中草药利用其特有的多糖、甙类、醇类、萜类、有机酸及生物碱等有效活性成分发挥抗病害的功能,具体的作用方式包括:(1)破坏细菌的细胞壁、细胞膜的完整性引起细菌内容物的释放,最终导致细菌裂解死亡;(2)干扰病原微生物的蛋白质或遗传物质的合成,影响其正常的生理代谢;(3)提高水产养殖动物的免疫相关酶活力,激活其自身免疫防御机制,以抵抗病原微生物的入侵。利用前期在广西大宗海水养殖鱼类卵形鲳鲹中分离得到的致病性溶藻弧菌为研究对象,在借鉴传统中草药理论研究和实践的基础上,选取具有抗菌消炎作用的黄连(Coptis chinensis Franch)[9-12],测定黄连对广西卵形鲳鲹源溶藻弧菌的抑制作用,并对黄连抑制溶藻弧菌的抗菌作用机制进行研究。通过对黄连的抗菌作用进行系统研究,为探究由溶藻弧菌引起的爆发性细菌性鱼病的高效防治提供科学的用药依据。
1 材料与方法 1.1 材料本研究所用的黄连购自广西南宁一心大药房(北京同仁堂生产);溶藻弧菌分离自广西钦州湾网箱养殖的发病卵形鲳鲹,编号为TOQZ01,保存于本实验室-80℃超低温冰箱;LB培养基和琼脂平板等购自广州环凯微生物有限公司;BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司;生化培养箱购自上海博迅实业有限公司,超净工作台为AIRTECH。
1.2 方法 1.2.1 溶藻弧菌菌液制备将保存的溶藻弧菌划线接种于琼脂平板,置于28℃培养24 h后,挑取单菌落接入LB培养基中振荡培养6 h,采用平板计数法计数,将菌液稀释至1×106 CFU/mL,置于4℃冰箱中保存备用。
1.2.2 溶藻弧菌菌液浓度与OD值回归方程的计算将溶藻弧菌菌液接种于1 mL LB培养基中,28℃摇床震荡培养12 h后,用500 μL灭菌生理盐水5 000 g 10 min离心清洗2次,然后将其混匀于1 mL灭菌生理盐水。细菌悬液稀释以后,以平板法培养计数。细菌悬液进行梯度稀释,以灭菌生理盐水作为对照,用分光光度计分别测定600 nm处波长,计算回归方程[13]。
1.2.3 黄连水提物的制备将黄连在电热鼓风干燥箱中60℃烘干至恒重,然后将其粉碎并用100目筛过滤。称取50 g黄连置于超纯水中4℃浸泡过夜,文火煎煮浓缩后用4层灭菌纱布过滤药液,然后将黄连煎煮至生药含量为500 mg/mL,4℃冰箱中避光保存备用。
1.2.4 最低抑菌浓度、最低杀菌浓度和半数致死量的测定采用二倍稀释法测定黄连水提物对溶藻弧菌的最低抑菌浓度(Minimum inhibitory concentration, MIC)、最低杀菌浓度(Minimum bactericidal concentration, MBC)和半数致死量(Median lethal dose, LD50)。黄连煎煮水提物的浓度为500 mg/mL,然后采用二倍稀释法将其在LB培养基中稀释至500.000 mg/mL、250.000 mg/mL、125.000 mg/mL、62.500 mg/mL、31.250 mg/mL、15.625 mg/mL、7.800 mg/mL、3.900 mg/mL共8个浓度梯度。分别将10 μL溶藻弧菌菌液接入8个浓度梯度的黄连药液中,溶藻弧菌菌液接入LB培养基中作为对照组(Con),然后28℃摇床震荡培养24 h。用500 μL灭菌生理盐水5 000 g 10 min离心清洗2次后,混匀于200 μL灭菌生理盐水,以灭菌生理盐水作为对照,用分光光度计分别测定600 nm处波长OD值(OD600),确定黄连水提物对溶藻弧菌的抑制率,其计算公式:抑制率=[1-(OD实验组-OD空白组)/(OD对照组-OD空白组)]×100%。无菌生长的最高稀释管对应的药液浓度即为黄连水提物对广西卵形鲳鲹源溶藻弧菌的MBC值,并吸取该管及上一浓度梯度管的培养液0.1 mL,涂布于琼脂平板上,28℃培养24 h,无菌落形成则证明MBC值无误。每个实验重复3次。
1.2.5 细菌内可溶性蛋白含量测定将溶藻弧菌菌液(OD600=1.2)离心移除上清液后,接入1 mL含有黄连煎煮水提物的LB培养基中,4℃孵育2 h,收集细菌作为实验组1(T1),溶藻弧菌菌液接入相应量的LB培养基作为对照组(Con)。然后在28℃摇床中震荡培养。分别在4 h、8 h、10 h收集细菌,用500 μL灭菌PBS 5 000 g 10 min离心清洗2次后,混匀于灭菌PBS中超声破碎,然后4℃ 5 000 g 10 min离心后收集上清液,使用BCA蛋白浓度测定试剂盒测定上清液中可溶性蛋白含量。每个实验重复3次。
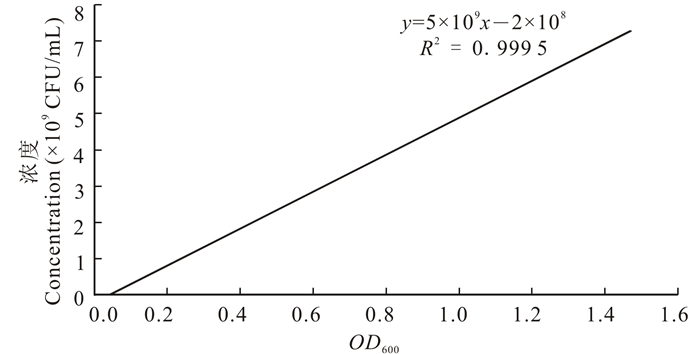
2 结果与分析 2.1 溶藻弧菌菌液浓度与OD值的回归方程如图 1所示,溶藻弧菌菌液浓度和菌液的OD值之间具有较好的线性关系,其回归方程为y= 5×109x-2×108,R2=0.999 5,说明细菌数与OD600之间存在着很好的线性关系。
|
| 图 1 溶藻弧菌细菌浓度和菌液OD值的回归方程 Fig.1 The regression equation of bacteria concentration and OD value of V.alginolyticus |
2.2 黄连水提物对溶藻弧菌的MIC、MBC和LD50的测定
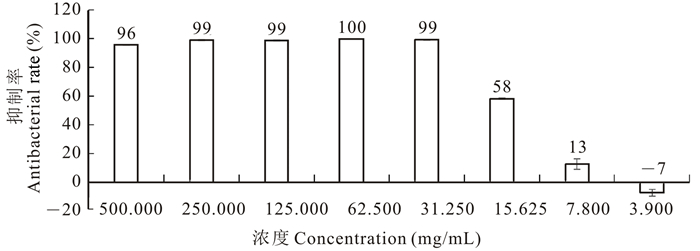
黄连水提物对溶藻弧菌的抑制结果如图 2所示,黄连水提物对溶藻弧菌具有明显的抑制作用,当浓度高于7.800 mg/mL,黄连水提物对溶藻弧菌抑制效率有显著性的差异,当浓度高于31.250 mg/mL时,黄连水提物对溶藻弧菌抑制效率可达到95%以上,当浓度为15.625 mg/mL时,抑菌浓度大于50%,即达到了半致死浓度。其对溶藻弧菌的MIC、MBC和LD50的值分别为7.800 mg/mL、31.250 mg/mL和15.625 mg/mL。
|
| 图 2 黄连水提物对溶藻弧菌的抑制率 Fig.2 The antibacterial effects of C.chinensis water extracts on V.alginolyticus |
2.3 黄连水提物对溶藻弧菌的抑制作用机制
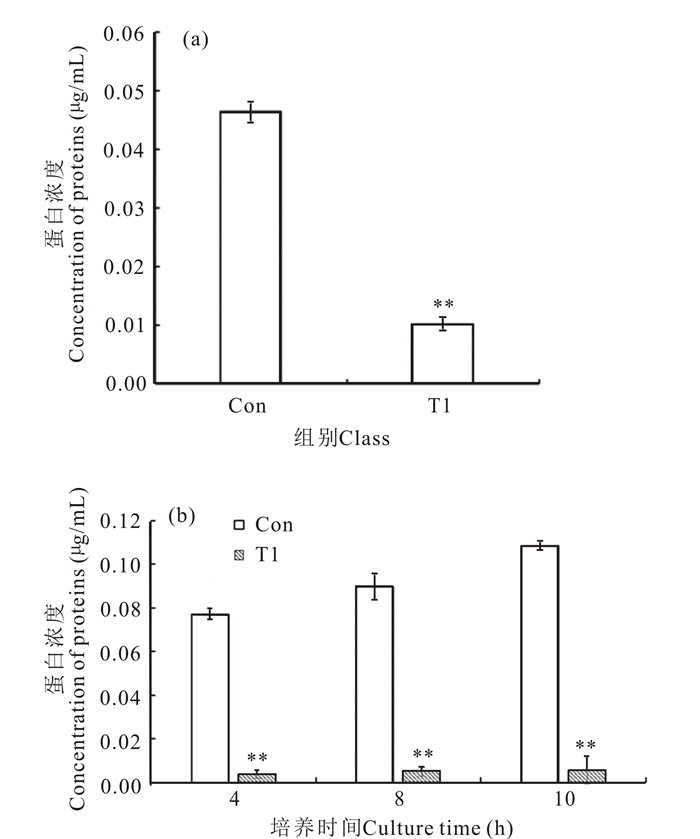
如图 3a所示,溶藻弧菌与黄连煎煮水提物在4℃孵育2 h后,与对照组相比,上清液中可溶性蛋白含量显著降低。如图 3b所示,溶藻弧菌与黄连煎煮水提物在28℃摇床中震荡培养8 h后,对照组细菌的可溶性蛋白随时间的延长含量逐步升高,而实验组细菌的可溶性蛋白浓度在各个时间点均处于较低水平且无明显变化,但各个时间点的可溶性蛋白浓度与对照组之间出现了极显著的降低。说明黄连水提物可能通过损伤细菌的细胞壁导致细菌内容物释放,引起菌体的裂解死亡。
|
| 图 3 黄连水提物对溶藻弧菌的抑制作用机制 Fig.3 The antibacterial mechanisms of C.chinensis water extracts against V.alginolyticus |
3 讨论
本研究选取传统中医理论中具有抗菌消炎作用的黄连作为研究对象,首先研究其对广西卵形鲳鲹源溶藻弧菌的抑制作用,研究结果显示黄连水提物对溶藻弧菌具有明显的抑制作用,其对溶藻弧菌的MIC、MBC和LD50的值分别为7.800 mg/mL,31.250 mg/mL和15.625 mg/mL(图 2),也就是说当黄连水提物浓度高于31.25 mg/mL时,可以完全抑制溶藻弧菌的生长。该结果表明,黄连水提物在浓度较低时对细菌的生长就有良好的抑制作用,所以黄连具有发展成为高效抗病害中草药制剂的潜力。由于菌体内可溶性蛋白主要是参与各种代谢的酶类,其含量可指示细菌体内代谢情况的变化[14],因此通过分析菌体内可溶性蛋白的含量,对黄连水提物抑制溶藻弧菌的抗菌作用机制进行了初步研究。研究结果表明,将黄连水提物与溶藻弧菌在4℃孵育2 h后超声破碎提取上清,与未进行药物处理的对照组细菌相比,药物处理组的细菌上清液中可溶性蛋白含量显著降低(图 3a)。处理温度为4℃时,细菌的细胞活动基本停止,代谢相关的蛋白合成基本停止,说明黄连可能通过损伤细菌的细胞壁,导致细菌内容物释放而使菌体裂解死亡。如图 3b所示,将溶藻弧菌与黄连煎煮水提物在28℃摇床中震荡培养,分别在4 h、6 h、8 h收集细菌并进行离心清洗和超声破碎,然后测定试剂盒测定上清液中可溶性蛋白含量,结果显示无药物处理的对照组细菌的可溶性蛋白含量逐渐升高,而黄连孵育处理的实验组细菌的可溶性蛋白含量始终处于较低水平且无明显变化,说明黄连不仅具有高效的抑制溶藻弧菌的效力,而且药效稳定作用时间长(图 3b)。综上结果表明,黄连具有发展成为一种高效抗水产病害中草药制剂的能力。未来我们将进一步系统开展黄连在鱼活体水平的抗菌保护效力和提高鱼体免疫力的研究。基于中草药着力开展绿色无药物残留的新型抗病害中药制剂的研究,对于促进水产养殖业持续健康发展,确保水产品质量和食品安全意义重大[15-16]。
4 结论本文首次系统研究并证实了黄连对广西卵形鲳鲹源溶藻弧菌的抑制作用,并对其抑制溶藻弧菌的抗菌作用机制进行研究。本研究采用二倍稀释法测定黄连水提物对溶藻弧菌的最低抑菌浓度(MIC)、最低杀菌浓度(MBC)和半数致死量(LD50),结果分别为7.800 mg/mL、31.250 mg/mL和15.625 mg/mL。将黄连水提物与细菌共同孵育时,发现随着时间的推移细菌胞内可溶性蛋白明显下降,表明黄连发挥抑菌作用的机制可能是通过损伤细菌的细胞壁导致细菌内容物释放并引起菌体的裂解死亡。所以黄连有望发展成为一种高效抗水产病害中草药制剂。
| [1] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [2] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |
| [3] |
余庆, 李菲, 王一兵, 等. 广西北部湾大宗海水养殖鱼类卵形鲳鲹感染溶藻弧菌及其致病性研究[J]. 广西科学, 2018, 25(1): 68-73. |
| [4] |
陈昌福. 我国水产养殖动物病害防治研究的主要成就与当前存在的问题[J]. 饲料工业, 2007, 28(10): 1-3. |
| [5] |
PARK Y H, HWANG S Y, HONG M K, et al. Use of antimicrobial agents in aquaculture[J]. Revue Scientifique et Technique, 2012, 31(1): 189-197. DOI:10.20506/rst.issue.31.1.49 |
| [6] |
HAI N V. The use of probiotics in aquaculture[J]. Journal of Applied Microbiology, 2015, 119(4): 917-935. DOI:10.1111/jam.12886 |
| [7] |
CARBONE D, FAGGIO C. Importance of prebiotics in aquaculture as immunostimulants.Effects on immune system of Sparus aurata and Dicentrarchus labrax[J]. Fish & Shellfish Immunology, 2016, 54: 172-178. DOI:10.1016/j.fsi.2016.04.011 |
| [8] |
SONG S K, BECK B R, KIM D, et al. Prebiotics as immunostimulants in aquaculture:A review[J]. Fish & Shellfish Immunology, 2014, 40(1): 40-48. |
| [9] |
李鑫.黄连、姜黄连抗菌谱及其物质基础比较研究[D].武汉: 湖北中医药大学, 2015.
|
| [10] |
王维, 李丹, 刘洋, 等. 黄连解毒汤的体外抑菌试验及拆方研究[J]. 动物医学进展, 2016, 37(11): 65-69. DOI:10.3969/j.issn.1007-5038.2016.11.014 |
| [11] |
王凯, 于永翔, 张正, 等. 黄连素对海水病原菌的杀灭效果及药效稳定性[J]. 水产科学, 2019, 38(1): 67-72. |
| [12] |
张文青, 龚一富, 金思, 等. 中草药及其配伍对嗜水气单胞菌的抑菌作用[J]. 渔业科学进展, 2012, 33(1): 114-121. DOI:10.3969/j.issn.1000-7075.2012.01.017 |
| [13] |
蒋启欢, 叶应旺, 胡王, 等. 草鱼嗜水气单胞菌L1灭活疫苗培养条件的优化[J]. 生物技术进展, 2012, 2(3): 206-211. DOI:10.3969/j.issn.2095-2341.2012.03.09 |
| [14] |
吴华彰, 费鸿君, 赵云利, 等. 萝卜硫素对大肠杆菌抑菌机制的研究[J]. 四川大学学报(医学版), 2012, 43(3): 386-390. |
| [15] |
YU Q, LIU M Z, SU H F, et al.Selection and characterization of ssDNA-aptamers specifically recognized pathogenic Vibrio alginolyticus[J].Journal of Fish Diseases, 2019.DOI: 10.1111/jfd.12985.[Epub ahead of print].
|
| [16] |
YU Q, LIU M Z, XIAO H H, et al.The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J].Journal of Fish Diseases, 2019.DOI: 10.1111/jfd.12987.[Epub ahead of print].
|



