2. 河南师范大学生命科学学院, 河南新乡 453007;
3. 广西近海海洋环境科学重点实验室, 广西南宁 530007;
4. 广西民族大学海洋与生物技术学院, 广西南宁 530006;
5. 印度尼西亚亚齐大学, 班达亚齐 999006
2. College of Life Science, Henan Normal University, Xinxiang, Henan, 453007, China;
3. Guangxi Key Laboratory of Marine Environmental Science, Nanning, Guangxi, 530007, China;
4. School of Marine Sciences and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530006, China;
5. Department of Aquaculture, Syiah Kuala University, Banda Aceh, 999006, Indonesia
卵形鲳鲹(Trachinotus ovatus)属脊椎动物门,硬骨鱼纲,鲈形目,鲹科,鲳鲹属。卵形鲳鲹肉质细腻,营养丰富,是名贵的食用海水鱼类。在我国当前消费升级的背景下,近年来卵形鲳鲹的需求量急剧增加。目前我国卵形鲳鲹年产量约为8万吨,产业产值超过百亿元[1]。然而,在当前高密度、“粗放式”的近海网箱养殖条件和养殖模式下,近海养殖环境日趋恶化,条件致病微生物数量持续增加,养殖病害问题日益严峻,所导致的鱼病多达数十种,特别是卵形鲳鲹细菌病、白芝麻病和小瓜虫病等,对卵形鲳鲹的致死率高达80%以上,造成了巨大损失,严重威胁着我国卵形鲳鲹养殖业的健康可持续发展[2-3]。药物防治具有操作简单、经济高效的特点,是目前防治卵形鲳鲹养殖病害最主要的手段。但是以抗生素为主的化学药物的超量、滥用现象在我国卵形鲳鲹养殖业中极为普遍,已造成药残超标、病原耐药性增强以及近海生态环境持续恶化等严重后果[4-7]。因此应着力开展绿色无药残的新型抗病害药物的研究,以促进卵形鲳鲹养殖业持续健康发展,确保海产品质量和食品安全。广西莪术(Curcuma kwangsiensis S.G.Lee et C.F.Liang)为姜科姜黄属植物,是广西的道地大宗药材,常生于向阳、土壤湿润地带。近年的研究表明,广西莪术具有显著的抗肿瘤、抗病毒、抗菌消炎和抗血栓等生物活性。例如,广西莪术中的莪术油、姜黄素对多种恶性肿瘤细胞的生长具有良好的抑制作用,同时还具有保肝降酶、改善蛋白质合成的作用。与常用的化学药物相比,广西莪术作为传统壮药不仅具有显著的抗病害效果,而且具有无毒副残留,提高免疫力等诸多优点[8]。目前广西莪术对卵形鲳鲹免疫力影响的研究尚属空白。本研究利用前期自主建立的卵形鲳鲹肾脏组织细胞系(Trachinotus ovatus kidney cell line, TOK cell line)[9],在细胞水平研究广西莪术水提物的细胞毒性,以及对细胞相关酶,包括细胞酸性磷酸酶(Acid phosphatase, ACP)、超氧化物歧化酶(Superoxide dismutase, SOD)、总一氧化氮合酶(Total nitricoxide synthase, T-NOS)和溶菌酶(Lysozyme)活性的影响。本文的目的是研究广西莪术提取物对TOK细胞免疫力的影响,探究其作为免疫增强剂应用于卵形鲳鲹养殖的可能,以提高卵形鲳鲹的免疫力和抗病能力。
1 材料与方法 1.1 材料广西莪术购自广西南宁一心大药房(北京同仁堂生产),卵形鲳鲹肾脏组织细胞系(TOK cell line)保存于本实验室[9];0.45 μm滤柱购自Millipore;96孔细胞培养板购自Corning;生化培养箱购自上海博迅实业有限公司,生物安全柜为ESCO,观察细胞用的倒置光学显微镜为Nikon C2;Cell Counting Kit-8试剂盒(CCK-8)购自上海碧云天生物技术有限公司;溶菌酶活性测定试剂盒、超氧化物歧化酶(SOD)活性测定试剂盒、总一氧化氮合酶(T-NOS)活性测定试剂盒、酸性磷酸酶(ACP)检测试剂盒均购自南京建成生物工程研究所。
1.2 方法 1.2.1 广西莪术水提物的制备将广西莪术在电热鼓风干燥箱中60℃烘至恒重后粉碎,100目筛过滤后,用分析天平称取50 g加500 mL超纯水,4℃浸泡过夜,文火煎煮浓缩至生药含量为500 mg/mL,0.45 μm滤柱过滤后即获得莪术水提物,将其置于4℃冰箱中保存备用。
1.2.2 广西莪术水提物安全浓度的测定将TOK细胞接入96孔细胞培养板(4×104个细胞/孔),28℃培养细胞。然后将广西莪术水提物分别在L15培养基中稀释至25 mg/mL、5 mg/mL和1 mg/mL,分别接入到96孔板的细胞中。试验组共3组:试验组1(Test 1),广西莪术水提物的终浓度为25 mg/mL;试验组2(Test 2),广西莪术水提物的终浓度为5 mg/mL;试验组3(Test 3),广西莪术水提物的终浓度为1 mg/mL;对照组(Con)为细胞无处理。各组细胞继续培养24 h后在光学显微镜下观察。为了测定广西莪术水提物安全浓度,即广西莪术水提物对TOK细胞活性的影响,各孔中的细胞加入20 μL的CCK-8溶液继续在28℃培养4 h,然后用酶标仪检测450 nm处的吸光值(OD450),并计算细胞与各浓度广西莪术水提物孵育条件下的细胞存活率,计算公式:细胞存活率=(试验组OD450 /对照组OD450)×100%,实验分别重复3次。
1.2.3 酶活性测定将广西莪术水提物(5 mg/mL)与TOK细胞孵育后,用试剂盒分别在6 h、12 h和24 h检测TOK细胞的酶活性,包括一氧化氮合成酶(T-NOS)、酸性磷酸酶(ACP)、超氧化物歧化酶(SOD),每个实验重复3次。另外,在第6 h检测溶菌酶活性,实验重复3次。具体操作见试剂盒说明。
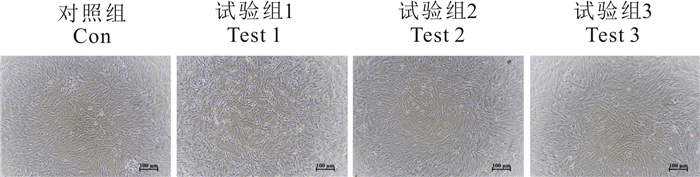
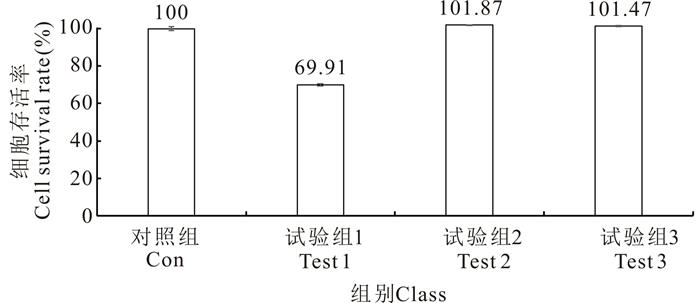
2 结果与分析 2.1 广西莪术水提物在细胞水平的安全浓度当广西莪术水提物的终浓度为25 mg/mL时,对TOK细胞具有明显的细胞毒性,具体表现为TOK细胞变圆皱缩,并且从细胞培养板的培养面上发生脱落(图 1)。细胞存活率的结果也证实,与对照组相比,25 mg/mL的广西莪术水提物处理后的TOK细胞存活率显著降低(图 2)。当广西莪术水提物的终浓度为5 mg/mL或1 mg/mL时,细胞生长状态正常,而且细胞存活率与对照组相比无明显差别(图 2)。
|
| 图 1 广西莪术水提物对TOK细胞系的细胞毒性 Fig.1 Cytotoxicity of Curcuma kwangsiensis water extracts on TOK cells |
|
| 图 2 不同浓度的广西莪术水提物对TOK细胞存活率的影响 Fig.2 Effects of different concentrations of Curcuma kwangsiensis water extracts on TOK cell survival rate |
2.2 广西莪术水提物对卵形鲳鲹细胞总一氧化氮合酶(T-NOS)活性的影响
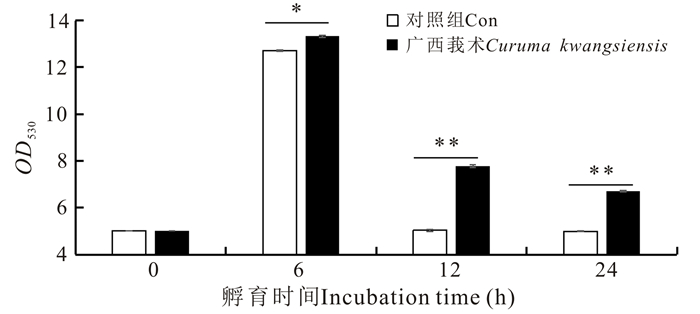
在各时间点,收集广西莪术水提物孵育后的TOK细胞,检测细胞总一氧化氮合酶活性,结果显示,与对照组细胞相比,广西莪术水提物对卵形鲳鲹TOK细胞的总一氧化氮合酶活性具有明显的促进作用,在6 h时达到最高,随后细胞的总一氧化氮合酶活性逐渐降低,但是广西莪术水提物处理组细胞的总一氧化氮合酶活性始终高于无药物处理的对照组细胞(图 3)。
|
| *表示差异显著(P < 0.05),**表示差异极显著(P < 0.01) *=statistically significant (P < 0.05), **=very statistically significant (P < 0.01) 图 3 广西莪术水提物对TOK细胞的总一氧化氮合酶活性的影响 Fig.3 Effects of Curcuma kwangsiensis water extracts on T-NOS in TOK cells |
2.3 广西莪术水提物对卵形鲳鲹细胞酸性磷酸酶(ACP)活性的影响
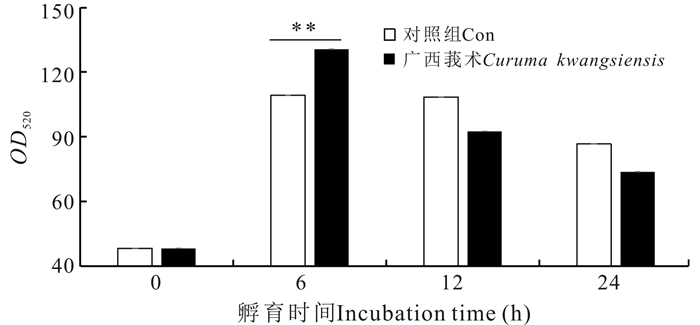
在各时间点,收集广西莪术水提物孵育TOK细胞后,检测TOK细胞酸性磷酸酶活性,结果显示,与对照组细胞相比,广西莪术水提物对卵形鲳鲹TOK细胞酸性磷酸酶活性在中药处理6 h之内具有明显的促进作用,随后细胞酸性磷酸酶活性逐渐降低,并且广西莪术水提物处理组细胞的磷酸酶活性比对照组降低速度更快(图 4)。
|
| **表示差异极显著(P < 0.01) **=very statistically significant (P < 0.01) 图 4 广西莪术水提物对TOK细胞的酸性磷酸酶活性的影响 Fig.4 Effects of Curcuma kwangsiensis water extracts on ACP in TOK cells |
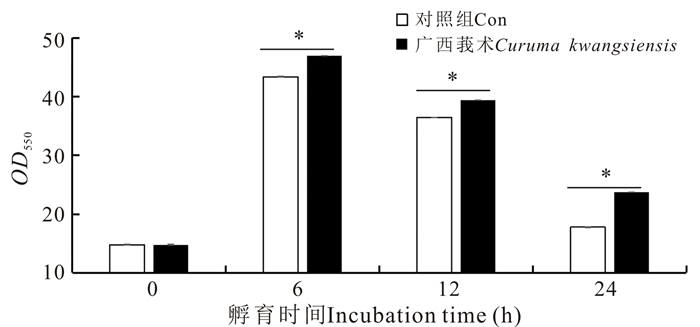
2.4 广西莪术水提物对卵形鲳鲹细胞超氧化物歧化酶(SOD)活性的影响
在各时间点,收集广西莪术水提物孵育后的TOK细胞,检测细胞超氧化物歧化酶活性的变化,结果显示,与对照组细胞相比,广西莪术水提物对卵形鲳鲹TOK细胞的超氧化物歧化酶活性具有明显的促进作用,在6 h时达到最高,随后细胞的超氧化物歧化酶活性逐渐降低,但是广西莪术处理组细胞的超氧化物歧化酶活性始终高于对照组细胞(图 5)。
|
| *表示差异显著(P < 0.05) **=statistically significant (P < 0.05) 图 5 广西莪术水提物对TOK细胞的超氧化物歧化酶活性的影响 Fig.5 Effects of Curcuma kwangsiensis water extracts on SOD in TOK cells |
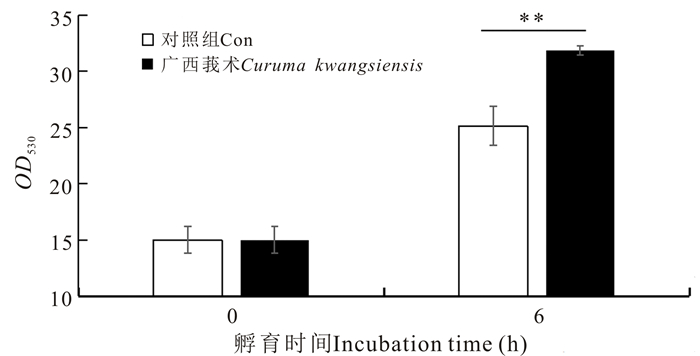
2.5 广西莪术水提物对卵形鲳鲹细胞溶菌酶活性的影响
在各时间点,收集广西莪术水提物孵育后的TOK细胞,检测细胞溶菌酶的活性,结果显示,与对照组细胞相比,广西莪术水提物对卵形鲳鲹TOK细胞的溶菌酶活性具有明显的促进作用(图 6)。
|
| **表示差异极显著(P < 0.01) **=very statistically significant(P < 0.01) 图 6 广西莪术水提物对TOK细胞溶菌酶活性的影响 Fig.6 Effects of Curcuma kwangsiensis water extracts on lysozyme in TOK cells |
3 讨论
广西莪术具有多种药理作用,目前在临床上得到了广泛应用[10]。广西莪术的主要药用成分是莪术油,其主要活性成分为莪术醇、β-榄香烯、莪术二酮、吉玛酮等。广西莪术中的莪术油、姜黄素对多种恶性肿瘤细胞的生长具有良好的抑制作用,例如广西莪术对鼻咽癌肿瘤细胞的抑制作用已在临床应用中获得证明[11]。广西莪术具有保肝降酶、改善蛋白质合成的作用,能够明显抑制血清谷丙转氨酶ALT、谷草转氨酶AST水平的升高[8]。广西莪术还具有预防肝纤维化的作用。研究表明,HSC细胞增多是发生肝纤维化的标志,彭岳等证实广西莪术提取物对HSC细胞具有明显的促凋亡作用,并且具有浓度梯度依赖效应[12]。
卵形鲳鲹是我国重要的海水养殖鱼类,经济价值极高,但近年来各种鱼病频繁爆发造成了巨大损失[13-14]。因此探究养殖病害的致病机理,并研制出相应抗病害药物是从根本上解决鱼类疾病的关键。目前鱼类细胞系已被广泛应用于病毒学、基因组学、细胞生物学和环境毒理学等方面的研究[13-19]。本研究中,我们利用卵形鲳鲹肾脏组织细胞系,研究了广西莪术水提物对卵形鲳鲹免疫力影响。研究结果显示,广西莪术水提物的细胞安全浓度为≤5 mg/mL,当广西莪术水提物的使用量超过安全浓度时,会对细胞产生毒性作用,包括细胞皱缩、死亡、细胞活性降低等。当使用安全浓度(≤5 mg/mL)的广西莪术水提物时,与对照组细胞相比,试验组细胞的非特异性免疫相关酶活力(酸性磷酸酶、超氧化物歧化酶、总一氧化氮合酶、溶菌酶)在初期0~6 h内明显升高,并且在第6 h达到高峰,随后在6~24 h内均呈现逐步降低的趋势,但是广西莪术水提物处理组细胞的总一氧化氮合酶(T-NOS)和超氧化物歧化酶(SOD)活性始终高于无药物处理的对照组细胞。本研究的结果表明,广西莪术水提物能够激活细胞酶活等自身免疫防御机制,以抵抗病原微生物的入侵和增殖,因此广西莪术提取物有潜力发展成为一种高效的水产免疫增强剂。未来我们将进一步研究广西莪术在鱼活体水平对卵形鲳鲹生长、免疫和抗病力的促进作用。基于传统壮药积极开展绿色无药残的新型抗病害中药制剂的研究,对于促进水产养殖业持续健康发展,确保水产品质量和食品安全意义重大[4, 20]。
4 结论本实验首次利用卵形鲳鲹肾脏组织细胞系,研究了广西莪术水提物对卵形鲳鲹细胞免疫相关酶活力的影响。结果显示,广西莪术水提物能够显著提高免疫相关酶活力(酸性磷酸酶、超氧化物歧化酶、总一氧化氮合酶、溶菌酶),广西莪术水提物的细胞安全浓度为≤5 mg/mL。
| [1] |
李坚明. "十三五"广西水产养殖业发展战略研究[J]. 中国渔业经济, 2016, 34(4): 25-31. DOI:10.3969/j.issn.1009-590X.2016.04.004 |
| [2] |
余庆, 李菲, 王一兵, 等. 广西北部湾大宗海水养殖鱼类卵形鲳鲹感染溶藻弧菌及其致病性的研究[J]. 广西科学, 2018, 25(1): 68-73. |
| [3] |
余庆, 李菲, 覃仙玲, 等. 广西卵形鲳鲹小脑来源细胞系的建立及特征分析[J]. 广西科学, 2018, 25(1): 74-79. |
| [4] |
李鹏飞, 余庆, 覃仙玲, 等. 广西北部湾海水养殖业现状与病害防控技术体系研究展望[J]. 广西科学, 2018, 25(1): 15-25. |
| [5] |
WANG X, RYU D, HOUTKOOPER R H, et al. Antibiotic use and abuse:A threat to mitochondria and chloroplasts with impact on research, health, and environment[J]. Bioessays, 2015, 37(10): 1045-1053. DOI:10.1002/bies.201500071 |
| [6] |
SMALDONE G, MARRONE R, CAPPIELLO S, et al. Occurrence of antibiotic resistance in bacteria isolated from seawater organisms caught in Campania Region:Preliminary study[J]. BMC Veterinary Research, 2014, 10: 161. DOI:10.1186/1746-6148-10-161 |
| [7] |
陈昌福. 我国水产养殖动物病害防治研究的主要成就与当前存在的问题[J]. 饲料工业, 2007, 28(10): 1-3. |
| [8] |
张贵杰, 黄克斌. 广西莪术化学成分和药理作用研究进展[J]. 广州化工, 2015, 11: 24-26. |
| [9] |
ZHOU L L, LI P F, LIU J X, et al. Establishment and characterization of a mid-kidney cell line derived from golden pompano Trachinotus ovatus, a new cell model for virus pathogenesis and toxicology studies[J]. In Vitro Cellular & Developmental Biology-Animal, 2017, 53(4): 320-327. |
| [10] |
朱凯, 李军, 罗桓, 等. 广西莪术化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2009, 26(1): 27-29. |
| [11] |
ZENG J, DAI P, REN L, et al. Apoptosis-induced anti-tumor effect of Curcuma kwangsiensis polysaccharides against human nasopharyngeal carcinoma cells[J]. Carbohydr Polym, 2012, 89(4): 1067-1072. DOI:10.1016/j.carbpol.2012.03.064 |
| [12] |
彭岳, 吴光, 韦燕飞, 等. 桂郁金提取物对人肝星状细胞增殖、细胞周期及凋亡影响的研究[J]. 时珍国医国药, 2012, 23(5): 1076-1078. DOI:10.3969/j.issn.1008-0805.2012.05.011 |
| [13] |
LI P F, ZHOU L L, NI S W, et al. Establishment and characterization of a novel cell line from the brain of golden pompano (Trachinotus ovatus)[J]. In Vitro Cellular & Developmental Biology-Animal, 2016, 52(4): 410-418. |
| [14] |
LI P F, ZHOU L L, WEI S N, et al. Establishment and characterization of a cell line from the head kidney of golden pompano Trachinotus ovatus and its application in toxicology and virus susceptibility[J]. Journal of Fish Biology, 2017, 90(5): 1944-1959. DOI:10.1111/jfb.13277 |
| [15] |
LI P F, ZHOU L L, WEI J G, et al. Development and characterization of aptamer-based enzyme-linked apta-sorbent assay for the detection of Singapore grouper iridovirus infection[J]. Journal of Applied Microbiology, 2016, 121(3): 634-643. DOI:10.1111/jam.13161 |
| [16] |
ZHOU L L, LI P F, NI S W, et al. Rapid and sensitive detection of redspotted grouper nervous necrosis virus (RGNNV) infection by aptamer-coat protein-aptamer sandwich enzyme-linked apta-sorbent assay (ELASA)[J]. Journal of Fish Diseases, 2017, 40(12): 1831-1838. DOI:10.1111/jfd.12656 |
| [17] |
LI P F, ZHOU L L, YU Y P, et al. Characterization of DNA aptamers generated against the soft-shelled turtle iridovirus with antiviral effects[J]. BMC Veterinary Research, 2015, 11(1): 245. DOI:10.1186/s12917-015-0559-6 |
| [18] |
LI P F, WEI S N, ZHOU L L, et al. Selection and characterization of novel specific DNA aptamers recognized by fish cells infected with Singapore grouper iridovirus[J]. The Journal of General Virology, 2015, 96: 3348-3359. DOI:10.1099/jgv.0.000270 |
| [19] |
YU Q, LIU M Z, WEI S N, et al. Isolation and characterization of nervous necrosis virus in cultured hybrid grouper (Epinephelus fuscoguttatus♀× E.lanceolatus♂) in Guangxi, China[J]. Fish Pathology, 2019, 54(1): 16-19. DOI:10.3147/jsfp.54.16 |
| [20] |
YU Q, LIU M Z, XIAO H H, et al.The inhibitory activities and antiviral mechanism of Viola philippica aqueous extracts against grouper iridovirus infection in vitro and in vivo[J].Journal of Fish Diseases, 2019.DOI: 10.1111/jfd.12987.[Epub ahead of print]
|



