2. 华东师范大学, 上海市城市化生态过程与生态恢复重点实验室, 河口海岸学国家实验室, 上海 200062
2. Shanghai Key Lab for Urban Ecological Processes and Eco-Restoration, State Key Laboratory of Estuarine and Coastal Research, East China Normal University, Shanghai, 200062, China
海洋中浮游植物尽管只占地球生物圈初级生成者生物量的0.2%,却提供了地球近50%的初级生成量[1]。受营养物质的影响,海洋中的浮游植物生物量和群落组成存在非常大的时空变化。因此,海洋中营养盐和浮游植物群落结构动态长期以来一直是生物海洋学领域的研究热点[2]。由于海洋中营养盐的分布状况与上升流、河流的输入、中尺度涡旋和台风等物理过程紧密相关[3],因此海洋学家们越来越关注海洋物理和海洋生态过程的耦合研究[4]。
因初级生产力和次级生产力很高[5],边缘海通常情况下是重要的渔场,同时在碳或其他元素的循环过程中起到非常重要的作用。因此在过去的几十年里,国际地圈生物圈计划(IGBP)中的全球海洋通量联合研究(JGOFS)和海岸带的海陆相互作用(LOICZ)等核心研究计划均把边缘海作为重要的研究区域[6]。
东海是西北太平洋最大的边缘海,受西侧的长江冲淡水、北面的黄海冷水团、东面的黑潮和南面的台湾暖流等影响,是物理环境最为复杂的海区之一。由于东海的海洋资源丰富,科学家对东海的水团、营养盐和浮游植物的时空分布开展了大量的研究和调查工作。如,Chen等[7]对东海夏季近岸上升流的浮游植物初级生产做了研究;Gong等[8]研究了东海物理和生物地化过程对营养盐和浮游植物生物量的分布影响;Jiao等[9]研究了超微型浮游植物在东海的分布;Zhou等[2]研究了东海浮游植物群落结构对长江营养盐输入的响应。目前,大部分的研究重点是关注东海中部和外陆架区域,而有关东海区域的水文、化学和物理过程对浮游植物群落结构的影响研究不多。本研究通过2006年和2011年两个夏季航次东海陆架夏季水文、叶绿素a(Chl.a)及浮游植物特征光合色素的分布对比分析,探讨东海的主要物理过程对浮游植物生物量和类群结构的时空分布影响。
1 材料和方法 1.1 研究区域和航次研究区域位于经度121.5°~126°E和纬度27.5°~33.5°N范围内水深小于100 m的东海陆架。调查时间为2006年8月20~31日和2011年8月17~31日,包括北向南的A~G 7个断面。具体情况见图 1。
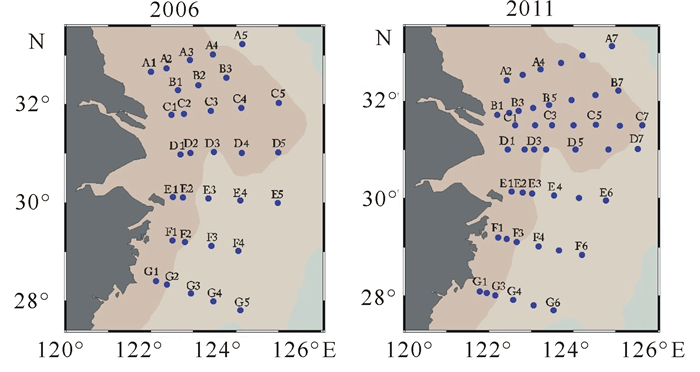
|
| 图 1 2006年和2011年8月份在东海陆架的研究区域和采样点位 Fig.1 Study area and sampling stations in the continents shelf of East China Sea in August 2006 and August 2011 |
1.2 采样及分析方法
水样以捆绑于SeaBird SBE(CTD)上的12个5 L的Niskin梅花型采水器采集。取一定体积(0.5~4.0 L)的水样,在负压小于75 mm汞柱,遮光的条件下采用47 mm的whatman GF/F滤膜过滤,过滤完毕后将滤膜对折封装于铝箔袋,立即保存于液氮中,转回实验室后立即测定或保存于-80℃的超低温冰箱中直至分析。
2006年航次光合色素的提取和分析根据Zhu等[10]方法进行,滤膜吸干水分后在-4℃避光条件下用5 mL 90%的丙酮提取14 h,提取液经过3 000 r/min离心5 min,上清液经过0.45 μm的有机相滤膜过滤,取上清液进行高效液相色谱分析。2011年航次光合色素提取和分析根据胡俊等[11]方法进行。滤膜吸干水分后剪碎,在-20℃避光条件下用3 mL N, N-二甲基甲酰胺(DMF)提取30 min,提取液经过6 000 r/min离心5 min,上清液经过0.45 μm的有机相滤膜过滤,取上清液进行高效液相色谱分析。
两种方法的洗脱程序如表 1所示。2006年航次,流动相A为甲醇:乙腈:水吡啶=50:25:25 (V:V:V),水吡啶(0.25 mol/L,用乙酸将pH值调整到5.0);流动相B为甲醇:乙腈:丙酮=20:60:20 (V:V:V)。2011年航次, 流动相A甲醇:乙酸胺水溶液=80:20 (V:V),乙酸胺水溶液(1 mol/L);流动相B为100%甲醇。
| 年份 Year |
时间 Time (min) |
流动相A Solvent A (%) |
流动相B Solvent B (%) |
| 2006 | 0 | 95 | 5 |
| 2 | 95 | 5 | |
| 22 | 60 | 40 | |
| 24 | 60 | 40 | |
| 30 | 5 | 95 | |
| 40 | 5 | 95 | |
| 42 | 95 | 5 | |
| 47 | 95 | 5 | |
| 2011 | 0 | 100 | 0 |
| 2 | 100 | 0 | |
| 16 | 55 | 45 | |
| 27 | 0 | 100 | |
| 36 | 100 | 0 |
样品测定分析系统均为Agilent 1100 Series液相色谱工作站,2006年采用Eclipse XDB C18柱(Agilent, Germany),2011年采用Eclipse XDB C8柱(Agilent, Germany),分析系统为二极管阵列检测器(DAD)。
光合色素定性和定量:光合色素定性根据光合色素保留时间(tR)以及洗出峰的扫描图谱(350~700 nm), 并参照标准光合色素及文献[11]所提供的光合色素扫描图谱来进行, 光合色素定量采用外标法, 光合色素标准样品购自丹麦DHI公司,记录440 nm波长下的吸收定量。
浮游植物群落结构的计算采用CHEMTAX1.95版进行分析,各类群特征色素和叶绿素a的比值参考Zhu等[10]。
调查期间研究区域内风场的数据基于综合海洋气象资料(COADS)分析获得。
2 结果与分析 2.1 风场情况如图 2所示,两个航次的风场条件差别较大,2006年8月东海陆架以弱的东北风(1~3 m/s)为主,风速由北向南逐渐减小;2011年8月则以较强的西南风(3~6 m/s)为主,风速由北向南逐渐增大。
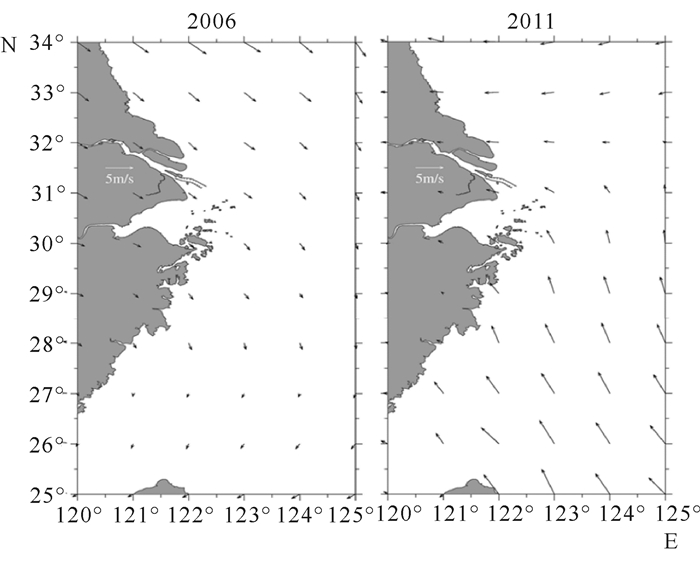
|
| 图 2 2006年和2011年8月东海陆架表层风向和风速月均值水平分布图 Fig.2 Horizontal distribution of monthly mean wind speed and direction in the study area in August 2006 and August 2011 |
2.2 温度和盐度状况 2.2.1 温度和盐度的水平分布特征
表层水的温度和盐度分布特征(图 3)表明,2006年和2011年夏季东海陆架均有高温低盐(< 31 psu)的长江冲淡水分布。2006年,长江冲淡水被相对高温高盐水分隔成两个部分,其中一部分位于最北的A、B断面,另一部分位于长江口南侧D、E、F断面的近海区域。2011年,长江冲淡水核心区域位于D断面近岸区域,最低盐度 < 22℃,且影响的区域更大;而A、B断面受冲淡水和黄海冷水团的共同作用,呈现低温(< 24℃)相对低盐(< 31 psu)的特征。在2006年和2011年E、F和G断面的外侧,表层水受黑潮的影响,呈现高温高盐的特征。
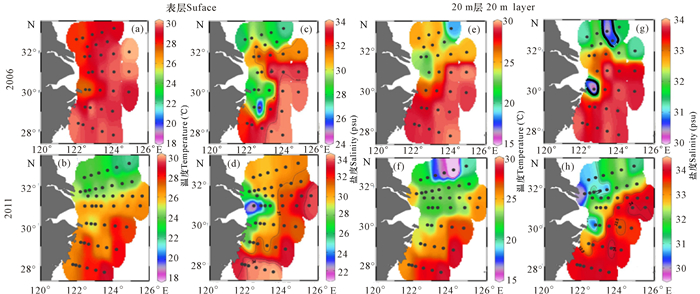
|
| 图 3 2006年和2011年夏季东海陆架表层及20 m层水的温度(a、b、e、f)和盐度(c、d、g、h)水平分布 Fig.3 Horizontal distributions of temperature (a, b, e, f) and salinity (c, d, g, h) at surface and 20 m layer in the shelf of East China sea in the summer of 2006 and 2011 |
在20 m层,温度和盐度特征表明,2006年和2011年均有两个区域存在长江冲淡水。2006年,一个位于A4、B3点位附近,另一个位于E1点位附近;2011年,分别位于B1和E1点位附近。相比较而言,在20 m层,2011年东海陆架断面受低温、相对低盐的黄海冷水团影响的区域明显大于2006年,而2006年受高温高盐的台湾暖流影响较大。
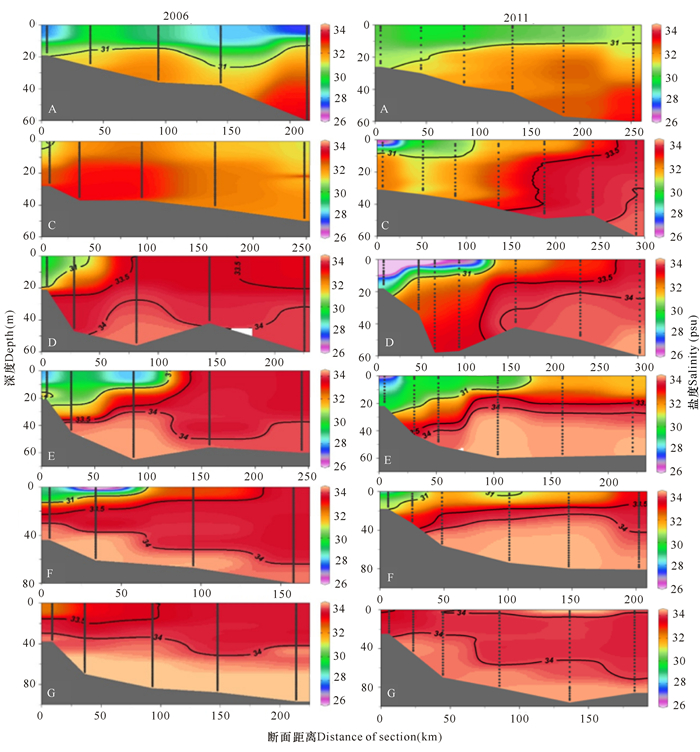
2.2.2 温度和盐度垂直分布特征除B断面外,由北向南6个断面的温度和盐度的垂直分布情况如图 4和图 5所示。两个航次在A断面均有明显的水体层化现象。在2006年,0~15 m水温更高,盐度相对更低,表明A断面冲淡水的影响更强;而2011年外侧的底层低温(< 15℃)和相对高盐(盐度为33 psu左右)的水的面积更大,温度更低,表明受黄海冷水团影响显著,从而导致2011年A断面0~20 m深的温度明显低于2006年。
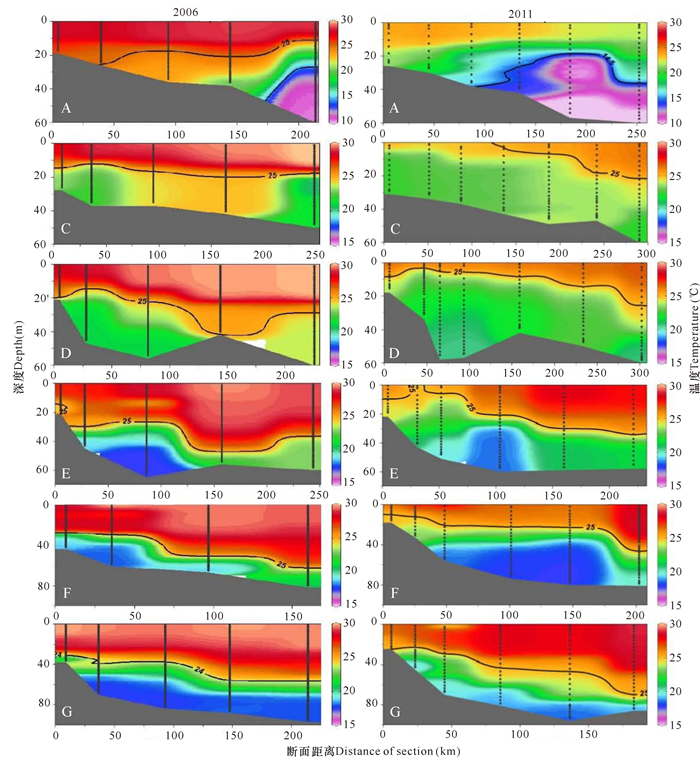
|
| 图 4 2006年和2011年A、C、D、E、F和G断面温度的垂直分布情况 Fig.4 The vertical distributions of temperature at section A、C、D、E、F and G in 2006 and 2011 |
|
| 图 5 2006年和2011年A、C、D、E、F和G断面盐度的垂直分布情况 Fig.5 The vertical distributions of salinity at section A、C、D、E、F and G in 2006 and 2011 |
在C、D、E和F断面的近岸区域,2006年和2011年上层均有高温、低盐的冲淡水存在;但2011年,在C、D和E断面盐度更低,盐度为31 psu的等值线的范围更大,表明冲淡水的强度和影响范围相对较大;外侧区域,2006年上层高温和相对高盐的混合水相对较厚,而2011年在中下层,温度为25℃和盐度为34 psu等值线更浅,达到30 m,表明存在低温、高盐水的涌升现象。
在G断面,2011年上层水温和盐度均更高,表明受台湾暖流的影响更明显。
2.2.3 浮游植物光合色素的平均浓度采用高效液相色谱法对两个航次的浮游植物光合色素含量进行分析表明(表 2),2006年和2011年的浮游植物光合色素组成有明显的差异。2006年8月,东海陆架Chl.a的平均浓度为1 228.6 ng/L,2011年8月Chl.a的浓度则明显高于2006年,为2 677.9 ng/L。硅藻的特征色素岩藻黄素(Fuco)的浓度在2006年和2011年比较接近,分别为1 136.2 ng/L和1 078.5 ng/L。但2006年,甲藻的特征色素多甲藻素(Peri)的浓度(284.5 ng/L)为2011年(59.5 ng/L)的4.8倍;蓝藻和原绿球藻的特征色素玉米黄素(Zea)和二乙烯基叶绿素a(DV_Chl.a)在2006年平均浓度分别为89.5 ng/L和16.0 ng/L,为2011年的2.7倍和3.8倍。绿藻的特征色素叶绿素b(Chl.b)的平均浓度为74.4 ng/L,为2011年的1/3左右。
| 年份 Year |
光合色素Pigments (ng/L) | |||||||||||
| 多甲藻素 Peri |
19-丁酰基氧化岩藻黄素 19-but |
岩藻黄素 Fuco |
新黄素 Neo |
青绿藻素 Prasino |
19-己酰基氧化岩藻黄素 19-hex |
紫黄素 Viola |
别藻黄素 Allo |
玉米黄素 Zea |
叶绿素b Chl.b |
二乙烯基叶绿素a DV-Chl.a |
叶绿素a Chl.a |
|
| 2006 | 285.4 | 18.6 | 1 136.6 | 12.6 | 16.3 | 56.5 | 14.7 | 12.1 | 89.5 | 74.4 | 16.0 | 1 228.6 |
| 2011 | 59.5 | 11.5 | 1 078.5 | 18.6 | 41.4 | 33.2 | 11.8 | 17.3 | 32.9 | 198.1 | 4.2 | 2 677.9 |
2.2.4 表层水中叶绿素a的水平分布
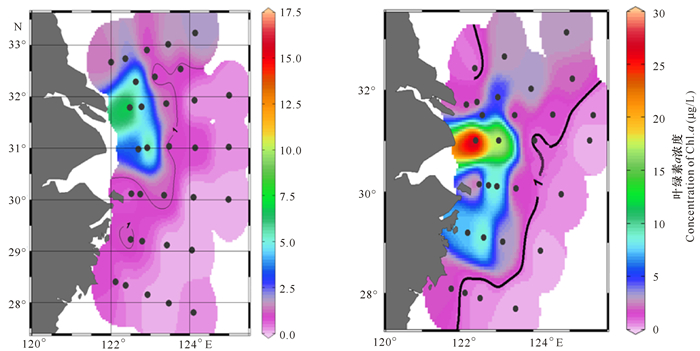
2006年和2011年夏季东海陆架表层水中Chl.a的水平分布有较大差异(图 6)。2006年表层在C1点位出现最大浓度(8 827.1 ng/L);在A断面所有点位及B、C和D断面内侧区域Chl.a 均在1 000 ng/L以上。在2011年夏季,表层在D1点位出现最大浓度(27 898.9 ng/L),在A~F断面,除最外测点位,所有点位的Chl.a均高于1 000 ng/L。
|
| 图 6 2006年和2011年8月东海陆架表层Chl.a的水平分布 Fig.6 Horizontal distributions of Chl.a at surface of East China sea shelf in August 2006 and August 2011 |
2.2.5 浮游植物类群组成
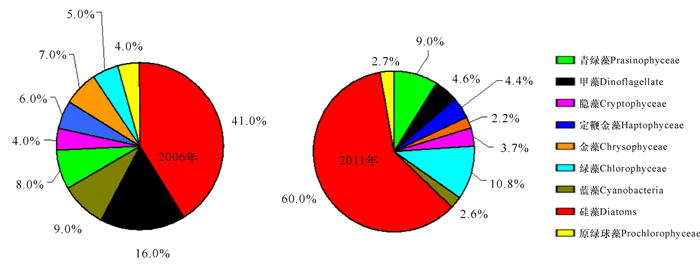
结合浮游植物光合色素的组成及Chl.a的浓度,通过化学分类软件CHEMTAX的计算,可知2006年和2011年东海陆架浮游植物群落结构组成平均值有较大差异(图 7),在2006年,东海陆架以硅藻和甲藻为主要浮游植物类群,分别占群落的41.0%和16.0%,而蓝藻、原绿球藻分别占9.0%和4.0%。2011年则以硅藻为绝对的优势类群,占60.0%,而绿藻的比重较2006年提升了一倍,占10.8%,蓝藻和原绿球藻的比重明显下降,分别占2.6%和2.7%。
|
| 图 7 2006年和2011年8月研究区域浮游植物类群组成平均值 Fig.7 Average value of phytoplankton community composition in the study area in August 2006 and August 2011 |
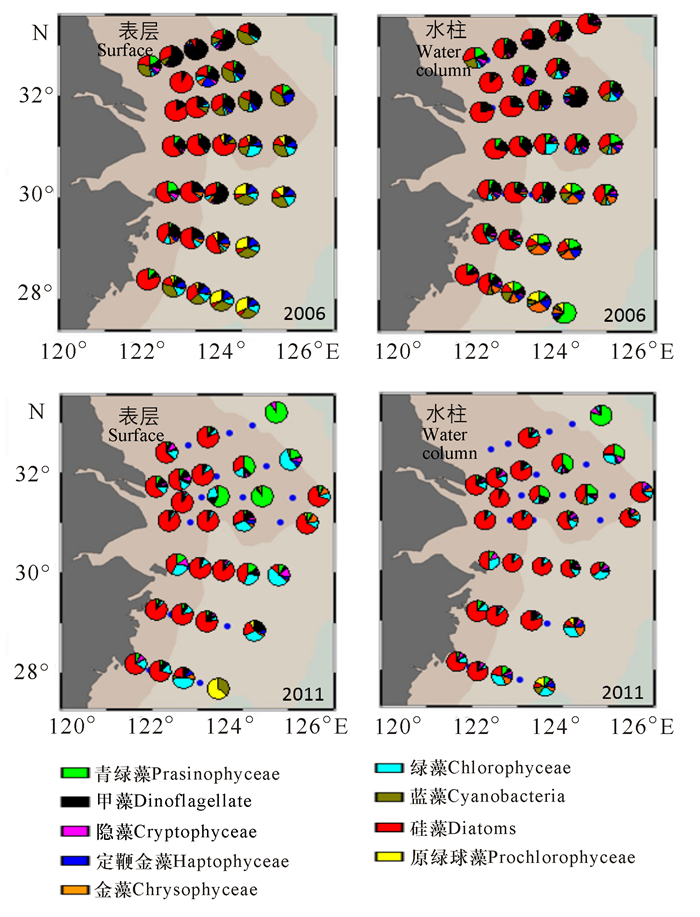
由浮游植物类群组成的空间分布可知(图 8),2006年,表层水的近岸区域主要以硅藻和甲藻为优势类群,外侧区域蓝藻和原绿球藻的比重有所增加。从水柱积分的浮游植物类群来看,硅藻和甲藻在近岸和长江口的北侧断面为主要优势类群,在东南面断面的外侧青绿藻、金藻和定鞭金藻等类群比重增加,表明蓝藻主要分布于表层,而金藻等主要分布于表层以下。2011年,表层水近岸区域以硅藻为绝对优势类群,在北侧受黄海冷水团影响的区域绿藻和青绿藻比重较大,而G断面的最外侧断面以原绿球藻和蓝藻为绝对优势类群;水柱积分的浮游植物类群在近岸区域并无显著变化,但是在外侧点位的青绿藻和绿藻的比例略有下降。
|
| 图 8 2006年和2011年8月各点位表层和水柱浮游植物类群组成 Fig.8 Composition of phytoplankton community at surface and water column of each station in August 2006 and August 2011 |
3 讨论
研究结果表明2006年和2011年夏季东海陆架的两个航次浮游植物生物量和浮游植物类群结构均有较大的差异,这种差异可能与风场、长江流量和黄海冰水团3个因素有关。
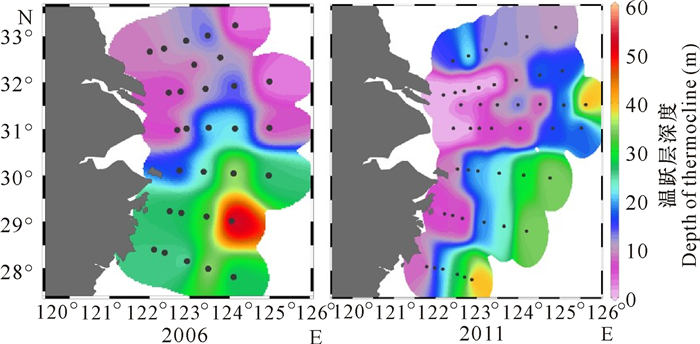
3.1 受不同的风场影响Chu等[12]结合1945—1989年数据分析东黄海8月表层风场的月平均值表明,东海8月份表层以西南风为主,风速为2~5 m/s。2006年,受弱东北风的影响,表层冲淡水难以向外扩展,使得陆架外侧表层水难以得到冲淡水的营养盐补充;而底层的低温高盐水也没法涌升,底层营养盐也难以进入真光层。2011年,受较强(3~6 m/s)的西南风的影响,表层水向外海移动,使得带有丰富营养盐的长江冲淡水在表层影响的范围更大;2011年温跃层的深度(温度差>0.2℃/m的深度)更浅,多数点位跃层深度小于15 m(图 9),表明底层水涌升明显,并进入真光层,因此,2011年8月东海陆架的浮游植物得到长江冲淡水和涌升水的营养盐补充,使得Chl.a的浓度明显高于2006年。
|
| 图 9 2006年和2011年8月各监测点位温跃层深度 Fig.9 The depth of thermocline at each station in the August 2006 and August 2011 |
3.2 长江流量的差异
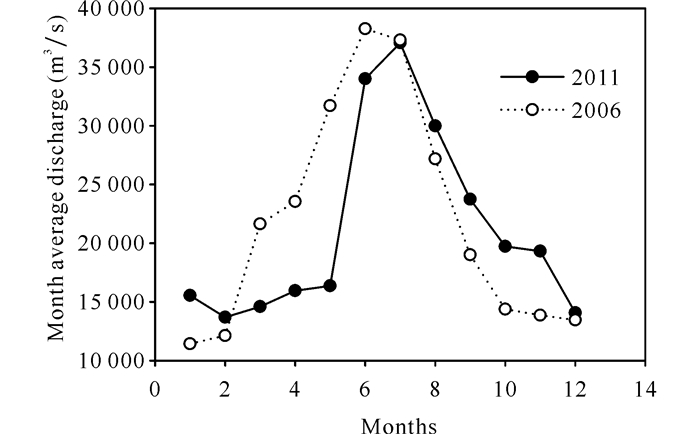
从空间分布而言,2006年和2011年夏季的两个航次中,长江冲淡水影响区的近岸区域硅藻均为群落中的优势类群。这与Furuya等[13]的研究结果基本一致。但2006年甲藻的特征光合色素多甲藻素(Peri)的浓度明显高于2011年,由CHEMTAX计算得到的甲藻比例相对较高。这可能与长江冲淡水的输入有关。Gong等[14]研究表明三峡大坝建成以后,夏季长江冲淡水的输入减少,甲藻成为冲淡水中的优势类群。由大通水文站的流量月均值(图 10)可知,2006年8月长江流量略小于2011年,因此在不利的风场条件下,长江冲淡水对东海陆架影响面积较小,因此,甲藻在近海区域的比重增加。
|
| 图 10 2006年和2011年大通站长江月均流量比较 Fig.10 Comparison of monthly average flow in Yangtze River at Datong station in 2006 and 2011 |
3.3 黄海冷水团的影响
由温盐的特征表明,2006年和2011年在A断面的外侧底层均有黄海冷水团的存在(图 3~4)。但2011年黄海冷水团的影响更为明显。2011年,在受黄海冷水团影响的区域,青绿藻的占比较大(图 8)。Huang等[15]采用光合色素和分子生物学等方法发现,在春季水华期黄海Micromonas和Ostreococcus等超微型的青绿藻细胞丰度达到4 000 cell/L的丰度。因此,在2011年青绿藻比重增加可能与受较强的黄海冷水团影响有关。
4 结论2006年和2011年8月,因东海陆架处于两种不同的风场条件,浮游植物的生物量和群落结构存在较大的差异。在2006年,受弱的东北风的影响,长江冲淡水无法向外陆架延伸,同时地层水无法向上涌升,浮游植物营养盐状况相对较差,生物量略低,硅藻和甲藻为浮游植物的主要优势类群;2011年,因受较强的西南风影响,长江冲淡水在表层分布范围较大,而且底层水也已经进入真光层,东海陆架叶绿素a的浓度较高,浮游植物生长状况良好,生物量高,硅藻为绝对优势类群。
| [1] |
孙军. 海洋浮游植物与生物碳汇[J]. 生态学报, 2011, 31(18): 5372-5378. |
| [2] |
ZHOU M J, SHEN Z L, YU R C. Responses of a coastal phytoplankton community to increased nutrient input from the Changjiang (Yangtze) River[J]. Continental Shelf Research, 2008, 28(12): 1483-1489. DOI:10.1016/j.csr.2007.02.009 |
| [3] |
GONG G C, WEN Y H, WANG B W, et al. Seasonal variation of chlorophyll a concentration, primary production and environmental conditions in the subtropical East China Sea[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2003, 50(6/7): 1219-1236. |
| [4] |
LEWIS M R. Variability of plankton and plankton processes on the mesoscale[M]//WILLIAMS PETER J LE B, THOMAS D N, REYNOLDS C S. Phytoplankton productivity: Carbon assimilation in marine and fresh water ecosystems. Oxford: Blackwell Science Ltd., 2007: 141-155.
|
| [5] |
唐启升, 苏纪兰. 中国海洋生态系统动力学研究Ⅰ关键科学问题与研究发展战略[M]. 北京: 科学出版社, 2000.
|
| [6] |
CHEN C T A. Distributions of nutrients in the East China Sea and the South China Sea connection[J]. Journal of Oceanography, 2008, 64(5): 737-751. DOI:10.1007/s10872-008-0062-9 |
| [7] |
CHEN C T A, LIU C T, CHUANG W S, et al. Enhanced buoyancy and hence upwelling of subsurface Kuroshio waters after a typhoon in the southern East China Sea[J]. Journal of Marine Systems, 2003, 42(1/2): 65-79. |
| [8] |
GONG G C, CHEN Y L L, LIU K K. Chemical hydrography and chlorophyll a distribution in the East China Sea in summer:Implications in nutrient dynamics[J]. Continental Shelf Research, 1996, 16(12): 1561-1590. DOI:10.1016/0278-4343(96)00005-2 |
| [9] |
JIAO N Z, YANG Y H, HONG N, et al. Dynamics of autotrophic picoplankton and heterotrophic bacteria in the East China Sea[J]. Continental Shelf Research, 2005, 25(10). |
| [10] |
ZHU Z Y, NG W M, LIU S M, et al. Estuarine phytoplankton dynamics and shift of limiting factors:A study in the Changjiang (Yangtze River) Estuary and adjacent area[J]. Estuar, Coast and Shelf Science, 2009, 84(3): 393-401. DOI:10.1016/j.ecss.2009.07.005 |
| [11] |
胡俊, 柳欣, 王磊, 等. 应用反相高效液相色谱定性和定量浮游植物光合色素[J]. 海洋科学, 2011, 35(11): 19-28. |
| [12] |
CHU P, CHEN Y C, KUNINAKA A. Seasonal variability of the Yellow Sea/East China Sea surface fluxes and thermohaline structure[J]. Advances in Atmospheric Sciences, 2005, 22(1): 1-20. |
| [13] |
FURUYA K, HAYASHI M, YABUSHITA Y, et al. Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2003, 50(2): 367-387. DOI:10.1016/S0967-0645(02)00460-5 |
| [14] |
GONG G C, CHANG J, CHIANG K P, et al. Reduction of primary production and changing of nutrient ratio in the East China Sea:Effect of the Three Gorges Dam?[J]. Geophysical Research Letters, 2006, 33(7). DOI:10.1029/2006gl025800 |
| [15] |
HUANG Q, XIN L, HUANG B Q, et al. Phytoplankton community structure during the spring bloom in central Yellow Sea using photosyntheitc pigments and TSA-FISH[C]//中国海洋湖沼学会藻类学分会.中国藻类学会第八次会员代表大会暨第十六次学术讨论会论文摘要集.青岛, 2011.
|


