北部湾近岸海域生态系统多样,自然资源丰富,拥有金滩和银滩等旅游资源,是北部湾地区重要旅游人群聚集区之一,也是我国南方近江牡蛎(Magallana rivularis)、马氏珍珠贝(Pinctada imbricata)、方格星虫(Sipunculus nudus)、二长棘鲷(Parargyrops edita)重要的增养殖区,因而研究北部湾近岸海域环境卫生风险状况并查找其成因、提出防范对策,对区域生态安全及人群健康有着重要的意义。近年来北部湾近岸海水水质良好,但水质异常现象增多,局部海域污染现象持续存在[1],超标因子包括pH值、无机氮、活性磷酸盐、石油类、粪大肠菌群等[2]。这些因子存在不同程度的相关性[3-6],当粪大肠菌群浓度达到104个/L以上时,伤寒沙门氏菌、志贺氏菌、副溶血弧菌有较高的阳性率[7-8],这些病原菌是水产品引起食物中毒的主要因子,致病性弧菌也是牡蛎等动物的致死因子[9-12]。海水中常见超标污染因子中,生物因子很少被关注,北部湾近岸海域粪大肠菌群等微生物的报道相对缺乏,也尚未见到北部湾近岸海域环境卫生风险方面的报道。粪大肠菌群是来自人与其他温血动物粪便的微生物群体,是卫生学中常用于反映粪便污染程度的指示菌群,可推测环境中肠道致病菌污染的存在以判断卫生风险。对粪大肠菌群污染的研究有利于避免人类及水生哺乳动物等生物受病原菌的侵害。本研究从微生物角度出发,分析2016年北部湾近岸海域受粪大肠菌群的污染状况、时空分布特征及其与其他环境因子的相关性,研究北部湾近岸海域环境卫生风险状况及其成因,并针对性提出防范对策。
1 材料与方法 1.1 调查海域状况北部湾位于南海西北侧,本研究主要关注其北部的近岸海域,重点是广西近岸海域,东起广东省雷州半岛西岸,西至中越北部湾海上分界线[13],沿海潮汐类型为不规则全日潮和规则全日潮,平均潮差2.12~2.55 m,最大潮差4.17~6.41 m,海湾动力以潮汐控制为主[14]。
1.2 调查时间与站位根据北部湾近岸海域的自然环境特点共设44个站位,于2016年枯水期(3月)、丰水期(6~8月)和平水期(9~10月)共3个水期调查。调查站位如图 1。

|
| 图 1 2016年北部湾近岸海域采样站位 Fig.1 Location of sampling stations in coastal waters of the Beibu Gulf in 2016 |
1.3 现场采样与样品分析方法
粪大肠菌群样品采集于水面以下10 cm左右的表层海水,用经灭菌后的专门采样瓶进行采样,在10℃冰箱保存带回实验室,采集后24 h内分析。样品选择3个接种量分别是10.0 mL、1.0 mL、0.1 mL,每个接种量接种5支乳糖蛋白胨在(44±0.5)℃培养24 h,产酸产气或只产酸的阳性管接入EC肉汤在(44±0.5)℃培养24 h,记录每个接种量产气的阳性管数量,查询Most probable number (MPN)表,换算为个/L。方法检出限为20个/L。
水温、盐度、pH值、无机氮、活性磷酸盐、化学需氧量、石油类等水质因子的采样、处理和分析方法按照《海洋监测规范》(GB 17378—2007)[15]进行,其中无机氮浓度为硝酸盐氮、亚硝酸盐氮和氨氮浓度之和。
1.4 评价方法粪大肠菌群的评价按《海水水质标准》(GB 3097—1997)[16]评价,第一类、第二类和第三类海水的粪大肠菌群标准均为≤2 000个/L,供人生食贝类养殖水质第一类、第二类和第三类海水的粪大肠菌群标准为≤140个/L。
1.5 数据处理分析方法分别选取2016年枯水期、丰水期、平水期北部湾近岸海域44个站点粪大肠菌群浓度数据,采用Surfer 11进行运算,根据最低检出限、供人生食的贝类养殖水质标准、第一类~第三类海水水质标准,选用MPN值为20个/L、140个/L、2 000个/L、10 000个/L、20 000个/L分类图,采用Surfer 11软件绘制北部湾近岸海域粪大肠菌群平面分布图。
选取2016年枯水期、丰水期和平水期北部湾近年海域44个站点的粪大肠菌群、pH值、盐度、无机氮、活性磷酸盐、化学需氧量、石油类共7个环境因子,采用SPSS Statistics 17.0进行等级相关系数(Spearman相关系数)运算,分析粪大肠菌群与其他水质指标的相关性。相关性的强弱程度按0<|r|<0.1为无相关性,0.1≤|r|<0.3为弱相关性,0.3≤|r|<0.5为中等相关,0.5≤|r|为强相关划分。
2 结果与分析 2.1 北部湾近岸海域的基本环境特征2016年3个水期北部湾近岸海域表层海水温度在18.4~34.0℃,丰水期水温最高,平水期次之,枯水期水温最低(表 1);靠外海域水温较高,河口近岸水温较低,但在钦州港、铁山港及防城港东湾等海区水温也相对其他河口近岸海域较高。2016年3个水期调查中北部湾近岸海域表层海水盐度在1.40‰~31.20‰,枯水期最高,平水期次之,丰水期最低(表 1);河口近岸海区盐度较低,靠外海域盐度高,在防城港西湾和钦州湾的内湾至外湾,盐度从湾内到湾外呈现明显的递增趋势。
| 指标 Indicators |
水温Temperature (℃) | 盐度Salinity (‰) | |||||
| 枯水期 Dry season |
丰水期 Wet season |
平水期 Normal season |
枯水期 Dry season |
丰水期 Wet season |
平水期 Normal season |
||
| 范围 Range |
18.4~28.8 | 29.7~34.0 | 27.1~31.0 | 15.20~30.90 | 1.40~28.30 | 9.40~31.20 | |
| 平均值 Average |
24.4 | 31.9 | 29.0 | 26.33 | 21.47 | 25.47 | |
2.2 粪大肠菌群时空分布特征
2016年北部湾近岸海域粪大肠菌群的统计结果见表 2。检出率为43.18%~52.27%,平均为49.24%;供人生食贝类养殖水质占比为25.00%~34.09%,平均为28.03%;劣三类海水占比为4.55%~9.09%,平均为6.82%。3个水期的粪大肠菌群检出率为枯水期=平水期>丰水期,超供人生食贝类养殖水质占比为平水期>枯水期=丰水期,劣三类海水占比为丰水期>枯水期>平水期。
| 水期 Seasons |
MPN值各区间占比 Proportion of MPN value in each interval (%) |
||
| ≥20 CFU/L | >140 CFU/L | ≥2 000 CFU/L | |
| 枯水期 Dry season |
52.27 | 34.09 | 6.82 |
| 丰水期 Wet season |
43.18 | 25.00 | 9.09 |
| 平水期 Normal season |
52.27 | 25.00 | 4.55 |
| 均值 Average |
49.24 | 28.03 | 6.82 |
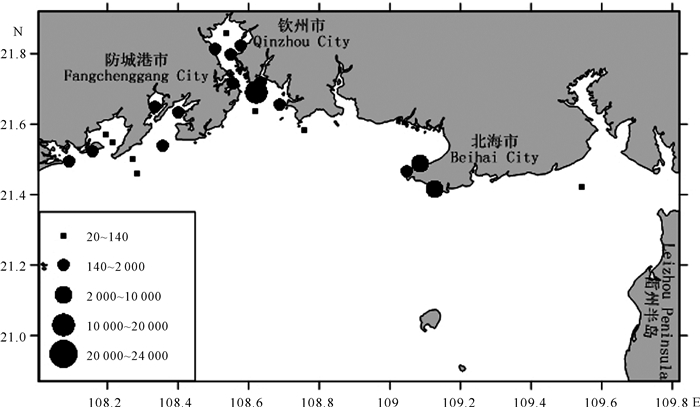
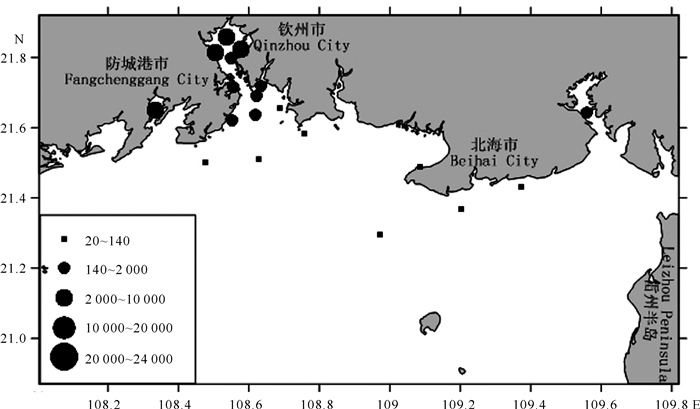
2016年北部湾近岸海域粪大肠菌群的分布特征见图 2~4。枯水期粪大肠菌群检出站点主要分布在防城港近岸海域、钦州湾及北海市的市区近岸海域(图 2),最高的粪大肠菌群数值分布在钦州港附近海区,其次在北海市市区附近站点,茅尾海及防城港湾、北仑河口附近站点数值也相对较高。丰水期北部湾近岸海域粪大肠菌群检出的站点主要分布在防城港西湾、钦州湾和北海市近岸海域,其中茅尾海和防城港西湾数值最高,其次为钦州港附近海区,丰水期总体上呈现出从河口到靠外海域逐渐减少的分布特征(图 3)。平水期粪大肠菌群的空间分布特征与丰水期相似,但最高值主要出现在防城港西湾和钦州港附近(图 4)。
|
| 图 2 2016年枯水期北部湾近岸海域粪大肠菌群平面分布(单位:个/L) Fig.2 Flat distribution of fecal coliform bacteria in the Beibu Gulf coastal water in the dry season of 2016 (unit:CFU/L) |
|
| 图 3 2016年丰水期北部湾近岸海域粪大肠菌群平面分布(单位:个/L) Fig.3 Flat distribution of fecal coliform bacteria in the Beibu Gulf coastal water in the wet season of 2016 (unit:CFU/L) |

|
| 图 4 2016年平水期北部湾近岸海域粪大肠菌群平面分布(单位:个/L) Fig.4 Flat distribution of fecal coliform bacteria in the Beibu Gulf coastal water in the normal season of 2016 (unit:CFU/L) |
2.3 重点贝类养殖海湾粪大肠菌群分布特征
防城港海域5~10号共6个站位,全年粪大肠菌群检出频次占监测总频次61.11%,劣于第三类生食贝类养殖用水(频次占监测总频次33.33%),劣于第三类海水水质(频次占监测总频次11.11%)。枯水期受污染海域为西湾、东湾及湾口,劣于第三类生食贝类养殖用水水质;丰水期受污染海域为西湾,劣于第三类海水水质标准;平水期除7号站位外其他站位均检出,其中东湾劣于第三类生食贝类养殖用水水质。
钦州湾海域11~24号共14个站位,粪大肠菌群检出频次占监测总频次83.33%,劣于第三类生食贝类养殖用水(频次占监测总频次57.14%),劣于第三类海水水质(频次占监测总频次11.9%)。全年3个水期,除外湾南部最外沿的22号站位未受到粪大肠菌群污染外,内湾、湾颈和外湾均受到粪大肠菌群不同程度的污染。枯水期劣于第三类生食贝类养殖用水水质的海域为内湾茅尾海的茅岭江、大榄江、钦江入海河口、外湾湾顶的金鼓江口,其中劣于第三类海水水质海域为外湾湾顶的金鼓江口;丰水期劣于第三类生食贝类养殖用水水质海域为内湾、湾颈、外湾顶部的榄埠江口至金鼓江河口,其中劣于第三类海水水质海域包括内湾湾顶的3个入海河口;平水期劣于第三类生食贝类养殖用水水质海域为内湾湾顶的茅岭江、大榄江、钦江入海河口、外湾东岸的金鼓江口和鹿耳环江-大灶江口以及企沙南部,其中劣于第三类海水水质海域为外湾湾顶金鼓江口附近。
廉州湾海域25~26号,28~30号共5个站位,粪大肠菌群劣于第三类生食贝类养殖用水(频次占监测总频次13.33%),劣于第三类海水水质(频次占监测总频次6.67%)。枯水期劣于第三类生食贝类养殖用水水质海域主要分布在廉州湾东南部的外沙和南澫附近,其中劣于第三类海水水质海域为廉州湾东南部的外沙附近海域;丰水期和平水期的廉州湾东南部外沙附近海域,平水期的廉州湾中部粪大肠菌群有检出,但均未超出第三类生食贝类养殖用水水质或第三类海水水质标准。
2.4 粪大肠菌群与环境因子的相关性如表 3所示, 粪大肠菌群与盐度、pH值、无机氮、活性磷酸盐、化学需氧量、石油类均为显著相关, 其中粪大肠菌群与盐度呈强负相关, 与pH值呈中负相关, 与无机氮呈强正相关;与活性磷酸盐、化学需氧量、石油类均呈现中正相关。
| 环境因子 Environment factors |
相关系数 Correlation coefficient |
Sig(双侧) Sig (Both sides) |
| 盐度Salinity | -0.557** | 0.001 |
| pH值pH value | -0.498** | 0.001 |
| 无机氮Inorganicnitrogen | 0.518** | 0.001 |
| 活性磷酸盐Active phosphate | 0.494** | 0.001 |
| 化学需氧量COD | 0.392** | 0.001 |
| 石油类Petroleum | 0.315** | 0.001 |
| 注:**在置信度(双侧)为0.01时,相关性是显著的 Note:**The correlation is significant when the confidence (both sides) is 0.01 | ||
3 讨论 3.1 粪大肠菌群的污染特征
从2.2节的粪大肠菌群MPN值的年均值来看,检出率为49.24%,供人生食贝类养殖水质站点占比为28.03%,劣三类水质占比为6.82%。这表明北部湾近岸海域受到粪大肠菌群污染范围中等,污染程度较轻。
比较表 2中各水期的粪大肠菌群MPN值各区间的占比,按一般水质标准评价,丰水期受粪大肠菌群的检出率较小,但劣三类水质占比最大,这表明丰水期粪大肠菌群的污染范围小,且污染程度更重;按供人生食贝类养殖水质标准评价,枯水期的检出率和劣第三类生食贝类养殖用水水质最高,枯水期相对较差。这表明了不同水期的粪大肠菌群污染程度有所差异。
纵观图 2~4,2016年粪大肠菌群MPN值在枯水期、丰水期和平水期的分布特征虽然略有不同,但总体分布特征基本一致,较高的粪大肠菌群MPN值沿着大陆沿岸分布,越近岸检出率和浓度越高,离岸越远检出率和浓度越低。高值区最主要分布在钦州港、北海市、防城港市附近海区以及钦江入海口和金鼓江入海口。表明粪大肠菌群具有典型的陆源污染特性,北部湾近岸海域粪大肠菌群的分布特征受城市及河流影响明显。
比较图 2和图 3的差距,丰水期局部离岸近的点位数值降低,但离岸远的点位检出率升高,而枯水期与之相反。对于开阔海域如钦州港湾外、廉州湾湾外和银滩海区,粪大肠菌群浓度在丰水期较低;对于半封闭式海湾如防城港西湾、茅尾海和铁山港湾内,粪大肠菌群浓度在丰水期较高。这表明降水带来的稀释和扩散有明显的影响,但这种影响在不同类型的海域有所差异。
3.2 环境卫生风险特征95%置信限值上限在104个/L以上对应的MPN值大部分集中在海水水质标准2 000个/L以上,即超第三类水质标准限值。本研究调查中,2016年3个水期劣于第三类海水水质标准的共6个站点,即13.6%站位存在肠道致病菌风险,主要分布于防城港西湾、钦州湾内湾、钦州湾外湾湾顶、廉州湾东南部和北海南部海域银滩,表明这些海区存在着致病菌的暴露卫生风险。这些存在环境暴露卫生风险的海区,主要集中在城市附近,部分海区也是海水浴场的集中分布区,如银滩海域附近有银滩浴场、海滩浴场及侨港浴场,粪大肠菌群污染使这些浴场对人体健康存在潜在的卫生风险,需要加大关注力度。
95%置信限值上限在140个/L以上对应的MPN值为海水水质标准60个/L以上。本研究调查中2016年3个水期出现劣于第三类生食贝类养殖用水水质标准的共20个站点,45.45%站点存在海产品致病风险,分布于防城港东湾和西湾、钦州湾内湾至外湾湾顶、廉州湾东南部、北海南部海域银滩、铁山港海区。除了银滩海区之外,其他海区都是牡蛎的主要集中养殖区。牡蛎是常见的生食贝类种类,这表明了粪大肠菌群污染对牡蛎的养殖以及生食有着潜在的环境卫生风险。从图 2~4可以看出,粪大肠菌群MPN高值区主要集中在钦州湾,不仅明显劣于第三类生食贝类养殖用水水质标准限值,也劣于第三类水质标准限值,粪大肠菌群对该区域的污染程度较高,使广西钦州湾大蚝养殖区的水产品健康及贝类生食面临着较高的风险。近年来钦州湾大蚝多次出现大量死亡现象,粪大肠菌群作为指示菌在该区域的高值分布,表明该海区牡蛎致病菌增加,可能与大蚝的死亡存在一定的联系。参照第三类生食贝类养殖用水水质标准要求,该区域生产的大蚝等贝类应避免生食,以免较高的卫生风险威胁食用者的健康。
3.3 环境卫生风险成因分析本研究2016年3期调查结果显示, 北部湾近岸海域超标因子有pH值、无机氮、活性磷酸盐、化学需氧量、石油类以及粪大肠菌群。粪大肠菌群与盐度、pH值、无机氮、活性磷酸盐、化学需氧量、石油类均存在显著的相关性(表 3),表明粪大肠菌群与这些因子有一定程度的同源性。盐度和pH值反映了淡水汇入海水混合的情况,大肠菌群与盐度强负相关,与pH值中负相关,揭示了近岸海域粪大肠菌群及其他环境因子污染来源与淡水汇入的联系较为紧密。粪大肠菌群的分布特征枯水期高浓度点位集中在入海河口,靠外海区浓度很低甚至未检出(图 2~4),丰水期时部分河口浓度下降,检出站位推移至连较远的海域,也进一步证明了入海河流的携带是主要的污染来源。在2016年的调查中,丰水期粪大肠菌群超第三类水质标准的比例最高,浓度也最高,位于防城河、茅岭江、钦江、金鼓江入海河口附近的站点丰水期粪大肠菌群浓度最高,平水期次之,枯水期最低(图 2~4),显示了入海河流对近岸海域粪大肠菌群的重要影响,其污染源可能主要来自流域畜禽养殖及农村生活污染源。然而也并非所有入海河流的影响都一致,如广西近岸海域中较大的南流江及大风江却没有显示出相似的特征,反而是枯水期廉州湾粪大肠菌群较高,平水期次之,丰水期较低,这可能与较强的入海径流稀释以及夏季较强的紫外线等因素的影响有关。
由于水动力条件不同,粪大肠菌群的扩散在不同类型的海域有明显的差异。对于开阔海域如钦州港湾外、廉州湾湾外和银滩海区,水交换能力较好,有利于粪大肠菌群的稀释,但不利于其污染范围的控制。对于半封闭式海湾如防城港西湾、茅尾海和铁山港湾内,由于水交换能力较差,降水增大使地面径流携带更多污染物进入近岸海域后无法稀释,以至于粪大肠菌群浓度升高。
本研究表明,北部湾近岸海域高浓度粪大肠菌群主要集中分布在钦州湾内湾、钦州港、廉州湾东南部、防城港西湾和银滩海区,这些区域都有一个共同的特征,都位于城市或港口码头附近,如廉州湾南部海域站点靠近北海市及外沙渔港,北海南部海域的银滩海域位于北海市周边,茅尾海位于钦州市附近,防城港西湾紧邻防城港市等,表明城市生活污水、港口船只的排污直接排入,或污水处理未有效杀灭粪大肠菌群可能是粪大肠菌群污染的途径。这也很好地解释了钦江、防城河与大风江、南流江河口附近站点粪大肠菌群浓度差异及季节变化的差异,因钦江口和防城河口上游不远就是钦州市和防城港市,而大风江流域没有较大城镇,南流江上游的玉林市等城市距离很远,经过稀释等因素,到入海口粪大肠菌群已较少。
除城市污水污染之外,从图 2~4可以看到,在没有城镇和较大河流汇入的部分养殖集中海区,如珍珠湾、铁山港内等海区也有较多的粪大肠菌群。本研究结果显示粪大肠菌群与活性磷酸盐、化学需氧量、无机氮等也具强相关性,这表明粪大肠菌群与这些主要富营养化因子有一定的同源性。除入海河流输入较多的营养盐之外,根据产排污系数手册[17],虾、蟹等水产养殖对化学需氧量排放量较大,已然成为除了入海河流之外的重要富营养化来源。珍珠湾、铁山港等海区是北部湾近岸海域主要的对虾及鱼排养殖区,2016年广西海水产品人工养殖产量达到1 205 074 t[18],大量的水产养殖可能给海区提供了丰富的营养盐,有利于粪大肠菌群在这些海区的生长,这可能是导致这些海区粪大肠菌群浓度也较高的主要原因。
3.4 环境卫生风险防控对策建议本研究调查发现北部湾近岸海域粪大肠菌群超标区域附近陆域均为人口密度较大、船只较多、城镇化程度较高、禽畜养殖和水产养殖发达、工业发达的区域,这部分海域存在致病菌分布风险。粪大肠菌群对银滩附近三大浴场的人体健康、茅尾海的养殖区和廉州湾的养殖区的贝类生食有不可忽视的风险存在。
钦州湾内湾和防城港西湾主要是在丰水期超标,粪大肠菌群污染的主要途径是入海河流携带的面源污染。禽畜养殖的废渣废水通常直排入河或回用于农田,降雨时回用农田部分随雨水冲入河流,沿海三市及玉林市禽畜养殖污染排放占北部湾近岸海域入海河流陆源污染的40%[19]。所以禽畜养殖污染防治是近岸海域污染物防控的关键控制点,需全面统筹流域养殖总量以免土地超载,促进禽畜养殖模式从散户养殖向规模化养殖模式转变,从而提高禽畜废水废渣处理比例及处理效果,并推广雨污分流,减少由于废水废渣直接回用于农田使污染物随降雨通过河流入海。此外加强乡镇和农村生活污水的治理,避免农村生活污水大量汇入河流,也是防治入海河流对近岸海域带来卫生风险增加的主要途径。
从2011—2016年,禽畜养殖增长率不高,但沿海三市城镇人口有18.10%~21.28%的增长[17, 20]。廉州湾东南部海域和北海南部海域的银滩海域超标区域陆源污染物主要是城市、港口、船只等生活污水或未有效处理的污水排入,此两处均为低矮地段并伴有大量船只停靠的码头,应加快城镇生活污水处理厂配套设施的建设,适当布置配套动力管网以提高低矮地段污水收集率,提高城镇污水处理能力及船只污染物回收处理能力,减少生活污水及船只污染物对近岸海域的影响,同时加强污水处理厂的灭菌消毒措施,减少病原微生物输入海区。
进一步加强对牡蛎养殖等水产养殖区域的生物体质量监测,尤其是茅尾海、龙门、金鼓江入海河口等海域的生物质量监测,卫生风险较高区域的水产品应尽量避免生食,需通过彻底的烹饪,杀死海产品中病原微生物,以降低食品卫生安全风险。结合调整养殖规模、产量及产品结构使目标污染物降低,以提高近岸海域水质,降低近岸海域水产养殖病害风险,确保海产品的养殖和食用安全。
| [1] |
陈兰, 蒋清华, 石相阳, 等. 北部湾近岸海域环境质量状况、环境问题分析以及环境保护建议[J]. 海洋开发与管理, 2016, 33(6): 28-32. DOI:10.3969/j.issn.1005-9857.2016.06.006 |
| [2] |
中华人民共和国环境保护部.2016中国近岸海域环境质量公报[Z].[S.l.: s.n.], 2017.
|
| [3] |
黎小正, 吴祥庆, 黄鸾玉, 等. 基于秩相关系数法分析广西钦州近江牡蛎增养殖区水质现状及变化趋势[J]. 江苏农业科学, 2012, 40(4): 365-367. DOI:10.3969/j.issn.1002-1302.2012.04.135 |
| [4] |
李昂臻.西安市典型地表水体常规水质指标与病原微生物的相关性研究[D].西安: 西安建筑科技大学, 2008.
|
| [5] |
王华然, 杨忠委, 刘美霞, 等. 天津地区典型地表水细菌污染状况与水质指标相关性研究[J]. 环境与健康杂志, 2015, 32(5): 408-411. |
| [6] |
张瑜斌, 章洁香, 肖俊华, 等. 湛江湾粪大肠菌群的时空分布及其与主要环境因子的关系[J]. 海洋环境科学, 2012, 31(4): 504-509. DOI:10.3969/j.issn.1007-6336.2012.04.010 |
| [7] |
张崇淼, 王晓昌, 周进宏, 等. 城市地表水中肠道病原微生物与粪便污染指示菌的关系研究[J]. 环境科学学报, 2012, 32(11): 2789-2794. |
| [8] |
蔡雷鸣, 肖莹. 福州近海牡蛎污染状况调查与评价[J]. 海洋环境科学, 2006, 25(1): 80-83. DOI:10.3969/j.issn.1007-6336.2006.01.022 |
| [9] |
雷铠璐, 王睿翔, 王哲, 等. 青岛第一海水浴场和第六海水浴场夏季海水细菌学监测及卫生学分析[J]. 中国卫生检验杂志, 2016, 26(3): 400-402. |
| [10] |
张崇淼.水环境中肠道病原体的PCR检测方法与健康风险评价研究[D].西安: 西安建筑科技大学, 2008.
|
| [11] |
梅玲玲, 潘雪霞, 朱敏, 等. 浙江省副溶血性弧菌污染水平及贝类海产品风险评估[J]. 中国人兽共患病学报, 2012, 28(7): 700-704,717. DOI:10.3969/cjz.j.issn.1002-2694.2012.07.011 |
| [12] |
王舟, 黄薇, 潘柳波, 等. 2006—2008年深圳市水产品污染状况分析[J]. 中国食品卫生杂志, 2010, 22(2): 165-167. |
| [13] |
广西壮族自治区人民政府.广西壮族自治区海洋功能区划(2011—2020)[Z].[S.l.: s.n.], 2012.
|
| [14] |
广西生物多样性保护战略与行动计划编制工作领导小组. 广西多样性保护战略研究:上册[M]. 北京: 中国环境出版社, 2016.
|
| [15] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.海洋监测规范: GB 17378-2007[S].北京: 中国标准出版社, 2018.
|
| [16] |
黄自强, 张克, 许昆灿, 等.海水水质标准: GB3097-1997[S].北京: 中国标准出版社, 1997.
|
| [17] |
全国污染普查水产养殖业污染源产排污系数测算项目组. 第一次全国污染源普查水产养殖业污染源产排污系数手册[M]. 北京: 环境科学出版社, 2011.
|
| [18] |
广西壮族自治区统计局. 广西统计年鉴-2017[M]. 北京: 中国统计出版社, 2017.
|
| [19] |
谢华. 广西省近岸海域海水环境质量与入海陆域污染影响对策研究[J]. 环境科学与管理, 2018, 43(3): 30-36. DOI:10.3969/j.issn.1673-1212.2018.03.008 |
| [20] |
广西壮族自治区统计局.广西统计年鉴-2012—2016[M]: 北京: 中国统计出版社, 2012—2016.
|



