2. 广西壮族自治区中国科学院广西植物研究所, 广西桂林 541006
2. Guangxi Institute of Botany, Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
胡椒碱是从胡椒科植物种子中提取的一种生物碱,是其主要活性成分。胡椒碱具有抗氧化、免疫调节和抗肿瘤功效,而且还能促进药物吸收代谢等[1-4]。此外,胡椒碱还是第一个被发现的、也是最有效的生物增强剂[5],可以增加许多药物的生物利用度,如人体口服胡椒碱能大幅提高姜黄素的生物利用度[6]。但据研究表明,当把胡椒碱作为主药时,由于它的难溶性导致其在体内无法达到有效治疗浓度[7],因此制成固体分散体是提高其疗效的重要方法。主流学者认为固体分散技术是以20世纪60年代由Sekiguehi(1961年)制备磺胺噻唑(ST)一尿素固体分散物为起源[8]。固体分散体(Solid dispersion,SD)指药物能够高度分散于其中,能大大提高药物生物利用度,并以固体形式存在的分散系统。在固体分散体中,可采用水溶性载体,使药物高度分散在载体中,在固体分散体溶解时可增强药物的可润湿性,从而改善药物的溶解速率,提高其口服生物利用度[9]。根据载体的不同特点,双载体固体分散体具有可调节药物的释放速度、增加药物溶解度等优点[10-12]。其中载体醋酸羟丙基甲基纤维素琥珀酸酯(HPMC-AS)具有两个特点,它既可以作为润湿剂提高药物的可润湿性,也能抑制药物结晶、提高药物稳定性[13]。聚乙烯吡咯烷酮PVP K30本身水溶性较好,同时可以使疏水性药物具有亲水性,从而促进药物的溶出[14]。因此,本实验使用醋酸羟丙基甲基纤维素琥珀酸酯(HPMC - AS)的3种异构体(HPMC-AS-HF、HPMC-AS-MF、HPMC-AS-LF,分别简称为HF、MF和LF)和聚乙烯吡咯烷酮PVP K30(K30)为原料,拟制得兼顾溶出速度和稳定性的双载体固体分散体,提高胡椒碱的溶出,从而提高其生物利用度。
1 材料与方法 1.1 材料紫外分光光度计(UV-1600PC,上海美谱达仪器有限公司),恒温磁力搅拌器(中国化工),差示扫描量热仪(STA-449-F3,德国Netzsch公司);红外分光光度计(IRrestige 21,日本岛津制作所),台式高速离心机(TG16-WS,湖南湘仪仪器有限公司),恒温水浴锅(HH-6,金坛区白塔新宝仪器厂)。
Pip(阿拉丁);聚乙烯吡咯烷酮PVP K30(K30,BAS);HPMC-AS-HF(HF,Ashland);HPMC-AS-MF(MF,Ashland);HPMC-AS-LF(LF,Ashland)。氯化钠(分析纯,西陇化工),氢氧化钠(分析纯,西陇化工),无水乙醇(分析纯,西陇化工),磷酸二氢钠(分析纯,西陇化工),乙腈(色谱纯,TEDIA),二甲基亚砜(分析纯,西陇化工),二氯甲烷(分析纯,光华化工)。
1.2 方法 1.2.1 样品的制备按照K30:HF= 4:1、K30:LF= 4:1、K30:MF= 4:1、MF:HF=3:1、MF:HF=2:1、MF:HF=1:1比例制备载体。将Pip和载体(1:10,W:W)加入50 mL乙醇-二氯甲烷溶液(V 乙醇:V 二氯甲烷=1:1)中,充分溶解。将溶液在60℃下减压旋转蒸发至玻璃态,转移至40℃真空干燥箱内干燥24 h,取出研磨,过100目筛,即得Pip无定型态双载体固体分散体,置于干燥器室温保存备用。
1.2.2 线性关系考察取Pip溶于无水乙醇中配制成4 mg/mL溶液,另外将适量载体分别溶于无水乙醇中,于200~500 nm波长处对上述溶液进行扫描,以无水乙醇作空白,确定Pip在342 nm处有最大吸收,且载体在此波长处无吸收,因此,选择342 nm为Pip的测定波长。配制1~10 μg/mL的Pip-乙醇溶液,在342 nm处用紫外分光光度计测定其对应的吸光度A。以吸光度A对浓度C进行线形回归,C=9.27017A+0.226 96,R2= 0.999 8。
1.2.3 热重分析称取3~4 mg的Pip标准品或Pip双载体固体分散体置于标准的铝坩埚内,采用DSC测定Pip的熔点(TM)、摩尔熔融热(△HM)。升温范围35~220℃;升温速率为10℃/min;以氮气为保护气,氮气流为10 mL/min。
1.2.4 X-射线粉末衍射分析采用溴化钾压片,对样品进行红外分析。扫描范围:400~4 000 cm-1得到溴化钾背景曲线。重复3次,取平均值并计算其标准偏差。
1.2.5 平衡溶解度测试称取40 mg载体,将其溶于200 mL磷酸盐缓冲液中,磁力搅拌下至完全溶解,加入100 mg Pip。分别于24 h、48 h取3 mL溶液,14 000 r/min离心10min。取上层清液0.5 mL稀释至4 mL。采用紫外分光光度计测定吸光度,并按照其线性关系曲线得出浓度。重复3次,取平均值并计算其标准偏差。
1.2.6 超饱和试验将Pip溶解在二甲基亚砜(DMSO)中,药物浓度为56 mg/mL,各种不同种类和浓度载体的PBS缓冲液(pH值为6.8)为反溶剂。在80 mL PBS缓冲液中加入0.16 g载体,37℃水浴下磁力搅拌至充分溶解,加入Pip-DMSO溶液(56 mg/mL) 100 μL。在第1 min、5 min、15 min、30 min、45 min、60 min、90 min、120 min、180 min和240 min各吸取3 mL,14 000 r/min离心10 min。取上层清液0.5 mL稀释至4 mL,使用紫外可见分光光度计测定其吸光度,随后根据线性关系曲线计算浓度。每个样品测3次,取平均值并算出其标准偏差。
1.2.7 体外溶出试验取32 mg Pip、320 mg Pip固体分散体(含Pip 32 mg)分别加入200 mL PBS缓冲液,37℃水浴恒温搅拌,于1 min、5 min、10 min、20 min、30 min、45 min、60 min、90 min、120 min、180 min、240 min、24 h分别取3 mL溶液(取出溶液后,立即补充3 mL同批次缓冲液)。将取出的溶液在14 000 r/min下离心10 min,吸取上层清液0.5 mL稀释至4 mL,使用紫外可见分光光度计按标准工作曲线测定药物浓度。重复3次,取平均值并计算其标准偏差。
2 结果与分析 2.1 热重分析通过DSC对比图(图 1)可以发现,这些载药量为10%的双载体固体分散体与无定形态胡椒碱的DSC曲线一致,没有结晶峰。由此可以确定这些载药量为10%的双载体固体分散体样品中的胡椒碱均为无定形态。
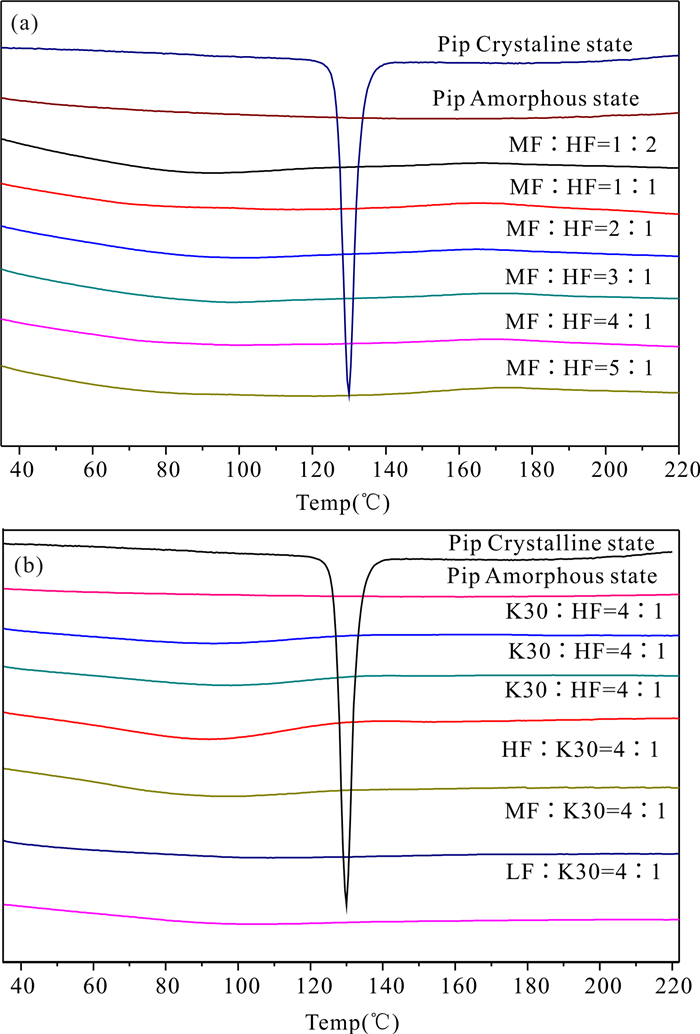
|
| (a)MF/HF双载体固体分散体,(b)K30/HF、K30/MF、K30/LF固体分散体 (a)MF/HF various proportions of solid dispersion with double carriers, (b)K30/HF, K30/MF, K30/LF various proportions of solid dispersion with double carriers 图 1 双载体固体分散体的DSC图谱 Fig.1 DSC spectra of solid dispersion with double carriers |
2.2 X-射线粉末衍射分析
如图 2a所示,结晶态Pip在1 633.7 cm-1与1 583.5 cm-1处有强吸收峰,分别是酰胺基的特征吸收峰与苯环的特征吸收峰[15]。而无定形态样品在这两处发生红移,这有可能是高分子中所含羧基与苯环共轭与酰胺基形成的氢键发生变化导致的。而对比标准品、样品和无定形态Pip的曲线可以发现,所有样品的吸收峰与无定型态Pip位置相同,都存在红移,且峰形都较圆滑,因此可以据此推断这些固体分散体样品全部为无定形态。从图 2b中可以看到,双载体固体分散体样品在1 748 cm-1左右有吸收峰,这是由于载体中羧基基团的振动吸收所引起的;与HF的1 743.9 cm-1和MF的1 739.7 cm-1相比,此处的吸收峰均发生较大偏移,进一步表明Pip的酰胺基与载体的羧基可能存在氢键作用。其偏离程度随着MF占比的增大而略有增加,这可能与高分子MF中羧基基团含量更多有关。
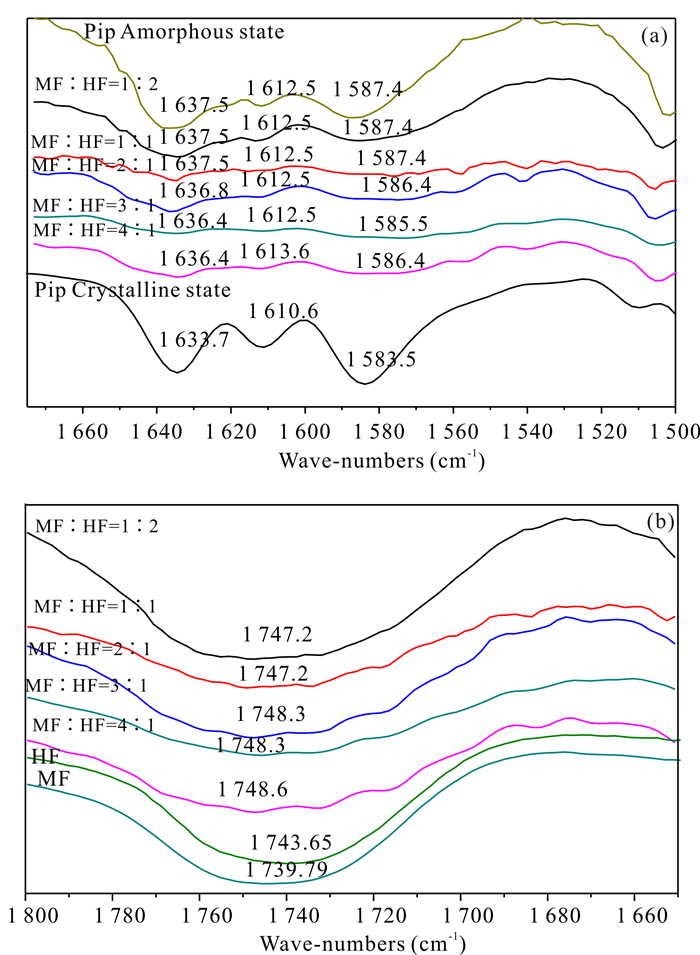
|
| 图 2 同双载体固体分散体样品的红外图谱 Fig.2 Infrared spectra of solid dispersion samples of different double carriers |
2.3 平衡溶解度测试结果与分析
如图 3a所示,Pip双载体样品的平衡溶解度均高于Pip无载体样品(图 3a、b中Blank),说明载体的存在对Pip有一定的增溶作用。而在图 3b中,双载体样品平衡溶解度随载体中MF占比增大而增大,这与高分子中的羧基含量直接相关(MF的羧基含量比HF略高)。这说明载体和药物之间存在酸碱相互作用,从而提高Pip的平衡溶解度。而MF: HF=4: 1的双载体样品平衡溶解度有所下降,可能是HF占比过低,抑制Pip结晶效果所致。
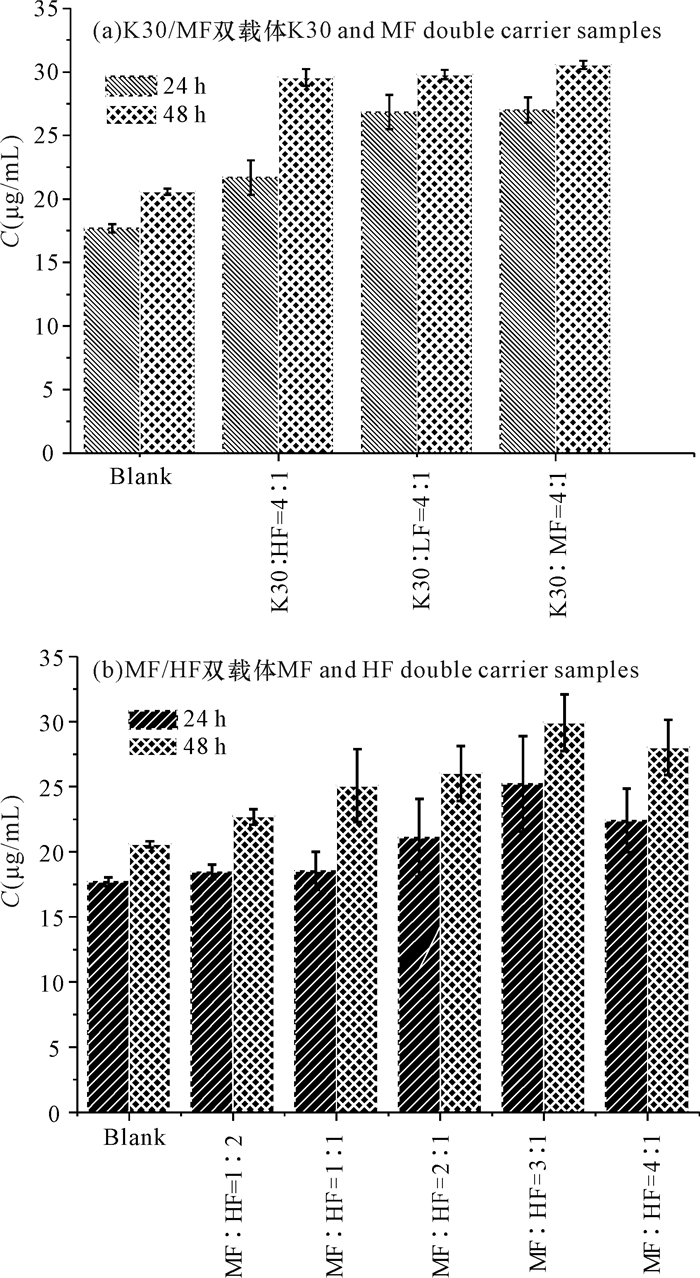
|
| 图 3 不同双载体样品的平衡溶解度对比 Fig.3 Comparison of equilibrium solubility of different double carrier samples |
2.4 超饱和实验
如图 4a所示,MF、HF对Pip超饱和溶液具有较好的稳定作用,这是因为MF、HF中含有羧基,羧基与Pip形成氢键,从而对超饱和溶液存在稳定作用。HF、MF、LF与K30制成双载体有增溶作用,超饱和浓度远超平衡溶解度,这可能与K30的水溶性好有关。但是K30与LF双载体相比于其他几种双载体效果较差,这与LF稳定Pip超饱和溶液能力差有关。LF羧基含量最高因而疏水性最弱,对Pip超饱和溶液稳定性最差;相反HF具有良好的超饱和稳定效果,MF对超饱和稳定效果次之。以上结果表明影响高分子载体维持药物超饱和溶液的因素包括氢键,氢键相互作用能够维持更高的超饱和浓度,疏水性越高对超饱和溶液稳定效果越好[6-8]。
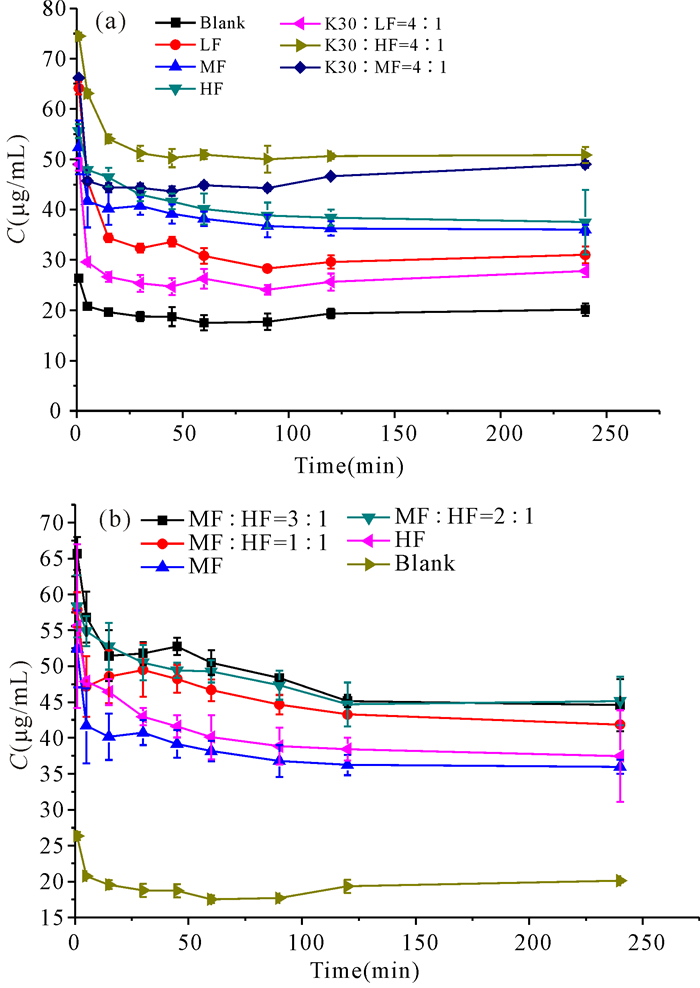
|
| 图 4 不同样品的超饱和对比曲线 Fig.4 Supersaturated comparison curve of different samples |
从图 4b中可以看见HF与MF双载体固体分散体的超饱和测试中,随着MF占比逐渐增大,同一时间的Pip浓度均有小幅上升,这与平衡溶解的结果类似。这些现象都与高分子载体中的羧基含量有直接相关,MF比HF羧基含量略高,因此高分子与药物的氢键相互作用更强。
2.5 体外溶出实验如图 5所示,有载体存在的样品溶出率均高于无载体存在的样品。随着样品中HF比例增加,几种样品的溶出率均增加。这些双载体的固体分散体溶出效果从好到差依次是K30/HF、K30/MF、K30/ LF,这与超饱和测试的结果一致。如图 5a所示,在MF与HF混合使用时,MF/HF比例为3:1时药物释放速度最缓慢,释放率最高;MF/HF比例为2:1时溶出效果次之;MF/HF比例为1:1时溶出效果最差,但是均比单一载体溶出效果好,与超饱和结果一致。
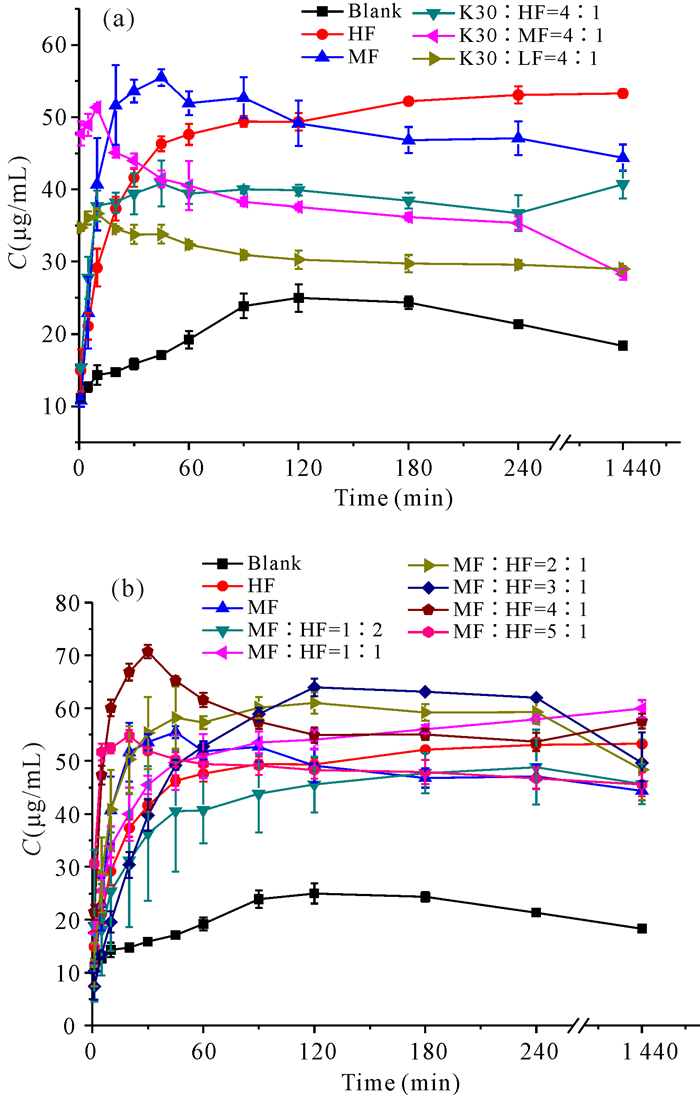
|
| 图 5 不同样品的溶出曲线对比 Fig.5 Dissolution curve comparison of different samples |
3 结论
高分子载体维持药物超饱和溶液的能力与高分子载体-药物相互作用、高分子的空间位阻等有关。Pip的酰胺基与高分子载体的羧基存在氢键作用,其强弱取决于高分子中羧基的含量;另外,高分子载体与Pip间的酸碱相互作用有利于增加Pip的溶解度,其增加程度与羧基的含量成正向关系。本实验选用不同羧基含量的纤维素衍生物HF、MF、LF和PVP-K30按比例组合为载体,采用溶剂法将胡椒碱与双载体制备成固体分散体。DSC结果表明固体分散体(载药量为10%)中Pip均以无定形态分散在载体中,且与纯药相比能显著提高药物溶出度和溶出速度,红外分析结果显示胡椒碱与载体之间有相互作用。根据平衡溶解度、超饱和、溶出等实验结果,PVP-K30与LF按一定比例所制的双载体固体分散体效果相比于单载体固体分散体效果稍差。HF与MF双载体固体分散体溶出效果相比于单载体的溶出效果较好,MF/HF比例为3:1时效果较好,且随MF所占比例增大溶出速度增加。因此,HF与MF在双载体以一定比例结合应用可以提高胡椒碱的超饱和度和溶出度。
| [1] |
RAAY B, MEDDA S, MUKHOPADHYAY S, et al. Targeting of piperine inter-calated in mannose-coated liposomes in experimental leishmaniasis, Indian[J]. J Biochem Biophys, 1999(36): 248-251. |
| [2] |
DOUCETTE C D, HILCHIE A L, LIWSKI R, et al. A dietary phyto-chemical, inhibits angiogenesis[J]. J Nutr Biochem, 2013(24): 231e. |
| [3] |
LI S, WANG C, WANG M W, et al. Antidepressant like effects of piperine in chronic mild stress treated mice and its possible mechanisms[J]. Life Sciences, 2007, 80(15): 1373-1381. DOI:10.1016/j.lfs.2006.12.027 |
| [4] |
VAIBHAV K, SHRIVASTAVA P, JAVED H, et al. Piperine suppresses cerebral ischemia-reperfusion-induced inflammation through the repression of COX-2, NOS-2, and NF-κB in middle cerebral artery occlusion rat model[J]. Molecular and Cellular Biochemistry, 2012, 367(1/2): 73-84. |
| [5] |
ATAL N, BEDI K L. Bioenhancers:Revolutionary concept to market[J]. Journal of Ayurveda and Integrative Medicine, 2010, 1(2): 96-99. DOI:10.4103/0975-9476.65073 |
| [6] |
SINGH S, JAMWAL S, KUMAR P. Piperine enhances the protective effect of curcumin against 3-NP induced neurotoxicity:Possible neurotransmitters modulation mechanism[J]. Neurochemical Research, 2015, 40(8): 1758-1766. DOI:10.1007/s11064-015-1658-2 |
| [7] |
PACHAURI M, GUPTA E D, GHOSH P C. Piperine loaded PEG-PLGA nanoparticles:Preparation, characterization and targeted delivery for adjuvant breast cancer chemotherapy[J]. Journal of Drug Delivery Science and Technology, 2015, 29: 269-282. DOI:10.1016/j.jddst.2015.08.009 |
| [8] |
SHIN S C. Studies on hydrophobic drug-soluble carrier coprecitates(Ⅱ)[J]. Archives of Pharmacal Research, 1979, 2(1): 49-64. DOI:10.1007/BF02856432 |
| [9] |
KARAVAS E, KTISTIS G, XENAKIS A, et al. Effect of hydrogen bonding interactions on the release mechanism of felodipine from nanodispersions with polyvinylpyrrolidone[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 63(2): 103-114. DOI:10.1016/j.ejpb.2006.01.016 |
| [10] |
谢燕, 邹珊珊, 李国文, 等. 醋柳黄酮固体分散体的制备研究[J]. 中草药, 2010, 41(9): 1469-1473. |
| [11] |
宗莉, 肖衍字, 陈伶俐. 用二元载体固体分散技术提高尼索地平溶出度和调节溶出速率[J]. 中国药学杂志, 2005, 40(3): 203-206. DOI:10.3321/j.issn:1001-2494.2005.03.014 |
| [12] |
张烨, 郑颖, 土一涛. 复方丹参制剂的质量研究[J]. 中成药, 2009, 31(12): 1855-1860. DOI:10.3969/j.issn.1001-1528.2009.12.017 |
| [13] |
BOGHRA R J, KOTHAWADE P C, BELGAMWAR V S, et al. Solubility, dissolution rate and bioavailability enhancement of irbesartan by solid dispersion technique[J]. Chem Pharm Bull (Tokyo), 2011, 59(4): 438-41. DOI:10.1248/cpb.59.438 |
| [14] |
上海医药工业设计院药物制剂教研部. 药用辅料应用技术[M]. 第2版. 北京: 中国医药科技出版社, 2002: 72.
|
| [15] |
李鑫, 史金儒, 羊梦诗, 等. 胡椒生物碱提取, 几何结构以及红外光谱的研究[J]. 光谱学与光谱分析, 2016, 36(7): 2082-2088. |



