2. 桂林医学院药学院, 广西桂林 541004;
3. 百色学院食品与农业工程学院, 广西百色 533000
2. College of Pharmacy, Guilin Medical University, Guilin, Guangxi, 541004, China;
3. College of Food and Agricultural Engineering, Baise University, Baise, Guangxi, 533000, China
扁桃斑鸠菊(Vernonia amygdalina Del.)别名桃叶斑鸠菊、杏叶斑鸠菊、神奇叶、尖尾凤、肝连、苦树、苦胆叶、苦叶、苦茶叶、南非树等,原产于热带非洲,在尼日利亚等地被当作一种蔬菜[1]。在我东南沿海地区被称为“将军叶”,这是由于它生长能力强,四季皆宜种。另外,它又俗称苦茶[2]。扁桃斑鸠菊作为药食两用特色植物,其叶味苦涩性凉,具有功能散热、凉血和清热解毒的功效,适用于降血压、降胆固醇、风热性或血热性皮肤病,对闪光、老花眼、近视及青光眼也有显著的功效[3]。东南亚民间常用扁桃斑鸠菊水煎剂治疗发热、疟疾、腹泻、痢疾、咳嗽、头痛和胃痛等疾病,该水煎剂具有抗氧化性、保肝、促胃酸分泌、降血脂、抗疟原虫[4]等功效,扁桃斑鸠菊水煎剂中含有的倍半萜内酯和斑鸠菊苷都有很强的抗癌药理活性[5-6]。医学研究表明,黄酮类物质能通过多种途径发挥较强的抗肿瘤作用,其主要机理包括:调节免疫功能[7-8]、降低细胞黏附和促进细胞间信号传递[9]、促进细胞凋亡[10]、清除自由基和抗氧化作用[11-12]等机制。因此,研究扁桃斑鸠菊的黄酮含量和抗氧化在卫生保健和医药领域具有广泛的前景。
扁桃斑鸠菊目前的研究主要集中在化学成分提取[13]、结构分析[14]和快速繁殖[15]等方面,而运用响应面分析法优化总黄酮的提取及抗氧化性的研究报道较少。由于取材的不同,提取条件的选择差异使得扁桃斑鸠菊总黄酮发挥的作用也不尽相同[16]。本研究拟运用单因素和响应面试验相结合,通过超声波辅助对扁桃斑鸠菊总黄酮的提取工艺进行优化,通过紫外可见分光光度法[16]对黄酮含量进行测定并研究了其体外抗氧化活性,确定扁桃斑鸠菊黄酮提取的最佳工艺,从而为其进一步开发利用提供理论基础。
1 材料与方法 1.1 原料与试剂供试材料:扁桃斑鸠菊原材料于2018年9月采自广西植物研究所喀斯特药用植物园,取其完整叶片,烘干、粉碎后过60目筛备用。
供试试剂:芦丁标准品(批号:MUST- 12040302,中国药品生物制品检定所);蒸馏水;乙醇、5%亚硝酸钠、10%硝酸铝、4%氢氧化钠、Al(NO 3)3、NaNO2、NaOH、VC、铁氰化钾、磷酸盐缓冲液、三氯乙酸、三氯化铁、DPPH、Tris-HCL、邻苯三酚、HCl、邻二氮菲、PBS、FeSO4、H2O2均为分析纯试剂,均购自桂林卓一生物有限公司。
1.2 仪器与设备TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);DL-720E智能超声波;电子分析天平(梅特勒-托利多仪器有限公司)。
1.3 方法 1.3.1 标准曲线的制备精密称取真空干燥至恒重的芦丁标准品20 mg,无水乙醇溶解制成0.4 mg/mL的对照品溶液[17]。分别取制备好的对照品溶液0.0 mL,0.1 mL,0.2 mL,0.4 mL,0.6 mL,0.8 mL,1.0 mL及提取液1.0 mL,置于25 mL容量瓶中。加50%乙醇至10 mL,加5%亚硝酸钠1 mL,混匀,静置6 min;加10%硝酸铝溶液1 mL,混匀,静置6 min;加4%氢氧化钠溶液10 mL,50%乙醇调至刻度,混匀,得空白液、对照品溶液及样品供试液;静置15 min后在190~900 nm处进行光谱扫描,确定选用510 nm作为测定波长。以吸光度为纵坐标,总黄酮浓度为横坐标绘制回归曲线,回归方程为y=0.2038x-0.0078,R2=0.999 2,总黄酮浓度为0.001 3~0.013 mg/mL,线性关系良好。
1.3.2 供试品溶液的制备称取扁桃斑鸠菊样品粉末0.5 g,按照料液比为1:48.5 g/mL加无水乙醇24.5 mL,61.9℃水浴提取20 min,超声波频率为35 kHz,超声波功率为409.6 W,提取结束后过滤,洗涤液合并,定容至50 mL,即得供试品溶液。
1.3.3 扁桃斑鸠菊黄酮提取工艺优化试验 1.3.3.1 单因素试验(1)超声波频率对扁桃斑鸠菊黄酮得率的影响
准确称取0.5 g样品粉末,按照料液比1:20 g/ mL加入50%乙醇10 mL,40℃水浴中提取30 min,超声波功率为180 W,超声波频率分别为高频(61 kHz)和低频(35 kHz),过滤,定容至50 mL,取1 mL移至25 mL容量瓶中。
(2)超声波功率对扁桃斑鸠菊黄酮得率的影响
准确称取样品粉末0.5 g,按料液比1:20 g/mL加入50%乙醇10 mL,40℃水浴中提取30 min,超声波功率分别为60 W、180 W、300 W、420 W、540 W,超声波频率为高频(61 kHz),过滤,定容至50 mL,按照制备芦丁标准曲线步骤加样,测定吸光度,计算总黄酮含量。
(3)提取温度对扁桃斑鸠菊黄酮得率的影响
准确称取样品粉末0.5 g,按料液比1:20 g/mL加入50%乙醇10 mL,分别在30℃、50℃、60℃、70℃、90℃水浴中提取30 min,超声波功率分别为420 W,超声波频率为高频(61 kHz),过滤,定容至50 mL,按照制备芦丁标准曲线步骤加样,测定吸光度,计算总黄酮含量。
(4)乙醇浓度对扁桃斑鸠菊黄酮得率的影响
准确称取样品粉末0.5 g,按料液比1:20 g/mL,分别加入20%、40%、60%、80%、无水乙醇10 mL,在60℃水浴中提取30 min,超声波功率为420 W,超声波频率为高频(61 kHz),过滤,定容至50 mL,按照制备芦丁标准曲线步骤加样,测定吸光度,计算总黄酮含量。
(5)料液比对扁桃斑鸠菊黄酮得率的影响
准确称取样品粉末0.5 g,分别按料液比1:20 g/ mL、1:30 g/mL、1:40 g/mL、1:50 g/mL、1:60 g/mL,加入无水乙醇V mL,在60℃水浴中提取30 min,超声波功率为420 W,超声波频率为高频(61 kHz),过滤,定容至50 mL,按照制备芦丁标准曲线步骤加样,测定吸光度,计算总黄酮含量。
(6)提取时间对扁桃斑鸠菊黄酮得率的影响
准确称取样品粉末0.5 g,按料液比1:20 g/mL,加入无水乙醇10 mL,在60℃水浴中分别提取10 min、30 min、60 min、90 min、120 min,超声波功率为420 W,超声波频率为高频(61 kHz),过滤,定容至50 mL,按照制备芦丁标准曲线步骤加样,测定吸光度,计算总黄酮含量。
1.3.3.2 黄酮得率的计算方法| $ 黄酮得率\left( \% \right) = \left( {{C^*}V} \right)/{M^*}100\% , $ |
式中[18]:C为提取液中黄酮的含量(mg/mL);V为提取液体积(mL),M为样品粉末质量(g)。
1.3.3.3 响应面分析采用Design Expert 8.0.6软件设计响应面试验。根据Box-Behnken的中心组合试验设计原理,从单因素试验中选取对提取结果影响比较大的4个因素:料液比(A)、超声功率(B)、提取温度(C)、提取时间(D)为自变量,黄酮得率为响应值,共计29个试验点进行组合试验[19-22]。因素与水平见表 1。
| 水平 Level |
因素Factor | |||
| A(g/mL) | B(W) | C(℃) | D(min) | |
| -1 | 1: 30 | 180 | 50 | 10 |
| 0 | 1: 40 | 300 | 60 | 30 |
| 1 | 1: 50 | 420 | 70 | 60 |
1.3.4 体外抗氧化活性试验 1.3.4.1 对· OH的清除作用
试管中加入1 mL 0.75 mol/L邻二氮菲,2 mL pH值为7.45的PBS溶液、1 mL蒸馏水、1 mL 0.75 mmol/L FeSO 4溶液,1 mL 0.01% H2O2,充分混匀后于37℃下恒温水浴1 h。536 nm处测定其吸光度Ap;用1 mL水代替H2O2,测定其吸光度Ab;用1 mL样液代替1 mL水,测定其吸光度As[23]。以VC做对照。
| $ \centerdot {\rm{OH清除率 }}\left( \% \right) = \left( {A{\rm{s}} - A{\rm{p}}} \right)/{\rm{ }}\left( {A{\rm{b}} - A{\rm{p}}} \right) \times 100\% {\rm{。}} $ |
不同浓度的黄酮样液与DPPH•溶液等体积混合,30 min后用无水乙醇作参比,在517 nm处测定其吸光度A1,测定不同浓度的样液与无水乙醇等体积混合液的吸光度A2,以及DPPH•溶液与无水乙醇等体积混合液的吸光度A0。取3次平行试验结果根据下列公式计算不同浓度的黄酮样液对DPPH·的清除率[24]。以VC做对照。
| $ {\rm{DPPH}} \cdot {\rm{清除率}}\left( \% \right) = [{A_0} - \left( {{A_1} - {A_2}} \right)]/{A_0} \times 100\% {\rm{。}} $ |
取5 mL 0.05 mol/L,pH值为8.2的Tris-HCl缓冲液25℃水浴预热20 min,分别加入1 mL样液,0.5 mL 25 mmol/L的邻苯三酚,混匀后25℃水浴准确反应4 min,立即加入2滴8 mol/L HCl终止反应。299 nm处测定吸光度A'1,空白对照组的吸光度A'0。将邻苯三酚溶液用0.5 mL蒸馏水代替,得到吸光度A' 2。取3次平行试验结果计算样液对O2-•的清除率[25]。以VC做对照。
| $ {\rm{O}}_2^ - \cdot {\rm{清除率}}\left( \% \right) = [{{A'}_0} - \left( {{{A'}_1} - {{A'}_2}} \right)]/{{A'}_0} \times 100\% 。$ |
1.0 mL样液加入2.5 mL的1%铁氰化钾溶液和2.5 mL的0.22 mol/L磷酸盐缓冲液,混合均匀后于50℃水浴中反应30 min,迅速冷却加入10%三氯乙酸2.5 mL,在4 000 r/min下离心10 min。最后取2.5 mL上清液,加2.5 mL蒸馏水和2.5 mL 0.1%三氯化铁溶液,混匀后静置10 min测定700 nm处的吸光度值[26]。以VC做对照。
2 结果与分析 2.1 单因素试验结果 2.1.1 提取温度的选择如图 1所示,在超声处理中,扁桃斑鸠菊中总黄酮的得率随水浴温度的升高先增加后降低,在70℃时,所提取的总黄酮得率达到最高值3.89%。继续升高温度,总黄酮提取率逐渐降低。这可能是在高温情况下,样品粉末中其他物质析出,影响了总黄酮的提取;也可能是温度过高使得黄酮化合物的结构被破坏,导致得率降低。按照单因素试验条件选择,应暂以70℃为宜。
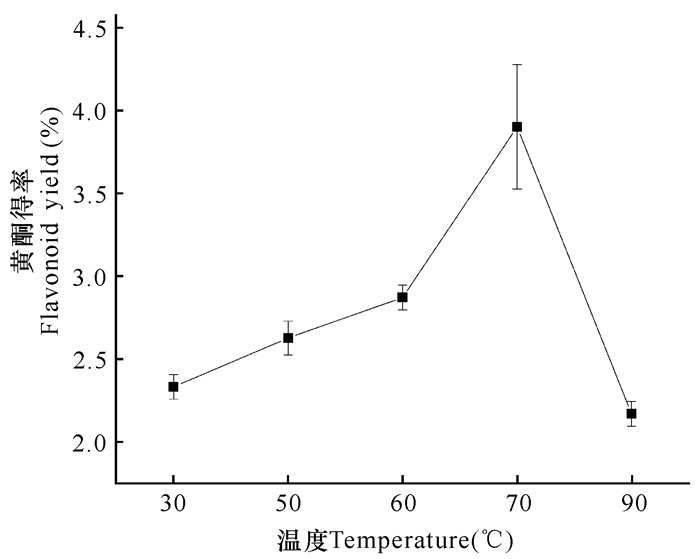
|
| 图 1 温度对黄酮提取率的影响 Fig.1 Effect of different temperature on yield of flavonoid |
2.1.2 乙醇浓度的选择
由图 2可知,随乙醇浓度的增加,总黄酮的提取率也随之增加。在无水乙醇条件下,所提取总黄酮得率达到9.02%。
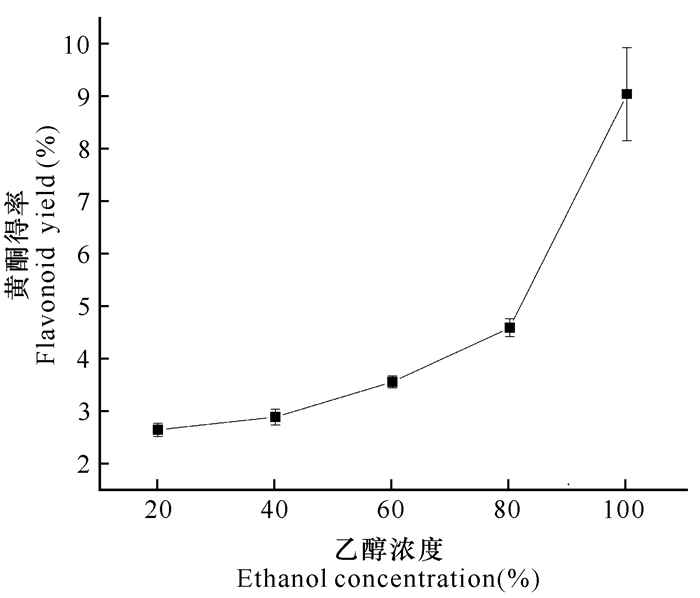
|
| 图 2 乙醇浓度对黄酮提取得率的影响 Fig.2 Effect of different ethanol concentration on yield of flavonoid |
2.1.3 料液比的确定
由图 3可知,随着料液提取液的增多,黄酮的提取率呈现先升高再降低再升高的趋势,在料液比1: 40(g/mL)处,所提取的扁桃斑鸠菊中黄酮得率达10.34%。随着提取液剂量增加,得率虽有增加但并没有达到1:40(g/mL)的水平,且继续增大溶剂量既浪费溶剂又不易回收,所以料液比1:40(g/mL)为宜。
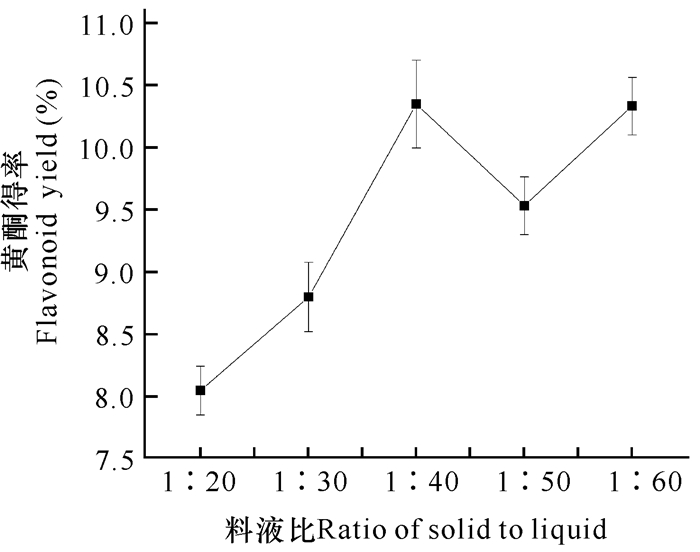
|
| 图 3 料液比对黄酮提取率的影响 Fig.3 Effect of different ratio of solid to liquid on yield of flavonoid |
2.1.4 超声功率的选择
由图 4可知,随着超声功率的增大,总黄酮的得率也相应增加。在超声波功率达到420 W时,所提取的扁桃斑鸠菊中黄酮得率达到最高值2.65%。继续增大超声功率,黄酮物质提取率开始降低。这可能是超声波功率的增大导致黄酮的结构被破坏,所以超声功率以420 W为宜。
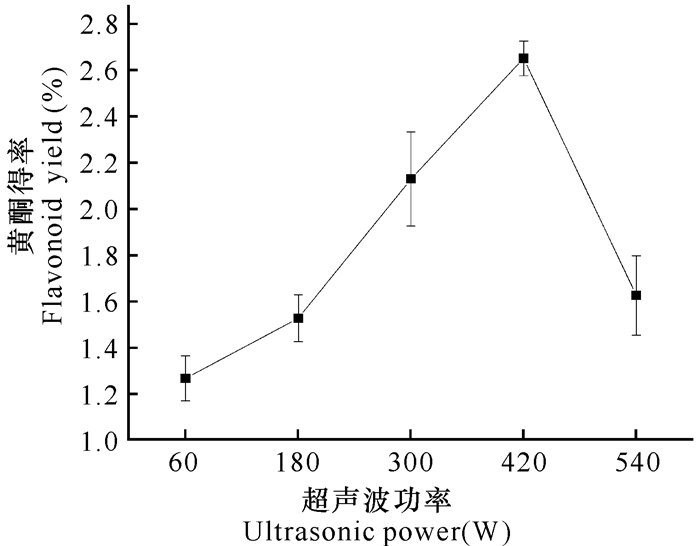
|
| 图 4 超声功率对黄酮提取率的影响 Fig.4 Effect of different ultrasonic power on yield of flavonoid |
2.1.5 提取时间的确定
由图 5可知,在10~90 min内扁桃斑鸠菊中总黄酮的得率随着时间的延长而增大,在90 min时黄酮提取率达到最高值10.93%。时间继续增加黄酮得率开始降低,这可能是因为时间太长,会使黄酮类化合物的结构遭到破坏,也可能是由于长时间提取会使粉末溶出其他杂质,使得总黄酮提取率降低。所以为保证黄酮物质的提取率以及减短提取周期,以90 min为宜。
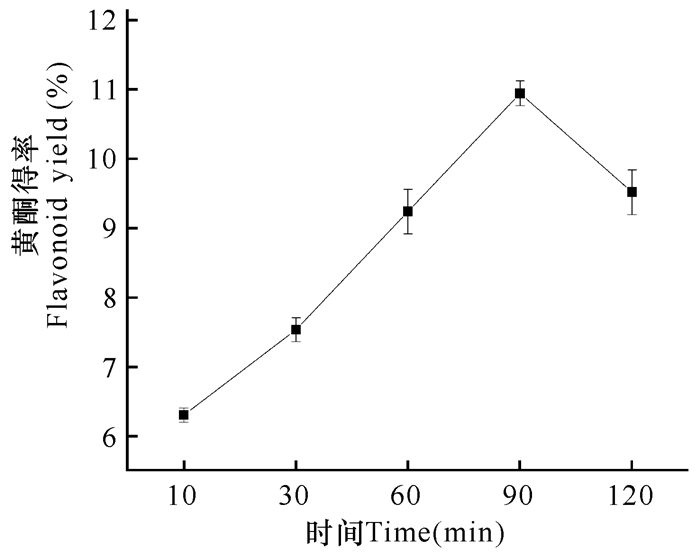
|
| 图 5 时间对黄酮提取得率的影响 Fig.5 Effect of different time on yield of flavonoid |
2.1.6 超声波高低频的选择
如图 6所示,当超声频率为低频(35 kHz)时,总黄酮的提取率达到1.23%,优于高频(61 kHz)。所以在超声辅助提取时选用低频(35 kHz)即可。
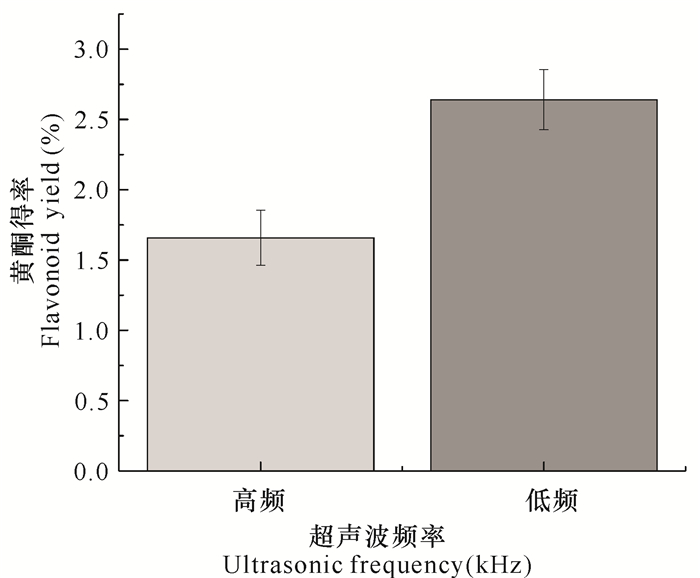
|
| 图 6 超声频率对黄酮提取率的影响 Fig.6 Effect of different ultrasonic frequency on yield of flavonoid |
2.2 响应面试验结果 2.2.1 试验结果
根据表 1设定的水平和因素,共设29个试验点,其中24个为析因点,5个为零点。得到各个试验条件的黄酮得率,试验结果见表 2、表 3。
| 试验号 Number |
料液比 Ratio of solid to liquid |
功率 Power (W) |
提取温度 Temperature (℃) |
提取时间 Time (min) |
黄酮得率 Flavonoid yield (%) |
| 1 | 1: 50 | 420 | 60 | 30 | 9.951 |
| 2 | 1: 50 | 180 | 60 | 30 | 9.755 |
| 3 | 1: 40 | 300 | 50 | 10 | 8.429 |
| 4 | 1: 40 | 180 | 60 | 60 | 10.245 |
| 5 | 1: 40 | 300 | 60 | 30 | 8.222 |
| 6 | 1: 40 | 420 | 60 | 10 | 10.196 |
| 7 | 1: 30 | 300 | 50 | 30 | 8.724 |
| 8 | 1: 40 | 300 | 60 | 30 | 8.823 |
| 9 | 1: 30 | 300 | 60 | 10 | 7.694 |
| 10 | 1: 40 | 420 | 70 | 30 | 11.865 |
| 11 | 1: 40 | 300 | 60 | 30 | 8.823 |
| 12 | 1: 40 | 180 | 50 | 30 | 10.491 |
| 13 | 1: 40 | 300 | 70 | 60 | 8.479 |
| 14 | 1: 30 | 300 | 70 | 30 | 8.675 |
| 15 | 1: 30 | 300 | 60 | 60 | 8.675 |
| 16 | 1: 30 | 420 | 60 | 30 | 8.626 |
| 17 | 1: 50 | 300 | 50 | 30 | 9.804 |
| 18 | 1: 40 | 300 | 70 | 10 | 10.540 |
| 19 | 1: 50 | 300 | 60 | 10 | 9.460 |
| 20 | 1: 40 | 180 | 70 | 30 | 9.068 |
| 21 | 1: 30 | 180 | 60 | 30 | 9.362 |
| 22 | 1: 40 | 420 | 50 | 30 | 8.430 |
| 23 | 1: 40 | 420 | 60 | 60 | 9.902 |
| 24 | 1: 40 | 180 | 60 | 10 | 9.460 |
| 25 | 1: 40 | 300 | 50 | 60 | 8.479 |
| 26 | 1: 40 | 300 | 60 | 30 | 8.822 |
| 27 | 1: 40 | 300 | 60 | 30 | 8.823 |
| 28 | 1: 50 | 300 | 70 | 30 | 11.030 |
| 29 | 1: 50 | 300 | 60 | 60 | 10.540 |
| 方差来源 Source of variance |
自由度 Degree of freedom |
平方和 Sum of square |
均方 Mean square |
F值 F value |
P值 P value |
显著性 Significant |
| 模型 Model |
14 | 20.84 | 1.49 | 4.91 | 0.002 6 | ** |
| A | 1 | 6.43 | 6.43 | 21.21 | 0.000 4 | ** |
| B | 1 | 0.029 | 0.029 | 0.095 | 0.762 0 | |
| C | 1 | 2.34 | 2.34 | 7.72 | 0.014 8 | * |
| D | 1 | 0.024 | 0.024 | 0.08 | 0.780 8 | |
| AB | 1 | 0.22 | 0.22 | 0.72 | 0.411 6 | |
| AC | 1 | 0.041 | 0.041 | 1.34 | 0.266 3 | |
| AD | 1 | 0.002 45 | 0.002 45 | 0.008 | 0.929 6 | |
| BC | 1 | 5.90 | 5.90 | 19.46 | 0.000 6 | ** |
| BD | 1 | 0.29 | 0.29 | 0.96 | 0.343 8 | |
| CD | 1 | 1.11 | 1.11 | 3.68 | 0.075 9 | |
| A2 | 1 | 0.11 | 0.11 | 0.37 | 0.554 8 | |
| B2 | 1 | 3.77 | 3.77 | 12.45 | 0.003 3 | ** |
| C2 | 1 | 0.77 | 0.77 | 2.56 | 0.132 2 | |
| D2 | 1 | 0.073 | 0.073 | 0.24 | 0.630 9 | |
| 残差 Residual |
14 | 4.24 | 0.30 | |||
| 失拟误差 Misfit error |
10 | 4.24 | 0.42 | 14 150 | < 0.000 1 | ** |
| 纯误差 Pure error |
4 | 0.001 2 | 0.003 | |||
| 总差 Total difference |
28 | 25.09 | ||||
| 注:*P < 0.05,显著;**P < 0.01,极其显著 Note:*P < 0.05,significant;**P < 0.01,extremely significant | ||||||
由软件分析得到回归方程为
| $ \begin{align} &Y=\text{8}\text{.82 + 0}\text{.73A + 0}\text{.049B + 0}\text{.44C + 0}\text{.045D +} \\ &\text{0}\text{.23AB + 0}\text{.32AC + 0}\text{.025AD + 1}\text{.21BC-0}\text{.27BD +} \\ &\text{0}\text{.53CD+0}\text{.13}{{\text{A}}^{\text{2}}}\text{+0}\text{.76B2+0}\text{.35}{{\text{C}}^{\text{2}}}\text{+0}\text{.11}{{\text{D}}^{\text{2}}}, \\ \end{align} $ |
其中Y为扁桃斑鸠菊黄酮含量的预测值。该模型的预测复相关系数R2=0.830 8,矫正系数Adj R2= 0.661 7,说明试验的实际值和预测值拟合度比较好。由图 3可以看出,P < 0.000 1,说明该模型极其显著,在统计学上是有意义的。A和C两个因素所模拟的一次项小于0.05,说明因变量和所选自变量之间的线性关系显著,该回归方程能代替试验真实点分析试验结果。模拟的二次项B2(P < 0.01),表明B因素对扁桃斑鸠菊黄酮的提取率达到极其显著的水平,交互项BC的P < 0.05,达到显著水平,由此可知,料液比与超声功率、超声功率与提取时间、提取温度与提取时间这些因素之间都存在一定的交互作用,并且它们之间的交互作用会对扁桃斑鸠菊中黄酮的提取率产生显著影响。
2.2.2 响应面交互作用分析通过Design-Expert 8.0.6软件,将AB、BD、CD交互进行分析比较,做出响应面曲线图,见图 7。由响应面三维图 7可知,当各因素在一定范围内增大时,对应的响应值也增大;但当响应值达到最高点,各因素的值继续增大时,其响应值却不断减小。等高线图的中心点在3D图上的投影即最高点,表明该点的提取率最高。
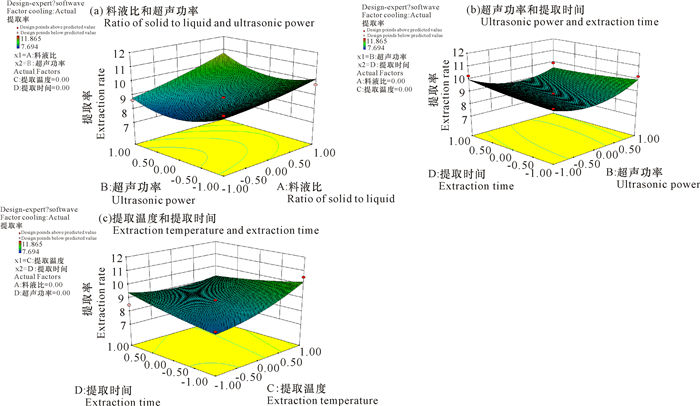
|
| 图 7 各个因子交互作用的响应面图 Fig.7 Response surface diagram for interaction of every two factors |
2.2.3 优化与验证试验
依据以上响应面试验模型和结果分析,得出最佳提取条件下的扁桃斑鸠菊中总黄酮的提取率为5.8%,料液比1:48.5 g/mL,超声功率409.6 W,提取温度61.9℃,提取时间20 min。在此最佳条件下,进行平行验证试验,重复5次,获得扁桃斑鸠菊黄酮提取率的平均值为5.7%。实际所测得提取率的平均值较预测值少0.1%,表明该模型的可靠性较高,并且提取工艺的重复性良好,在后续试验中可选取以上条件进行抗氧化活性研究。
2.3 扁桃斑鸠菊总黄酮体外抗氧化活性由图 8可以看出,扁桃斑鸠菊中黄酮对·OH、O2-•、DPPH·均能够起到清除作用,并且在试验浓度范围内,对自由基的清除能力呈现量效关系。当扁桃斑鸠菊黄酮浓度为2 mg/mL左右时,对·OH、O2-•和DPPH·的最大清除率分别为54.7%、79.2%和32%。在试验浓度范围内,扁桃斑鸠菊总黄酮和VC的还原力均随浓度的增大而增大(图 8d),线性关系较好,其中2 mg/mL的扁桃斑鸠菊黄酮与0.67 mg/ mL的VC几乎均等,可见其黄酮体外抗氧化活性较好。
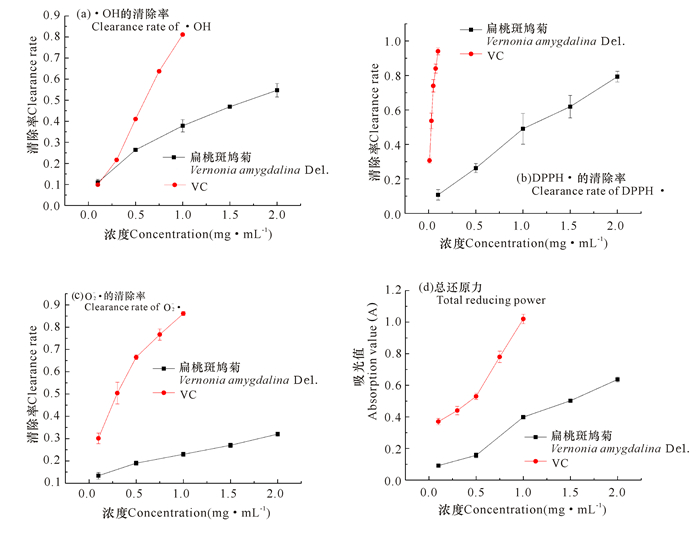
|
| 图 8 扁桃斑鸠菊总黄酮的· OH、O2- •、DPPH·清除率及还原力 Fig.8 · OH、O2- •、DPPH·clearance rate and reducing power of Vernonia amygdalina Del. flavonoids |
3 结论
本研究采用响应面法优化扁桃斑鸠菊黄酮的提取工艺条件,然后在最佳提取条件下测定其含量,并研究了其体外抗氧化活性。试验获得的最优提取工艺条件为超声波功率409.6 W,超声频率35 kHz,无水乙醇,料液比1:48.5 g / mL,提取温度61.9℃,提取时间20 min,总黄酮得率为5.7%。试验获得扁桃斑鸠菊黄酮对·OH、O2-•、DPPH·均能够起到清除作用,当其浓度为2 mg/mL左右时,对它们的最大清除率分别为54.7%、79.2%和32%。浓度为2 mg/mL的扁桃斑鸠菊黄酮与0.67 mg/mL VC的吸光值几乎均等,可见其黄酮体外抗氧化活性较好。通过热溶剂浸提超声波辅助提取法提取扁桃斑鸠菊中的黄酮类化合物,所用时间短、要求温度低、提取率好,方法简单易行,具有明显的优势。本研究采用响应面法确定该方法的最佳提取工艺,以期为药食两用植物扁桃斑鸠菊进一步产业化及开发新天然抗氧化剂和保鲜剂提供理论基础。
| [1] |
杨早. 南非叶化学成分及药理作用研究进展[J]. 南京中医药大学学报, 2013, 29(4): 397-400. DOI:10.3969/j.issn.1000-5005.2013.04.027 |
| [2] |
SANI A A, ALEMIKA E T, ABDULRAHEEM R O, et al. A study review of documented phytochemistruy of Vernonia amygdalina (family asteraceae) as the basis for pharmacologic activity of plant extract[J]. Journal of Natural Sciences Research, 2012, 2(7): 1-8. |
| [3] |
JISAKA M, KAWANAKA M, SUGIYAMA H, et al. Antischistosomal activities of sesquiterpene lactones and steroid glucosides from Vernonia amygdalina, possibly used by wild chimpanzees against parasite-related diseases[J]. Bioscience Biotechnology Biochemistry, 1992, 56(5): 845-846. DOI:10.1271/bbb.56.845 |
| [4] |
OBASEIKI-EBOR E E, ODUKOYA K, TELIKEPALLI H, et al. Antimutagenic activity of extracts of leaves of four common edible vegetable plants in Nigeria (west Africa)[J]. Mutation Research Letters, 1993, 302(2): 109-117. DOI:10.1016/0165-7992(93)90012-K |
| [5] |
KUPCHAN S M, HEMINGWAY R J, KARIM A, et al. Tumor inhibitors. XLVⅡ. Vernodalin and vernomygdin, two new cytotoxic sesquiterpene lactones from Vernonia amygdalina Del.[J]. Journal of Organic Chemistry, 1969, 34(12): 3908-3911. DOI:10.1021/jo01264a035 |
| [6] |
TADESSE A, GEBRE-HIWOT A, ASRES K, et al. The in vitro activity of Vernonia amygdalina on Leishmania aethiopica[J]. Ethiopian Medical Journal, 1993, 31(3): 183-189. |
| [7] |
闫鑫, 李青旺, 李健. 蕨菜总黄酮对宫颈癌作用的研究[J]. 黑龙江畜牧兽医:科技版, 2009(21): 95-97. |
| [8] |
BUNTRU A, ROTH A, NYFFENEGGER-JANN N J, et al. HemITAM signaling by CEACAM3, a human granulocyte receptor recognizing bacterial pathogens[J]. Archives of Biochemistry and Biophysics, 2012, 524(1): 77-83. DOI:10.1016/j.abb.2012.03.020 |
| [9] |
木合布力·阿布力孜, 王永波, 徐方野, 等. 新疆光果甘草黄酮对人肝癌Bel-7402细胞增殖的抑制活性研究[J]. 新疆医科大学学报, 2013, 36(12): 1744-1748. |
| [10] |
胡旭娇, 刘彩霞, 杨仙, 等. miR-21在山核桃叶总黄酮抑制人脐静脉内皮细胞增殖中的作用研究[J]. 浙江中医药大学学报, 2014, 38(5): 613-616, 640. |
| [11] |
孟庆华, 于晓霞, 张海凤, 等. 天然黄酮类化合物清除自由基机理及其应用进展[J]. 云南民族大学学报:自然科学版, 2012, 21(2): 79-83. |
| [12] |
郭志芳, 马川兰, 贾娟. 蜂胶中黄酮类化合物清除自由基性能研究[J]. 食品研究与开发, 2014, 35(7): 17-19. DOI:10.3969/j.issn.1005-6521.2014.07.005 |
| [13] |
江燕, 林翠梧, 柴桦, 等. 扁桃斑鸠菊挥发性化学成分的顶空固相微萃取-气相色谱-质谱法分析[J]. 时珍国医国药, 2010, 21(11): 2884-2886. DOI:10.3969/j.issn.1008-0805.2010.11.079 |
| [14] |
陆阳. 从扁桃斑鸠菊中分得两种新皂甙[J]. 国外医药:植物药分册, 1996, 11(3): 125-126. |
| [15] |
王华宇, 陈乃明, 杨利平, 等. 药用植物扁桃斑鸠菊的离体快速繁殖技术研究[J]. 湖北农业科学, 2016, 55(19): 5087-5090. |
| [16] |
柳建军, 许立松, 刘锡葵. 野生食用蔬菜甜菜树的抗氧化活性研究[J]. 食品科学, 2008, 29(8): 125-127. DOI:10.3321/j.issn:1002-6630.2008.08.022 |
| [17] |
史艳财, 邹蓉, 韦记青, 等. 黄花倒水莲总黄酮提取工艺研究[J]. 北方园艺, 2014(12): 134-137. |
| [18] |
赵娟娟. 分心木黄酮超声-微波协同提取及抗氧化性研究[J]. 食品研究与开发, 2018, 39(18): 70-76. DOI:10.3969/j.issn.1005-6521.2018.18.013 |
| [19] |
许静雅, 苏小军, 李清明, 等. 响应面法优化淮山中总黄酮提取工艺的研究[J]. 中国酿造, 2016, 35(5): 115-118. |
| [20] |
李云龙, 李红梅, 胡俊君, 等. 响应面法优化苦荞酒糟黄酮提取工艺的研究[J]. 中国酿造, 2013, 32(7): 38-42. DOI:10.3969/j.issn.0254-5071.2013.07.010 |
| [21] |
邓梦琴, 何夏怡, 何慕怡, 等. 响应面法优化菠萝蜜果皮黄酮提取工艺[J]. 食品工业科技, 2016, 37(5): 222-227. |
| [22] |
焦文静, 林洁荣, 叶健军, 等. 响应面分析法优化紫象草花青素提取工艺[J]. 黑龙江畜牧兽医:科技版, 2015(19): 11-15, 20, 294. |
| [23] |
蔡碧琼.稻壳黄酮类化合物的提取、精制及抗氧化活性研究[D].福州: 福建师范大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10394-2009096329.htm
|
| [24] |
朱会霞. 覆盆子黄酮抗氧化活性研究[J]. 现代食品科技, 2012, 28(10): 1302-1305. |
| [25] |
吴玉兰.金樱子总黄酮对氧化损伤HUVEC保护作用的研究[D].衡阳: 南华大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10555-1012458956.htm
|
| [26] |
高行恩, 王洪新. 不同提取方法对山药多糖含量及其体外抗氧化活性的影响[J]. 食品与发酵工业, 2015, 41(7): 256-262. |



