2. 青岛市疾病预防控制中心,山东青岛 266033
2. Qingdao Municipal Center for Disease Control and Prevention, Qingdao, Shandong 266033, China
【研究意义】 海洋中存在着种类繁多的微生物,它们附着于工程材料表面,形成生物膜(Biofilm)。在生物膜内部,pH值、溶解氧、有机物和无机物种类等因素都与海洋本体环境完全不同,生物膜内微生物的活性控制电化学反应的速率和类型,这种受微生物影响的金属和合金的腐蚀称为微生物腐蚀(Microbiologically Influenced Corrosion MIC)[1]。【前人研究进展】大多数人认为微生物一定会加速金属的腐蚀速率,但是近年来越来越多的研究表明,一些细菌通过形成生物膜可以对金属的腐蚀起到抑制作用[2-5]。海藻希瓦氏菌(Shewanella algae)由于其特殊代谢性,被越来越多的学者研究[6]。已有研究表明,该细菌能够将不溶性的三价铁离子还原为可溶性的二价铁及消耗氧气,从而抑制钢铁的腐蚀速率[7-9]。锌阳极具有较高的电流效率,对金属设施保护效果较好,所以在金属防腐工程中的应用非常广泛[10-12]。【本研究切入点】关于海藻希瓦氏细菌对该牺牲阳极影响的研究,尚未见相关报道。【拟解决的关键问题】采用电化学阻抗谱、扫描电镜和荧光显微技术等方法,探讨海藻希瓦氏菌对纯锌牺牲阳极的腐蚀行为及特点。该研究对牺牲阳极的性能评价、寿命预测等具有重要意义。
1 材料与方法 1.1 材料实验菌种来源于中国科学院海洋研究所菌种库。实验材料为Zn-Al-Cd合金,试片规格为10 mm×10 mm×6 mm,其化学成分(质量分数)为w(Al)=0.36%,w(Cd)=0.045%,w(Pb)=0.00092%,w(Cu)=0.0012%,w(Fe)=0.0021%,余量为Zn。样品经切削加工制成,用酒精及丙酮去油后参照国家标准GB 5776—1986进行表面处理。实验前,试样的工作面经水磨砂纸逐级打磨到1200#后,用蒸馏水冲洗干净,经乙醇超声清洗,再用无水乙醇冲洗;实验前,将试样放在超净工作台中,距紫外灯30 cm处紫外灭菌30 min。
1.2 试验体系实验用的海水介质取自青岛汇泉湾,经粗砂过滤净化,在实验室放置15 d以后使用。取200 mL灭菌后的Postgate’s C培养基,加入10 mL过夜培养的Shewanella algae菌液均匀混合,作为有菌体系;取200 mL灭菌后的Postgate’s C培养基作为无菌体系。
1.3 Shewanella algae生长曲线的测定由于在一定范围内,微生物细胞浓度与光密度(OD值)成正比,光密度可以由广电池精确测出,所以本研究通过分光光度计测光密度来绘制Shewanella algae的生长曲线[13]。用光度扫描法测定实验所用的Shewanella algae在紫外-可见光范围的最大特征吸收波长为400 nm。对不同生长时间的Shewanella algae培养液从1 d开始依次进行测定,每次取出3 mL培养液在400 nm处进行吸光度测量。对浓度大的菌液用无菌Postgate’s C培养基适当稀释后测定,使其OD值在0.2~0.8,然后将稀释后测得的OD值乘以稀释倍数即可以得培养液实际的OD值。每天的样品测3次,取OD值的平均数。
1.4 电化学实验电化学测试采用Solartron公司的SI 1287恒电位仪和SI 1260频响分析仪进行,测试体系为三电极体系。工作电极为Zn-Al-Cd试样,对电极为铂电极,参比电极为饱和甘汞电极(SCE)。开路电位和交流阻抗谱测试都在室温下进行,周期为15 d。交流阻抗谱的激励信号为10 mV正弦波电压,扫描频率为100 kHz~10 MHz。采用Zplot软件进行数据采集,采用ZSimpWin电化学分析软件对实验结果进行拟合分析。
1.5 表面分析实验及荧光显微镜观察取2个经121℃高温高压灭菌处理的250 mL广口瓶,在超净工作台中分别加入灭菌Postgate’s C培养基200 mL(其中一个广口瓶中加入10 mL过夜培养的菌液),每个广口瓶中分别放入2个按1.1节中方法处理好的试样。在5 d和9 d后,分别在洁净工作台中迅速取出无菌体系和有菌体系中的试样进行预处理。无菌试样依次用50%(体积分数,下同)乙醇(溶剂为PBS)浸泡15 min,75%乙醇浸泡15 min,100%乙醇浸泡15 min进行逐级脱水处理;有菌试样用5%戊二醛溶液(溶剂为PBS)浸泡2 h后,采用上述不同浓度的乙醇溶液逐级脱水。真空临界干燥后,采用SEM对腐蚀形貌进行观察。
周期性地从Shewanella algae培养基中取出试样做微生物荧光显微镜观察实验。实验前,用5%戊二醛(PBS稀释)固定30 min,然后用0.1%的4, 6-Diamidino-2-phenylindole (DAPI)避光染色15 min。在避光条件下自然风干后,将染色的试样放置在载玻片上,于Zeiss Axioplan荧光显微镜下观察。
2 结果与分析 2.1 Shewanella algae的生长曲线Shewanella algae在培养基中1个生长周期内的生长曲线如图 1所示。由图 1可以看出,在培养基中Shewanella algae的生长数量变化大致分为3个阶段:1~4 d为指数生长阶段,大量营养物质的加入使得细菌数量迅速增长,并在第4天数量达到最大值;5~6 d为稳定阶段,由于培养基中营养物质消耗、毒性产物等不利因素的影响,细菌繁殖速度渐趋下降,此阶段细菌增殖数与死亡数趋于平衡,细菌数量相对比较稳定;7~10 d为衰亡阶段,此阶段内,由于有限的营养物质被耗尽,细菌繁殖越来越慢,活性Shewanella algae数量迅速减少。

|
图 1 Shewanella algae的生长曲线 Fig.1 Growth curve of Shewanella algae |
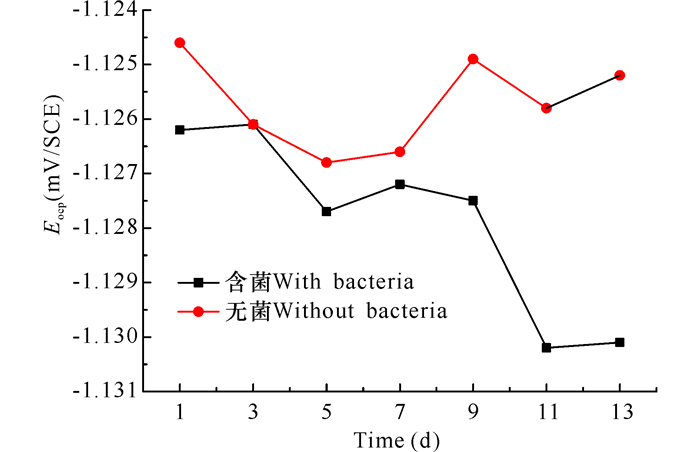
由图 2可以看出,试样在含菌培养基中的开路电位与在无菌培养基中的开路电位的变化趋势不同。在无菌培养基中,其开路电位呈下降趋势,这可能是由于随着时间的推移,试样的腐蚀不断加重引起的。在含菌培养基中,试样的开路电位呈现先下降又上升的趋势:在前7 d,试样的开路电位不断下降,这可能是由细菌的活动引起的;在实验后期,随着营养物质的消耗,细菌逐渐死亡,加上腐蚀产物在试样表面的不断沉积,试样的开路电位呈现上升趋势。整个实验期间,试样在含菌培养基中的开路电位要高于在无菌培养基中的开路电位,说明该细菌可以使试样的开路电位升高。
|
图 2 试样在不同培养基中开路电位随时间的变化曲线 Fig.2 The open circuit potential-time curve of the samples in different culture mediums |
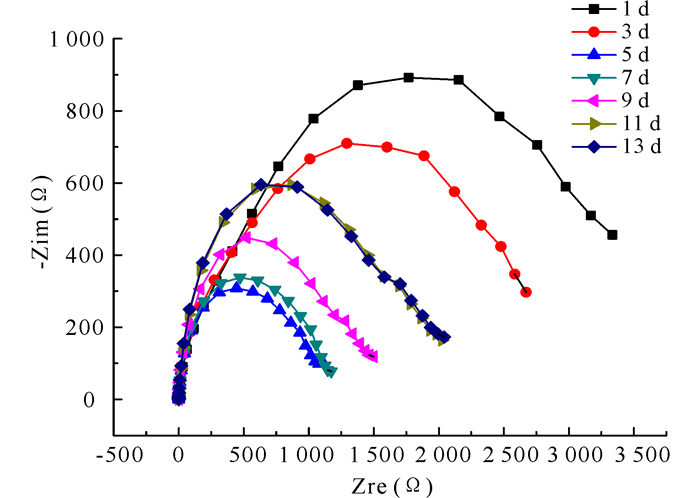
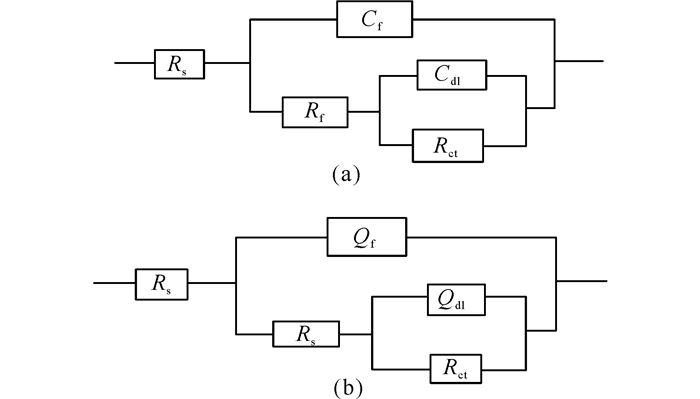
图 3显示了试样在无菌培养基中的交流阻抗图谱随时间的变化趋势。采用图 4a的等效电路对交流阻抗图谱进行拟合,所得的数据如表 1所示。其中,Rs表示溶液电阻,Cf表示表面层电容,Rf表示表面层电阻,Cdl表示界面双电层电容,Rct表示电荷传递电阻。Rct可以用来表征金属的腐蚀速率,其值越小则表明金属腐蚀速率越大[14]。从表 1可以看出,在整个实验期间,Rs的变化很小,说明电化学体系在整个实验期间是比较稳定的。
|
图 3 试样在无菌培养基中的交流阻抗谱图随时间的变化 Fig.3 Nyquist plots for the samples in culture medium without bacteria |
|
图 4 试样在不同培养基中的阻抗等效电路模型 Fig.4 Equivalent circuits of the impedance diagrams of the sample in different culture mediums |
| 表 1 试样在无菌培养基中电化学阻抗模型的参数分析 Table 1 Results of the fit with the equivalent circuit for culture medium without bacteria |
从图 3中可以看出交流阻抗图谱的变化趋势为先下降又升高,说明试样的腐蚀速率呈现先增大后减小的趋势。这与采用图 4a等效电路拟合出的试样Rct值的变化趋势是一致的,说明拟合电路采用得较好。在1~5 d,Rct值从2 343 Ω·cm2减小到498.9 Ω·cm2,表明试样的腐蚀速率在前5 d一直呈现减小的趋势。原因可能是因为海水中的腐蚀介质在试样表面发生作用,加速了试样的腐蚀速率;又因为该试样是牺牲阳极,本身就较活跃,能够在海水中发生快速腐蚀。到11 d,Rct值又逐渐增加到845.2 Ω·cm2,试样的腐蚀速率逐渐减小,可能的原因是在试样表面沉积的腐蚀产物阻挡了腐蚀介质与试样的接触。到13 d,Rct值又开始减小,是因为随着时间的延长,试样表面的腐蚀产物开始脱落,试样表面又与腐蚀介质接触,造成试样的腐蚀速率增大。综上,试样在灭菌海水中的腐蚀速率呈现先增大后减小,然后再增大的趋势。
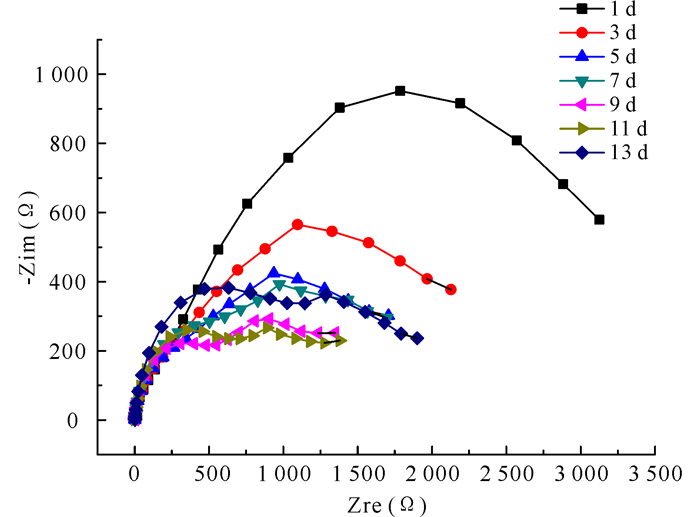
图 5显示了试样在含菌培养基中的交流阻抗图谱随时间的变化趋势。根据体系自身特点,选用了图 4b为天然海水体系的等效电路模型,相同参数物理意义同前,所得的数据如表 2所示。Qf表示表面层电容,Qdl表示界面双电层电容。常相位角组件Q的阻抗值ZCPE=Y0-1(jω)-n,其中,n为弥散指数,0<n<1,可用来判断金属表面的粗糙程度[15]。从表 2可以看出,在整个实验期间,Rs的变化很小,说明电化学体系在整个实验期间是比较稳定的。从Rct的变化趋势看,在1~5 d,Rct值从3 591 Ω·cm2减小到1 970 Ω·cm2,表明试样在这一试验期间的腐蚀速率在增大。可能的原因是在试样表面还没有形成完整的生物膜,试样表面与溶液中的腐蚀介质相接触,以及溶液中存在的溶解氧加速了试样的腐蚀。在7 d,试样的Rct值又增大到2 667 Ω·cm2,是因为试样表面形成了生物膜,这层生物膜阻挡了试样表面与腐蚀介质的接触,使得试样的腐蚀速率减小。随着时间的推移,生物膜在试样表面逐渐脱落,试样的腐蚀速率又开始增大。在整个实验期间,试样在含菌培养基中的腐蚀速率呈现先增大后减小,再增大的趋势。
|
图 5 试样在含菌培养基中的交流阻抗谱图 Fig.5 Nyquist plots for the samples in culture medium with bacteria |
| 表 2 试样在含菌培养基中的电化学阻抗模型的参数分析 Table 2 Results of the fit with the equivalent circuit for culture medium with bacteria |
为了更直观地比较纯锌试样在无菌培养基和含菌培养基中的耐腐情况,我们把试样在上述2种培养基中传递电阻Rt随时间的变化作曲线如图 6所示。由图 6可知,在整个实验期间,纯锌在含菌培养基中的Rt值大于无菌培养基中的Rt值,这说明该细菌对纯锌阳极材料的腐蚀起抑制作用,其主要原因是在含菌体系中,细菌通过代谢活动消耗掉溶解氧,在试样表面形成一层生物膜,该生物膜阻挡了腐蚀介质与试样表面的接触,从而使试样的腐蚀受到抑制。
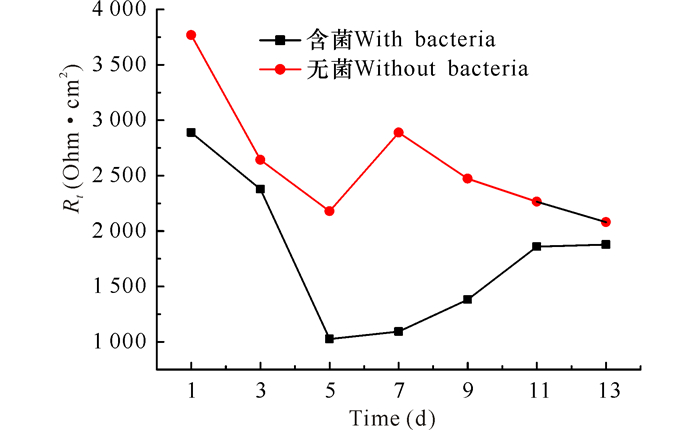
|
图 6 锌阳极在不同培养基中极化电阻随时间的变化曲线 Fig.6 The variation curve of Rt with time of zinc anode immersed in different culture mediums |
图 7显示了纯锌试样在无菌培养基中分别浸泡5 d和9 d的扫描电镜照片。试样浸泡5 d后,在腐蚀介质的作用下,表面发生腐蚀,这是试样Rct值降低的原因,同时在腐蚀区域周围有白色腐蚀产物的存在。浸泡9 d后,试样发生腐蚀的区域增大,由图 7可以看出,试样表面有腐蚀裂缝的出现,同样在试样表面分布有白色的腐蚀产物。

|
图 7 纯锌试样在无菌培养基中浸泡后的SEM Fig.7 SEM images of the pure zinc samples immersed in culture medium without bacteria |
图 8为试样在含菌培养基中分别浸泡5 d和9 d的扫描电镜照片。由图 8可以看出,浸泡5 d后,试样表面有大量的细菌存在,这些细菌及其代谢物抑制了试样的腐蚀。浸泡9 d后,试样表面的腐蚀情况加重,但是与无菌试样的扫描电镜照片相比,腐蚀情况要较轻微,这与前面电化学所测的数据也是一致的。

|
图 8 纯锌试样在含菌培养基中浸泡后的SEM Fig.8 SEM images of the pure zinc samples immersed in culture medium with bacteria |
由图 9可以看出,试样浸泡3 d后,表面已经吸附有大量的细菌,这些细菌的分布比较均匀,已经开始团聚,有形成生物膜的趋势。在浸泡7 d后,在试样表面已经形成比较完整的生物膜,但是生物膜的厚度不均匀。随着营养物质和氧气的消耗,培养基中的细菌逐渐死亡,生物膜也开始脱落。在9 d,完整的生物膜已经脱落,但是仍有残留。在13 d,残留的生物膜已经基本脱落,只剩少量的细菌在试样表面。

|
图 9 纯锌试样在含菌培养基中浸泡不同时间的荧光显微镜照片 Fig.9 Fluorescence microscopy of pure zinc exposed in culture medium with bacteria for different days |
电化学测试结果表明,Shewanella algae可以使纯锌试样的腐蚀电位升高,并且显著抑制试样的腐蚀。其主要原因是在含菌体系中,细菌通过代谢活动消耗掉溶解氧,在试样表面形成一层生物膜,该生物膜阻挡了腐蚀介质与试样表面的接触,从而使试样的腐蚀受到抑制;扫描电镜结果也证明了这一结论。荧光显微镜观察结果表明,浸泡7 d,试样表面形成完整的生物膜,随着营养物质及氧气的消耗,生物膜逐渐脱落。由此可见该细菌生物膜的形成需要一定的时间及充足的营养物质和氧气。
| [1] |
刘光洲, 吴建华. 海洋微生物腐蚀的研究进展[J]. 腐蚀与防护, 2001, 22(10): 430-433. LIU G Z, WU J H. Advances in the study of microbiologically influenced corrosion in marine environment[J]. Corrosion and Protection, 2001, 22(10): 430-433. DOI:10.3969/j.issn.1005-748X.2001.10.005 |
| [2] |
ZUO R J. Biofilms:Strategies for metal corrosion inhibition employing microorganisms[J]. Applied Microbiology and Biotechnology, 2007, 76(6): 1245-1253. DOI:10.1007/s00253-007-1130-6 |
| [3] |
MANSFELD F, HSU C H, OERNEK D, et al. Corrosion control using regenerative biofilms on aluminum 2024 and brass in different media[J]. Journal of the Electrochemical Society, 2002, 149(4): 2291-2302. |
| [4] |
JONES-MEEHAN J, WALCH M, LITTLE B J, et al. Effect of mixed sulfate-reducing bacterial communities on coatings[J]. Abstracts of Papers of the American Chemical Society, 1992(204): 32-IEC. |
| [5] |
ÖRNEK D, JAYARAMAN A, WOOD T K, et al. Pitting corrosion control using regenerative biofilms on aluminium 2024 in artificial seawater[J]. Corrosion Science, 2001, 43(11): 2121-2133. DOI:10.1016/S0010-938X(01)00005-1 |
| [6] |
BELENEVA I A, MAGARLAMOV T Y, ELISEIKI NA M G, et al. Biochemical and pathogenic properties of the natural isolate of Shewanella algae from Peter the Great Bay, Sea of Japan[J]. Journal of Invertebrate Pathology, 2009, 102(3): 250-255. DOI:10.1016/j.jip.2009.09.001 |
| [7] |
VIDELA H A. Manual of biocorrosion[M]. Florida: CRC Lewis Press, 1996: 121-135.
|
| [8] |
DUBIEL M, HSU C H, CHIEN C C, et al. Microbial iron respiration can protect steel from corrosion[J]. Applied and Environmental Microbiology, 2002, 68(3): 1440-1445. DOI:10.1128/AEM.68.3.1440-1445.2002 |
| [9] |
LEE A K, BUEHLER M G, NEWMAN D K. Influence of a dual-species biofilm on the corrosion of mild steel[J]. Corrosion Science, 2006, 48(1): 165-178. DOI:10.1016/j.corsci.2004.11.013 |
| [10] |
龙晋明, 郭忠诚, 樊爱民, 等. 牺牲阳极材料及其在金属防腐工程中的应用[J]. 云南冶金, 2002, 31(3): 142-148. LONG J M, GUO Z C, FAN A M, et al. Sacrificial anode materials and their application in corrosion prevention of metals[J]. Yunnan Metallurgy, 2002, 31(3): 142-148. |
| [11] |
马士德, 姚振玲, 廖阳飞, 等. 三种锌防腐层的海水腐蚀与防污性能初探[J]. 广西科学院学报, 2016, 32(3): 185-189. MA S D, YAO Z L, LIAO Y F, et al. Antifouling properties and corrosion resistances of three kinds of zinc coating in the sea[J]. Journal of Guangxi Academy of Sciences, 2016, 32(3): 185-189. |
| [12] |
王在峰. 石油平台水下部分阴/阳极监测系统[J]. 广西科学院学报, 2016, 32(3): 180-184. WANG Z F. Monitoring system for cathode and anode of under-water structures of one offshore platform[J]. Journal of Guangxi Academy of Sciences, 2016, 32(3): 180-184. |
| [13] |
沈萍, 范秀容, 李广武. 微生物学实验[M]. 北京: 高等教育出版社, 1999: 95. SHEN P, FAN X R, LI G W. Microbiology experiment[M]. Beijing: Higher Education Press, 1999: 95. |
| [14] |
YI W, ZHANG D, LIU H Q, et al. Influence of sulphate-reducing bacteria on environmental parameters and marine corrosion behavior of Q235 steel in aerobic conditions[J]. Electrochimica Acta, 2010, 55(5): 1528-1534. DOI:10.1016/j.electacta.2009.10.009 |
| [15] |
CUI X Y, MARTIN D C. Electrochemical deposition and characterization of poly(3, 4-ethylenedioxythiophene) on neural microelectrode arrays[J]. Sensors and Actuators B:Chemical, 2003, 89(1/2): 92-102. |
 2017, Vol. 33
2017, Vol. 33 


