2. 环北部湾海洋药用动物利用与保护研究所,广东湛江 524048
2. Round Beibu Gulf Institute for the Protection and Utilization of Marine Animals in Medicine, Zhanjiang, Guangdong, 524048, China
【研究意义】虎斑乌贼(Sepiapharaonis)属于软体动物门(Mollusca),头足纲(Cephalopoda)鞘亚纲(Coleoidea),乌贼目(Sepiida),乌贼科(Sepiidae),乌贼属(Sepia),分布于菲律宾群岛,马来群岛,大洋洲东部、北部和西部,印度近海,红海及我国的南海近海海域[1]。虎斑乌贼个体大、肉细嫩、味道鲜美、营养丰富,是一种高蛋白低脂肪的海产品[2]。目前,对虎斑乌贼的研究主要集中在药用价值方面,如乌贼墨有抗癌、抗辐射、止血等作用;乌贼骨(海螵蛸)有各种收敛作用,可以治疗胃病等;乌贼肉和乌贼血有活血化瘀、滋阴等作用[3],但对虎斑乌贼生物活性物质研究较少。多糖(polysaccharide)又称多聚糖,是一种由醛糖和酮糖通过脱水形成糖苷键,并由糖苷键线性或者分枝连接组成的链状聚合物,具有广泛生物活性[4]。【前人研究进展】近年来,国内外很多学者对多糖的生物活性展开研究。郑玉寅等[5]研究发现乌贼墨肽聚糖具有较好的抗前列腺癌的活性;Zong等[6]对曼氏无针乌贼墨汁硫酸多糖进行研究,结果显示该多糖具有很好的抗转移和抑制血管增生活性;Chen等[7]发现灵芝多糖具有抑制宫颈癌肿瘤细胞的活性;Yuan等[8]研究川芎多糖抗氧化及体外细胞毒活性;Liu等[9]研究仿刺参Apostichopus japonicas多糖的抗氧化及抗高血脂的活性。【本研究切入点】目前,除对乌贼墨多糖[10]、性腺多糖[11-12]及虎斑乌贼糖蛋白[13]的抗氧化活性有个别报道外,关于虎斑乌贼肌肉多糖抗氧化活性研究鲜有报道。【拟解决的关键问题】采用Sevag法、三氯乙酸法、等电点法脱蛋白,比较3种脱蛋白方法对虎斑乌贼肌肉水提多糖体外抗氧化活性的影响。考察其作为天然抗氧化剂的潜力,以期为虎斑乌贼肌肉多糖在海洋功能食品和医药制品领域的综合利用与开发提供物质基础。
1 材料与方法 1.1 材料虎斑乌贼:购于湛江霞山水产批发市场,挑选成体虎斑乌贼6头,每头体重(1.5±0.5) kg,胴体长(26±4) cm,胴宽(12±4) cm。铁氰化钾(AR),天津市大茂化学试剂厂;三氯乙酸(AR),广州市金华大化学试剂有限公司;三(羟甲基)氨基甲烷(BR),国药集团化学试剂有限公司;焦性没食子酸(AR),广州市金华大化学试剂有限公司;水杨酸(AR),广州市金华大化学试剂有限公司;30%过氧化氢(AR),上海穗试剂公司;硫酸亚铁(AR),广州市金华大化学试剂有限公司;抗坏血酸(AR),上海穗试剂公司;甲醇(AR),广州市金华大化学试剂有限公司;无水乙醇(AR),天津市大茂化学试剂厂;DPPH(AR),美国Sigma公司;牛血清蛋白、干酪素、酪蛋白、三氯乙酸、磷酸氢二钠、磷酸二氢钠、柠檬酸、三羟甲基氨基甲烷(Tris)、考马斯亮蓝、苯酚、浓硫酸、葡萄糖、无水乙醇、氢氧化钠、氯化钠等均为国产分析纯。
1.2 仪器与设备紫外可见分光光度计(UV-3000),上海美谱达仪器有限公司;高速组织捣碎机(DS-1),上海标本模型厂;冷冻干燥机(LGJ-18),北京四环科学仪器厂;手提式高速中药粉碎机(DFY-200),青州市三宝中药机械厂;台式离心机(H/T18MM),湖南赫西仪器有限公司;电冰箱(BCD-348WA/H),科龙公司;pH(酸度)计(PHS-3C),上海天达仪器有限公司;电子天平(AUX320),日本岛津公司;电热恒温水浴锅(HHS),上海博迅实业有限公司;全自动电热蒸馏水器(YN-Z0-Z-10),上海博迅实业有限公司;循环水式多用真空泵(SHZ-95B),巩义市予华仪器有限公司;低温冷却液循环泵(DLSB-5/20),郑州长城科工贸有限公司;旋转蒸发仪(N-1100), 上海爱朗仪器有限公司。
1.3 方法 1.3.1 虎斑乌贼肌肉多糖的制备原料预处理:解剖虎斑乌贼,除去表皮、内脏,得乌贼肌肉,切碎;加适量蒸馏水用组织捣碎机打成匀浆状,采用丙酮脱脂3次;冷冻干燥,用中草药粉碎机粉碎得虎斑乌贼肌肉冻干粉,密封保存在-20℃冰箱,备用。
多糖提取:参考戴宏杰等[11]的方法,按料液比1:30g/mL,90℃水浴提取1 h后,4 000 r/min,15 min离心;取上清液旋转浓缩至原体积的1/5,向浓缩液中加入3倍体积无水乙醇,4℃静置过夜;4 000 r/min,15 min离心,取沉淀,4℃透析48 h(每8 h换1次水),冷冻干燥制备得水提多糖。
1.3.2 虎斑乌贼肌肉多糖的脱蛋白工艺(1) Sevag法
参照殷秀红等[14]的方法。取适量虎斑乌贼肌肉粗多糖溶液,加入1/4体积的Sevag溶液(氯仿:正丁醇=4:1,V:V),摇匀,搅拌30 min,离心,取水层;加同上体积的Sevag液重复操作2~3次,直至氯仿与水的界面无沉淀析出。合并水相旋转蒸发浓缩至原体积的1/5,用3倍体积95%乙醇沉淀,4℃静置过夜;收集沉淀,冷冻干燥即得脱蛋白后的虎斑乌贼肌肉多糖,密封保存于4℃冰箱中,备用。
(2) 三氯乙酸法
参照李知敏等[15]的方法略作改动。将20 g/100 mL三氯乙酸溶液, 按照体积比为9%添加到50 mL虎斑乌贼肌肉粗多糖溶液中,混匀后4℃静置过夜;在4 000 r/min条件下离心20 min,取上清,得脱蛋白液并旋转蒸发浓缩至原体积的1/5;用3倍体积95%乙醇沉淀,4℃静置过夜,收集沉淀,真空冷冻干燥即得脱蛋白后的虎斑乌贼肌肉多糖,密封保存于4℃冰箱中,备用。
(3) 等电点法
参照董宏平等[16]的方法。取适量虎斑乌贼肌肉粗多糖溶液,加入柠檬酸缓冲液调节pH值至4.0,在4 000 r/min条件下离心20 min,取上清;得脱蛋白液并旋转蒸发浓缩至原体积的1/5,用3倍体积95%乙醇沉淀,4℃静置过夜,收集沉淀;真空冷冻干燥即得脱蛋白后的虎斑乌贼肌肉多糖,密封保存于4℃冰箱中,备用。
1.3.3 虎斑乌贼肌肉多糖体外抗氧化活性测定(1) 对DPPH自由基清除能力的测定
按照强伟等[17]的方法,取2 mL不同质量浓度的多糖溶液,加入2 mL含0.2 mmol/L DPPH自由基的无水乙醇溶液后混匀,在黑暗环境中常温反应30 min,在波长517 nm处测定吸光度。以维生素C(VC)为阳性对照,按式1) 计算清除率:
| $清除率\left( \% \right) = \frac{{{A_0} - \left( {{A_1} - {A_2}} \right)}}{{{A_0}}} \times 100\% ,$ | (1) |
式中:A1为2 mL多糖溶液加2 mL DPPH自由基的吸光度,A2为2 mL多糖溶液加2 mL无水乙醇的吸光度,A0为2 mL双蒸水加2 mL DPPH自由基的吸光度。
(2) 对·OH自由基清除能力的测定
参考胡喜兰等[18]的方法,取1 mL不同质量浓度的多糖溶液,加入1 mL 9 mmol/L FeSO4溶液,1 mL 9 mmol/L的水杨酸-乙醇溶液和1 mL 8.8 mmol/L H2O2溶液,混匀后37℃水浴条件下反应30 min;3 000 r/min离心10 min,取上清液测定其在波长510 nm处的吸光度。以维生素C(VC)为阳性对照,空白对照组以双蒸水代替多糖溶液,按式2) 计算清除率:
| $清除率\left( \% \right) = \frac{{{A_0} - \left( {{A_x} - {A_1}} \right)}}{{{A_0}}} \times 100\% ,$ | (2) |
式中:A0为空白对照的吸光度,Ax为加入多糖溶液的吸光度,A1为以双蒸水代替H2O2溶液的吸光度。
(3) 对O2-自由基清除力测定
采用邻苯三酚自氧化法,参照李娇娇[19]的方法略作修改。取4.5 mL 0.05 mol/L Tris-HCl缓冲液(pH值为8.2),置于25℃水浴中预热20 min,分别加入1.0 mL样品溶液和0.5 mL 25 mol/L邻苯三酚溶液,混匀后于25℃水浴中反应5 min,加入1 mL 8 mol/L HCl终止反应,于320 nm处测定吸光度A样品,空白组以相同体积蒸馏水代替样品,测定吸光值A空白。对照组以相同体积的蒸馏水代替邻苯三酚,测定吸光值A对照。重复3次,取平均值,按式3) 计算清除率,并与维生素C(VC)对照比较。
| $清除率\left( \% \right) = \left[ {1 - \left( {{A_{样品}} - {A_{对照}}} \right)/{A_{空白}}} \right] \times 100\% 。$ | (3) |
参照文献[19-20],取1.0 mL样品溶液,然后加入2.5 mL 0.2 mol/L磷酸盐缓冲液(pH值为6.6) 和2.5 mL 1%的铁氰化钾溶液于试管中混匀。混合物在50℃水浴中反应20 min,迅速冷却并加入2.5 mL 10%的三氯乙酸,混匀后以4 000 r/min离心10 min。取2.5 mL上清液加入0.5 mL 0.1%的三氯化铁溶液混匀,再加1 mL蒸馏水摇匀,以蒸馏水调零,室温反应10 min后在700 nm处测定吸光值。以去离子水代替样品作为空白对照,每个样品做3次平行试验,取平均值,并与VC对照比较。
2 结果与分析 2.1 虎斑乌贼肌肉多糖抗氧化活性的比较(1) 清除DPPH自由基的能力
如图 1所示,在实验设置浓度范围内,经Sevag法、三氯乙酸法和等电点法脱蛋白的虎斑乌贼肌肉多糖对DPPH自由基的清除率随其浓度的升高而逐渐增加,在浓度为1~5 mg/mL时,Sevag法脱蛋白多糖具有较高的清除能力,远高于三氯乙酸法和等电点法脱蛋白多糖。当多糖浓度为5 mg/mL时,Sevag法、三氯乙酸法和等电点法脱蛋白多糖对DPPH自由基的清除率分别为87.05%、42.35%和38.54%,均低于VC(98.69%)。不同脱蛋白方法获得的多糖对DPPH自由基的清除能力有差异:Sevag法脱蛋白多糖对DPPH自由基的清除能力最好,三氯乙酸法和等电点法脱蛋白多糖对DPPH自由基的清除效果相当。
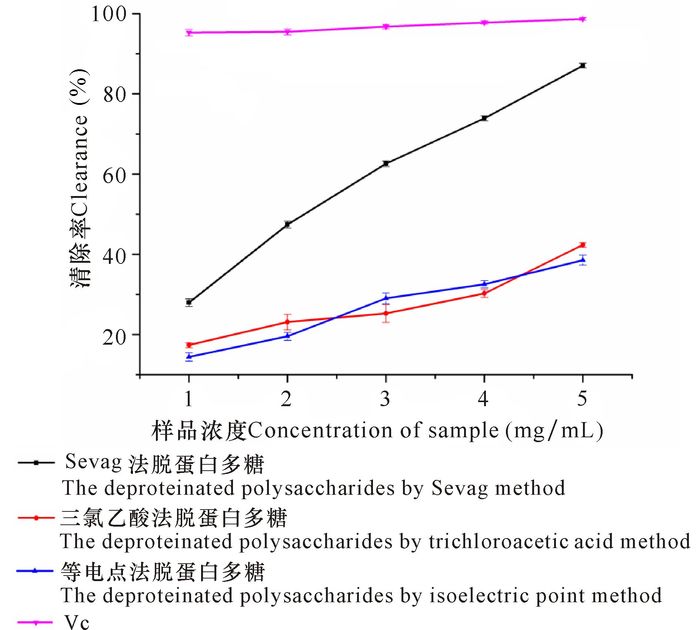
|
图 1 虎斑乌贼肌肉多糖和VC对DPPH自由基的清除作用 Fig.1 Effect of removing DPPH free radicals of polysaccharides from cuttlefish muscle of Sepiapharaonis and VC |
(2) 清除·OH自由基的能力
由图 2可见,在所选浓度范围内,3种脱蛋白方法得到的多糖对·OH自由基均有一定清除能力;随着多糖浓度的增加,其清除·OH自由基能力也相应增加,呈现良好的剂量关系。当浓度为5mg/mL时,Sevag法、三氯乙酸法和等电点法脱蛋白多糖对·OH自由基的清除率分别为93.67%、70.80%和68.75%,其中Sevag法对·OH自由基的清除率与VC (94.33%)相当。不同脱蛋白方法获得的多糖对·OH自由基的清除能力有差异,清除能力大小顺序依次为Sevag法>三氯乙酸法>等电点法。
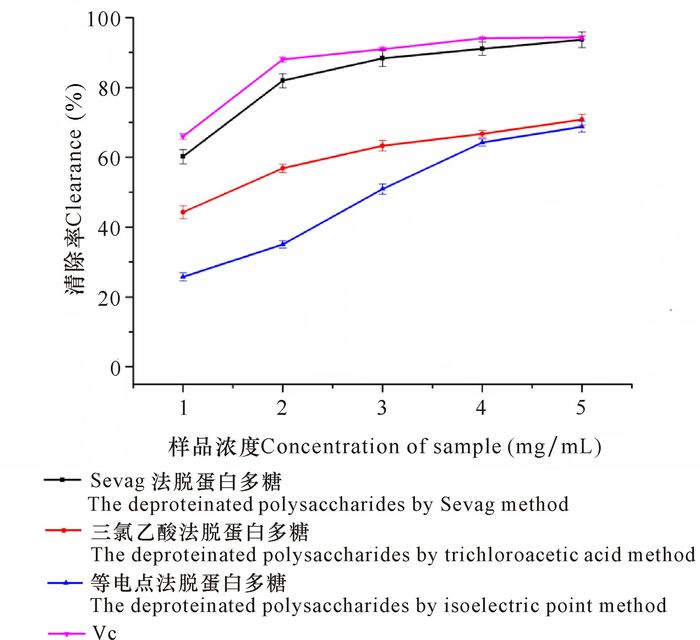
|
图 2 虎斑乌贼肌肉多糖和VC对·OH自由基的清除作用 Fig.2 Effect of scavenging hydroxyl free radical of polysaccharides from cuttlefish muscle of Sepiapharaonis and Vc |
(3) 清除O2-自由基能力的比较
随着多糖浓度的增加,其清除O2-自由基能力也相应增加,说明多糖浓度与清除能力呈正相关关系(图 3)。在浓度为1~5 mg/mL时,Sevag法脱蛋白多糖对O2-自由基具有更好的清除活性,高于三氯乙酸法和等电点法脱蛋白多糖。当浓度为5 mg/mL时,Sevag法、三氯乙酸法和等电点法脱蛋白多糖对O2-自由基的清除率分别为72.33%、62.42%和53.33%。3种脱蛋白方法获得的多糖对O2-自由基的清除能力大小顺序为Sevag法>三氯乙酸法>等电点法。
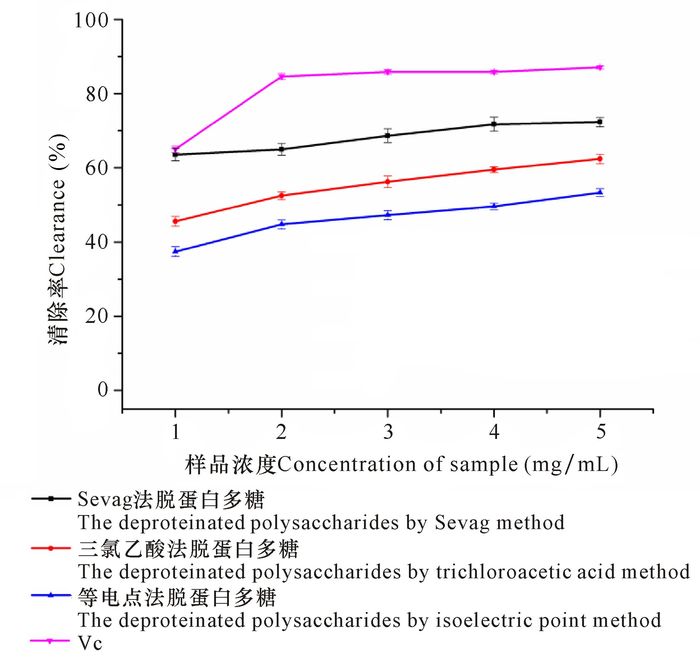
|
图 3 虎斑乌贼肌肉多糖和Vc对O2-自由基的清除作用 Fig.3 Effect of removing O2- free radicals of polysaccharides from cuttlefish muscle of Sepiapharaonis and Vc |
(4) 虎斑乌贼肌肉多糖还原力的比较
虎斑乌贼肌肉多糖的还原力大小与多糖浓度呈正相关关系(图 4)。不同脱蛋白方法获得的多糖样品还原力有差异,Sevag法脱蛋白多糖高于三氯乙酸法和等电点法脱蛋白多糖。与Vc相比,在多糖浓度为1~5.0 mg/mL时,3种脱蛋白方法得到的多糖还原力远低于Vc;当浓度为5.0 mg/mL时,Sevag法、三氯乙酸法和等电点法脱蛋白多糖还原力分别为0.183, 0.160和0.144;而在相同浓度范围内,Vc的还原力均在0.97以上。
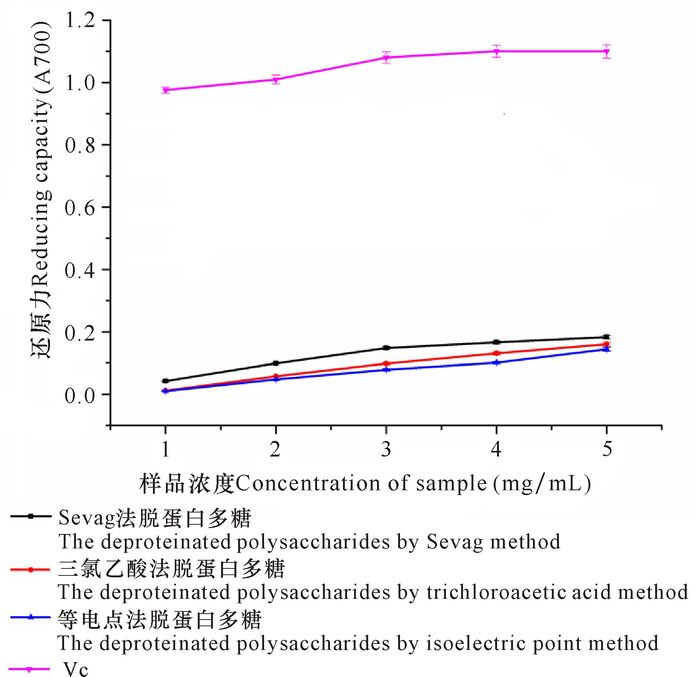
|
图 4 虎斑乌贼肌肉多糖和Vc的还原力测定 Fig.4 Determination of reducing capacity of polysaccharides from cuttlefish muscle of Sepiapharaonis and VC |
由表 1可知,3种脱蛋白方法得到的多糖对3种自由基的半清除率浓度有差异,Sevag法脱蛋白多糖对DPPH自由基、·OH自由基和O2-自由基的半清除率浓度在这3种方法中最低,清除效果最好。
| 表 1 虎斑乌贼肌肉多糖对3种自由基半清除率浓度(IC50)比较 Table 1 The comparing results of the half scavenging concentration (IC50) of three free radicals of polysaccharides from cuttlefish musche of Sepiapharaonis |
在抗氧化活性研究方面,梅新娅[21]采用三氯乙酸法脱蛋白获得黄瓜多糖,当其浓度为5 mg/mL时,对O2-自由基清除率为40%,而本研究同浓度的Sevag法脱蛋白多糖对O2-自由基清除率为72.33%;李鸿梅等[22]发现当经等电点法脱蛋白后的罗耳阿太菌胞外多糖浓度为4 mg/mL时,对DPPH自由基清除率仅为47.98%,而本研究同浓度的Sevag法脱蛋白多糖浓度对DPPH自由基清除率为73.93%。本研究结果优于上述文献报道,可能是因为Sevag法脱蛋白的效果优于三氯乙酸法和等电点法。张艳萍等[23]发现山茱萸酶提脱蛋白后的多糖浓度为1.2mg/mL时,对·OH自由基的清除率为89.9%;张强等[24]研究表明洋葱多糖表现出较强的还原力,当其浓度为5 mg/mL时,还原能力约为1.0,这些实验结果略高于本研究结果,可能的原因是这些文献采用了温和的酶法和酶法-Sevag法联合脱蛋白,而本研究仅采用Sevag法脱蛋白,后续的研究将考虑采用多种联合方法来脱蛋白。
4 结论本研究采用热水浸提虎斑乌贼肌肉多糖,并采用Sevag法、三氯乙酸法和等电点法对提取的粗多糖进行脱蛋白和体外抗氧化活性的研究。结果显示经Sevag法脱蛋白得到的多糖抗氧化活性在这3种方法中最优,可能因为Sevag法是去除游离蛋白的有效方法,能将游离蛋白变性成为不溶性物质,经离心分离后去除[25-26],从而使脱蛋白后的多糖纯度相对较高。
我国海域辽阔,海洋生物资源丰富,海洋动物多糖的研究与开发具有广阔的应用前景。本实验中虎斑乌贼肌肉脱蛋白多糖多具有一定的抗氧化能力,尤其是通过Sevag法脱蛋白的多糖对·OH自由基的清除效果较好,表现出优良的抗氧化活性,该研究可以为开发虎斑乌贼多糖功能性食品、医药保健品、食品添加剂等提供物质基础和理论依据。
| [1] |
陈新军, 刘必林, 王尧耕. 世界头足类[M]. 北京: 海洋出版社, 2009: 440-441. CHEN X J, LIU B L, WANG Y G. Cephalopods of the world[M]. Beijing: Ocean Press, 2009: 440-441. |
| [2] |
陈道海, 文菁, 赵玉燕, 等. 野生与人工养殖的虎斑乌贼肌肉营养成分比较[J]. 食品科学, 2014, 35(7): 217-222. CHEN D H, WEN J, ZHAO Y Y, et al. Analysis of nutritional components in muscle of cultivated and wild Sepia pharaonis[J]. Food Science, 2014, 35(7): 217-222. DOI:10.7506/spkx1002-6630-201407043 |
| [3] |
杨晓燕, 贾福星. 乌贼的综合药用[J]. 中国海洋药物, 1999(2): 46-47, 31. YANG X Y, JIA F X. The squid's comprehensive medicinal[J]. Chinese Journal of Marine Drugs, 1999(2): 46-47, 31. |
| [4] |
吴东儒. 糖类的生物化学[M]. 北京: 高等教育出版社, 1987: 125-126. WU D R. The biochemistry of carbohydrates[M]. Beijing: Higher Education Press, 1987: 125-126. |
| [5] |
郑玉寅, 杨永芳, 丁国芳, 等. 乌贼墨肽聚糖的制备工艺与体外抗前列腺癌研究[J]. 时珍国医国药, 2012, 23(1): 111-113. ZHENG Y Y, YANG Y F, DING G F, et al. The peptidoglycan extracted from ink of Sepia and the inhibition against the growth of prostatic cancer in vitro[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(1): 111-113. |
| [6] |
ZONG A Z, ZHAO T, ZHANG Y, et al. Anti-metast-atic and anti-angiogenic activities of sulfated polysaccharide of Sepiella maindroni ink[J]. Carbohydrate Polymers, 2013, 91(1): 403-409. DOI:10.1016/j.carbpol.2012.08.050 |
| [7] |
CHEN X P, WANG W X, LI S B, et al. Optimization of ultrasound-assisted extraction of Lingzhi polysaccharides using response surface methodology and its inhibitory effect on cervical cancer cells[J]. Carbohydrate Polymers, 2010, 80(3): 944-948. DOI:10.1016/j.carbpol.2010.01.010 |
| [8] |
YUAN J F, ZHANG Z Q, FAN Z C, et al. Antioxidant effects and cytotoxicity of three purified polysaccharides from Ligusticum chuanxiong Hort[J]. Carbohydrate Polymers, 2008, 74(4): 822-827. DOI:10.1016/j.carbpol.2008.04.040 |
| [9] |
LIU X, SUN Z L, ZHANG M S, et al. Antioxidant and antihyperlipidemic activities of polysaccharides from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers, 2012, 90(4): 1664-1670. DOI:10.1016/j.carbpol.2012.07.047 |
| [10] |
罗萍, 师莉莎, 刘华忠. 乌贼墨多糖的体外抗氧化作用[J]. 食品研究与开发, 2013, 34(8): 1-4. LUO P, SHI L S, LIU H Z. Antioxidant effects of polysaccharides from squid ink in vitro[J]. Food Research and Development, 2013, 34(8): 1-4. |
| [11] |
戴宏杰, 孙玉林, 郑小林, 等. 拟目乌贼生殖腺多糖提取工艺优化及自由基清除能力研究[J]. 食品工业科技, 2015, 36(5): 198-203. DAI H J, SUN Y L, ZHENG X L, et al. Study on the extraction optimization and antioxidant activity of polysaccharides in gonad of Sepia lycidas[J]. Science and Technology of Food Industry, 2015, 36(5): 198-203. |
| [12] |
戴宏杰, 孙玉林, 杨梅语, 等. 拟目乌贼生殖腺碱提多糖的抗氧化及吸湿保湿特性[J]. 食品科学, 2016, 37(2): 31-38. DAI H J, SUN Y L, YANG M Y, et al. Antioxidant activity, moisture absorption and retention capacities of alkali-soluble polysaccharides extracted from gonad of Sepia lycidas[J]. Food Science, 2016, 37(2): 31-38. DOI:10.7506/spkx1002-6630-201602006 |
| [13] |
戴宏杰. 虎斑乌贼肌肉糖蛋白分离纯化、结构分析及其抗氧化活性初步研究[D]. 杭州: 浙江工商大学, 2015. DAI H J.Study on the extraction, purificaton, structure and antioxidation of glycoprotein from Sepia pharaonis muscle[D].Hangzhou:Zhejiang Gongshang University, 2015. http://d.wanfangdata.com.cn/Thesis/Y2750823 |
| [14] |
殷秀红, 赵峡, 张紫恒, 等. 紫贻贝多糖的提取、分离和基本理化性质分析[J]. 中国海洋药物, 2011, 30(2): 12-18. YIN X H, ZHAO X, ZHANG Z H, et al. Extraction, purification and physicochemical properties analyses of Mytilus edulis linnaeus polysaccharides[J]. Chinese Journal of Marine Drugs, 2011, 30(2): 12-18. |
| [15] |
李知敏, 王伯初, 周菁, 等. 植物多糖提取液的几种脱蛋白方法的比较分析[J]. 重庆大学学报, 2004, 27(8): 57-59. LI Z M, WANG B C, ZHOU J, et al. Comparison of three methods of removing protein from polysaccharide extract in the plant[J]. Journal of Chongqing University, 2004, 27(8): 57-59. |
| [16] |
董宏平, 李建宏, 范海红. 水花微囊藻多糖复合物的提取[J]. 南京师大学报:自然科学版, 1999, 22(3): 91-94. DONG H P, LI J H, FAN H H. Study on extraction of polysaccharides from water bloom cyanophyta, microcystis flosaquae[J]. Journal of Nanjing Normal University:Natural Science, 1999, 22(3): 91-94. |
| [17] |
强伟, 朱利娜, 史俊友, 等. 青海沙棘果粉抗氧化活性的研究[J]. 中国野生植物资源, 2014, 33(1): 24-27. QIANG W, ZHU L N, SHI J Y, et al. Study on antioxidant activity of fruit powder from Qinghai's Hippophae rhamnoides L[J]. Chinese Wild Plant Resources, 2014, 33(1): 24-27. |
| [18] |
胡喜兰, 许瑞波, 陈宇. 牛蒡叶多糖的提取及生物活性研究[J]. 食品科学, 2013, 34(2): 78-82. HU X L, XU R B, CHEN Y. Extraction and biological activity of polysaccharides from of burdock (Arctium lappa L.) leaves[J]. Food Science, 2013, 34(2): 78-82. |
| [19] |
李娇娇. 鹅骨抗氧化肽的酶解工艺优化及其分离纯化的研究[D]. 雅安: 四川农业大学, 2013. LI J J.Optimization of enzymatic hydrolysis and purification of goose bone antioxidant peptides[D].Ya'an:Sichuan Agricultural University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10626-1014102587.htm |
| [20] |
陈欣, 龚兰, 刘冠卉. 食用真菌多糖提取条件的优化及其还原力的比较[J]. 食品科学, 2010, 31(14): 140-144. CHEN X, GONG L, LIU G H. Extraction and ferric reducing antioxidant power of polysaccharides from four edible fungi[J]. Food Science, 2010, 31(14): 140-144. |
| [21] |
梅新娅. 黄瓜多糖的脱蛋白方法及抗氧化活性研究[J]. 食品科技, 2013, 38(3): 176-178. MEI X Y. Deproteinization and antioxidant activity of cucumber polysaccharide[J]. Food Science and Technology, 2013, 38(3): 176-178. |
| [22] |
李鸿梅, 张桂弘, 魏明, 等. 罗耳阿太菌胞外多糖蛋白的脱除及其体外抗氧化活性[J]. 食品科技, 2015, 40(12): 161-166. LI H M, ZHANG G H, WEI M, et al. Deproteinization and antioxidant activities in vitro of exopolysaccharides from Athelia rolfsii[J]. Food Science and Technology, 2015, 40(12): 161-166. |
| [23] |
张艳萍, 尤玉如, 戴志远. 山茱萸多糖体外清除自由基和抗氧化作用研究[J]. 中国食品学报, 2008, 8(6): 18-22. ZHANG Y P, YOU Y R, DAI Z Y. Study on scavenging radicals capability and antioxidant activity of polysaccharides from Cornus oficinalis Seib.et Zucc[J]. Journal of Chinese Institute of Food Science and Technology, 2008, 8(6): 18-22. |
| [24] |
张强, 牟雪姣, 周正义, 等. 洋葱多糖的提取及其抗氧化活性研究[J]. 食品与发酵工业, 2007, 33(1): 138-141. ZHANG Q, MOU X J, ZHOU Z Y, et al. Study on the extraction and antioxidant activity of onion polysaccharide[J]. Food and Fermentation Industries, 2007, 33(1): 138-141. |
| [25] |
齐慧玲, 魏绍云, 王继伦, 等. Sevag法去除白及多糖中蛋白的研究[J]. 天津化工, 2000, 14(3): 20-22. QI H L, WEI S Y, WANG J L, et al. Study on removal of protein from Bletillastriata polysaccharide by Sevag method[J]. Tianjin Chemical Industry, 2000, 14(3): 20-22. |
| [26] |
苏拨贤. 生物化学制备技术[M]. 北京: 科学出版社, 1994: 58. SU B X. Biochemical preparation technology[M]. Beijing: Science Press, 1994: 58. |
 2017, Vol. 33
2017, Vol. 33 


