2. 青岛市大型海藻工程技术研究中心,山东青岛 266104;
3. 温州大学生命与环境科学学院,浙江温州 325035
2. Ma-croalgae Engineering Technology Research Centre of Qingdao, Qingdao, Shandong, 266104, China;
3. College of Life and Environmental Science, Wenzhou University, Wenzhou, Zhejiang, 325035, China
【研究意义】裙带菜是一种重要经济海藻。它的蛋白含量高,含有19种氨基酸,包括全部人体必需氨基酸; 并且含有多种矿质元素、维生素、不饱和脂肪酸及多糖,其纤维素含量仅为干重的3%左右,因此易被人体消化[1]。可以说,裙带菜具有较高的营养价值,其药用和保健作用也日益受到重视。裙带菜的育苗大都采用细胞工程育苗技术,其大致过程包括克隆的建立和培养以及用克隆育苗[2]。裙带菜雌、雄配子体是由游孢子转变而来,在温度25℃、光照强度2000 Lux左右的条件下,雌、雄配子体可进行营养生长而不发育,并处于比较旺盛的细胞分裂状态,可用于扩养。经过大量扩养的克隆可以在任何时候使用,进行育苗。在适宜的条件下,雌、雄混合的克隆可迅速形成孢子体。【前人研究进展】目前国内对裙带菜的研究主要集中在其蛋白质、纤维素等营养成分开发利用以及岩藻黄质、岩藻多糖的提取利用方面[3-7],对裙带菜的育种以及育种过程中营养盐需求研究相对较少[8-9],如南春容等[10]研究得出大型藻类在生长和繁殖期对水体中的氮元素需求大并且利用率高;李大鹏等[11]认为裙带菜配子体能够有效利用氨态氮和硝态氮进行扩增,且可同时吸收两种氮源,但配子体氨态氮的吸收速率略大于硝态氮的吸收;吸收速率随着氮浓度的增加而升高。【本研究切入点】在裙带菜配子体的培育过程中,需要在海水中增加一定数量的营养盐以满足其生长发育的需要,其一是由于在室内用玻璃瓶养藻,与自然海区相比,室内海水流动小,营养交换的速度慢;另一个更重要的原因是室内水体少,幼苗在高密度培养下,只有在营养浓度大的情况下,才能吸收到各自所需要的各种营养。氮是裙带菜配子体的培育过程中不可缺少的营养元素之一, 因此,找出适合裙带菜雄配子体生长的最佳氮浓度是推广该项技术有待解决的问题,也是本试验的主要目的。【拟解决的关键问题】通过在不同氮浓度下培养裙带菜雄配子体,测定各自的生长状况,找出最适于其生长的氮浓度。
1 材料与方法 1.1 材料裙带菜雄配子体藻种(LD♂)从中国科学院海洋研究所(青岛)获得。沙滤过的海水经10μm滤膜过滤,煮沸消毒后加入无氮的PES培养液。
1.2 方法 1.2.1 裙带菜雄配子体的培养将待用藻种用筛绢滤出后,用DS-1高速组织捣碎机内以12 000 r/min的速度打碎,加入新鲜培养液培养1 d后更换培养液继续培养。将裙带菜雄配子体取出并培养于5 L三角瓶中,加入无氮的培养液培养2 d,使配子体通过代谢达到氮饥饿,以免其本身排出的氮影响试验结果。
培养条件:光周期12/12,温度为25℃,光照强度为80μmol·m-2·s-1,通气培养。分别在5 L无氮培养液中加入不同剂量的氯化铵溶液,第一次实验设置氮浓度梯度为第1组:0 mg/L, 第2组:5 mg/L, 第3组:15 mg/L, 第4组:20 mg/L; 第二次实验将氮浓度分别保持在Ⅰ组:5 mg/L, Ⅱ组:10 mg/L, Ⅲ组:15 mg/L, Ⅳ组:20 mg/L。各自加入氮饥饿后的藻体,初始培养密度为1 g/L。
1.2.2 藻体代谢物对裙带菜雄配子体生长的影响取一定量的裙带菜雄配子体,用无氮PES培养液培养14d后分成等量的两组,将A组加入新的培养液,B组继续用旧的培养液培养(其中含有14 d内积累的配子体代谢废物),并使各组培养液中的氨态氮含量均保持一致,藻体密度均为1 g/L,培养14 d。
将这批藻继续培养,仍然是A组加入新的培养液,B组继续用旧的培养液培养,各组培养液中的氨态氮含量恢复为5 mg/L,初始藻体密度不再是1 g/L,而是用现有密度(7.55 g/L、8.52 g/L)培养,培养32 d。
1.2.3 藻体生长的测定方法将射入光强定为3 000 Lux,在培养期间每天定时定点在培养瓶背光面用PANLUX照度计测量穿透光强,利用以下公式计算出消光值[12]:E=lg(I0/I),其中E为消光值,I0为培养开始时的穿透光强(Lux),I为培养结束后的穿透光强(Lux)。消光值与鲜重的增加有紧密的相关关系,从而可以间接反映藻体密度。
1.2.4 培养液中含氮量的测定氨态氮的测定方法采用次溴酸盐氧化法[13]。次溴酸盐在碱性介质中将氨氧化成亚硝酸盐,而亚硝酸盐在酸性介质中与磺胺进行重氮化反应,其产物再与盐酸萘乙二胺偶合生成红色偶氮染料,于543 nm处有吸收光值。具体测定步骤如下:抽取待测水样50 mL(如果浓度超过本方法的测定范围,则采用稀释的方法,将其浓度调节到适当的范围),放入50 mL具塞磨口锥形瓶中,并加入5 mL 0.47mol/L的次溴酸钠溶液,混匀,放置5 min;再加入5 mL 2 g/L的磺胺溶液,混匀,放置5 min;然后加入1 mL 1.0 g/L的盐酸萘乙二胺溶液,混匀,放置15 min,最后测定波长543 nm处的吸光值,对照氨态氮吸收的标准曲线,计算出待测液的氨态氮浓度。
1.2.5 工作标准曲线使用氨标准溶液配制氨态氮浓度分别为0 mg/L、0.02mg/L、0.04 mg/L、0.08 mg/L、0.12 mg/L、0.16 mg/L、0.20 mg/L的溶液,作出工作曲线。
1.2.6 裙带菜雄配子体平均日生长量及平均日生长率的计算X=(W-W0)/N,W=W0(1+Y)N,其中,X为平均日生长量(g/d),Y为平均日生长率(%),W为培养结束时藻体重(g),W0为培养开始时藻体重(g),N为培养时间(d)。
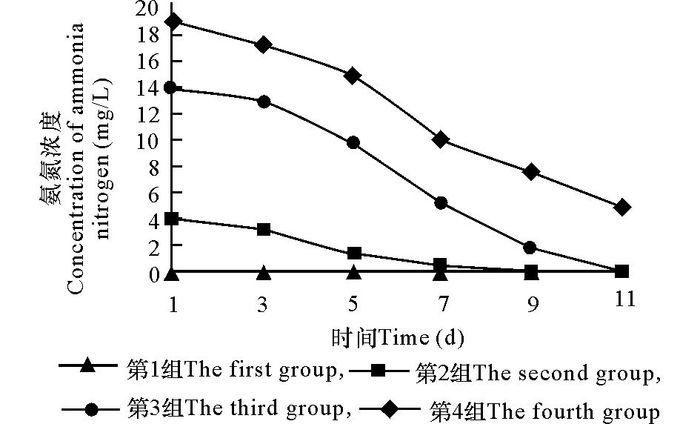
2 结果与分析 2.1 培养过程中裙带菜配子体对氨态氮的吸收在氨态氮浓度依次为0 mg/L、5 mg/L、15 mg/L、20 mg/L的条件下,裙带菜雄配子体对氨态氮的吸收较快,第3组中15 mg/L的氮几乎在11 d之内被消耗尽(图 1)。11 d后,第4组20 mg/L的氮也降低较多。而且,第2组5 mg/L的氮在大约7 d的时间内被吸光。在这4种不同的氨氮浓度下,由于20 mg/L的氮维持时间长,因此藻体长得最好,直至培养到第11天还未出现颜色变浅等缺氮现象。同时可以看出,裙带菜雄配子体并没有因为长时间培养,水中代谢废物的增多而使其生长受到影响。
|
图 1 裙带菜雄配子体对氨氮的吸收 Fig.1 Ammonia nitrogen absorption of Undaria gametophyte |
在开始培养时将氨氮浓度设置为0 mg/L、5 mg/L、15 mg/L、20 mg/L,培养过程中不再加氮,使得培养液中的氮浓度逐日下降。由表 1可见,在初始氨态氮浓度为20 mg/L时,裙带菜雄配子体平均日生长速度最大,为6.19 g/d,约为0 mg/L组的2倍,其平均日生长率约为25%。但是由于其他3组的氮先于第4组被消耗光,因此这个差异可能是由于前3组缺氮导致的生长减缓。从图 2可以看出,在培养前6 d,即第3, 4组中的氨态氮均未消耗完全时,第3组的消光值最大。而当第3组中氨态氮消耗光后,只有第4组仍保持较快的生长。
| 表 1 培养液中的氨氮浓度变化对裙带菜雄配子体生长的影响 Table 1 The effect of ammonia nitrogen concentration on Undaria male gametophyte growth |

|
图 2 氨态氮浓度变化情况下裙带菜配子体消光值的变化 Fig.2 The change of extinction value of Undaria male gametophyte under different concentration of nitrogen |
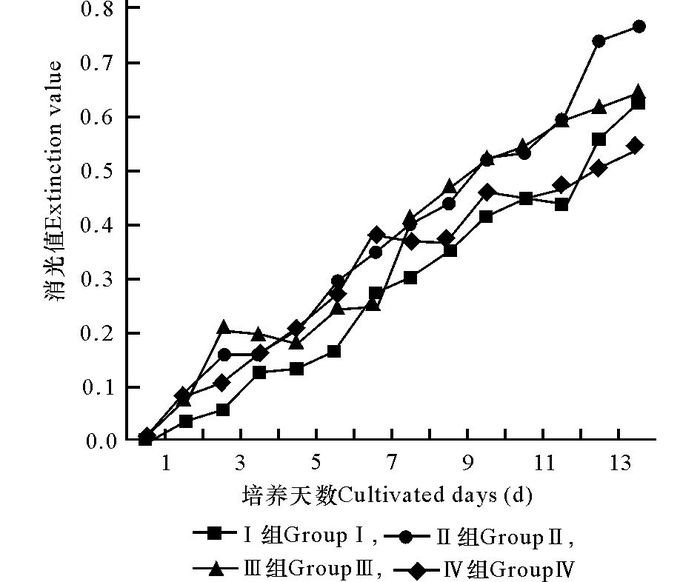
开始培养时将氨氮浓度设置为5mg/L、10 mg/L、15 mg/L、20 mg/L,并在培养过程中每隔1 d测量一次培养液中的氨态氮含量,根据培养液氨态氮含量的变化补充氨态氮以维持其浓度的恒定。从表 2可以看出,Ⅱ组和Ⅲ组,即氨氮浓度分别为10 mg/L和15 mg/L时的生长速度较快,其平均日生长率分别为15.3%和17.7%。图 3反映的结果也大致相同,只是由于培养后期藻体密度变大导致藻丝相互缠绕,穿透光强而上升使消光值反而下降。
| 表 2 培养液中的氨氮浓度不变对裙带菜雄配子体生长的影响 Table 2 The effect of ammonia nitrogen concentration on the growth of Undaria male gametophyte |
|
图 3 氨态氮浓度不变情况下裙带菜雄配子体消光值的变化 Fig.3 The change of extinction value of Undaria male gametophyte under the same concentration of nitrogen |
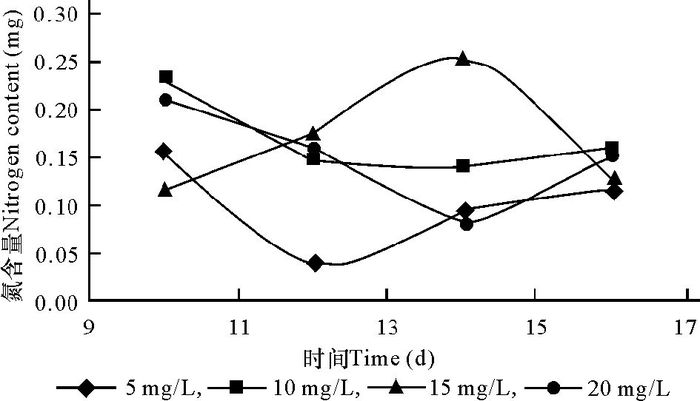
另外,根据培养液中每日含氮量的变化以及平均每日克隆的重量算出平均每日每克克隆吸收的氨态氮毫克数(图 4)。从图中可以看出,含氮量为10 mg/L和15 mg/L的培养液中生长的克隆平均每日吸氮量较多,从一定程度上反映克隆中蛋白质含量增加较快。
|
图 4 平均每日每克克隆的吸氮量 Fig.4 The average asorption of nitrogen daily per gram of Undaria male gametophyte |
用新旧培养液培养14 d后观察培养结果,发现两组之间无明显差别(表 3)。
| 表 3 藻体代谢产物对裙带菜雄配子体生长的影响(一) Table 3 The effect of metabolites on growth of Undaria male gametophyte(一) |
继续培养32d后结果如表 4所示,各组的生长速度之间并无明显的区别,但都减慢了。这可能是由于开始培养时藻体密度较大,使得培养过程中各克隆之间遮光并相互争夺养料。但是,各组在形态上是有差别的。第1组的藻可见新枝的萌出,第2组的藻细胞似乎只向一个方向分裂,新枝较少见。
| 表 4 藻体代谢产物对裙带菜雄配子体生长的影响(二) Table 4 The effect of metabolites on growth of Undaria male gametophyte(二) |
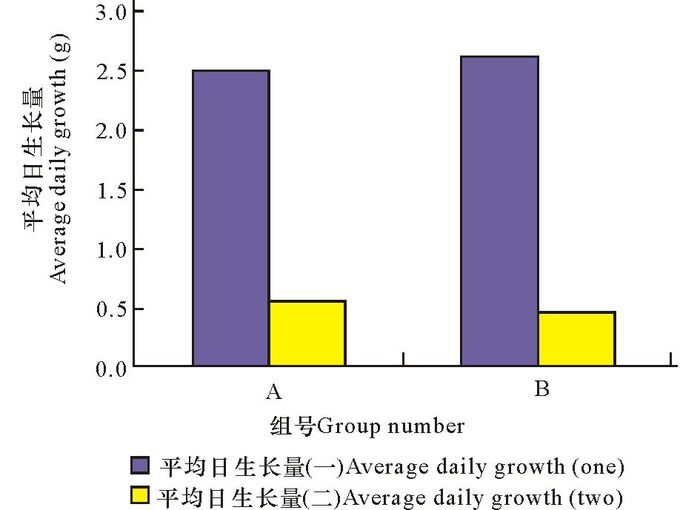
另外实验还发现,克隆密度高的情况下,生长速度会有所下降(图 5,其中平均日生长量(一)指的是培养14d的结果,平均日生长量(二)指的是培养32 d的结果)。所以在培养时应该注意及时分瓶扩养。
|
图 5 两次新旧培养液对照培养的比较 Fig.5 The compare of new and old medium |
前人研究表明,植物对于多种无机盐的吸收,都呈现出以下的规律,即开始时是一个快速吸收阶段,之后紧接着一个持续时间较长的缓慢吸收阶段[14],裙带菜雄配子体对于氨态氮的吸收即为该种规律,饥饿的骨条藻以及海链藻细胞也具有类似的氨态氮吸收特性[15]。雄配子体这种吸收速度形式的变化,有如下两种推测:一是随着溶液中氨态氮浓度的降低,溶液中可供吸收的氨态氮浓度降低,藻体对于氨态氮的吸收速率也相应降低;另一说法是雄配子体对氨态氮的吸收速度与雄配子体内部氨态氮水平相关。当藻体在很短时间内将培养液中大部分的氨态氮吸收以后,雄配子体内的氨态氮水平远远高于溶液中剩余的氨态氮水平,阻止雄配子体对氨态氮进一步的吸收,藻体的吸收速度也随之下降。例如马铃薯组织对无机盐的吸收规律即是如此[14]。
氮对于裙带菜雄配子体的生长是必不可少的。而且在一定范围内提高氮浓度会加快配子体克隆的生长。但过高的氮浓度会影响它的发育。对于以氨态氮形式存在的氮元素,由于高浓度的NH3对细胞有毒害作用,更要限制它的浓度[16]。因此,在实验中将氨态氮浓度设置为5~20mg/L,并作了一个不额外加入氮、只利用海水中原有氮的对照组。结果表明,增加自然海水中的氮含量至一定水平的确可以将裙带菜雄配子体的生长速度提高很多倍,这对于在实验室中快速培养出大量具有优良品质的配子体是一项有效并且简单易行的措施。
雄配子体经多次分裂后,形成多分枝的丝状体[17]。如果培养液中这样的丝状体过多,它们之间就会相互缠绕,彼此争夺养分,遮挡光线。在实验过程中,当克隆被培养至第15天左右时,消光值有明显的下降。这就是由于藻丝相互缠绕造成穿透光强的增高[18]。
在海中生长的裙带菜由于海水不停地流动带走了它的代谢产物[19]。而对于在实验室中瓶养的裙带菜,其代谢产物积累在培养液中。这些代谢产物对克隆生长的危害与否决定着更换培养液的必要性与频率[20]。从实验结果中看不出46d内水中积累的代谢产物对雄配子体克隆生长的不利影响。在新、旧水中培养的克隆除在形态方面略有差别之外,生长速度无显著差异。由此看来,至少在生长速度方面,克隆的代谢产物不会在裙带菜配子体培养过程中产生危害。至于对克隆生长其它方面的影响,还需做进一步的探讨。
| [1] |
张文竹, 刘红兵, 管华诗. 裙带菜的化学成分及其生物活性研究进展[J]. 海洋科学, 2009, 33(4): 72-75. ZHANG W Z, LIU H B, GUAN H S. Advances in the studies on the chemical constituents and biological activity of marine seaweed Undaria pinnatifida[J]. Marine Sciences, 2009, 33(4): 72-75. |
| [2] |
逄少军, 吴超元. 我国裙带菜人工育苗技术的现状和展望[J]. 海洋科学, 1994(6): 25-27. PANG S J, WU C Y. Present and prospects of the techniques to raise Undaria sporeelings in China[J]. Marine Sciences, 1994(6): 25-27. |
| [3] |
于慧, 李明艳, 张典, 等. 响应面试验优化裙带菜蛋白酶解工艺及酶解液抗氧化活性[J]. 食品科学, 2017, 38(6): 96-103. YU H, LI M Y, ZHANG D, et al. Optimization of enzymatic hydrolysis of Undaria pinnatifida protein and antioxidant activity of its hydrolysate[J]. Food Science, 2017, 38(6): 96-103. DOI:10.7506/spkx1002-6630-201706015 |
| [4] |
周卫松. 裙带菜中岩藻黄质、岩藻多糖的综合提取纯化研究[D]. 杭州: 浙江大学, 2013. ZHOU W S.Extraction and purification of fucoxanthin and fucoidan from Undaria pinnatifida[D].Hangzhou:Zhejiang University, 2013. http://d.wanfangdata.com.cn/Thesis/Y2507755 |
| [5] |
李丹彤, 陈国栋, 张玲丽, 等. 裙带菜岩藻黄素的提取分离及对人肝癌细胞HepG2的抑制作用研究[J]. 辽宁师范大学学报:自然科学版, 2012, 35(3): 383-389. LI D T, CHEN G D, ZHANG L L, et al. Study on extraction, isolation of fucoxanthin of Undaria pinnatifida and the effect of inhibition proliferation of HepG2[J]. Journal of Liaoning Normal University:Natural Science Edition, 2012, 35(3): 383-389. |
| [6] |
周卫松, 杨艳, 刘明社. 裙带菜中岩藻黄质的提取纯化工艺研究[J]. 食品工业科技, 2015(3): 260-265. ZHOU W S, YANG Y, LIU M S. Extraction and purification of fucoxanthin from Undaria pinnatifida[J]. Science and Technology of Food Industry, 2015(3): 260-265. |
| [7] |
张警予, 李裕博, 余洋定, 等. 纤维素酶辅助提取裙带菜孢子叶多糖工艺条件优化的研究[J]. 食品科技, 2014, 39(8): 178-181. ZHANG J Y, LI Y B, YU Y D, et al. Optimization on cellulase-assistant extracting technological conditions of polysaccharide from sporophyll of Undaria pinnatifida[J]. Food Science and Technology, 2014, 39(8): 178-181. |
| [8] |
单体锋, 李静, 逄少军. 我国裙带菜育苗和育种技术的回顾和展望[J]. 中国农业科技导报, 2016, 18(1): 164-170. SHAN T F, LI J, PANG S J. Review and prospect on seedling production and breeding techniques of Undaria pinnatifida in China[J]. Journal of Agricultural Science and Technology, 2016, 18(1): 164-170. |
| [9] |
逄少军, 单体锋, 刘明泰, 等. 辽东半岛裙带菜室内常温全人工育苗:双高光控制、温度变化和配子体发育[J]. 渔业科学进展, 2011, 32(5): 74-83. PANG S J, SHAN T F, LIU M T, et al. Cultivation of Undaria pinnatifida in Liaodong Peninsula:Irradiance control, ambient temperature changes vs.gametogenesis in seedling production process[J]. Marine Fisheries Research, 2011, 32(5): 74-83. |
| [10] |
南春容, 王铁杆, 张鹏, 等. 南麂列岛铜藻氮磷吸收特征研究[J]. 上海海洋大学学报, 2014, 23(5): 706-711. NAN C R, WANG T G, ZHANG P, et al. Absorption characteristics of N and P by a macroalga, Sargassum horneri, in Nanji Islands[J]. Journal of Shanghai Ocean University, 2014, 23(5): 706-711. |
| [11] |
李大鹏, 邓海临, 李慧, 等. 裙带菜(Undaria pinna-tifida)配子体对氨态氮和硝态氮的吸收利用比较[J]. 海洋与湖沼, 2016, 47(4): 847-853. LI D P, DENG H L, LI H, et al. Comparison in assimilation of ammonia nitrogen and nitrate nitrogen by Undaria pinnatifida gametophytes[J]. Oceanologia et Limnologia Sinica, 2016, 47(4): 847-853. DOI:10.11693/hyhz20160400079 |
| [12] |
贺锋, 吴振斌, 邱东茹. 东湖围隔中菹草与藻类生化他感作用的初步研究[J]. 水生生物学报, 2002, 26(4): 421-424. HE F, WU Z B, QIU D R. Allelopathic effects between aquatic plant (Potamogeton crispus) and algae (Scenedesmus obliquus) in the enclosures at Donghu Lake[J]. Acta Hydrobiologica Sinica, 2002, 26(4): 421-424. |
| [13] |
海洋环境监测规范水质分析: HY 003. 4-1991[S]. 北京: 海洋出版社, 1992. Marine environmental monitoring code water quality analysis: HY 003.4-1991[S].Beijing:Ocean Press, 1992. |
| [14] |
KRAMER P J.The uptake of salts by plant cells[M]//Allgemeine physiologie der pflanzenzelle/General physiology of the plant cell.Springer Berlin Heidelberg, 1956:290-315.
|
| [15] |
姚南瑜. 藻类生理学[M]. 大连: 大连工学院出版社, 1987. YAO N Y. Algae physiology[M]. Dalian: Dalian Institute of Technology Press, 1987. |
| [16] |
王宗诚, 方宗熙. 无机氮和磷对海带配子体生长发育的影响[J]. 山东海洋学院学报, 1980, 10(4): 74-77. WANG Z C, FANG Z X. Effects of inorganic nitrogen and phosphorus on the growth and development of laminaria japonice female gametophytes[J]. Journal of Shandong College of Oceanology, 1980, 10(4): 74-77. |
| [17] |
曾呈奎. 经济海藻种质种苗生物学[M]. 济南: 山东科学技术出版社, 1999. ZENG C K. Economic seaweed germplasm biology[M]. Jinan: Shandong Science and Technology Press, 1999. |
| [18] |
曾呈奎, 吴超元. 海带养殖学[M]. 北京: 科学出版社, 1962. ZENG C K, WU C Y. Kelp aquaculture[M]. Beijing: Science Press, 1962. |
| [19] |
PANG S J, HU X Y, WU C Y, et al. Intraspecific crossings of Undaria pinnatifida (harv.) sur.-a possible time-saving way of strain selection[J]. Chinese Journal of Oceanology and Limnology, 1997, 15(3): 227-235. DOI:10.1007/BF02850878 |
| [20] |
PANG S J, WU C Y. Study on gametophyte vegetative growth of Undaria pinnatifida and its applications[J]. Chinese Journal of Oceanology and Limnology, 1996, 14(3): 205-210. DOI:10.1007/BF02850381 |
 2017, Vol. 33
2017, Vol. 33 


