2. 青岛市大型海藻工程技术研究中心,山东青岛 266104;
3. 青岛鲁海水产技术发展公司,山东青岛 266100
2. Macroalgae Engineering Technology Research Center of Qingdao, Qingdao, Shandong, 266104, China;
3. Qingdao Luhai Aqua Technology Development Company, Qingdao, Shandong, 266100, China
【研究意义】以马尾藻类为代表的大型褐藻,在对海洋环境的调节和稳定过程中发挥着非常重要的作用。在自然界,这些海藻多数依靠有性繁殖扩大分布区域,依靠新生枝条维持种群繁茂。随着我国海洋牧场建设工作的不断推进,开展大型海藻的人工繁育从而提供大量苗种显得尤为重要。目前,海黍子(Sargassum muticum)等大型海藻的苗种繁育工作已有实践性的开展。海黍子是褐藻门的大型藻类之一,隶属于马尾藻科、马尾藻属。其藻体从主干上发生的第一次分枝称为初生分枝,初生分枝上再次发生的第二次分枝称为次生分枝,次生分枝上发生三生分枝,其特有的三生分枝在苗种繁育过程中具有重要的实践意义。【前人研究进展】海黍子是北太平洋西部特有的暖温带性种类,主要分布在我国黄海渤海沿岸[1]。另外俄罗斯(萨哈林岛、千岛群岛)和日本沿岸也有分布[2]。海黍子具有较高的经济价值和生态价值,除了作为传统的褐藻胶原材料[3-4]及饵料[5]之外,还是构建潮下带海藻场的重要种类之一,可为海洋生物如鱼类、贝类等提供产卵、繁育和索饵的场所[6]。海黍子营养丰富且比较均衡,富含矿物质及人体必需的微量元素; 海黍子富含褐藻多酚,是天然的抗氧化剂[7],抗氧化能力较强,食用及药用价值均比较突出[8]。【本研究切入点】目前关于海黍子的研究主要集中在两个方面:一是生理生化和生态学等方面,如不同光照条件下海黍子的生长情况、光照强度对叶绿素a等生化物质的影响[9]、对氮磷等营养盐的去除效果[10]以及对外源无机碳利用机制[11]等。二是苗种繁育方面,如海黍子新生枝条的室内培养和有性生殖同步化研究[12],并初步开展了苗种繁育工作[6, 13]。关于在繁殖期海黍子分生枝条的变化等方面的研究未见报道。【拟解决的关键问题】本研究对繁殖期的海黍子藻体形态进行观察,并初步阐述三生分枝在海黍子生长及繁殖过程中的重要意义,同时对三生分枝进行离体培养,研究离体培养情况下三生分枝的生长及生殖托数量的变化情况,为全面了解海黍子的生活史并为其后续的人工繁育及养殖等工作提供理论支撑。
1 材料和方法 1.1 材料实验材料采集于山东省荣成市沿海潮间带。选择生长旺盛、藻体完整、分枝繁茂的海黍子成体,将70%以上三生分枝挂托的海黍子藻体连同固着器一起采集。采集到的海黍子藻体于过滤海水中反复冲洗后用于藻体形态观察实验。
将带有生殖托的海黍子三生分枝从藻体上剥离后,在光照培养箱中进行培养,培养容器为培养皿(直径12 cm)。培育期间保持培育条件:温度18℃、光照强度7 000 Lux,光周期14:10 (L/D)。培养用的海水为加富的消毒海水,并每天更换。
1.2 方法 1.2.1 藻体形态观察次生分枝长度与三生分枝数量的关系:随机选择繁殖期的海黍子成体50株,每株选择1条有代表性的海黍子次生分枝,分别测量次生分枝长度和三生分枝数量。
三生分枝在次生分枝上的分布:选择健康的海黍子次生分枝,由基部开始标记海黍子三生分枝次序,依次测量三生分枝长度。
三生分枝长度与生殖托数量的关系:从健康生长的海黍子次生分枝上随机选取带有生殖托的三生分枝50条,分别测量三生分枝长度及生殖托数量。
1.2.2 离体培养三生分枝生殖托数量变化:分别对实验前后三生分枝上生殖托数量进行计数,并以生殖托增加数量为考查指标进行聚类分析。
三生分枝特定生长率:分别测量实验前后三生分枝长度,并以长度变化为考查指标进行特定生长率计算分析。试验时间为7d。
特定生长率SGR=(lnlt-lnl0)/t×100%,其中:l0为海黍子三生分枝初始长度(cm);lt为试验结束时海黍子三生分枝的长度(cm);t为试验持续的天数。
1.2.3 数据处理数据均以平均值±标准差(X±SD)表示。通过统计软件SPSS 22.0对数据进行线性回归分析,显著性水平设为0.05。
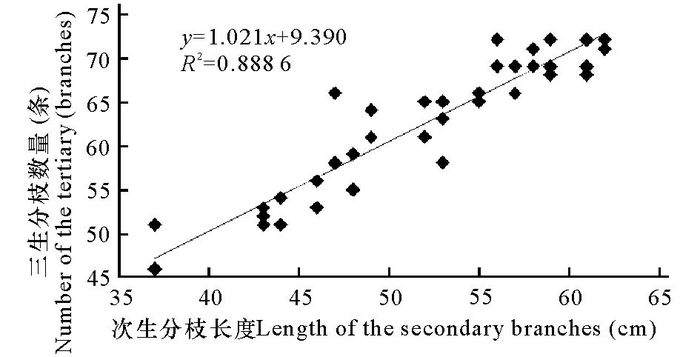
2 结果与分析 2.1 藻体形态观察 2.1.1 次生分枝长度与三生分枝数量的关系测量结果表明,三生分枝的数量(62.8±7.65) 条同次生分枝的长度(52.28±7.06) cm呈正相关(P<0.05,R2=0.8886),平均每(1.20±0.06) cm即分布有一条三生分枝(图 1)。
|
图 1 次生分枝长度与三生分枝数量的关系 Fig.1 Relationship of the secondary branches and tertiary branches |
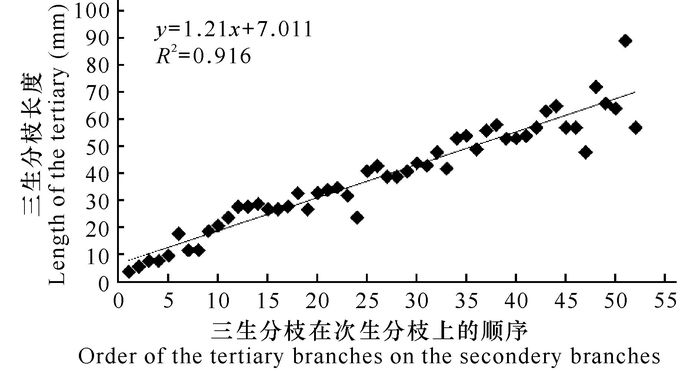
在次生分枝上各个三生分枝呈塔型分布。同一条次生分枝上,三生分枝的长度为(4.04±1.82) cm,长度差异较大,在基部最长的三生分枝可达89 mm,而在顶端的较短三生分枝则仅为8 mm。这与三生分枝在次生分枝上的分布实验结果相一致(P<0.05,R2=0.916),如图 2。
|
图 2 三生分枝在次生分枝上的分布 Fig.2 Distribution of the tertiary branches on secondary branches |
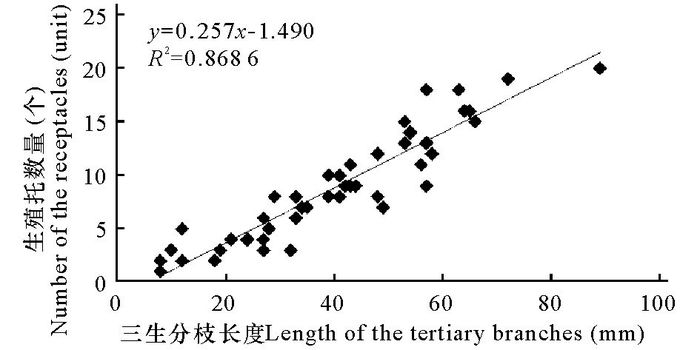
根据实验结果可以看到,虽然不同的海黍子三生分枝上生殖托数量差异较大,最多为20个,最少为1个,但是海黍子生殖托数量(8.94±5.05) 个同三生分枝的长度(4.04±1.82) cm呈正相关的关系(P<0.05,R2=0.8686),平均每(0.50±0.16) cm即分布有1个生殖托(图 3)。
|
图 3 三生分枝长度与生殖托数量的关系 Fig.3 Relationship between the length of tertiary branches and the number of receptacles |
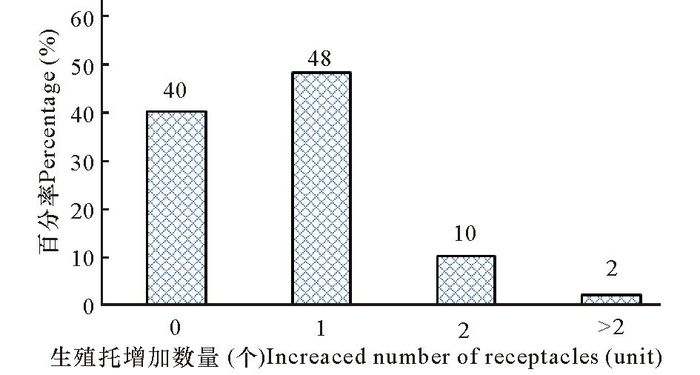
离体培养情况下,研究海黍子三生分枝生殖托的数量变化,可以发现,试验期间生殖托数量变化不大,多数(88%)为增长1个或者不增长,少数(12%)能增加2个以上(含2个)生殖托(图 4)。
|
图 4 离体培养生殖托数量变化情况 Fig.4 Changes of the number of receptacles in vitro culture |
对海黍子三生分枝特定生长率计算及分析可以发现,离体培养试验期间三生分枝均有不同程度的增长,特定生长率多数(86%)集中在0%~2%,不增长或出现负增长的占12%(图 5)。
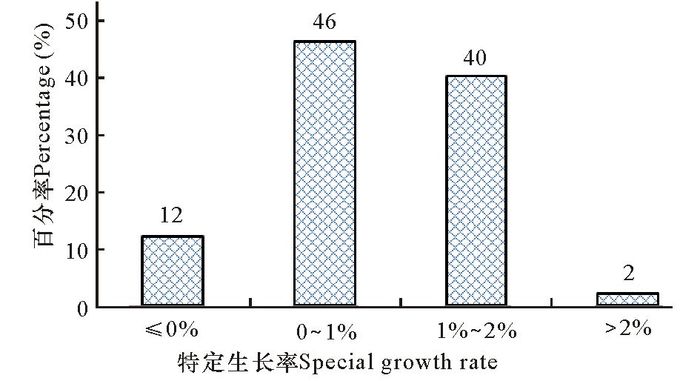
|
图 5 离体培养海黍子三生分枝生长情况 Fig.5 The SGR of tertiary branches in vitro culture |
海黍子属于大型海藻,已经初步具备了类似根、茎、叶的分化。海黍子藻体庞大,在北方海水中长度可达4 m以上。海黍子不喜丛生,一般为单株分布,整株藻体借助气囊漂浮于海水中,在静水中分枝散开,在流水状态下呈束状。海黍子于每年的3—4月份进入生长旺盛期直至繁殖期,次生分枝、三生分枝生长旺盛,生殖托在繁殖期逐渐出现,并快速生长。海黍子三生分枝是叶片、气囊和生殖托发生的主要部位,在藻体的初生分枝和次生分枝上少有叶片分布,仅在顶端偶有气囊和生殖托发生。次生分枝上分布有楔形或亚楔形的叶片,从叶腋间发生长短不一的三生分枝。三生分枝在次生分枝上发生的数量,随着次生分枝长度的不同而不同。
实验研究发现,在次生分枝上各个三生分枝呈塔型分布,即基部分枝较长,而沿着次生分枝由基部向上,三生分枝长度逐渐变短。这种分布形式,在海水中便于整个藻体的次生分枝、三生分枝等不同部位接受充足的阳光照射,确保海黍子生长发育及繁殖过程中对于光线的捕捉和利用,满足了海黍子光合作用的需求,同时也是墨角藻目海藻顶端生长的结果[14]。
3.2 海黍子生殖托及三生分枝的立体培养与生长情况生殖托是海黍子的生殖器官。生殖托内有生殖窝发生,精囊及卵囊存在于生殖窝内。海黍子雌雄同体,雌雄生殖窝均分布在同一个生殖托上,雌性生殖窝分布在生殖托的中上部,雄性生殖窝分布在生殖托基部近柄部,雌性生殖窝个体大于雄性生殖窝[6]。海黍子生殖托大多发生于三生分枝上,其数量的多少关系到藻体的繁殖能力,生殖托数量越多,其产生的精子和卵子越多,可形成的受精卵数量也越多。本研究发现,海黍子生殖托数量变化不大,在7d试验期间内,增加1个生殖托的数量占48%,另有40%不增加生殖托个数,说明海黍子在资源分配上不再倾向于生殖托数量的增加,而倾向于生殖托自身个体的发育。虽然生殖托在三生分枝上的分布较多,但是生长情况并不平均,发育也不同步。即便是同一条三生分枝上,在基部和顶端的生殖托发育也并不完全同步。不仅如此,即便是同一个生殖托上,精子及卵子的成熟和排放也不同步。一般认为,成熟的卵子排放出生殖托体外后,黏附于生殖托表面等待授精[5-6],这与鼠尾藻[13]、羊栖菜[15]等海藻的卵子排放及授精过程相一致。海黍子的受精卵是被动附着,在自然环境条件下附着率偏低,但是海黍子拥有大量的怀卵生殖托,在数量上能够保证海黍子完成有性繁殖过程,从而保障了海黍子群体的不断繁衍。
海黍子的生殖器官即生殖托大多集中发生在三生分枝上,在海黍子种菜促熟阶段,可以有目的地对三生分枝进行离体培养,从而获取集中成熟的生殖托及受精卵。本研究发现,试验期间生殖托数量变化不大,但是三生分枝有不同程度的生长,特定生长率能够保持在一定范围(0%~2%),说明为了满足生殖器官发育成熟的营养需求,三生分枝也在进行一定程度的生长,从而实现对营养资源的进一步获取。对鼠尾藻生长和生殖的权衡研究表明[16],在生殖期间,鼠尾藻营养组织和生殖组织的生物量均有不同程度的增加,但是生殖组织的增加速率要高于营养组织。这是植物在对可以获取的资源进行分配的过程中自我权衡的结果[17]。
4 结论三生分枝是海黍子叶片、气囊和生殖托发生的主要部位,在海黍子生长及繁殖过程中具有重要的意义。不同分枝特别是三生分枝在海黍子藻体上的分布有一定的规律性,与次生分枝长度有一定的相关性,同时三生分枝的长度和其产生的生殖托数量也有密切的关系。
在离体培养条件下,三生分枝依然能够继续生长,并有不同数量的新生生殖托产生,这一特点有助于海黍子人工有性繁殖工作的开展。
| [1] |
马伟伟, 李丽, 周革非. 海黍子硫酸多糖体外免疫与抗肿瘤活性研究[J]. 食品科学, 2013(7): 270-274. MA W W, LI L, ZHOU G F. In vitro immunoregulatory and antitumor activity of sulfated polysaccharides from Sargassum kjellmanianum[J]. Food Science, 2013(7): 270-274. DOI:10.7506/spkx1002-6630-201307057 |
| [2] |
CURIEL D, BELLEMO G, MARZOCCHI M. Distri-bution of introduced Japanese macroalgae Undaria pinnatifida, Sargassum muticum (Phaeophyta) and Antithamnion pectinatum (Rhodophyta) in the Lagoon of Venice[J]. Hydrobiologia, 1998, 385(1/2/3): 17-22. |
| [3] |
钱树本, 刘东艳, 孙军. 海藻学[M]. 青岛: 中国海洋大学出版社, 2005: 452-459. QIAN S B, LIU D Y, SUN J. Phycology[M]. Qingdao: China Ocean University Press, 2005: 452-459. |
| [4] |
曾呈奎, 陆保仁. 中国海藻志:第三卷褐藻门:第二册墨角藻目[M]. 北京: 科学出版社, 2000: 54-56. ZENG C K, LU B R. The records of China seaweed (3rd volumes) Phaeophyta (2nd volumes) Fucales[M]. Beijing: The Science Publishing Company, 2000: 54-56. |
| [5] |
曹淑青, 张泽宇, 王国书, 等. 海黍子室内人工育苗技术的研究[J]. 大连水产学院学报, 2008, 23(5): 359-363. CAO S Q, ZHANG Z Y, WANG G S, et al. Indoor artificial seeding of seaweed Sargassum muticum[J]. Journal of Dalian Fisheries University, 2008, 23(5): 359-363. |
| [6] |
詹冬梅, 吴海一, 王翔宇, 等. 海黍子苗种繁育技术初探[J]. 海洋湖沼通报, 2015(2): 1-8. ZHAN D M, WU H Y, WANG X Y, et al. Studies on seedling development and seedling-rearing of Sargassum muticum[J]. Transactions of Oceanology and Limnology, 2015(2): 1-8. |
| [7] |
CHEW Y, LIM Y, OMAR M, et al. Antioxidant activity of three edible seaweeds from two areas in South East Asia[J]. LWT-Food Science and Technology, 2008, 41(6): 1067-1072. DOI:10.1016/j.lwt.2007.06.013 |
| [8] |
陈震, 刘红兵. 马尾藻的化学成分与生物活性研究进展[J]. 中国海洋药物, 2012, 31(5): 41-51. CHEN Z, LIU H B. Progress in research on chemical constituents and bioactivities of Sargassum[J]. Chinese Journal of Marine Drugs, 2012, 31(5): 41-51. |
| [9] |
詹冬梅, 吴海一, 刘梦侠, 等. 光照强度对海黍子生长及部分生化指标的影响[J]. 渔业科学进展, 2013, 34(1): 140-144. ZHAN D M, WU H Y, LIU M X, et al. Impact of irradiances on growth and biochemical composition of Sargassum muticum[J]. Progress in Fishery Sciences, 2013, 34(1): 140-144. |
| [10] |
王翔宇, 王志刚, 吴海一. 海黍子(Sargassum muticum)池塘养殖及对氮磷去除效果的研究[J]. 海洋湖沼通报, 2015(1): 91-95. WANG X Y, WANG Z G, WU H Y. Study on cultivation in pond of Sargassum muticum and its capacity to uptake ammonium and phosphoru[J]. Transactions of Oceanology and Limnology, 2015(1): 91-95. |
| [11] |
程苗, 吴海一, 詹冬梅, 等. 海黍子对外源无机碳利用机制的初步研究[J]. 植物生理学报, 2015, 51(5): 679-685. CHENG M, WU H Y, ZHAN D M, et al. Preliminary study on exogenous inorganic carbon utilization in Sargassum muticum[J]. Plant Physiology Journal, 2015, 51(5): 679-685. |
| [12] |
柴雨, 王丽梅, 宋广军, 等. 海黍子新生枝条的室内培养及有性生殖同步化[J]. 海洋渔业, 2012, 34(4): 422-428. CHAI Y, WANG L M, SONG G J, et al. The culture condition optimization of growth and sexual reproduction synchronization in young tress of Sargassum muticum[J]. Marine Fisheries, 2012, 34(4): 422-428. |
| [13] |
张泽宇, 李晓丽, 韩余香, 等. 鼠尾藻的繁殖生物学及人工育苗的初步研究[J]. 大连水产学院学报, 2007, 22(4): 255-259. ZHANG Z Y, LI X L, HAN Y X, et al. Indoor artificial seeding in sea weed Sargassum thunbergii[J]. Journal of Dalian Fisheries University, 2007, 22(4): 255-259. |
| [14] |
李R E. 藻类学[M]. 段德麟, 胡自民, 胡征宇, 译. 4版. 北京: 科学出版社, 2012: 475. LEE R E.Phycology[M].DUAN D L, HU Z M, HU Z Y(eds).4th ed.Beijing:The Science Publishing Company, 2012:475. |
| [15] |
逄少军, 费修绠, 肖天, 等. 羊栖菜生殖托的离体培养的初步研究[J]. 海洋科学, 2000, 24(3): 1-3. PANG S J, FEI X G, XIAO T, et al. Suspended culture of the receptacles of Hizikia fusiformis[J]. Marine Sciences, 2000, 24(3): 1-3. |
| [16] |
张树宝, 唐永政, 王志芳, 等. 鼠尾藻生长与生殖的权衡[J]. 生态学报, 2010, 30(22): 6027-6034. ZHANG S B, TANG Y Z, WANG Z F, et al. Trade-off between growth and reproduction of Sargassum thunbergii[J]. Acta Ecologica Sinica, 2010, 30(22): 6027-6034. |
| [17] |
BAZZAZ F A, CHIARIELLO N R, COLEY P D, et al. Allocating resources to reproduction and defense:New assessments of the costs and benefits of allocation patterns in plants are relating ecological roles to resource use[J]. BioScience, 1987, 37(1): 58-67. DOI:10.2307/1310178 |
 2017, Vol. 33
2017, Vol. 33 


