2. 广西科学院, 国家非粮生物质能源工程技术研究中心, 广西南宁 530007
2. National Engineering Research Center for Non-Food Biorefinery, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
在伤口创面的护理中,人类的认识经历了3个重要的认知变革:最初追溯到古罗马时代,人类认识到在伤口覆盖物料可以促进伤口愈合,从而使用各种材料包扎伤口;从19世纪末期开始,人们建立起干燥伤口愈合的理念——能很好地吸收创面渗液、保持创面干燥才是创面愈合的关键,在这个理论的基础上发明并应用棉垫作为伤口敷料;在20世纪初,研究者逐渐意识到湿性环境下伤口愈合比干性环境下要好,从而开创并形成现代的湿润创面处理理论[1]。美国FDA在2000年8月新颁布的《创面医疗用品(外用药和敷料)行业指南》中特别强调:“保持创面湿润环境是标准的伤口处理方法”。在新认知的理念下,对创面敷料提出新的要求。
1 创面敷料材料的发展历程伤口的愈合修复过程是一个动态过程,包含细胞、酶分子活动、生化代谢途径变化这些综合性的过程[2]。在创面的损伤、愈合以及后续发展进程中,基本上分为凝血期(1d)、炎症期(3~4 d)、修复期(20 d)以及后续的重建期(图 1)。这些创面的发展进程时间虽然因伤口创面的类型、创面的大小以及人体体质的不同有所差异,但进程的发展以及进程各个阶段中经历的变化因素是一致的[3]。
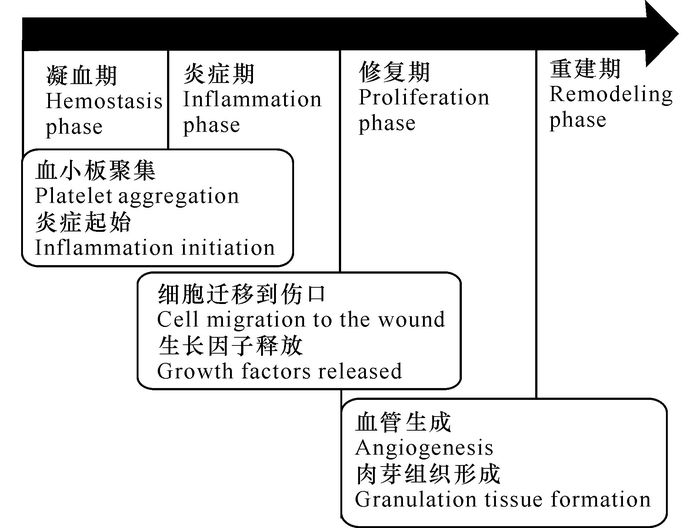
|
图 1 伤口创面恢复过程 Fig.1 The wound healing process |
传统上使用的纱布类敷料,无法保持创面湿润,创面愈合慢;敷料纤维容易和肉芽组织融合,造成异物反应,同时又造成换药的疼痛;纱布敷料则需要频繁换药,换药的工作量大,且纱布敷料的换药,会造成新生组织的损伤,增加新的创伤[4]。根据湿润创面处理理论,湿润的创面环境促进上皮形成、减缓敷料在伤口移动的不适、提高各种生长因子的释放,这些因素能促进伤口的愈合[5]。潮湿的环境促使毛细血管持续释放嗜中性粒细胞、巨噬细胞、成纤维细胞等抗炎症细胞,持续帮助创面抵御微生物感染[6]。巨噬细胞释放的各种生长因子又会持续地影响后期各个阶段的细胞生长和增殖,帮助伤口恢复。湿润创面处理的理念更具有先进性。
在新的理论指导下,出现各种新的敷料形态:水胶体(hydrocolloids)、水凝胶(hydrogels)、泡沫(foams)、半透型薄膜(transparent films)。
水胶体:利用各种有弹性的聚合物胶体颗粒与粘性物混合加工而成,并使用甲基纤维素等做成胶体颗粒,与伤口渗透液接触可以转变成胶冻样的物质[7]。
水凝胶:由多糖大分子和多孔介质材料组成的三维立体网状材料。这种材料可以发生反复水合作用,含水量达到70%以上。通过水凝胶的水合作用,创面的水分可达到平衡状态[8]。
泡沫:由多糖分子形成疏松多孔和多层的材料,在伤口接触面上会形成泡沫结构。具有强的创面渗透液吸收能力[9]。
半透型薄膜:具有半透性的薄膜,允许氧气和水蒸气通过,但对病原体具有隔离作用;同时具有透明性,便于观察伤口[10]。
相比于传统的纱布敷料,新形态的敷料材料取得长足的改进,摒弃了纱布敷料的缺点,为创面护理带来新的发展。
2 作为敷料材料使用的多糖大分子材料在自然界中,75%以上的有机物是以多糖形式存在的,但目前被研究和使用为敷料的多糖分子只是极少数。
天然成分的生物多糖作为敷料材料使用,具有无可比拟的优势:作为天然来源的多糖分子,和生物体的兼容性好,没有有机溶剂的毒性;很多多糖分子具有生物功能活性,自身就具有消炎等活性;生物多糖分子具有可降解性。但另一方面,由于多糖分子是由生物体产生的,结构上具有多样性,有一些会导致人体的免疫抗原反应。
在目前已被应用的多糖大分子中,从这些多糖的分子带电荷情况来看,可以分为3类:中性(β-葡聚糖、纤维素)、酸性(海藻酸、透明质酸)、碱性(几丁质、壳聚糖)。
2.1 β-葡聚糖β-葡聚糖是以葡萄糖为单元,由β-1, 3-1, 6-键连接而成的多糖,存在于某些微生物生长过程所分泌的粘液中,分子量在50万左右。作为天然来源的多糖,β-葡聚糖具有形成弹性胶的能力,葡聚糖还具有抑制肿瘤细胞分化、抑制炎症的作用[11]。在对来源于酵母细胞壁葡聚糖的测试发现,葡聚糖具有抑制成脂分化的作用,应用在创面上可以帮助减少皮肤灼伤感[11]。研究者将明胶和葡聚糖混合,利用冻干的方法获得多孔疏松材料,这样的材料具有90~150 μm的多孔球形结构;并以此为基础,结合使用1-(3-二甲基氨丙基)-3-乙基碳二亚胺盐酸盐作为偶联剂做成的创面覆盖膜,相对于非生物来源的材料来说更有利于上皮细胞的形成,从而更适合于用作创面敷料材料[12]。
2.2 纤维素纤维素是以葡萄糖为单元,由β-1, 4-糖苷键连接而成的多糖,提取自多种植物以及微生物中,分子量为5万到250万。在这些来源的纤维素中,细菌来源的纳米纤维素受到了格外的关注。这些由微生物产生的纳米纤维素由于具有良好的生物兼容性、可降解性、亲水性,以及广泛的化学可塑性特性成为新的选择[13]。纳米纤维素适合于制作成各种膜材料用于创面敷料上,特别是作为基础性的支撑或固定结合其他材料混合使用[14]。纳米纤维素形成的敷料材料膜适合于大面积的皮肤损伤或是皮肤移植[13]。更进一步地,通过把微生物纤维素浸没于壳聚糖溶液,然后进行冻干就可以获得纤维素和壳寡糖的混合物,该混合物具有更好的生物兼容性,而且结合了壳寡糖的优势,已经成功地被用在创面敷料以及细胞工程上[15]。另一方面,通过在纤维素基架上引入一定比例的羧甲基基团,形成羧甲基纤维素,使纤维素获得溶解性,从而可以形成具有一定粘度的溶液,其水溶液除具有粘性以外,还具有成膜、水分保持、胶体保护以及乳化的特性。利用改性的羧甲基纤维素作为支架,以PEG6000进行凝胶纺丝,可以得到物理特性改进的水凝胶覆盖材料。通过羧甲基纤维素的交联可以减少凝胶的膨胀性,提供一个三维的支撑结构和多孔吸水的特性,从而改善水凝胶最终的特性[16]。
2.3 海藻酸海藻酸是由甘露糖醛酸和葡萄糖醛酸单位组成的线性多糖,分子量从1万到60万不等。海藻酸分离自海藻,海藻酸形成凝胶的条件温和,可以避免敏感性药物、蛋白质、细胞和酶等活性物质的失活[17]。而海藻酸具有吸收自身20倍体积的强水分吸收能力,这样的特性为创面提供一个湿润的环境,同时该特性为调控伤口的水分,吸收伤口渗出液提供一个良好的载体,因而海藻酸适合作为水凝胶覆盖材料使用[18]。但海藻酸的缺陷在于缺乏吸附特性,粘着力较弱,单独作为凝胶使用没有足够的表面吸附力,还需要和其他材料联合使用以提供粘着力[19]。
2.4 透明质酸透明质酸是由两个双糖单位D-葡萄糖醛酸及N-乙酰葡糖胺组成的多糖。人体结构中本身就包含有透明质酸,所以透明质酸作为创面敷料不会引起人体免疫反应。透明质酸具有很高的水分吸收和滞留能力,而且其可以和蛋白质、蛋白多糖、生长因子等重要的活性成分相互吸附和结合,支持新生血管的生成和血管修复,从而帮助伤口愈合[20]。对小鼠皮肤伤口实验模型的测试表明,使用透明质酸和聚氨酯相结合形成的银离子泡沫材料,在1周的时间内,伤口面积就减少77%,而且没有炎症发生[21]。透明质酸的分子量和它的生理活性密切相关。Holstlaw等[22]分析由不同分子量的透明质酸制作的伤口敷料,实验表明小分子透明质酸结合形成的敷料相对于大分子的透明质酸具有更快的血管生成效应,该实验也说明透明质酸作为功能因子具有帮助伤口愈合的作用,同时也说明生物多糖的分子量大小影响到功能因子的发挥。
2.5 几丁质和壳聚糖几丁质和壳聚糖都是由葡糖胺分子连接而成的多糖,提取自甲壳类海洋动物的外壳。壳聚糖是几丁质经过碱处理脱去乙酰基后的产物。壳聚糖和几丁质是在创面敷料中应用最广泛的天然多糖分子,目前已经被做成水溶性敷料[23]、微球颗粒材料[23]、薄膜材料[24-25]、水凝胶材料[26-27]等形式的敷料使用。
壳聚糖材料包容性好,可以和各种材料相互兼容。已有研究把壳聚糖和银纳米颗粒做成抗菌薄膜敷料,壳聚糖载体可以维持银离子的纳米颗粒状态,结合壳聚糖的阳离子效应和银离子的抑菌作用,对大肠杆菌和芽孢杆菌有很好的抑菌作用[28]。把生长因子和壳聚糖结合,利用壳聚糖胶体包含EGF生长因子,24 h内EGF释放量达到97.3%[29]。这样可以实现生长因子的敷料混合使用,在减少医护人员工作量的同时,也为药物的缓释、有控制释放提供研究基础。
3 新兴的多糖大分子材料在众多的生物多糖大分子中,有一些多糖具有优异的特性,非常适合用于新型创面敷料材料。这些多糖也被证明对人体没有毒害作用,已经被广泛应用于食品和工业领域。但是这些多糖大分子并没有在创面敷料中得到广泛的应用,主要原因在于这些多糖分子具有复杂的结构,不但有不同的糖分子单元,而且有支链结构。复杂的结构导致人们对这些材料的研究滞后,以及材料在敷料制作上存在困难。
在这些多糖中,可得胶、结冷胶、阿拉伯胶、魔芋葡甘聚糖等来自于植物、微生物,这些多糖大分子产量大,无毒害,已经被应用在食品工业中,从而拥有作为敷料材料使用的巨大潜力。随着技术的发展,这些复杂结构的多糖大分子也慢慢被认识和应用到创面敷料上,并且体现出优异的特性。比如结冷胶,它是由葡萄糖、鼠李糖和葡萄糖醛酸单位组成的线性杂多糖,来自于微生物多糖,并表现出阴离子的特性。结冷胶的水溶液有很高的粘度,是一种分子聚集体的分散液。在这个结构中,葡萄糖醛酸单元可以与各种离子结合形成混合盐,体现特性上的多样性。结冷胶的凝胶化状态和结合在结冷胶上面的阳离子类型、浓度相关。这个特性适合于用作凝胶敷料[30]。更进一步地,为改善敷料凝胶的使用方便性,研究者根据结冷胶的凝结特性,利用硫醇对其进行改性,使其凝胶温度得到降低,在人体体温下实现凝胶化[31]。相对于使用双元凝结法的化学凝胶来说,该改进简化了商品化凝胶的储存,不仅方便使用,还避免有机溶剂残留对人体的毒害。
而像来自于魔芋的葡甘露聚糖,它由甘露糖和葡萄糖两种单元通过1, 4-糖苷键组成,结构中又夹杂有1, 6-糖苷键的支链,分子量大小为100万,被认为是具有乙酰化的中性多糖。魔芋葡甘露聚糖具有特殊的凝胶化特性,在低浓度条件下就体现出高粘度的特性。根据这些特性,魔芋葡甘露聚糖已经被用作保湿的成膜材料,表现出很好的保湿效果,该膜材料即使在高湿度条件下也能具有很好的力学性能[32]。而魔芋葡甘露聚糖作为一种极好的水凝胶基质,可在水溶液中制备成纳米颗粒而无需有机溶剂和化学试剂,并可使用该纳米颗粒固定蛋白质。这些特性体现了魔芋葡甘露聚糖的优势,将其应用到敷料材料上将会给敷料的性能带来新的发展[33]。
4 展望创面敷料正在处于一个新变革时期,各种新材料、新型态、新应用陆续涌现。生物多糖大分子作为天然来源的材料,具有无毒、免疫抗原性小、不含有机溶剂的优点。但是由于生物多糖材料的结构复杂性,在加工制作工艺上难度大。而利用化学法合成的有机材料容易加工成各种形态的敷料,因而有机材料仍是工业界敷料材料的主要力量。但有机合成的材料在吸水性上仍无法和一些新兴的生物多糖分子相比,生物多糖分子卓越的水分容纳和平衡特性是有机合成材料仍无法超越的。
因而对各种已有生物多糖大分子,特别是微生物发酵和植物提取得到的多糖大分子材料进行生物法或是化学法改性,以及各种材料的搭配和各种材料不同特性的适配,实现材料性能的互补,将促进这些材料的进一步利用。对生物多糖大分子在敷料新材料的研发不但促进公众健康的改善,促进大健康产业的发展,也促进当地农产品产业链的升级。然而,生物材料的开发,需要多学科的协同研究,需要材料、高分子、医学、分子生物学等领域的相互合作,才能得到真正有应用前景的新材料。
| [1] |
WINTER G D. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young domestic pig[J]. Nature, 1962, 193(4812): 293-294. DOI:10.1038/193293a0 |
| [2] |
NINAN N, THOMAS S, GROHENS Y. Wound healing in urology[J]. Advanced Drug Delivery Reviews, 2015, 82-83: 93-105. DOI:10.1016/j.addr.2014.12.002 |
| [3] |
KASUYA A, TOKURA Y. Attempts to accelerate wound healing[J]. Journal of Dermatological Science, 2014, 76(3): 169-172. DOI:10.1016/j.jdermsci.2014.11.001 |
| [4] |
BETHELL E. Why gauze dressings should not be the first choice to manage most acute surgical cavity wounds[J]. Journal of Wound Care, 2003, 12(6): 237-239. DOI:10.12968/jowc.2003.12.6.26503 |
| [5] |
MOUËS C M, HEULE F, HOVIUS S E. A review of topical negative pressure therapy in wound healing:Sufficient evidence?[J]. The American Journal of Surgery, 2011, 201(4): 544-556. DOI:10.1016/j.amjsurg.2010.04.029 |
| [6] |
STOJADINOVIC A, CARLSON J W, SCHULTZ G S, et al. Topical advances in wound care[J]. Gynecologic Oncology, 2008, 111(2 Suppl): S70-S80. |
| [7] |
MOHANDAS A, ANISHA B S, CHENNAZHI K P, et al. Chitosan-hyaluronic acid/VEGF loaded fibrin nanoparticles composite sponges for enhancing angiogenesis in wounds[J]. Colloids and Surfaces B:Biointerfaces, 2015, 127: 105-113. DOI:10.1016/j.colsurfb.2015.01.024 |
| [8] |
KUMAR A, WANG X, NUNE K C, et al. Biodegradable hydrogel-based biomaterials with high absorbent properties for non-adherent wound dressing[J]. International Wound Journal, 2017, 1-12. DOI:10.1111/iwj.12762 |
| [9] |
DOWLING M B, SMITH W, BALOGH P, et al. Hydrophobically-modified chitosan foam:Description and hemostatic efficacy[J]. Journal of Surgical Research, 2015, 193(1): 316-323. DOI:10.1016/j.jss.2014.06.019 |
| [10] |
DUTRA J A P, CARVALHO S G, ZAMPIROLLI A C D, et al. Papain wound dressings obtained from poly(vinyl alcohol)/calcium alginate blends as new pharmaceutical dosage form:Preparation and preliminary evaluation[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2017, 113: 11-23. DOI:10.1016/j.ejpb.2016.12.001 |
| [11] |
LEHTOVAARA B C, GU F X. Pharmacological, structural, and drug delivery properties and applications of 1, 3-β-glucans[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 6813-6828. DOI:10.1021/jf200964u |
| [12] |
LEE S B, JEON H W, LEE Y W, et al. Bio-artificial skin composed of gelatin and (1→3), (1→6)-β-glucan[J]. Biomaterials, 2003, 24(14): 2503-2511. DOI:10.1016/S0142-9612(03)00003-6 |
| [13] |
FU L N, ZHOU P, ZHANG S M, et al. Evaluation of bacterial nanocellulose-based uniform wound dressing for large area skin transplantation[J]. Materials Science and Engineering:C, 2013, 33(5): 2995-3000. DOI:10.1016/j.msec.2013.03.026 |
| [14] |
CZAJA W K, YOUNG D J, KAWECKI M, et al. The future prospects of microbial cellulose in biomedical applications[J]. Biomacromolecules, 2007, 8(1): 1-12. DOI:10.1021/bm060620d |
| [15] |
KIM J, CAI Z J, LEE H S, et al. Preparation and characterization of a bacterial cellulose/chitosan composite for potential biomedical application[J]. Journal of Polymer Research, 2011, 18(4): 739-744. DOI:10.1007/s10965-010-9470-9 |
| [16] |
LI D F, YE Y X, LI D R, et al. Biological properties of dialdehyde carboxymethyl cellulose crosslinked gelatin-PEG composite hydrogel fibers for wound dressings[J]. Carbohydrate Polymers, 2016, 137: 508-514. DOI:10.1016/j.carbpol.2015.11.024 |
| [17] |
THU H E, ZULFAKAR M H, NG S F. Alginate based bilayer hydrocolloid films as potential slow-release modern wound dressing[J]. International Journal of Pharmaceutics, 2012, 434(1/2): 375-383. |
| [18] |
GOH C H, HENG P W S, CHAN L W. Alginates as a useful natural polymer for microencapsulation and therapeutic applications[J]. Carbohydrate Polymers, 2012, 88(1): 1-12. DOI:10.1016/j.carbpol.2011.11.012 |
| [19] |
DANTAS M D M, CAVALCANTE D R R, ARAU ' JO F E N, et al. Improvement of dermal burn healing by combining sodium alginate/chitosan-based films and low level laser therapy[J]. Journal of Photochemistry and Photobiology B:Biology, 2011, 105(1): 51-59. DOI:10.1016/j.jphotobiol.2011.06.009 |
| [20] |
LEE S B, JEON H W, LEE Y W, et al. Artificial dermis composed of gelatin, hyaluronic acid and (1→3), (1→6)-β-glucan[J]. Macromolecular Research, 2003, 11(5): 368-374. DOI:10.1007/BF03218378 |
| [21] |
CHO Y S, LEE J W, LEE J S, et al. Hyaluronic acid and silver sulfadiazine-impregnated polyurethane foams for wound dressing application[J]. Journal of Materials Science:Materials in Medicine, 2002, 13(9): 861-865. DOI:10.1023/A:1016500429225 |
| [22] |
HOLSTLAW T A, MAHOMED M, BRIER L W, et al. Biopolymer molecular weight can modulate the wound healing efficacy of multivalent sonic hedgehog-hyaluronic acid conjugates[J]. Biomacromolecules, 2017, 18(8): 2350-2359. DOI:10.1021/acs.biomac.7b00553 |
| [23] |
SUGAMORI T, IWASE H, MAEDA M, et al. Local hemostatic effects of microcrystalline partially deacetylated chitin hydrochloride[J]. Journal of Biomedical Materials Research, 2000, 49(2): 225-232. DOI:10.1002/(ISSN)1097-4636 |
| [24] |
AZAD A K, SERMSINTHAM N, CHANDRKRAC-HANG S, et al. Chitosan membrane as a wound-healing dressing:Characterization and clinical application[J]. Journal of Biomedical Materials Research, 2004, 69(2): 216-222. |
| [25] |
BELLINI M Z, CALIARI-OLIVEIRA C, MIZUKA-MI A, et al. Combining xanthan and chitosan membranes to multipotent mesenchymal stromal cells as bioactive dressings for dermo-epidermal wounds[J]. Journal of Biomaterials Applications, 2014, 29(8): 1155-1166. |
| [26] |
CHEN X, ZHANG M, CHEN S, et al. Peptide-modified chitosan hydrogel accelerates skin wound healing by promoting fibroblast proliferation, migration and secretion[J]. Cell Transplantation, 2017. DOI:10.3727/096368917X695687 |
| [27] |
CHEN Y, ZHANG Y, WANG F J, et al. Preparation of porous carboxymethyl chitosan grafted poly (acrylic acid) superabsorbent by solvent precipitation and its application as a hemostatic wound dressing[J]. Materials Science and Engineering:C, 2016, 63: 18-29. DOI:10.1016/j.msec.2016.02.048 |
| [28] |
THOMAS V, YALLAPU M M, SREEDHAR B, et al. Fabrication, characterization of chitosan/nanosilver film and its potential antibacterial application[J]. Journal of Biomaterials Science, Polymer Edition, 2009, 20(14): 2129-2144. DOI:10.1163/156856209X410102 |
| [29] |
ALEMDAROG ČLU C, DEG ČIM Z, ÇELEBI N, et al. An investigation on burn wound healing in rats with chitosan gel formulation containing epidermal growth factor[J]. Burns, 2006, 32(3): 319-327. DOI:10.1016/j.burns.2005.10.015 |
| [30] |
OLIVEIRA J T, SANTOS T C, MARTINS L, et al. Gellan gum injectable hydrogels for cartilage tissue engineering applications:In vitro studies and preliminary in vivo evaluation[J]. Tissue Engineering Part A, 2010, 16(1): 343-353. DOI:10.1089/ten.tea.2009.0117 |
| [31] |
DU H W, HAMILTON P, REILLY M, et al. Injectable in situ physically and chemically crosslinkable gellan hydrogel[J]. Macromolecular Bioscience, 2012, 12(7): 952-961. DOI:10.1002/mabi.201100422 |
| [32] |
XIAO C B, GAO S J, ZHANG L N. Blend films from konjac glucomannan and sodium alginate solutions and their preservative effect[J]. Journal of Applied Polymer Science, 2000, 77(3): 617-626. DOI:10.1002/(ISSN)1097-4628 |
| [33] |
WANG R, XIA B, LI B J, et al. Semi-permeable nanocapsules of konjac glucomannan-chitosan for enzyme immobilization[J]. International Journal of Pharmaceutics, 2008, 364(1): 102-107. DOI:10.1016/j.ijpharm.2008.07.026 |
 2017, Vol. 33
2017, Vol. 33 


