2. 广西大学轻工与食品工程学院,广西南宁 530004;
3. 广西海洋研究所广西海洋生物技术重点实验室,广西北海 536000
2. College of Light Industry and Food Engineering, Guangxi University, Nanning, Guangxi, 530004, China;
3. Guangxi Key Laboratory of Marine Biotechnology, Guangxi Institute of Oceanology, Beihai, Guangxi, 536000, China
【研究意义】海芒果Cerbera manghas L.,又名海檬果,为夹竹桃科Apocynaceae海芒果属Cerbera红树植物,常绿小乔木,分布于日本、印度、中国、澳大利亚的热带地区,在我国主产于广西、广东、海南、台湾等地[1]。海芒果是《全国中草药汇编》中收录记载的3种药用红树植物之一,具有独特的生态适应性和生态功能[2]。作为一种具有特殊药用价值的红树植物,海芒果的内生细菌及其根际土壤的细菌可作为寻找新型抗生素的重要源泉。随着我国水产品养殖业的迅速发展,水产品产量跃居世界首位,但各种鱼类疾病也随之涌现[3],且新的疾病及致病菌耐药性等问题也层出不穷。对养殖海洋鱼类的致病菌株的流行病学调查发现,弧菌病是鱼类养殖中危害极大的病症,可危及鱼苗和成鱼[4]。哈维氏弧菌(Vibrio harveyi)、副溶血弧菌(Vibiro parahaemolyticus)和溶藻弧菌弧菌(Vibrio alginolyticus)是海水养殖鱼类的常见致病菌,这3种弧菌引起的大范围发病率给养殖业带来严重的经济损失。同时,误食这些被弧菌污染的鱼类海产品可引起食物中毒,严重者会出现休克,甚至死亡,给人们生命健康带来严重威胁。因此,对这些弧菌引起的海洋鱼类疾病的治疗显得尤为重要。【前人研究进展】海芒果作为一种具有特殊药用价值的半红树植物,其果实有剧毒,而树皮、叶子和乳汁均可以用药,有催吐、下泻、堕胎等作用[5]。曹雷雷等[6]首次从海芒果果实中分离得到苯甲酸(benzoic acid),香草酸(vanillic acid),香草醛(vanillin),对羟基苯甲醛(p-hydroxybenzaldehyde)以及间醛基苯甲酸(isophthalaldehydic acid)等15个化合物。胡世伟等[7]发现还芒果树叶的挥发油和脂肪酸中,2, 6 -二叔丁基-4 -甲基苯酚为挥发油主要成分,十六酸(棕榈酸)和9, 12 -十八碳二烯酸(亚油酸)的含量在脂肪酸中比较高。林爱玉等[8]报道了4种半红树植物内生真菌的抗菌活性。夏丽娟等[9]研究发现药用红树植物根际土壤真菌和内生真菌次级代谢产物中存在着丰富的天然活性物质。【本研究切入点】通过多种技术手段,深入研究红树植物海芒果及其根际土壤可培养细菌的多样性及其对3种海水养殖鱼类致病弧菌的抑菌活性。【拟解决的关键问题】为广西红树植物资源的研究、保护和利用提供参考依据,为海洋鱼类养殖中弧菌病的有效防治提供新的思路和方法。
1 材料与方法 1.1 材料红树植物海芒果(全株)及其根际土壤于2015年5月采集于广西北仑河口国家级自然保护区。
哈维氏弧菌分离自北部湾的红笛鲷,溶藻弧菌来源于斜带石斑鱼,副溶血弧菌分离自养殖区海水。
1.2 仪器和试剂Carestream GelLogic 2200Pro冷CCD凝胶成像分析系统(美国Carestream公司),Tgradient多功能梯度PCR仪(德国Bimetra),EXF24086V超低温冰箱(Thermo scientific),MINI B-100恒温金属浴(杭州米欧仪器有限公司), VB55高压蒸汽灭菌锅(Systec),SW-CJ-2F洁净工作台(苏州佳宝净化工程设备有限公司),HH.B11-BS-Ⅱ电热恒温培养箱(上海跃进医疗器械公司),DHG-9140A电热恒温鼓风干燥箱(上海精宏实验设备有限公司),IS-RDS3恒温振荡器(苏州精骐有限公司),Mini-6K微型离心机(珠海黑马医学仪器有限公司),VCX-500超声波细胞破碎仪(南京新辰生物科技有限公司),SHB-B95循环水式多用真空泵(河南省予华仪器有限公司)。
16S rRNA PCR扩增引物(27F:5′-AGAGTT-TGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACGACTT-3′)购自南宁科迪生物科技有限公司。
1.3 培养基及保藏剂M4培养基:1 g L-天门冬酰胺,5 g海藻糖,1 000 mL去离子水,15%琼脂,pH值7.2~7.4,121℃灭菌20 min。
M5培养基:5 g海藻糖,1 g脯氨酸,10 mL复合盐母液,1 mL维生素母液,13%琼脂,pH值7.2~7.4,121℃灭菌20 min。
M9培养基:1 g精氨酸,6 mL丙三醇,10 mL复合盐母液,15%琼脂,1 000 mL去离子水,pH值7.2~7.4,121℃灭菌20 min。
M10培养基:10 g葡萄糖,0.5 g水解酵素,10 mL复合盐母液,15%琼脂,1 000 mL去离子水,pH值7.2~7.4,121℃灭菌20 min。
AGG培养基:10 g淀粉,1 g葡萄糖,5 mL丙三醇,10 mL复合盐母液,15%琼脂,1 000 mL去离子水,121℃灭菌15 min。
R2A培养基:0.5 g酵母粉,0.5 g蛋白胨,0.5 g酪蛋白氨基酸,0.5 g葡萄糖,0.5 g可溶性淀粉,0.3 g磷酸二氢钾,0.05 g七水硫酸镁,0.3 g丙酮酸钠,15%琼脂,pH值7.2~7.4,121℃灭菌15 min。
固体ISP2培养基:2.0 g酵母粉,2.0 g麦芽提取粉,2.0 g葡萄糖,1 000 mL陈海水,15%琼脂,121℃灭菌20 min。
液体ISP2培养基:2.0 g酵母粉,2.0 g麦芽提取粉,2.0 g葡萄糖,陈海水定容至1 L,121℃灭菌20 min。
保藏剂:20%的甘油冻存管,121℃灭菌30 min。
1.4 方法 1.4.1 菌株载体采集与处理海芒果植株去除表层泥样,立即装入无菌袋,根际土壤暂存于放有冰块的保温箱内,送回实验室后冷藏保存(-20℃)。
1.4.2 菌株的分离、纯化和保藏称取0.2 g土壤,置于50 mL锥形瓶中,加入10 mL带有玻璃珠的无菌陈海水后,放入摇床(28℃,140 r/min)富集2 h。取土壤悬液依次制备10-1~10-4 4个不同的稀释度,吸取100 μL不同稀释度的稀释液涂布于7种不同类型的固体培养基(M4、M5、M9、M10、AGG、R2A、ISP2) 上,每个平板培养基设置4个平行样,置于28℃恒温培养箱中,培养3~5 d。
海芒果的根、茎、叶、果实经前处理后,根、茎、叶分别切碎,果实切开取出果核,分别放入研磨器中充分研磨,加入1 mL无菌水混匀,吸取1 mL混合液至离心管中。取混合液稀释至10-3浓度,吸取100 μL稀释液涂布于7种不同培养基上,每个平板培养基设置4个平行样,置28℃恒温培养箱中培养3~4 d,直到长出可辨认的菌落。
观察已经涂布平板上长出的菌落特征,以及每个平板上菌落的总数、种类和数量。根据菌落的大小、颜色及表面形态(透明度、外观形状、干燥程度、突起程度)等特征,挑取单菌落进行纯化。将纯化菌株接种在ISP2培养基上,用含20%甘油管保存纯化的菌株,每株菌株保存10管,使用分段降温法,最后保存于超低温冰箱(-80℃),所有步骤均按常规无菌方法操作。
1.4.3 菌株的16S rRNA基因鉴定及系统发育分析将菌株活化后,按照周双清等[10]的方法,提取菌株总DNA。以此作为模板,采用27F/1492R引物进行PCR扩增。PCR反应条件:95℃预变性5 min;94℃变性1 min,55℃复性5 min,72℃延伸15 min,共31个循环;72℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测,电压110 V,点样量为2.5 μL,最后在凝胶成像系统下观察并照相。根据细菌的特殊形态特征和颜色差异,选取15株代表菌株提取DNA及16S rRNA的扩增。所得产物委托广州美吉生物科技有限公司测序。
将测定的基因序列,在NCBI数据库和韩国标准菌株数据库中采用BLAST程序进行在线比对分析。经BLAST比对后,选取每个菌种相似度最高的16S rRNA基因序列作为标准株,通过Clustal X软件[11]进行多序列比对及相似性分析,并用MEGA5.0软件[12]以Neighbor-Joining法构建系统进化树。
1.4.4 活性供试样品的制备将纯化的菌株按2%的接种量,接种到装有50 mL液体ISP2培养液的250 mL锥形瓶中,进行小规模发酵,置28℃、180 r/min的摇床上,振荡培养10 d,然后提取发酵产物。菌体细胞采用超声波细胞破碎仪破碎,以等体积比(V:V=1:1) 加入乙酸乙酯溶液,萃取发酵液。收集萃取液,进行真空浓缩至少量,转移至已称重西林瓶中至完全干燥,制得所需活性供试样品。
1.4.5 抑菌试验采用滤纸片法[13]测试供试样品对3种常见鱼类致病菌:哈维氏弧菌、溶藻弧菌和副溶血弧菌的抑制活性,将供试指示菌分别制成菌悬液,各取25 μL滴在平板上,涂布棒均匀涂布,制成含指示菌的平板,用镊子将灭菌的滤纸片(6 mm)贴于平板上。取5 μL供试样品滴在滤纸片上,恒温(28℃)培养24 h,通过测量抑菌圈直径来判定抑菌活性。供试样品浓度为5 mg/mL,5 μL的DMSO作为阴性对照,5 mg/mL的卡那霉素为阳性对照。
2 结果与分析 2.1 菌落形态特征鉴定从海芒果全株及其根际土壤中共分离得到15株可培养细菌,其形态特征见表 1,多数菌落为黄白色,极少数为红色,且表面均呈光滑、湿润。少数菌落,由于孢子产生色素,使菌落两面呈现不同颜色,呈灰黑色,表面干燥,有皱褶。大多菌落为不透明状,少数呈半透明状。
| 表 1 海芒果及其根际土壤可培养细菌菌落特征 Table 1 The colony characteristics of cultivated bacteria from Cerbera manghas and its rhizosphere soil |
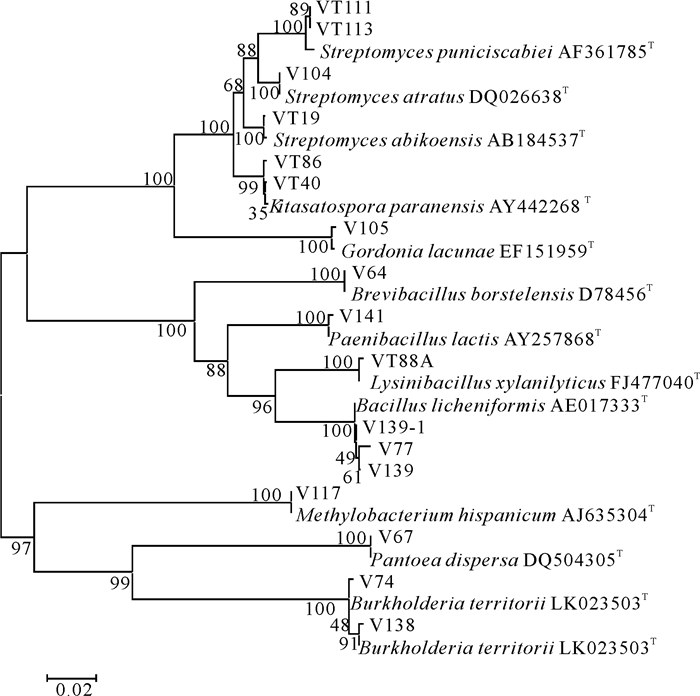
根据16S rRNA基因序列比对结果(表 2),15株代表菌株分属于2个大的细菌发育类群:厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),所占比例分别为53%和47%,其中4株为芽孢杆菌属(Bacillus sp.),6株为链霉菌属(Streptomyces)。构建的系统进化树见图 1。
| 表 2 海芒果及其根际土壤可培养细菌的16S rRNA基因序列比对结果 Table 2 The comparison results of cultivated bacteria from Cerbera manghas and its rhizosphere soil |
|
图 1 海芒果及其根际土壤可培养细菌的系统进化树 Fig.1 Neighbor-joining tree showing the phylogenetic relationship among strains isolated from Cerbera manghas and rhizosphere soil of C.manghas |
如表 3所示,15株菌对副溶血弧菌均表现出抑制作用,其中菌株VT86(K.paranensis)有明显的抑制活性(抑菌圈直径为9.8 mm),菌株V139-2(S.luteireticuli, 抑菌圈直径为9.3 mm)和菌株VT113(S.niveiscabiei,抑菌圈直径为9.0 mm)有中等抑制活性。VT19(抑菌圈直径为9.5 mm)和V140-2(抑菌圈直径为9.0 mm)对溶藻弧菌有中等抑制作用。所有菌株对哈维氏弧菌抑制作用都较弱(抑菌圈直径小于8.0 mm)。
| 表 3 海芒果及其根际土壤可培养细菌抑菌活性结果 Table 3 The antibacterial activities of cultivated bacteria from Cerbera manghas and its rhizosphere soil |
本研究对海芒果及其根际土壤中可培养细菌进行分离、纯化,选取了15株具有代表性的细菌进行16S rRNA序列检测,发现这些菌分属于2个大的细菌发育类群:厚壁菌门(占比为53%)和放线菌门(占比为47%),其中4株为芽孢杆菌属,6株为链霉菌属。初步抑菌活性测试发现,15株菌对3种海洋鱼类致病弧菌均有抑制作用,5株抑菌效果较好,其中抑菌活性最好的是VT86(K.paranensis), 抑菌圈直径为9.8 mm,对挖掘新型防治鱼类致病弧菌药物具有潜在研究价值。
| [1] |
李巧连, 李可, 谢明杰, 等. 海洋放线菌次级代谢产物及其活性研究进展[J]. 中国海洋药物, 2010, 29(5): 57-65. LI Q L, LI K, XIE M J, et al. Study progress on the secondary metabolites of marine actinomycetes and their activities[J]. Chinese Journal of Marine Drugs, 2010, 29(5): 57-65. |
| [2] |
范航清. 红树林:海岸环保卫士[M]. 南宁: 广西科学技术出版社, 2000: 18-23. FAN H Q. Mangrove:Coast guardian[M]. Nanning: Guangxi Science and Technology Press, 2000: 18-23. |
| [3] |
张明, 王建华, 赵毅, 等. 20味中药对鳗弧菌的药敏试验[J]. 动物医学进展, 2005, 26(8): 77-79. ZHANG M, WANG J H, ZHAO Y, et al. Study on the inhibition for Vibrisis anguillarumz of fish disease with Chinese herb medicine[J]. Progress in Veterinary Medicine, 2005, 26(8): 77-79. |
| [4] |
杨少丽, 王印庚, 董树刚. 海水养殖鱼类弧菌病的研究进展[J]. 海洋水产研究, 2005, 26(4): 75-83. YANG S L, WANG Y G, DONG S G. Progress of research on vibriosis in marine cultured fish[J]. Marine Fisheries Research, 2005, 26(4): 75-83. |
| [5] |
杜士杰, 朱文. 海芒果的毒性研究及其开发利用[J]. 亚热带植物科学, 2006, 35(4): 79-81. DU S J, ZHU W. Progress in study on toxicity of Cerbera manghas and its exploitation[J]. Subtropical Plant Science, 2006, 35(4): 79-81. |
| [6] |
曹雷雷, 田海妍, 王友绍, 等. 红树植物海芒果果实的化学成分研究[J]. 中国药学杂志, 2013, 48(13): 1052-1056. CAO L L, TIAN H Y, WANG Y S, et al. Chemical constituents in fruits of mangrove plant Cerbera manghas L[J]. Chinese Pharmaceutical Journal, 2013, 48(13): 1052-1056. |
| [7] |
胡世伟, 宋文东, 王浩, 等. 红树植物海芒果树叶中的挥发油和脂肪酸研究[J]. 福建林业科技, 2010, 37(2): 46-50. HU S W, SONG W D, WANG H, et al. Study on the volatile oil and fatty acids of the leaves of the mangrove plants Cerbera manghas[J]. Journal of Fujian Forestry Science and Technology, 2010, 37(2): 46-50. |
| [8] |
林爱玉, 邢晓科, 郭顺星, 等. 4种药用半红树植物内生真菌的分离及其抗菌活性研究[J]. 中国药学杂志, 2006, 41(12): 892-894. LIN A Y, XING X K, GUO S X, et al. Study on isolation of endophytic fungi from four medicinal semi-mangrove plants and its antimicrobial activity[J]. Chinese Pharmaceutical Journal, 2006, 41(12): 892-894. DOI:10.3321/j.issn:1001-2494.2006.12.004 |
| [9] |
夏丽娟, 张焜, 黄华容, 等. 5种红树根际土壤真菌和内生真菌的分离及抑菌活性的研究[J]. 中国农学通报, 2014, 30(4): 259-263. XIA L J, ZHANG K, HUANG H R, et al. The antimicrobial activity of 5 kinds of mangrove fungi in rhizosphere soil and endophytic fungi[J]. Chinese Agricultural Science Bulletin, 2014, 30(4): 259-263. DOI:10.11924/j.issn.1000-6850.2013-0519 |
| [10] |
周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报, 2010(2): 123-125. ZHOU S Q, HUANG X L, HUANG D Y, et al. A rapid method for extracting DNA from actinomycetes by Chelex-100[J]. Biotechnology Bulletin, 2010(2): 123-125. |
| [11] |
THOMPSON J D, GIBSON T J, PLEWNIAK F, et al. The Clustal_X windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(24): 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [12] |
TAMURA K, DUDLEY J, NEI M, et al. MEGA4:Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 |
| [13] |
方燕, 潘丽霞, 易湘茜, 等. 柳珊瑚Anthogorgia cae-rulea相关可培养细菌抗污活性筛选[J]. 广西科学, 2012, 19(3): 253-256. FANG Y, PAN L X, YI X X, et al. Antifouling activity of culturable bacteria associated with the gorgonian Anthogorgia caerulea[J]. Guangxi Sciences, 2012, 19(3): 253-256. |
 2017, Vol. 33
2017, Vol. 33 


