当前材料科学的一个主要挑战是探寻更高效的能源存储系统,以解决人类对于能源的各种不同需求。综合衡量环境和经济两方面的因素,将氢作为一种替代能源载体和原料是一个极具前景的解决方案。特别是,储氢材料与氢燃料电池可以组成高效的能源存储系统[1-3]。氢(123 MJ/kg)具有比化石燃料(46 MJ/kg)更高的能量密度,但由于运输的困难使其受到较大限制。例如,高压和低温这两种物理存储方式面临容器重量及安全性问题。因此,其中一个替代方式是化学储氢,即将两个氢分别以负离子或质子的形式存储在材料当中,这些材料包括金属氢化物[4-6]、氨硼烷衍生物[2-3, 7]、甲酸[2, 8-17]以及甲醇[18-21]。然而,氨硼烷衍生物虽然具有非常好的储氢容量(≤19.4 wt% H2),但其燃烧过的燃料几乎无法循环利用[2-3, 7];甲酸基体系虽然性能优良[8, 15-16],但储氢量相对较低(4.4 wt% H2);到目前为止,在低温条件下(≤100℃)仍具有较好性能的甲醇基体系(12.6 wt% H2),也由于其对空气敏感,在氧气条件下可能产生分解等原因,使其应用受到限制。此外,甲酸和甲醇在脱氢过程中需要添加剂,这对于提高储氢量是一个不利条件。水的价格便宜而且储量丰富,其储氢量达11 wt%,是一种相当吸引人的储氢体系,但水在电化学、光裂解和热分解过程中需要大量的能量[22-23],而且均匀的水裂解过程很难实现,目前为止尚未找到能够在效率和产氢量上满足实用化要求的方法[24]。甲酸和甲醇的优点是反应产生的气体中只有H2和CO2,并且在使用钌(Ru)作为催化剂的条件下,没有CO和甲烷产生[8, 16, 18],而这些因素对于氢燃料电池的实际应用起着决定性的作用,因为附加产物中如果存在CO,将对燃料电池中的催化剂产生毒害作用。
关于利用甲醇[20]和甲酸[17]制氢的研究可以追溯到1960年左右,但是在接下来的约50年时间里,在甲醛辅助下均相催化水分解的研究未见报道。直到2008年,采用催化剂对甲酸基体系生产氢的研究才又重新开始[15-16]。到了2013年,Nielsen等[18]首次报道了利用催化剂在常温常压条件下可以将甲醇分解成CO2和H2。
1 单核Ru基钳型化合物催化甲醇制氢 1.1 几种典型的Ru基钳型配体化合物甲醇可以作为一种储氢材料,因为它在室温下呈液态并且储氢量达12.6 wt%。利用甲醇分解制氢需要较高的温度(超过200℃)和压强(25~50 bar),这些条件限制了甲醇的应用前景[25-26]。为了使液态甲醇能够在低温条件下进行脱氢,很多研究者采用Ru化合物作为催化剂。最近,一种包含钳型配体的有机金属化合物在氢化和脱氢反应中展示出了很好的催化活性[27-37]。图 1给出了几种典型的Ru基钳型配体化合物。
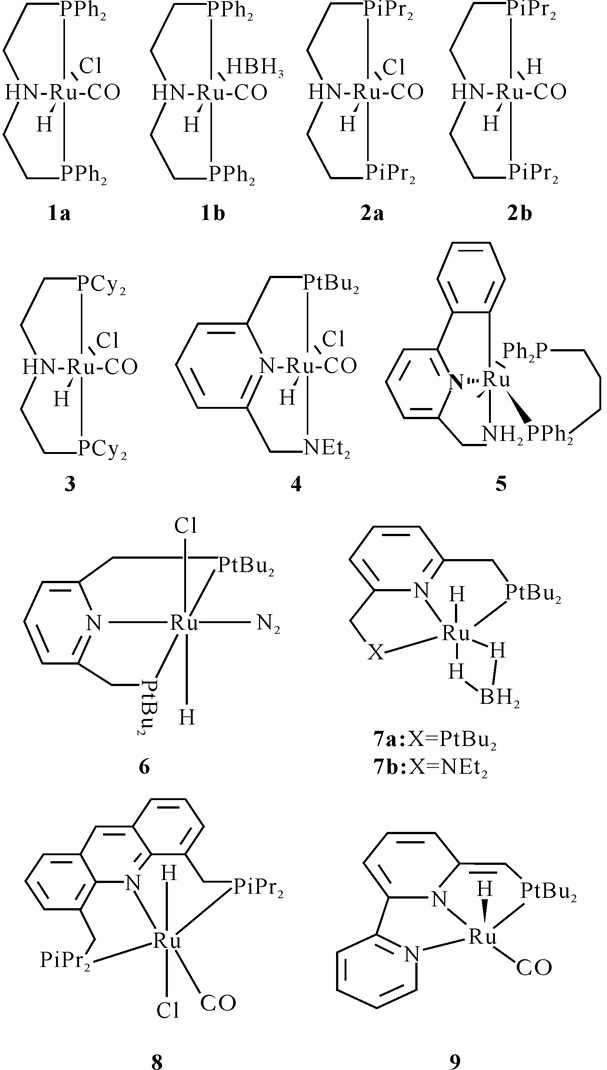
|
图 1 单核Ru基化合物 Fig.1 Mononuclear Ru based compounds |
Baratta等[33]的研究指出:化合物5在氢化过程中展示出了高效的催化效果,它可以在短时间内将各种不同的酮类还原成醇类。Meistein课题组[27, 31-32]研究了基于铂氮氮(PNN)型配体的Ru化合物4,在其催化作用下,在117~157℃的温度范围乙醇脱氢得到乙酯。Beller课题组[18]在72℃条件下对一系列的Ru基钳型配体化合物进行研究,发现具有氢铂氮铂(HPNP)配合物的钳型催化剂1a, 1b和3可以催化甲醇生成氢气。在催化剂1~5催化下生成的H2纯度很高(没有CH4气体,CO含量 < 10 ppm)。其中,[RuHCl (CO)(HN (C2H4PPh2)2)]催化剂1a的催化活性最好,在前3 h的反应时间内体系的转化频率(TOF,即一个催化剂分子在一个小时中产生的氢分子数目)稳定在121~124 h-1。
1.2 不同种类配体对催化剂活性的影响为了提高催化活性,研究者测试了不包含卤化物配体的催化剂。然而,采用苯环保护的[RuH (BH4)(CO)(HN (C2H4PPh2)2)]化合物1b并没有提高其催化活性(TOF=121~126 h-1)。但是,在没有添加NaOH基体的条件下,用1b作催化剂却没有氢气产生。利用烷基异丙基替代芳香苯得到2a,导致系统的TOF下降到45~48 h-1。与1b类似,在没有添加NaOH基体的条件下,2a也无法催化甲醇生成氢气。利用体积更大的环乙基替代芳香苯得到催化剂3,其催化活性较2a进一步下降(29~31 h-1)。化合物4在Beller课题组[18]给出的实验条件下没有展示出催化活性,化合物5的催化活性也很低。当温度提高到95℃时,1a和2a展示出了优良的催化活性,1a的TOF达1 093 h-1; 2a的TOF达4 734 h-1,总的转化次数超过350 000次。这使得氢能够在可移设备上传输,也使得将甲醇作为储氢的载体更接近实用化。
不同研究者对图 1的几种典型Ru基钳型配体化合物的催化活性的研究结果说明,这类化合物在催化醇类、酸类等脱氢的过程中性能优良。
2 双核Ru基化合物催化甲酸、甲醛制氢 2.1 双核Ru基化合物催化甲酸制氢除了上述单核Ru基化合物展示出了良好的催化活性外,双核Ru基化合物在催化甲酸、甲醛制氢方面也展示出了优异的催化活性[16, 38-46],相关的分子结构如图 2所示。

|
图 2 双核Ru基化合物 Fig.2 Dinuclear Ru based compounds |
Puddephatt课题组[38-39]首先报到了利用双核Ru磷化氢化合物10催化甲酸脱氢,在室温条件下TOF接近500 h-1。之后Wills课题组[40-41]利用Ru (DMSO4)和双苯基膦原位生成双核Ru化合物11,并对其进行详细研究。Bell课题组[16, 42-45]用双核Ru磷化氢化合物[(RuCl2(p-cymene))2]12作为催化剂对甲酸进行脱氢研究,在连续不断添加甲酸的情况下,获得很高的转化频率和转化总数。
2.2 双核Ru基化合物催化甲醛制氢Prechtl课题组[46]在2014年报道:多聚甲醛或甲醛与水的混合溶液是很好的氢分子存储系统,溶液中可以形成稳定的甲醛一水化物(CH2(OH)2),在双核Ru基化合13的催化作用下,甲醛一水化物很容易并且有选择性地在脱氢过程中形成H2和CO2(即使是利用浓度只有37 wt%的甲醛水溶液稀释的甲醛一水化物溶液,其产氢量也达到5.0 wt%)[46]。在这一系统中,两种分子都是氢源,如果取一个当量的水和一个当量的甲醛,体系的理论产氢量为8.4%。因此,甲醛与水混合体系的产氢量要比甲酸(4.4 wt%)的高。在低温以及大气环境下,甲醛和水混合体系也能够在双核Ru基化合物13的催化作用下高效产生氢气。由于甲醛一水化物溶液在催化剂作用下所产生的气体中只包含有H2和CO2,这使得将水和液态有机溶液作为氢输运系统的氢燃料电池更接近实用化。特别地,H2和CO2的气流大小可以控制,且H2和CO2混合气体很容易分离,使甲醛一水化物溶液可以在发动机上应用,这就克服了压力气瓶所存在的技术困难。甲醛和多聚甲醛可以在工业上利用银或者金属氧化物作为催化剂,通过对甲醇脱氢而得到。甲醇本身可以通过CO、可再生能源[26],或者CO2的氢化[19]而得到。因此,一个完整的氢存储系统可以这样实现:甲醇(CH3OH)通过FORMOX公司提供的工艺流程生成甲醛(H2CO),然后在水中混合生成甲醛一水化物(H2C (OH)2),在催化剂作用下产生H2和CO2; CO2通过氢化作用重新生成甲醇[47]。
甲醛辅助水分解体系所产生的氢可用于燃料电池[46],该体系具有两个优点:一是水直接分解所产生的氧气,在形成二氧化碳的同时被吸收掉,使得在体系中没有能够产生氧化作用的氧气,从而避免了燃料电池中催化剂的钝化或氧化作用,也避免形成氢气和氧气混合在一起的爆炸性混合物,使得氢气在非燃烧性的液体中生成,这比甲醇体系更安全。二是分离H2/CO2混合气体要比分离H2/O2混合气体更容易。上述这些优点使得甲醛辅助水分解体系成为生产氢的一个优良选择,并将有力促进甲醇经济的实现[21, 48]。另外,在净化包含有甲醇杂质的废水时,这一方法可以很容易地将废水催化转化成H2和CO2。
2.3 脱氢路径为了进一步获取脱氢路径的详细信息、气相的成分以及液态中的各种组分,Prechtl课题组[46]利用2H和13C对水、甲醛以及多聚甲醛进行了同位素标记。采用质谱分析方法对气相进行分析发现,水和(多聚)甲醛都是形成氢气的氢源[46]。通过核磁共振(NMR)分析和同位素标记法,发现化合物13 (图 2)是催化过程中的催化活性物质。Prechtl课题组认为甲醛一水化物脱氢的催化过程[46]与双核Ru化合物[(Ru (μ-CO)(CO)4(μ-dppm)2] 10催化甲酸脱氢的过程相似[38]。Gao等[38]首次报道了在甲酸分解成CO2和H2的过程中,双核Ru化合物10比单核Ru化合物具有更强的催化活性。在催化分解甲酸时,双核金属合化物更容易达到配位不饱和状态,因而相对单核过渡金属催化剂而言,双核金属化合物有明显的优势。Gao等[38]采用质谱分析、核磁共振等方法确定了甲酸分解过程中出现的几种化合物的分子结构,并据此提出了一个可能的催化反应路径,但是他们所提出的反应路径比较简略,并没有详细讨论反应过程中的细节问题。Scholten等[8]研究发现[(RuCl2(p-cymene))2] 12对于甲酸脱氢过程起到了明显的催化作用,催化系统的转化频率(TOF)达到1 540 h-1。观测发现两种双核Ru基化合物分别具有甲酸基氢化物桥和甲酸基氯化物桥,但Scholten等[8]也没有给出催化的具体路径。
3 影响催化剂活性的因素 3.1 碱添加剂对催化过程的作用有关甲酸和甲醇的报道表明,催化碱的存在对于储氢体系成功地脱氢起着至关重要的作用[8, 15-16, 18]。然而,Prechtl课题组[46]的研究发现,由甲醛或多聚甲醛生成的甲醛一水化物可以在没有碱添加剂的情况下脱氢,如果添加碱,可以对甲醛一水化物体系在常压下的脱氢过程起到有益的促进和加速作用。
3.2 溶液的pH值对催化过程的作用有研究表明,催化剂的催化活性与溶液的pH值有关。Prechtl课题组[46]的研究指出,采用pH调节剂(K3PO4)对反应过程有利,没有加入pH调节剂的溶液在反应过程中逐渐变成为强酸性溶液,体系的反应速率随着反应溶液的酸性上升而下降。然而,在pH=2.4(75%)和pH=9(73%)之间,体系的转化效率处于稳定状态(转化效率为73%~75%),其中在pH=5.5(85%)时达到最高值,在pH=1.4(53%)时降至最低值。Beller课题组[18]采用1a和2a(图 1)作为催化剂研究溶液的pH值和生成气体之间的关系,在反应的前30 min,pH值为13,H2/CO2的比值大于500:1;在1 h的时候,pH值下降到12,H2/CO2的比值为57:1;经过约4 h,pH值降到10,H2/CO2的比值为4.1:1;在接下来的时间里(一直到18 h),pH值基本保持不变,H2/CO2的比值稳定在3.2:1。可见pH值为10左右是体系比较稳定的状态。
4 展望综上所述,在单核Ru基钳型化合物和双核Ru基化合物的催化作用下,甲醛和甲醇能够在一个大气压,低于100℃的条件下生成H2和CO2,使其成为极具应用前景的储氢材料。单核Ru基钳型化合物和双核Ru基化合物在催化甲醇、甲酸、甲醛脱氢方面展示出了很好的催化活性。但是,一些关于催化路径(催化机制)和影响催化剂活性的因素,需要作进一步的研究,以设计出性能更好的催化剂,或改进原有催化剂的催化活性。具体可以考虑从以下方向展开:
(1) 探索单核Ru基钳型化合物和双核Ru基化合物催化甲醛、甲醇脱氢的催化机制。催化剂在催化甲醇或甲醛脱氢过程中,有可能起到直接输运质子(H+)的作用,也有可能在甲醛或甲醇辅助下输运质子,根据实验测出的部分中间产物,设计出不同的反应路径,运用第一性原理计算方法讨论可能的催化路径。
(2) 分析不同配体构型和不同种类配体对催化剂活性的影响,寻找性能更优良的配体构型和配体种类。对于单核Ru基钳型化合物,比较对称型配体(PNP型:如1a,2a,3,6等)和非对称型配体(PNN型:如4,5,7b)对催化活性的影响。PNN型配体属于半不稳定型结构,其一侧包含不稳定的供体功能基团,另一侧供体则和中心金属原子稳定成键。比较PNP型和PNN型配体与甲醇或甲醛相互作用的微观细节,分析其相互作用的微观机制。
(3) 研究单核Ru基钳型化合物和双核Ru基化合物中金属-配体协同作用。根据实验测出的部分中间产物,假设几种可能的反应路径,寻找反应过程中经历的过渡态,并分析稳定产物中金属和配体之间的相互作用。
| [1] |
STEELE B C H, HEINZEL A. Materials for fuel-cell technologies[J]. Nature, 2001, 414(6861): 345-352. DOI:10.1038/35104620 |
| [2] |
PRECHTL M H G, SAHLER S. Hydrogen storage using ionic liquid media[J]. Current Organic Chemistry, 2013, 17(3): 220-228. DOI:10.2174/1385272811317030004 |
| [3] |
SAHLER S, PRECHTL M H G. Advancement in molecular hydrogen storage systems[J]. Chem Cat Chem, 2011, 3(8): 1257-1259. |
| [4] |
SCHLAPBACH L, ZVTTEL A. Hydrogen-storage materials for mobile applications[J]. Nature, 2001, 414(6861): 353-358. DOI:10.1038/35104634 |
| [5] |
SCHVTH F, BOGDANOVIC B, FELDERHOFF M. Light metal hydrides and complex hydrides for hydrogen storage[J]. Chemical Communications, 2004(20): 2249-2258. DOI:10.1039/B406522K |
| [6] |
FILINCHUK Y, CHERNYSHOV D, NEVIDOMSKY-Y A, et al. High-pressure polymorphism as a step towards destabilization of LiBH4[J]. Angewandte Chemie International Edition, 2008, 47(3): 529-532. DOI:10.1002/(ISSN)1521-3773 |
| [7] |
SAHLER S, KONNERTH H, KNOBLAUCH N, et al. Hydrogen storage in amine boranes:Ionic liquid supported thermal dehydrogenation of ethylene diamine bisborane[J]. International Journal of Hydrogen Energy, 2013, 38(8): 3283-3290. DOI:10.1016/j.ijhydene.2012.12.150 |
| [8] |
SCHOLTEN J D, PRECHTL M H G, DUPONT J. Decomposition of formic acid catalyzed by a phosphine-free ruthenium complex in a task-specific ionic liquid[J]. Chem Cat Chem, 2010, 2(10): 1265-1270. |
| [9] |
MORET S, DYSON P J, LAURENCZY G. Direct, in situ determination of pH and solute concentrations in formic acid dehydrogenation and CO2 hydrogenation in pressurised aqueous solutions using 1H and 13C NMR spectroscopy[J]. Dalton Transactions, 2013, 42(13): 4353-4356. DOI:10.1039/c3dt00081h |
| [10] |
BODDIEN A, FEDERSEL C, SPONHOLZ P, et al. Towards the development of a hydrogen battery[J]. Energy & Environmental Science, 2012, 5(10): 8907-8911. |
| [11] |
GRASEMANN M, LAURENCZY G. Formic acid as a hydrogen source-recent developments and future trends[J]. Energy & Environmental Science, 2012, 5(8): 8171-8181. |
| [12] |
BODDIEN A, MELLMANN D, GÄRTNER F, et al. Efficient dehydrogenation of formic acid using an iron catalyst[J]. Science, 2011, 333(6050): 1733-1736. DOI:10.1126/science.1206613 |
| [13] |
PAPP G, CSORBA J, LAURENCZY G, et al. A charge/discharge device for chemical hydrogen storage and generation[J]. Angewandte Chemie International Edition, 2011, 50(44): 10433-10435. DOI:10.1002/anie.201104951 |
| [14] |
FEDERSEL C, BODDIEN A, JACKSTELL R, et al. A well-defined iron catalyst for the reduction of bicarbonates and carbon dioxide to formates, alkyl formates, and formamides[J]. Angewandte Chemie International Edition, 2010, 49(50): 9777-9780. DOI:10.1002/anie.201004263 |
| [15] |
FELLAY C, DYSON P J, LAURENCZY G. A viable hydrogen-storage system based on selective formic acid decomposition with a ruthenium catalyst[J]. Angewandte Chemie International Edition, 2008, 47(21): 3966-3968. DOI:10.1002/anie.v47:21 |
| [16] |
LOGES B, BODDIEN A, JUNGE H, et al. Controlled generation of hydrogen from formic acid amine adducts at room temperature and application in H2/O2 fuel cells[J]. Angewandte Chemie International Edition, 2008, 47(21): 3962-3965. DOI:10.1002/anie.v47:21 |
| [17] |
MARS P, SCHOLTEN J J F, ZWIETERING P. The catalytic decomposition of formic acid[J]. Advances in Catalysis, 1963, 14: 35-113. |
| [18] |
NIELSEN M, ALBERICO E, BAUMANN W, et al. Low-temperature aqueous-phase methanol dehydrogenation to hydrogen and carbon dioxide[J]. Nature, 2013, 495(7439): 85-89. DOI:10.1038/nature11891 |
| [19] |
WESSELBAUM S, VOM STEIN T, KLANKERMA-YER J. Hydrogenation of carbon dioxide to methanol by using a homogeneous ruthenium-phosphine catalyst[J]. Angewandte Chemie International Edition, 2012, 51(30): 7499-7502. DOI:10.1002/anie.201202320 |
| [20] |
MEABURN G M, MELLOWS F W, REIFFSTECK A. Production of hydrogen in the radiolysis of methanol vapour[J]. Nature, 1964, 204(4965): 1301-1302. DOI:10.1038/2041301a0 |
| [21] |
OLAH G A. Beyond oil and gas:The methanol economy[J]. Angewandte Chemie International Edition, 2005, 44(18): 2636-2639. DOI:10.1002/(ISSN)1521-3773 |
| [22] |
SCHÜTH F. Challenges in hydrogen storage[J]. The European Physical Journal Special Topics, 2009, 176(1): 155-166. DOI:10.1140/epjst/e2009-01155-x |
| [23] |
EBERLE U, FELDERHOFF M, SCHVTH F. Chemical and physical solutions for hydrogen storage[J]. Angewandte Chemie International Edition, 2009, 48(36): 6608-6630. DOI:10.1002/anie.v48:36 |
| [24] |
KOHL S W, WEINER L, SCHWARTSBURD L, et al. Consecutive thermal H2 and light-induced O2 evolution from water promoted by a metal complex[J]. Science, 2009, 324(5923): 74-77. DOI:10.1126/science.1168600 |
| [25] |
PALO D R, DAGLE R A, HOLLADAY J D. Methanol steam reforming for hydrogen production[J]. Chemical Reviews, 2007, 107(10): 3992-4021. DOI:10.1021/cr050198b |
| [26] |
CORTRIGHT R D, DAVDA R R, DUMESIC J A. Hydrogen from catalytic reforming of biomass-derived hydrocarbons in liquid water[J]. Nature, 2002, 418(6901): 964-967. DOI:10.1038/nature01009 |
| [27] |
ZHANG J, LEITUS G, BEN-DAVID Y. Facile conversion of alcohols into esters and dihydrogen catalyzed by new ruthenium complexes[J]. Journal of the American Chemical Society, 2005, 127(31): 10840-10841. DOI:10.1021/ja052862b |
| [28] |
SPASYUK D, SMITH S, GUSEV D G. From esters to alcohols and back with ruthenium and osmium catalysts[J]. Angewandte Chemie International Edition, 2012, 51(11): 2772-2775. DOI:10.1002/anie.201108956 |
| [29] |
BERTOLI M, CHOUALEB A, LOUGH A J, et al. Osmium and ruthenium catalysts for dehydrogenation of alcohols[J]. Organometallics, 2011, 30(13): 3479-3482. DOI:10.1021/om200437n |
| [30] |
FRIEDRICH A, DREES M, SCHMEDT AUF DER GVNNE J, et al. Highly stereoselective proton/hydride exchange:Assistance of hydrogen bonding for the heterolytic splitting of H2[J]. Journal of the American Chemical Society, 2009, 131(48): 17552-17553. DOI:10.1021/ja908644n |
| [31] |
GUNANATHAN C, MILSTEIN D. Metal-ligand cooperation by aromatization-dearomatization:A new paradigm in bond activation and "Green" catalysis[J]. Accounts of Chemical Research, 2011, 44(8): 588-602. DOI:10.1021/ar2000265 |
| [32] |
GUNANATHAN C, MILSTEIN D. Applications of acceptorless dehydrogenation and related transformations in chemical synthesis[J]. Science, 2013, 341(6143): 1229712. DOI:10.1126/science.1229712 |
| [33] |
BARATTA W, CHELUCCI G, GLADIALI S, et al. Ruthenium (Ⅱ) terdentate CNN complexes:Superlative catalysts for the hydrogen-transfer reduction of ketones by reversible insertion of a carbonyl group into the Ru-H bond[J]. Angewandte Chemie International Edition, 2005, 44(38): 6214-6219. DOI:10.1002/(ISSN)1521-3773 |
| [34] |
ZHANG J, GANDELMAN M, SHIMON L J W, et al. Electron-rich, bulky ruthenium PNP-type complexes.Acceptorless catalytic alcohol dehydrogenation[J]. Organometallics, 2004, 23(17): 4026-4033. DOI:10.1021/om049716j |
| [35] |
ZHANG J, BALARAMAN E, LEITUS G, et al. Electron-rich PNP-and PNN-type Ruthenium (Ⅱ) hydrido borohydride pincer complexes.Synthesis, structure, and catalytic dehydrogenation of alcohols and hydrogenation of esters[J]. Organometallics, 2011, 30(21): 5716-5724. DOI:10.1021/om200595m |
| [36] |
GUNANATHAN C, SHIMON L J W, MILSTEIN D. Direct conversion of alcohols to acetals and H2 catalyzed by an acridine-based ruthenium pincer complex[J]. Journal of the American Chemical Society, 2009, 131(9): 3146-3147. DOI:10.1021/ja808893g |
| [37] |
BALARAMAN E, KHASKIN E, LEITUS G, et al. Catalytic transformation of alcohols to carboxylic acid salts and H2 using water as the oxygen atom source[J]. Nature Chemistry, 2013, 5(2): 122-125. DOI:10.1038/nchem.1536 |
| [38] |
GAO Y, KUNCHERIA J, PUDDEPHATT R J, et al. An efficient binuclear catalyst for decomposition of formic acid[J]. Chemical Communications, 1998(21): 2365-2366. DOI:10.1039/a805789c |
| [39] |
GAO Y, KUNCHERIA J K, JENKINS H A, et al. The interconversion of formic acid and hydrogen/carbon dioxide using a binuclear ruthenium complex catalyst[J]. Journal of the Chemical Society, Dalton Transactions, 2000(18): 3212-3217. DOI:10.1039/b004234j |
| [40] |
MORRIS D J, CLARKSON G J, WILLS M. Insights into hydrogen generation from formic acid using ruthenium complexes[J]. Organometallics, 2009, 28(14): 4133-4140. DOI:10.1021/om900099u |
| [41] |
MAJEWSKI A, MORRIS D J, KENDALL K, et al. A continuous-flow method for the generation of hydrogen from formic acid[J]. Chem Sus Chem, 2010, 3(4): 431-434. DOI:10.1002/cssc.v3:4 |
| [42] |
BODDIEN A, LOGES B, JUNGE H, et al. Hydrogen generation at ambient conditions:Application in fuel cells[J]. Chem Sus Chem, 2008, 1(8/9): 751-758. |
| [43] |
JUNGE H, BODDIEN A, CAPITTA F, et al. Impro-ved hydrogen generation from formic acid[J]. Tetrahedron Letters, 2009, 50(14): 1603-1606. DOI:10.1016/j.tetlet.2009.01.101 |
| [44] |
BODDIEN A, LOGES B, JUNGE H, et al. Continuous hydrogen generation from formic acid:Highly active and stable ruthenium catalysts[J]. Advanced Synthesis & Catalysis, 2009, 351(14/15): 2517-2520. |
| [45] |
BODDIEN A, GÄRTNER F, FEDERSEL C, et al. CO2-"neutral" hydrogen storage based on bicarbonates and formates[J]. Angewandte Chemie International Edition, 2011, 50(28): 6411-6414. DOI:10.1002/anie.201101995 |
| [46] |
HEIM L E, SCHLVRER N E, CHOI J H, et al. Selective and mild hydrogen production using water and formaldehyde[J]. Nature Communications, 2014, 5: 3621. |
| [47] |
HULL J F, HIMEDA Y, WANG W H, et al. Reversible hydrogen storage using CO2 and a proton-switchable iridium catalyst in aqueous media under mild temperatures and pressures[J]. Nature Chemistry, 2012, 4(5): 383-388. DOI:10.1038/nchem.1295 |
| [48] |
OLAH G A. The role of catalysis in replacing oil by renewable methanol using carbon dioxide capture and recycling (CCR)[J]. Catalysis Letters, 2013, 143(10): 983-987. DOI:10.1007/s10562-013-1096-1 |
 2016, Vol. 32
2016, Vol. 32 


