【研究意义】走马胎(Ardisia gigantifolia Stapf)为紫金牛科紫金牛属植物大叶紫金牛的干燥根及根茎[1],主要分布广西、江西、广东等地。走马胎祛风湿、壮筋骨、活血祛瘀,为民间常用的跌打伤科用药。随着走马胎的开发利用,野生走马胎资源日益减少。开展人工种植、扩大药材资源对走马胎及其制剂的可持续发展具有现实意义。【前人研究进展】现有的研究表明,走马胎含有皂苷、黄酮、挥发油等多种成分[2-5],具有显著的抗恶性肿瘤、抗炎、抗氧化等生物活性[6-12]。【本研究切入点】目前为止,尚未见野生走马胎和种植走马胎的化学成分对比研究的报道。【拟解决的关键问题】参考文献[13],对比研究野生走马胎与种植走马胎的化学成分,为其入药提供依据。在不同展开系统下对野生和种植走马胎不同部位进行薄层色谱分析,并采用紫外分光光度法测定野生和种植走马胎中多糖的含量。
1 材料与方法 1.1 材料岛津UV2550紫外可见风光光度计和高速多功能粉碎机(上海冰都电器有限公司),电子天平(梅特勒XS-205瑞士梅特勒-托利多公司),HH-S数显恒温水浴锅(金坛市医疗仪器厂),KQ-5200B型超声波清洗器(昆山市超声仪器有限公司),电热恒温鼓风干燥箱(上海精宏实验设备有限公司),ZF-90D暗箱式紫外分析仪(上海光豪分析仪器有限公司)。
野生走马胎采自广西乐业县,种植走马胎采自广西乐业县甘田镇种植基地。经广西中医药研究院何开家主任药师鉴定两者都为紫金牛科紫金牛属植物大叶紫金牛的干燥全株;D-无水葡萄糖对照品(批号:110833-201205)由中国食品药品检定研究院提供,水为超纯水,其他试剂为分析纯。
1.2 方法 1.2.1 TLC鉴别 1.2.1.1 供试品溶液的制备将干燥的种植走马胎及野生走马胎的根茎、茎、叶部位分离并粉碎过40目筛,分别称取2 g置于具塞锥形瓶中,加入甲醇20 mL,静置浸泡30 min,超声提取1 h;0.45 μm微孔滤膜滤过,取续滤液。
1.2.1.2 供试品溶液的展开在同一块G-硅胶板上,取1.2.1.1节制备的供试品点样,分别以环己烷-丙酮(2:1)、石油醚-乙酸乙酯(4:1)、正己烷-乙酸乙酯(3:1)为展开剂,预饱和10 min,展开后取出晾干,再分别以10%硫酸乙醇溶液显色,105℃的烘箱中烘5 min,置紫外灯(365 nm)下检视。
1.2.2 多糖含量测定 1.2.2.1 对照品溶液配制取D-无水葡萄糖对照品适量,精密称定,置容量瓶中,加水溶解并稀释至刻度,摇匀,制成每1 mL含D-无水葡萄糖0.5 mg的溶液。
1.2.2.2 供试品溶液配制取走马胎根茎粉末(40目)约5 g,精密称定,置具塞锥形瓶中,加5倍量80%乙醇浸泡1 h,回流提取2次,每次1 h,弃去滤液,滤渣用15倍水回流提取1 h,完全转移至100 mL容量瓶,加水至刻度,摇匀,0.45 μm微孔滤膜滤过,取续滤液。
1.2.2.3 测定波长的选择参照文献[14],取供试品溶液及对照品溶液各0.5 mL,加蒸馏水1.5 mL,摇匀,立即加入6%的苯酚溶液1 mL,摇匀,再加浓硫酸5 mL,于40℃水浴中保温20 min,取出,置冰浴中保持15 min,以相应溶剂为空白,在400~600 nm范围进行光谱扫描。
2 结果与分析 2.1 薄层色谱鉴别将野生走马胎与种植走马胎的根茎、茎、叶的供试品溶液点于同一薄层板上,分别在不同展开系统下展开。图 1结果显示, 种植与野生走马胎对应部位的薄层色谱特征基本一致。
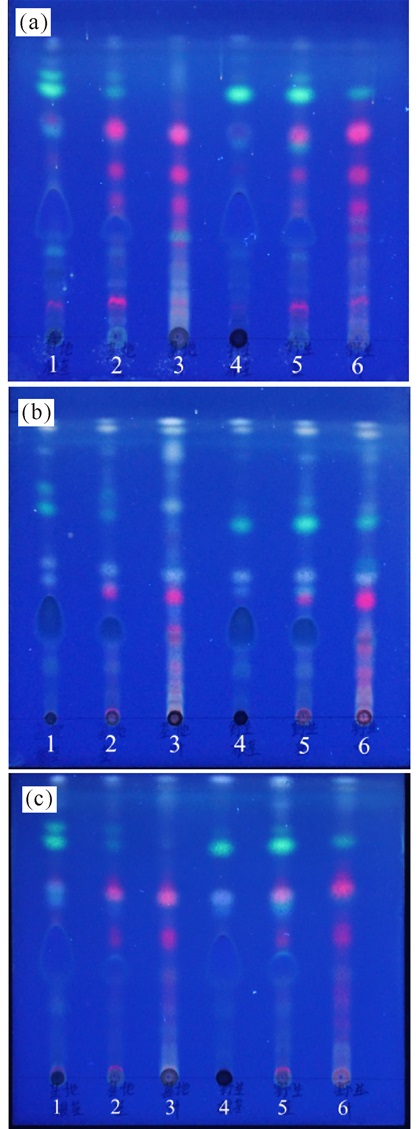
|
(a)环己烷-丙酮(2:1);(b)石油醚-乙酸乙酯(4:1);(c)正己烷-乙酸乙酯(3:1);1:种植根茎; 2:种植茎; 3:种植叶; 4:野生根茎; 5:野生茎; 6:野生叶 (a) Cyclohexane-acetone (2:1);(b) Petroleum ether-ethyl acetate (4:1);(c) n-hexane-ethyl acetate (3:1); 1:Cultivated rhizome; 2:Cultivated stem; 3:Cultivated leaf; 4:Wild rhizome; 5:Wild stem; 6:Wild leaf 图 1 野生与种植走马胎的TLC图谱 Fig.1 TLC of wild and cultivated Ardisia gigantifolia Stapf |
将进行显色反应后的供试品溶液及葡萄糖对照品溶液在400~600 nm范围进行光谱扫描。结果两种溶液在491 nm处均有最大吸收(图 2),故选择491 nm作为含量测定的检测波长。
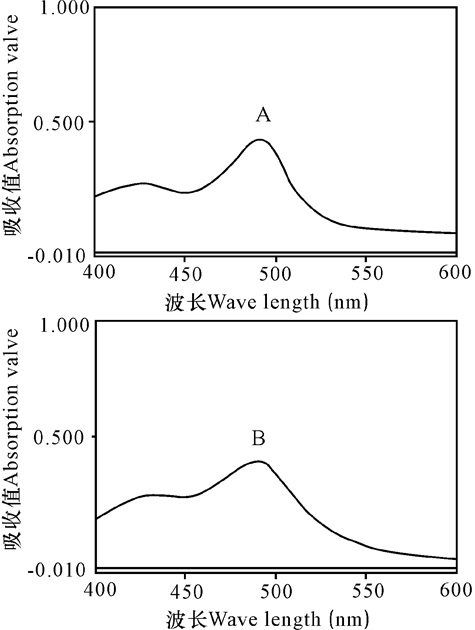
|
A:对照品Standard;B:供试品Sample 图 2 对照品及供试品光谱 Fig.2 Spectrogram of the standard and sample |
参照文献方法[14],对比测定种植走马胎与野生走马胎根茎中多糖含量,结果分别为15.02 mg/g、15.88 mg/g。
3 结论采用薄层色谱法对比种植与野生走马胎的色谱特征,并用分光光度法对比其多糖含量。为了全面反应种植走马胎与野生走马胎在化学成分上的差异,将其根茎、茎和叶分开对比分析,但由于其药用部位是根茎,故只选择对比根茎部位的多糖含量;虽然走马胎中含有多种成分[2-5],但因药材中含量低或缺少对应的化学对照品,故本文未在薄层色谱中引入相应的对照品进行对比鉴别。薄层色谱和分光光度测定结果表明,种植走马胎与野生走马胎对应部位的薄层色谱特征及多糖含量均无明显差别,为种植走马胎代替野生走马胎入药提供了科学依据。
| [1] |
广西壮族自治区食品药品监督管理局.广西壮族自治区壮药质量标准:第一卷[S].南宁:广西科学技术出版社, 2008. Guangxi Food and Drug Administration.Quality Standard of Guangxi Zhuang Medicine:Vol.1[S].Nanning:Guangxi Science and Technology Press, 2008. |
| [2] |
卢文杰, 王雪芬, 陈家源, 等. 大叶紫金牛化学成分的研究[J]. 华西药学杂志, 1990, 5(3): 136-138. LU W J, WANG X F, CHEN J Y, et al. Studies on the chemical constituents of Ardisia gigantifolia Stapf[J]. West China Journal of Pharmaceutical Sciences, 1990, 5(3): 136-138. |
| [3] |
封聚强, 黄志雄, 穆丽华, 等. 走马胎化学成分研究[J]. 中国中药杂志, 2011, 36(24): 3463-3466. FENG J Q, HUANG Z X, MU L H, et al. Study on chemical constituents of rhizome of Ardisia gigantifolia[J]. China Journal of Chinese Materia Medica, 2011, 36(24): 3463-3466. |
| [4] |
李群芳, 娄方明, 段兴丽, 等. 气相色谱-质谱联用法测定走马胎挥发油成分[J]. 时珍国医国药, 2009, 20(11): 2883-2884. LI Q F, LOU F M, DUAN X L, et al. Determination of volatile oil in Ardisia gigantifolia by GC-MS[J]. Lishizhen Medicine and Materia Medica Research, 2009, 20(11): 2883-2884. |
| [5] |
娄方明, 李群芳, 张倩茹, 等. 微波辅助水蒸气蒸馏走马胎挥发油的研究[J]. 中药材, 2010, 33(5): 815-819. LOU F M, LI Q F, ZHANG Q R, et al. Study on extraction of volatile oil in Ardisia gigantifolia by microwave assisted steam distillation[J]. Journal of Chinese Medicinal Materials, 2010, 33(5): 815-819. |
| [6] |
穆丽华, 赵海霞, 龚强强, 等. 走马胎中的三萜皂苷类成分及其体外抗肿瘤活性研究[J]. 解放军药学学报, 2011, 27(1): 1-6. MU L H, ZHAO H X, GONG Q Q, et al. Triterpenoid saponins and the antitumor activity from the rhizome of Ardisia gigantifolia Stapf[J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2011, 27(1): 1-6. |
| [7] |
陈超, 孙艳, 董宪喆, 等. 走马胎中化合物AG4对人鼻咽癌细胞裸鼠移植瘤的影响[J]. 中国药物应用与监测, 2015, 12(1): 12-15. CHEN C, SUN Y, DONG X Z, et al. Inhibition of compound AG4 from Ardisia gigantifolia Stapf on xenograft tumor growth of human nasopharyngeal carcinoma in nude mice[J]. Chinese Journal of Drug Application and Monitoring, 2015, 12(1): 12-15. |
| [8] |
杨竹, 黄敬辉, 王乃利, 等. 走马胎中新的岩白菜素衍生物的提取分离及体外抗氧化活性测定[J]. 沈阳药科大学学报, 2008, 25(1): 30-34. YANG Z, HUANG J H, WANG N L, et al. New bergenin derivatives and the antioxidant activity from Ardisia gigantifolia Stapf[J]. Journal of Shenyang Pharmaceutical University, 2008, 25(1): 30-34. |
| [9] |
郑小丽, 董宪喆, 穆丽华, 等. 走马胎中皂苷成分AG4对MCF-7肿瘤细胞增殖的影响及机制研究[J]. 中国药理学通报, 2013, 29(5): 674-679. ZHENG X L, DONG X Z, MU L H, et al. Antiproliferation activity of triterpenoid saponins AG4 from Ardisia gigantifolia Stapf on MCF-7 cells[J]. Chinese Pharmacological Bulletin, 2013, 29(5): 674-679. |
| [10] |
谷永杰, 穆丽华, 董宪喆, 等. 走马胎中三萜皂苷成分H1对6株肿瘤细胞增殖及对A549肺癌细胞凋亡及细胞周期的影响[J]. 中国实验方剂学杂志, 2014, 20(10): 130-133. GU Y J, MU L H, DONG X Z, et al. Effect of triterpenoid saponins H1 from Ardisia gigantifolia on proliferation of six different tumor cell lines and apoptosis and cell cycle of A549 tumor[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(10): 130-133. |
| [11] |
沈诗军, 周定刚, 黎德兵. 走马胎提取液体内抗血栓作用研究[J]. 时珍国医国药, 2008, 19(9): 2224-2226. SHEN S J, ZHOU D G, LI D B. Studies on the anti-thrombosis effects of Ardisia gigantifolia Stapf extract in vivo[J]. Lishizhen Medicine and Material Medica Research, 2008, 19(9): 2224-2226. |
| [12] |
唐亚平. 中药走马胎治疗类风湿关节炎的临床观察[J]. 四川中医, 2007, 25(1): 54-55. TANG Y P. Clinical observation on treatment of rheumatoid arthritis by Ardisia gigantifolia Stapf[J]. Journal of Sichuan of Traditional Chinese Medicine, 2007, 25(1): 54-55. |
| [13] |
陈赤, 何开家, 刘布鸣, 等. 野生与野生抚育猫爪草药材的分析比较研究[J]. 广西科学, 2008, 15(1): 70-74. CHEN C, HE K J, LIU B M, et al. The study on the comparison between wild and cultivated Radix ranunculus ternatus[J]. Guangxi Sciences, 2008, 15(1): 70-74. |
| [14] |
戴敏, 周凌云. 走马胎多糖含量测定及其提取工艺初步研究[J]. 中国药业, 2014, 23(19): 47-49. DAI M, ZHOU L Y. Content determination of polysaccharide in Ardisia gigantifolia Stapf and preliminary study on its extraction process[J]. China Pharmaceuticals, 2014, 23(19): 47-49. |
 2016, Vol. 32
2016, Vol. 32 


