2. 广西民族大学海洋与生物技术学院, 广西南宁 530008;
3. 新余学院建筑工程学院, 江西新余 338004
2. School of Marine Science and Biotechnology, Guangxi University for Nationalities, Nanning, Guangxi, 530008, China;
3. School of Architecture Engineering, Xinyu University, Xinyu, Jiangxi, 338004, China
[研究意义]运动或游泳对海月水母Aurelia aurita碟状幼体捕捉食物、躲避天敌及在水体中保持运动方向有重要影响。Costello等[1]研究表明碟状幼体在生存的大部分时间都在活跃地游动,Sullivan等[2]证明了游泳运动对碟状幼体捕食的重要性。因此,研究碟状幼体的游泳运动是了解海月水母碟状幼体种群生存和生长状态的前提。[前人研究进展]目前已有一些关于海月水母的拍动速度的研究报道,然而这些研究中,仅有Mangum等[3]和Dillon[4]研究了碟状幼体的拍动速度。两项研究结果均表明水温对海月水母碟状幼体的拍动速度有强烈影响。还有研究发现海月水母碟状幼体具有极端强耐饥饿性和恢复能力[5]。[本研究切入点]饥饿状态下碟状幼体型会缩小并出现形态损伤[5],这可能会降低碟状幼体与猎物相遇的频率、捕食成功的概率及躲避天敌的能力。[拟解决的关键问题]在实验室条件下,研究饥饿持续时间及水温对海月水母碟状幼体拍动速度的影响,并探讨游泳能力对碟状幼体种群生存和生长的影响。
1 材料和方法 1.1 材料的采集和培养2010年7月在日本九州岛北部博多湾捕获成熟的海月水母,从其口腕上获得浮浪幼虫。将所获得的浮浪幼虫放入塑料培养容器中(直径:15 cm,高:6.5 cm),容器中装有1 L盐度为32‰的过滤海水(将海水用滤孔为0.2 μm的滤纸过滤,以除去海水中的杂质)。将培养容器放在温度为25℃的黑暗培养箱中静置,以使浮浪幼虫附着在培养容器的底部或侧壁上。当浮浪幼虫变态为螅状体后,每周投喂1~2次足量的卤虫Artemia sp.无节幼体,投喂3~4 h后换水。这些螅状体被用作原种培养。
1.2 方法将培养的螅状体转移到13℃下,以诱发横裂生殖,使其释放碟状幼体[6-7]。将60只刚刚释放的( < 24 h)碟状幼体分别放入聚苯乙烯六孔细胞培养板中,每孔1只碟状幼体。培养板每孔中含有10 mL盐度为32‰的过滤海水。以每20只碟状幼体为一组,分别转移到3个温度(9℃,12℃和15℃)下,并使这些碟状幼体保持饥饿直至实验结束。实验期间,培养板孔中海水每周更换2次。为了防止因个体差异造成的实验结果误差,实验开始前,将每只碟状幼体放在解剖镜下拍照,以测量它们的伞径。碟状幼体的伞径通过图像分析软件(Image J, National Institute of Health, USA)来测量。
将单只碟状幼体放入容量为1 L的塑料T型瓶中(直径:10 cm,高:12.8 cm),瓶中装有各自培养温度的过滤海水。每隔10 d测量1次碟状幼体的拍动速度,即碟状幼体每分钟伞部收缩次数。用手持计数器连续测量3次,每次测量1 min。每只碟状幼体的拍动速度由3次测量的平均值来决定。以海月水母碟状幼体的拍动速度来衡量其游泳能力。
1.3 数据分析采用SPSS13.0软件对各处理组的均值进行单因素或双因素方差分析,以P < 0.05为差异显著,P < 0.01为差异极显著。当方差分析的结果为差异显著时,采用Tukey’s检验进行两两比较,以确定各处理之间的差异。
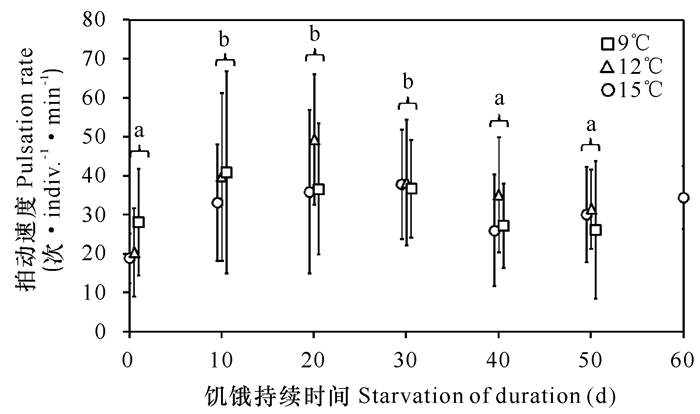
2 结果与分析实验开始时,碟状幼体的平均伞径为(2.16±0.17) mm。共有20只碟状幼体在实验过程中因机械损伤而死亡,因此实验结束时,在9℃,12℃和15℃下分别还有14,13和13只碟状幼体存活。这些存活的碟状幼体均游动活跃。
刚刚释放的碟状幼体的平均拍动速度在9℃,12℃和15℃下分别为(18.9±6.4)次·indiv.-1·min-1,(20.4±11.3)次·indiv.-1·min-1和(28.1±13.7)次·indiv.-1·min-1(图 1),不同水温下的拍动速度差异显著(单因素方差分析,P < 0.05)。在长达50 d的饥饿时间内,饥饿对碟状幼体拍动速度的影响显著(双因素方差分析P < 0.01),但温度及其交互作用对拍动速度的影响不显著(双因素方差分析P>0.05)。Tukey’s检验结果显示碟状幼体的拍动速度在第0天显著低于第10天、第20天和第30天(P < 0.05),检验结果同样还显示碟状幼体在第20天的拍动速度显著高于第0天、第40天和第50天。
|
误差线:标准差; 图中不同字母表示拍动速度差异显著 Error bars:S.D.; Means with different letters are significantly different 图 1 不同饥饿时间下海月水母碟状幼体的平均拍动速度 Fig.1 The mean pulsation rate of an Aurelia aurita ephyra kept starved for various periods |
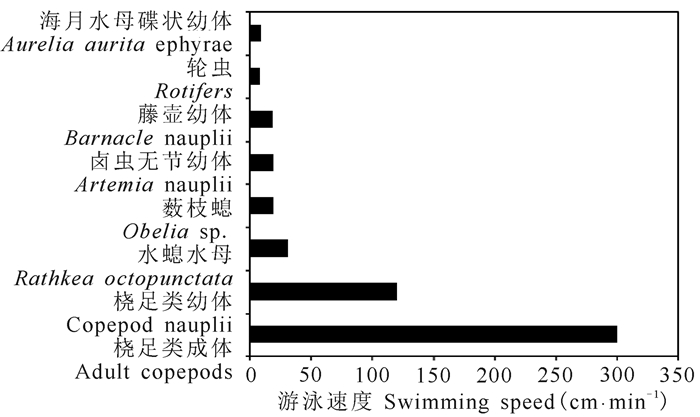
海月水母碟状幼体是依靠触觉捕捉食物的捕食者,没有任何远程探测食物的能力,因此碟状幼体的运动与摄食密切相关。在本实验中,碟状幼体的最大平均拍动速度为49.3次·min-1,表明海月水母碟状幼体属于连续游动的“巡航捕食者”。如果依照Sullivan等[2]所观察到的碟状幼体每拍动1次能够产生1.8 mm的运动来计算,本实验中碟状幼体的最大游泳速度为8.9 cm·min-1。这个游泳速度要远远低于桡足类等浮游动物的游泳速度(图 2)。尽管碟状幼体并不依靠追逐猎物,而是通过与猎物相遇而捕食,然而碟状幼体即使遇到了猎物,具有较高游泳速度的猎物也会从碟状幼体的伞下或口柄上挣脱。因此,预计海月水母碟状幼体在自然海域中主要捕食游泳速度比较慢的猎物,比如轮虫Rotifers、藤壶Barnacle幼体及水螅水母Rathkea octopunctata等等。桡足类幼体(逃脱速度:120 cm·min-1)及成体(逃脱速度:>300 cm·min-1)不太可能成为海月水母碟状幼体的主要食物,尽管它们可能会在意外的情况被捕食。
|
图 2 海月水母碟状幼体与多种浮游动物游泳速度[2]的比较 Fig.2 Comparison of the swimming speed of Aurelia aurita ephyrae and various zooplankton |
在本实验中,碟状幼体在3个水温下都能够活跃地游动,并且拍动速度在不同水温下差异不显著(除了刚刚释放的碟状幼体外)。Mangum等[3]和Dillon[4]发现当水温在25℃以下时,海月水母碟状幼体的拍动速度随着温度的升高而升高,当水温超过25℃后,碟状幼体的拍动速度又会随着温度的进一步升高而下降。海月水母成体也被发现有同样的温度效应[8-10]。本实验结果与先行研究的差异可能是由于碟状幼体对实验温度的适应时间不同而造成的。先行研究是将碟状幼体突然转移到实验温度下测量拍动速度,而本实验中碟状幼体对实验水温的适应时间要更长一些。本实验结果表明在9~15℃的范围内(碟状幼体在濑户内海出现时的水温),海月水母碟状幼体可以通过活跃地游动来寻找食物及躲避天敌。
本实验发现饥饿10 d或20 d后的碟状幼体的拍动速度显著高于刚刚释放的碟状幼体,表明饥饿有可能会加速碟状幼体的拍动速度,以使碟状幼体寻找更多的食物。拍动速度在饥饿20 d后达到最高,之后开始下降,但一开始的下降幅度并不是很大,在30 d后才开始显著下降。拍动速度的下降连同身体的收缩可能会显著降低碟状幼体的捕食能力。此外,拍动速度的下降同样会造成碟状幼体躲避天敌能力的下降,从而导致自然海域中碟状幼体更高的死亡率。
4 结论碟状幼体的最大平均拍动速度为49.3次·min-1,代表着碟状幼体的最大游泳速度为8.9 cm·min-1。这个游泳速度要远远低于常见浮游动物,如桡足类的游泳速度。所以,海月水母碟状幼体主要捕食游泳速度缓慢的猎物。在9~15℃的范围内,碟状幼体的拍动速度不受温度的影响,但受饥饿持续时间的影响。在饥饿10~20 d后,碟状幼体的拍动速度显著加快,然而当饥饿时间进一步延长时,碟状幼体的拍动速度也随之下降。饥饿所导致的拍动速度下降连同身体收缩可能会降低碟状幼体与猎物相遇的频率,并同时会降低碟状幼体躲避天敌的能力。
| [1] |
COSTELLO J H, KLOS E, FORD M D. In situ time budgets of the scyphomedusae Aurelia aurita, Cyanea sp., and Chrysaora quinquecirrha[J]. Journal of Plankton Research, 1998, 20(2): 383-391. DOI:10.1093/plankt/20.2.383 |
| [2] |
SULLIVAN B K, SUCHMAN C L, COSTELLO J H. Mechanics of prey selection by ephyrae of the scyphomedusa Aurelia aurita[J]. Marine Biology, 1997, 130(2): 213-222. DOI:10.1007/s002270050241 |
| [3] |
MANGUM C P, OAKES M J, SHICK J M. Rate-temperature responses in scyphozoan medusae and polyps[J]. Marine Biology, 1972, 15(4): 298-303. DOI:10.1007/BF00401389 |
| [4] |
DILLON T M. Effects of acute changes in temperature and salinity on pulsation rates in ephyrae of the scyphozoan Aurelia aurita[J]. Marine Biology, 1977, 42(1): 31-35. DOI:10.1007/BF00392011 |
| [5] |
FU Z L, SHIBATA M, MAKABE R, et al. Body size reduction under starvation, and the point of no return, in ephyrae of the moon jellyfish Aurelia aurita[J]. Marine Ecology Progress Series, 2014, 510: 255-263. DOI:10.3354/meps10799 |
| [6] |
KAKINUMA Y. On some factors for the differentiations of Cladonema uchidai and of Aurelia aurita[J]. Bulletin of the Marine Biological Station of Asamushi, 1962, 11: 81-85. |
| [7] |
HAN C H, UYE S I. Combined effects of food supply and temperature on asexual reproduction and somatic growth of polyps of the common jellyfish Aurelia aurita s.l.[J]. Plankton and Benthos Research, 2010, 5(3): 98-105. DOI:10.3800/pbr.5.98 |
| [8] |
OLESEN N J. Clearance potential of jellyfish Aurelia aurita, and predation impact on zooplankton in a shallow cove[J]. Marine Ecology Progress Series, 1995, 124: 63-72. DOI:10.3354/meps124063 |
| [9] |
HANSSON L J. Effect of temperature on growth rate of Aurelia aurita(Cnidaria, Scyphozoa) from Gullmarsfjorden, Sweden[J]. Marine Ecology Progress Series, 1997, 161: 145-153. DOI:10.3354/meps161145 |
| [10] |
MARTIN M B, BÅMSTEDT U. Digestion rate in relation to temperature of two gelatinous planktonic predators[J]. Sarsia, 2001, 86(1): 21-35. DOI:10.1080/00364827.2001.10420458 |
 2016, Vol. 32
2016, Vol. 32 

