【研究意义】胶原是一类重要的结构蛋白,广泛分布于动物的骨骼、皮肤、结缔组织和软骨等部位[1],胶原的水解产物被称为胶原蛋白质,变性产物俗称明胶,明胶、胶原蛋白质统称为胶原蛋白质[2]。胶原分子呈现三螺旋构型,其非螺旋部位的范围和分布决定了胶原蛋白质的不同类型,而不同类型的胶原蛋白质具有不同的生物活性,使其在美容、食品和医药等不同领域具有广泛的应用[3-5]。近年来,胶原蛋白质的市场需求量逐年增加,而陆地畜源胶原蛋白质主要局限于猪皮及牛皮,由于疯牛病、口蹄疫等安全性原因及宗教原因,世界各国都在寻找应用更加广泛的水产胶原蛋白质源[6]。狭鳕鱼(Theragra chalcogramma)属于鳕形目(Anacanthini),鳕鱼科(Gadidae),狭鳕属(Theragra)[7],目前多用于加工冻鱼片,加工过程中产生的大量鱼皮、鱼骨等往往作为饲料原料处理,利用率较低,又由于这些副产物胶原蛋白质含量高且安全,是较好的水产胶原蛋白质来源,如果能有效利用该资源,可产生巨大的经济效益。【前人研究进展】Yan等[8]发现狭鳕鱼片胶原蛋白属于Ⅰ型胶原蛋白,在228 nm波长处有最大吸收值,谭洪亮等[9]研究表明金枪鱼(Katsuwonus pelamis)鱼骨胶原蛋白肽具有良好的抗氧化活性,可以用于相关功能食品、药品或食品添加剂,邓晓龙等[10]研究表明秘鲁鱿鱼(Dosidicus gigas)真皮胶原蛋白质最大吸收波长在228 nm处,盐浓度大于2.0%时,相对溶解度迅速下降至4.23%。【本研究切入点】响应面法设计是回归试验设计的一种,既可以用于分析实验中各因子间的交互影响,又可以用来建立准确合理的数学模型,更好地处理数据[11]。本研究以狭鳕鱼鱼皮为原料,利用乙酸提取酸溶性胶原蛋白质,在单因素实验基础上,采用响应面法优化提取条件,通过Box-Benhnken试验设计,确定多因素系统的最优条件。【拟解决的关键问题】在评价各因素对响应值的影响及其交互作用的同时,优化酸溶性胶原蛋白质的提取,获得最佳条件,为实际生产提供工艺数据和理论依据。
1 材料与方法 1.1 材料狭鳕鱼鱼皮由青岛奥海生微生态生物有限公司提供,洗净,控水,4℃冷藏备用;Premixed Protein Marker (Board)为TaKaRa产品(大连宝生生物);其他试剂均为分析纯。UV2450型分光光度计(日本岛津);Avanti J-26XP系列高效离心机(美国贝克曼);EPS-600电泳仪(上海天能)。
1.2 方法 1.2.1 预处理洗净的鱼皮加入0.1 mol/L的NaOH溶液浸泡24 h除去杂质蛋白和色素,洗至中性,匀浆,备用。
1.2.2 酸溶性胶原蛋白质制备取预处理的鱼皮浆,按照实验设计的料液比、乙酸浓度和时间浸提,经4℃、11 400×g离心30 min,上清液逐渐添加研细的NaCl,控制加入NaCl的质量,至溶液中最终浓度为2.6 mol/L,呈絮状物析出的沉淀即为胶原蛋白质。4℃、11 400×g离心30 min,沉淀物以0.5 mol/L的乙酸溶液复溶,依次以0.1 mol/L的乙酸透析1 d,蒸馏水透析2 d,透析后的液体经冷冻干燥,即可得到酸溶性胶原蛋白质[12]。
1.2.3 胶原蛋白质提取率测定羟脯氨酸(Hydroxyproline,Hyp)是胶原蛋白的特征性氨基酸,其含量乘以换算系数即为提取液中胶原蛋白质含量[13]。
标准曲线的绘制[14]:配制羟脯氨酸储备液(1 mg/mL),之后稀释储备液得到标准溶液(10 μg/mL),取标准溶液0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL,分别以0.001 mol/L的HCl补足至1 mL,加入2 mL氯胺T溶液,混匀,室温静置20 min,之后加入2 mL高氯酸溶液,混匀室温静置5 min,再加入对二甲基氨基苯甲醛溶液2 mL,混匀,60℃加热20 min显色,流水冲冷,以空白液调零,在560 nm处测定各自吸光度(A)值,绘制标准曲线。
样品测定:按照实验设计的料液比、浓度和时间,经乙酸4℃浸提离心的样品上清液1 mL于安瓿瓶中,加入1 mL 6 mol/L的HCl,130℃水解3 h,上清液按照文献[14]方法测定羟脯氨酸含量:
| $ 胶原蛋白质提取率=\frac{C\times V}{m}\times 100\% $ |
式中,m表示狭鳕鱼鱼皮中羟脯氨酸的质量(g);C表示提取液中羟脯氨酸的浓度(g/mL);V表示提取液的体积(mL)。
1.2.4 单因素实验准确称取鱼皮浆20 g,经过0.1 mol/L NaOH预处理,选取乙酸浓度、提取时间和料液比(W/V)为单因素,以提取液中羟脯氨酸含量为提取率指标,每组实验重复3次,取平均值。
(1)乙酸浓度 固定料液比为1:10,4℃提取24 h,乙酸浓度分别为0.2 mol/L、0.3 mol/L、0.4 mol/L、0.5 mol/L、0.6 mol/L、0.7 mol/L和0.8 mol/L,确定最佳乙酸浓度。
(2)提取时间 固定料液比为1:10,以0.5 mol/L乙酸浸提,4℃提取,提取时间分别为6 h、12 h、24 h、48 h和96 h,确定最佳提取时间。
(3)料液比 以0.5 mol/L乙酸浸提,4℃下提取48 h,料液比分别为1:5、1:10、1:15、1:20和1:50,确定最佳料液比。
1.2.5 响应面法优化设计实验采用响应面法中的Box-Behnken设计[15-16],以酸溶性胶原蛋白质的提取率(Y)为响应值,选取乙酸浓度(A)、提取时间(B)和料液比(C)做三因素三水平的响应面实验设计,利用Design Expert 8.0进行数据分析,建立二次响应面模型,寻找最佳的提取工艺条件。
1.2.6 胶原蛋白质的鉴定采用SDS-PAGE电泳鉴定胶原蛋白质,取1.2.2节制备的酸溶性胶原蛋白质冷冻干燥样品溶于0.5 mol/L的乙酸溶液(浓度1~2 mg/mL),以NaOH溶液调节pH值至中性。分离胶8%、浓缩胶5%,上样量20 μL,采用直流恒压电源(电压200 V)电泳40 min,考马斯亮蓝R-250染色20 min后脱色,观察染色条带[17]。
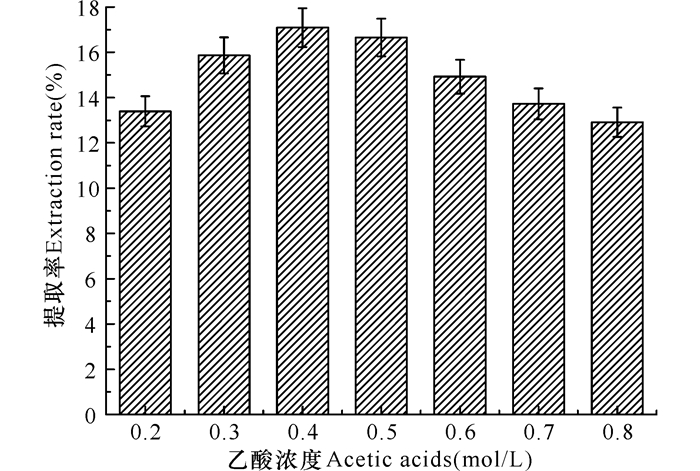
2 结果与分析 2.1 单因素实验 2.1.1 乙酸浓度的影响在乙酸0.2~0.4 mol/L浓度区间内,随乙酸浓度的增加,酸溶性胶原蛋白质的提取率也升高;在0.4~0.8 mol/L浓度区间内,随乙酸浓度的增加,提取率下降;当乙酸浓度为0.4 mol/L时,提取率最大(图 1),因此最佳乙酸浓度为0.4 mol/L。
|
图 1 乙酸浓度对酸溶性胶原蛋白质提取率的影响 Fig.1 Effect of concentration on the extraction yield |
随提取时间的延长,酸溶性胶原蛋白质提取率增加,48 h内提取率增加较快,超过48 h,提取率增加不显著(图 2),因此48 h为最佳提取时间。

|
图 2 提取时间对酸溶性胶原蛋白质提取率的影响 Fig.2 Effect of time on the extraction yield |
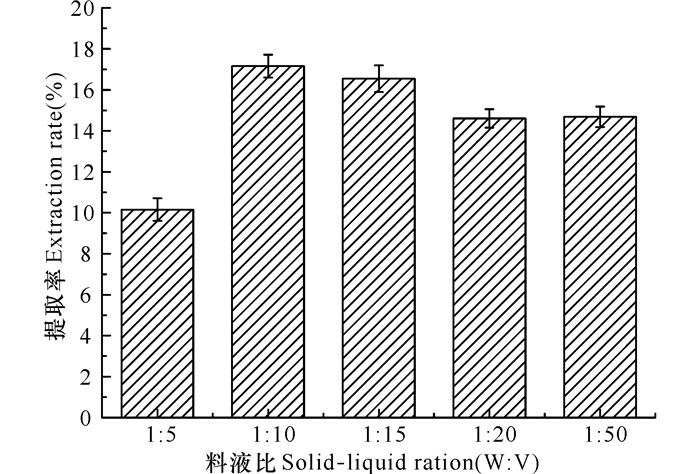
随料液比增加,酸溶性胶原蛋白质提取率逐渐增加,当料液比达到1:10时,提取率最大,之后料液比增加,提取率不再增加(图 3),因此确定最佳料液比为1:10。
|
图 3 料液比对酸溶性胶原蛋白质提取率的影响 Fig.3 Effect of solid-to-liquid on the extraction yield |
采用中心组合设计,得到17个实验点,其中12个析因点,5个零点(估计误差)。析因点为自变量取值在A、B、C所构成的三维顶点,零点为区域的中心点(表 1)。
| 表 1 酸溶性胶原蛋白质提取工艺Box-Behnken试验设计及结果 Table 1 Box-Behnken design and result |
为检验方程的可靠性,对方程进行方差分析,结果见表 2。
| 表 2 提取工艺回归模型方差分析 Table 2 Variance analysis for the regression model |
根据表 2结果,对数据进行多元回归拟合,得到回归方程为
| $ \begin{align} & Y=19.46+1.25*A-0.68*B-0.61*C- \\ & 1.94*A*B+1.10*A*C-0.59*B*C- \\ & 1.59*{{A}^{2}}-1.47*2-1.09*{{C}^{2}}, \\ \end{align} $ |
A、B、C均为编码值。
对回归方程进行显著性分析,可知失拟项P不显著(0.294 8>0.05),表明该回归模型的预测值与实际值拟合较好。模型P<0.01,表明该模型极其显著,实验方法准确可行,所选的二次回归模型用于模拟提取过程的三因素三水平有效。在所选的各因素水平范围内,对结果的影响排序为料液比>提取时间>乙酸浓度(由P值可知)。模型R2=94.93%(>90%),说明各因素存在线性相关,拟合程度良好,试验误差小。因此,可以采用该模型分析和预测不同条件下的提取率。
方程中A、B、C对提取率的影响均显著,二次项影响也显著,交互项AB作用极其显著,AC作用显著,说明乙酸浓度、提取时间和料液比对提取率的影响不是简单的线性关系,二次项和交互项对提取率也有影响。
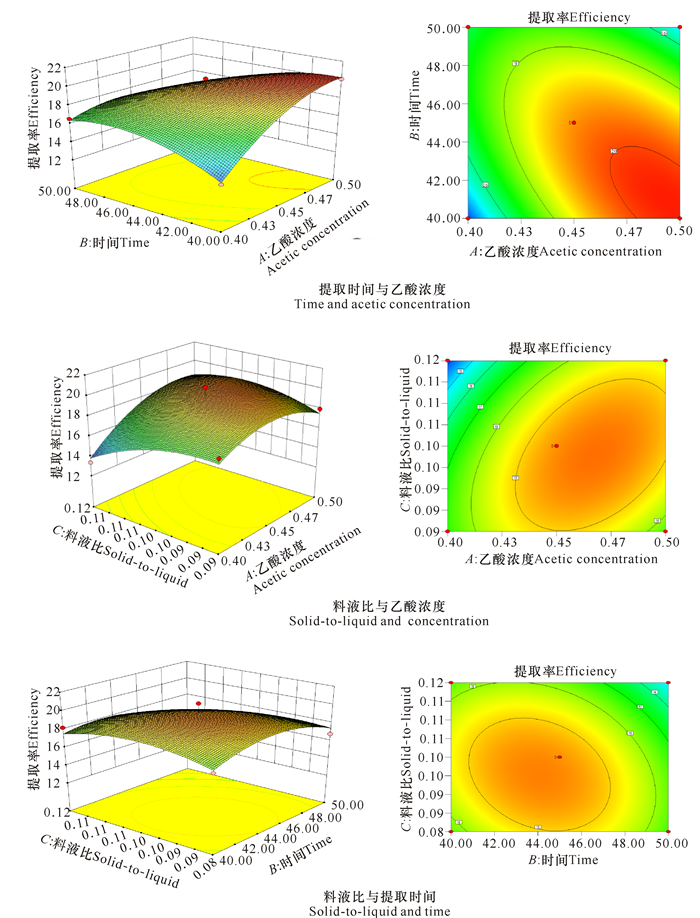
2.2.2 响应面分析根据三维立体图对任何两个因素的交互作用及各因素对响应值的影响进行分析,确定最佳因素水平(图 4)。响应面三维图等高线的形状可反应交互项影响的强弱,椭圆形表明两者交互作用显著,越接近圆形表示两因素的交互作用越弱[18]。等高线呈椭圆形,表明提取时间与乙酸浓度、料液比与乙酸浓度、料液比与提取时间交互作用均比较明显(图 4)。
|
图 4 两因素交互作用对酸溶性胶原蛋白质提取率的影响 Fig.4 Response surface plot for interactive effects on the extraction efficiency |
优化分析后,确定最佳的乙酸提取狭鳕鱼鱼皮酸溶性胶原蛋白质的工艺参数为乙酸浓度0.5 mol/L,提取时间40 min,料液比1:9,在此参数条件下,提取率的理论预测值为20.53%,实际测得提取率为(20.10±1.25)%,表明该模型合理可行。
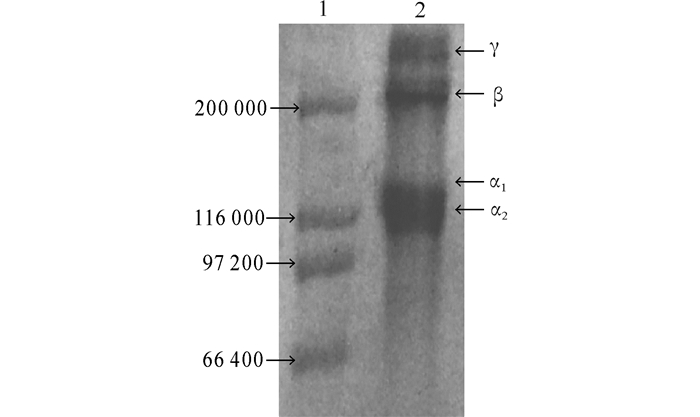
2.3 胶原蛋白质结构狭鳕鱼鱼皮的酸溶性胶原蛋白至少由两条α链(α1和α2)组成,β链含量较高,并含有少量的γ链(图 5)。
|
1:蛋白质标准品;2:酸溶性胶原蛋白质 1:Premixed protein marker; 2:Acid-soluble collagen 图 5 酸溶性胶原蛋白质的SDS-PAGE电泳图 Fig.5 SDS-PAGE patterns of ASC |
本研究中狭鳕鱼鱼皮酸溶性胶原蛋白质的提取率为20.10%,要高于赵海英等[19]的提取率(19.3%),与其他原料来源的研究提取率也不尽相同,这可能与原料种类、温度、羟脯氨酸换算系数、液料比、pH值及时间等因素有关[20-22],对本研究结果来说,提取温度及换算系数影响较大。水产胶原一般在25℃左右即开始变性, 因此,为保证生理活性,胶原的提取及前处理都在低于10℃下的环境下进行[22]。本试验在4℃下进行,得到的酸溶性胶原蛋白质实际上应该是胶原,赵海英等[19]对鳕鱼皮胶原蛋白的提取温度为37℃,产物应为胶原蛋白,因此,两者提取率不同。而李莉等[22]在提取大鲵胶原蛋白质时,空白试验(未添加酶)提取率为28.88%,添加胃蛋白酶后提取率可达到66.99%,说明酶的添加能显著提高提取率,但此情况下产物不再是单一胶原,而成为胶原、胶原蛋白质及明胶的混合物,高于本研究结果。朱文学等[14]采用响应面法优化提取黄河鲤鱼酸溶性胶原蛋白质的提取率为15.89%,低于本研究结果,可能是由于原料种类存在差异;李八方等[23]在4℃下提取胡子鲶鱼酸溶性胶原蛋白质的提取率为20.32%,温度与本实验一致,胶原蛋白质的提取率也与本实验较为接近。另外,羟脯氨酸与胶原蛋白之间不同的换算系数也会导致各研究中提取率有所不同。来自不同原料、不同组织、不同部位的胶原蛋白中羟脯氨酸的含量互不相同,因而两者之间的换算系数会因为原料、组织、部位等因素而不能采用单一数值。一般情况下,陆生动物的常用换算系数为7.1,而水生动物采用11.1或14.1。也有报道采用其他系数的,例如Nalinanon等[24]采用7.7作为换算系数,而张帅等[25]采用14.7。Nalinanon等[24]研究鲷鱼的胶原蛋白提取率仅为9.86%, 远低于本实验结果,而张帅等[25]研究罗非鱼的胶原蛋白提取率为30.30%, 要高于本实验结果。这就造成了换算系数不一致使得提取率难以比较,较低的换算系数会导致最终提取率数值偏低,而较高的换算系数提取率数值会偏高。
3.2 酸溶性胶原蛋白质的结构本研究中α1和α2所测相对分子质量约为110 000和105 000,稍小于罗非鱼[26] (α1和α2分别为125 000和116 000)、草鱼(α1和α2都大于116 000)等[26, 4]淡水鱼胶原;β相对分子质量约为200 000;γ相对分子质量为220 000。胶原蛋白质作为结构蛋白,其中的β链是两条α链的二聚体,γ链为结构比较完整的α链三聚体[27]。
| [1] |
蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 28. JIANG T D. Collagen and Collagen Hydrolysate[M]. Beijing: Chemical Industry Press, 2006: 28. |
| [2] |
李国英, 张忠楷, 雷苏, 等. 胶原、明胶和水解胶原蛋白的性能差异[J]. 四川大学学报:工程科学版, 2005, 37(4): 54-58. LI G Y, ZHANG Z K, LEI S, et al. Differences in properties of collagen, gelatin and collagen hydrolysate[J]. Journal of Sichuan University:Engineering Science Edition, 2005, 37(4): 54-58. |
| [3] |
LIN Y K, LIU D C. Effects of pepsin digestion at different temperatures and times on properties of telopeptide-poor collagen from bird feet[J]. Food Chemistry, 2006, 94(4): 621-625. DOI:10.1016/j.foodchem.2004.12.007 |
| [4] |
林琳, 郑钰, 吕顺, 等. 有机酸提取草鱼皮胶原蛋白的工艺研究[J]. 安徽农业科学, 2009, 37(5): 2246-2247, 2301. LIN L, ZHENG Y, LV S, et al. Research on the extraction technology of collagen from carp skin with organic acid[J]. Journal of Anhui Agricultural Sciences, 2009, 37(5): 2246-2247, 2301. |
| [5] |
刘丽莉, 马美湖, 杨协力, 等. 牛骨Ⅰ型胶原蛋白提取及结构表征[J]. 食品科学, 2010, 31(2): 87-91. LIU L L, MA M H, YANG X L, et al. Extraction and characterization of type Ⅰ collagen from bovine bone[J]. Food Science, 2010, 31(2): 87-91. |
| [6] |
赵玉勤, 王玉梅, 王斌, 等. 绿鳍马面鲀(Navodon sep-tentrionalis)鱼头酸溶性与酶溶性胶原蛋白的分离纯化及理化性质研究[J]. 海洋与湖沼, 2015, 46(3): 703-709. ZHAO Y Q, WANG Y M, WANG B, et al. Isolation and characterization of acid and pepsin soluble collagens from the head of bluefin leatherjacket (Navodon septentrionalis)[J]. Oceanologia et Limnologia Sinica, 2015, 46(3): 703-709. |
| [7] |
南京熙, 王海丽, 刘畅, 等. 深海明太鱼油中脂肪酸含量的测定[J]. 食品科技, 2011, 36(12): 313-315. NAN J X, WANG H L, LIU C, et al. Determination of fatty acid content in deep-sea Alaska pollack[J]. Food Science and Technology, 2011, 36(12): 313-315. |
| [8] |
YAN M Y, LI B F, ZHAO X, et al. Characterization of acid-soluble collagen from the skin of walleye pollock (Theragra chalcogramma)[J]. Food Chemistry, 2008, 107(4): 1581-1586. DOI:10.1016/j.foodchem.2007.10.027 |
| [9] |
谭洪亮, 郁迪, 王斌, 等. 金枪鱼鱼骨胶原肽的制备及抗氧化活性研究[J]. 水产学报, 2014, 38(1): 143-148. TAN H L, YU D, WANG B, et al. Preparation and evaluation of an antioxidant peptide from collagen hydrolysate of skipjack tuna fishbone[J]. Journal of Fisheries of China, 2014, 38(1): 143-148. |
| [10] |
邓晓龙, 高德友, 俞微微, 等. 秘鲁鱿鱼皮酸溶性胶原蛋白的分离及特征分析[J]. 食品科技, 2015, 40(7): 252-256. DENG X L, GAO D Y, YU W W, et al. Isolation and characterization of acid soluble collagen from the skin of Peru squid (Dosidicus gigas)[J]. Food Science and Technology, 2015, 40(7): 252-256. |
| [11] |
ELECHOWSKA E, SADOWSKA M, TURK M. Isolation and some properties of collagen from the backbone of Baltic cod (Gadus morhua)[J]. Food Hydrocolloids, 2010, 24(4): 325-329. DOI:10.1016/j.foodhyd.2009.10.010 |
| [12] |
YU D, CHI C F, WANG B, et al. Characterization of acid-and pepsin-soluble collagens from spines and skulls of skipjack tuna (Katsuwonus pelamis)[J]. Chinese Journal of Natural Medicines, 2014, 12(9): 712-720. DOI:10.1016/S1875-5364(14)60110-2 |
| [13] |
宫子慧, 林琳, 孟昌伟, 等. 乳酸提取鮰鱼皮胶原蛋白工艺优化[J]. 肉类研究, 2011, 25(7): 18-23. GONG Z H, LIN L, MENG C W, et al. Optimization of conditions for collagen extraction with lactic acid from channel catfish (Ictalurus punctatus) skin[J]. Meat Research, 2011, 25(7): 18-23. |
| [14] |
朱文学, 邱园园, 肖枫, 等. 响应面法优化黄河鲤鱼鱼鳞酸溶性胶原蛋白提取工艺[J]. 食品科学, 2013, 34(20): 94-98. ZHU W X, QIU Y Y, XIAO F, et al. Optimization of extraction process for acid-soluble collagen from Cyprinus carpio haematopterus scale by response surface methodology[J]. Food Science, 2013, 34(20): 94-98. |
| [15] |
杨文雄, 高彦祥. 响应面法及其在食品工业中的应用[J]. 中国食品添加剂, 2005(2): 68-71. YANG W X, GAO Y X. Response surface methodology & its application in food industry[J]. China Food Additives, 2005(2): 68-71. |
| [16] |
AHMAD M, BENJAKUL S. Extraction and charac-terisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterus monocerous)[J]. Food Chemistry, 2010, 120(3): 817-824. DOI:10.1016/j.foodchem.2009.11.019 |
| [17] |
汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2002: 77-90. WANG J Z, FAN M. The Technical Manuals of Protein[M]. Beijing: Science Press, 2002: 77-90. |
| [18] |
赵黎骅, 张文, 吕珍珍, 等. 响应面法优化酒糟微波间歇干燥工艺[J]. 农业工程学报, 2011, 27(3): 369-374. ZHANG L H, ZHANG W, LV Z Z, et al. Optimization of intermittent microwave drying technology for lees by response surface methodology[J]. Transactions of the CSAE, 2011, 27(3): 369-374. |
| [19] |
赵海英, 梁程超, 缪锦来, 等. 鳕鱼皮胶原蛋白的制备及其成分分析[J]. 中国海洋药物, 2005, 24(5): 30-32. ZHAO H Y, LIANG C C, MIAO J L, et al. Preparation and composition analysis of cod skin collagen protein[J]. Chinese Journal of Marine Drugs, 2005, 24(5): 30-32. |
| [20] |
NAGAI T, SUZUKI N. Isolation of collagen from fish waste material-skin, bone and fins[J]. Food Chemistry, 2000, 68(3): 277-281. DOI:10.1016/S0308-8146(99)00188-0 |
| [21] |
ETHERINGTON D J, SIMS T J. Detection and estimation of collagen[J]. Journal of the Science of Food and Agriculture, 1981, 32(6): 539-546. DOI:10.1002/(ISSN)1097-0010 |
| [22] |
李莉, 顾塞麒, 王锡昌, 等. 响应面法优化酶法提取大鲵皮胶原蛋白工艺[J]. 中国水产科学, 2013, 20(4): 876-883. LI L, GU S L, WANG X C, et al. Optimization of conditions for the extraction of pepsin-soluble collagen from the skin of Chinese giant salamander (Andrias davidianus)[J]. Journal of Fishery Sciences of China, 2013, 20(4): 876-883. DOI:10.3724/SP.J.1118.2013.00876 |
| [23] |
李八方, 郭鸣, 候虎, 等. 胡子鲶鱼皮酸溶性胶原蛋白的理化性质研究[J]. 现代食品科技, 2013, 29(11): 2580-2585. LI B F, GUO M, HOU H, et al. Physicochemical properties of acid-soluble collagen from skin of Clarias fuscus[J]. Modern Food Science and Technology, 2013, 29(11): 2580-2585. |
| [24] |
NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of bigeye snapper (Priacanthus tayenus)[J]. Food Chemistry, 2007, 104(2): 593-601. DOI:10.1016/j.foodchem.2006.12.035 |
| [25] |
张帅.罗非鱼皮胶原蛋白提取及性质研究[D].上海:上海海洋大学, 2010:12-13. ZHANG S.Study on Extraction and Characterization of Collagen from Tilapia Skin[D].Shanghai:Shanghai Ocean University, 2010:12-13. |
| [26] |
张俊杰, 段蕊, 刘佳梅, 等. 鲤鱼鱼皮胶原蛋白的提取及其性质研究[J]. 氨基酸和生物资源, 2008, 30(1): 18-21. ZHANG J J, DUAN R, LIU J M, et al. Study on extraction and properties of collagen from carp skin[J]. Amino Acids & Biotic Resources, 2008, 30(1): 18-21. |
| [27] |
江颖, 邓明霞, 汪海婴, 等. 热变性对鱼胶原海绵材料性能的影响[J]. 功能材料, 2015, 46(9): 9045-9051. JIANG Y, DENG M X, WANG H Y, et al. Effect of thermal denaturation on the properties of collagen sponges from fish[J]. Journal of Functional Materials, 2015, 46(9): 9045-9051. |
 2016, Vol. 32
2016, Vol. 32 


