2. 暨南大学药学院,中药及天然药物研究所,广东广州 510632;
3. 广西中医药大学药学院,广西南宁 530001;
4. 广西科学院,广西海洋天然产物与组合生物合成化学重点实验室培育基地,广西南宁 530007
2. College of Pharmacy, Jinan University, Guangzhou, Guangdong, 510632, China;
3. School of Pharmaceutical Sciences, Guangxi University of Chinese Medicine, Nanning, Guangxi, 530001, China;
4. Guangxi Key Laboratory of Marine Natural Products and Combinatorial Biosynethesis Chemistry, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
海桑属植物(Sonneratia)是红树植物的重要组成部分,属于真红树植物,隶属桃金娘目(Myrtales),海桑科(Sonneratiaceae)[1]。海桑属植物一般长得都比较高大(7~10 m),为双子叶植物纲,由于受气温的影响其叶子长年呈绿色,非常适合在热带沿海地区生长[2]。海桑属植物根系发达,具有较强的耐缺氧和抗旱等能力。王瑞江等[3]在调查海桑科植物的系统进化和地理分布时认为全球海桑属植物共分为9种,分别为海桑(S.caesolaris)、杯萼海桑(S.alba)、凹叶海桑(S.griffithii)、卵叶海桑(S.ovata)、披针叶海桑(S.lanceolata)、海南海桑(S.hainanensis)、拟海桑(S.gulngai)、澳洲海桑(S.urama)、无瓣海桑(S.apetala)。中国海桑属植物主要分布在海南岛,目前总共有6种,其中无瓣海桑属于外来物种,1985年从孟加拉国引进并种植于海南、广西、广东、台湾、福建等沿海一带[4]。海桑属植物富含甾醇、黄酮、酚类、醌类等化合物,部分化合物表现出抗氧化、抗肿瘤、抑制病原菌等生物活性,因此本文就海桑属植物化学成分的研究进行全面的总结回顾,旨在为海桑属植物食用和药用研究提供参考资料。
1 海桑属植物药食同源特性的研究与应用海桑属植物一般挂果的时间为10月份到11月份,果实呈球形或椭球形,未成熟的海桑果实,颜色较深且较硬,成熟的海桑果实尝起来味道像奶酪,既可以生吃也可以熟吃。另外,南亚地区的渔民还利用海桑果实来发酵制成醋,或添加在辣椒中一起制成辣椒酱、咖喱酱和各种秋季饮料。近几年,国家对海洋资源的开发和利用的投入资金越来越多,很多学者也紧跟着国家政策,将关注点放在红树林上,并对一些可食用红树果实的营养成分进行较为科学地分析。宋文东项目组发现无瓣海桑叶子和果实中共含有23种脂肪酸,叶子中主成分为9, 12, 15-十八烷三烯酸(亚麻酸)和9, 12-十八烷二烯酸(亚油酸),果实中主成分为8, 11-十八烷二烯酸[5]。同时,该项目组还发现无瓣海桑叶子和果实中含有7种人体必需氨基酸,9种非必需氨基酸[6]。
除直接食用或是作为调料品外,很多红树植物还具有非常重要的药用价值。邵长伦等[7]曾对中国红树植物药用研究现状进行调查,发现中国共有红树植物20科37种,已发现具有药用价值的有23种,民间药用的红树植物主要有13种。广东、福建沿海的居民将海桑的果实捣烂成糊状,用来止血,或治疗扭伤,其叶、花和果实用水煎可作为内科用药[8],杯萼海桑果实榨汁发酵,可用于止溢血[9]。
2 海桑属红树植物的化学成分及活性研究进展红树植物常年生长在海陆交汇边缘环境中。土壤缺氧严重、日照时间长且紫外线强、盐渍化程度高等特征促使红树植物为适应环境衍生出一套特殊的生物系统,该特点使红树可产生一些不同于陆生植物的特殊产物。海桑属植物化学成分研究始于1950年,Chaudhry等是海桑属植物化学成分研究的先驱者。近几年陆续有学者对海桑属植物的化学成分和生物活性进行研究,并从中发现一些具有较好生物活性的化学成分。
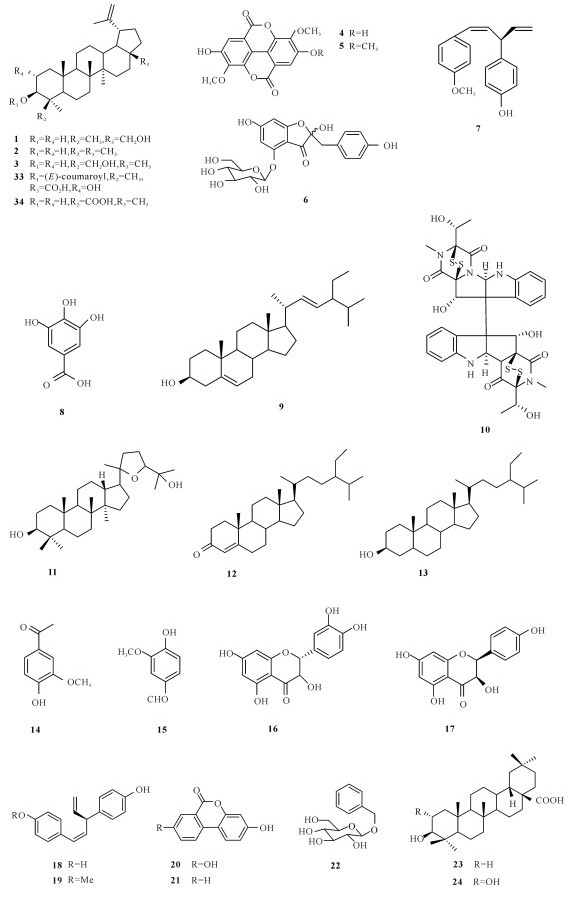
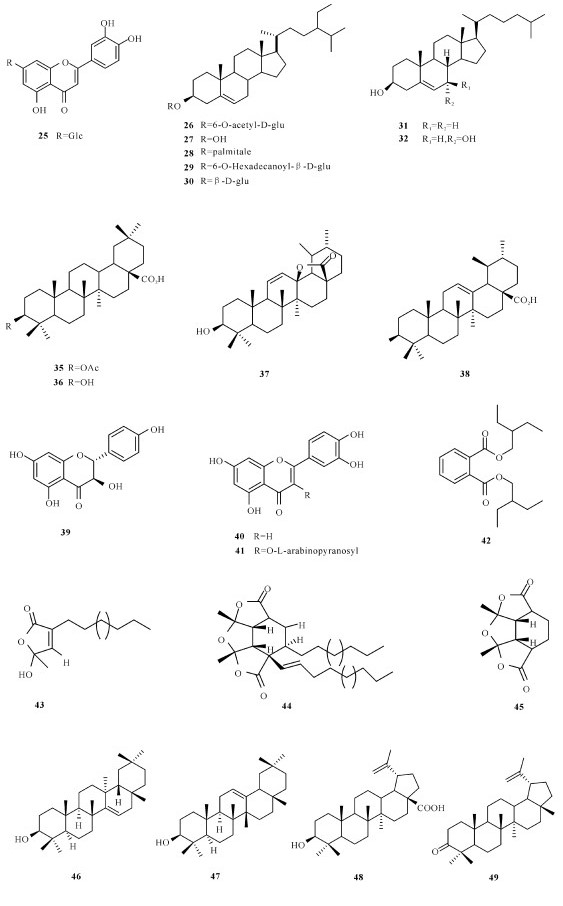
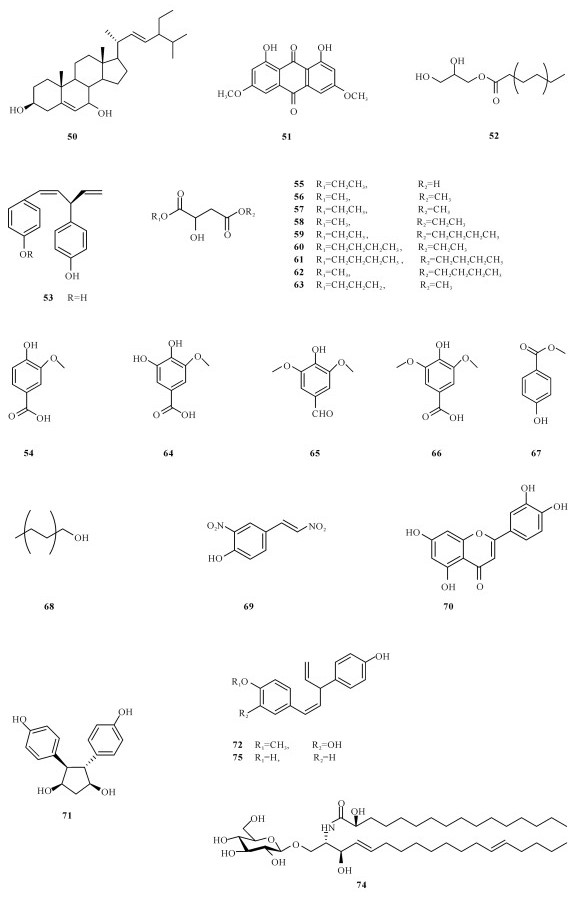
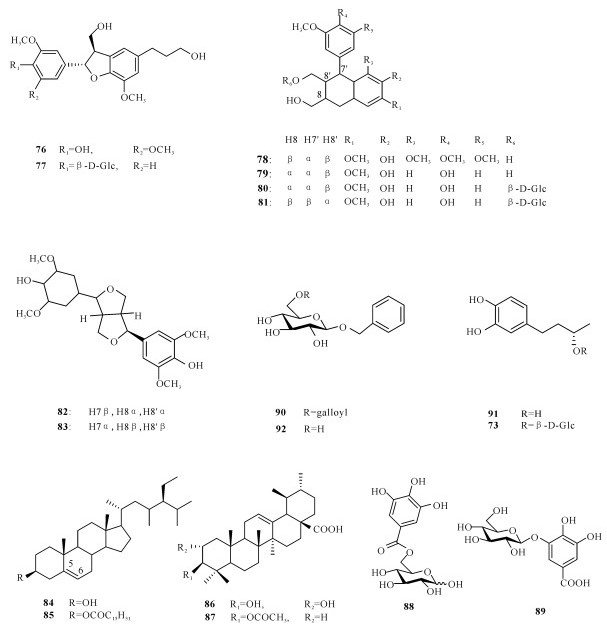
2.1 国内海桑属植物化学成分和生物活性研究状况2008年,郑喆等[10]从采集于福建厦门的卵叶海桑树枝中共分离并鉴定出17个化合物(1~17)。Wu等[11]于2009年分别在海桑和卵叶海桑的干果粉末提取物中共分离得到9个化合物(6, 18~25),其中有6个化合物(18~21,23~24)为两种果实共有。2009年,田敏卿等[12]从海桑的茎枝中分离并鉴定得到24个化合物,分别为7个甾醇类化合物(26~32),10个三萜类化合物(1~3,31,33~38),3个黄酮类化合物(39~41),3个安息香衍生物(4~5,42),其中26,29~30,1~5,31~39和41是首次从海桑中分离得到,但它们都没有显示出显著的抑菌活性,而化合物40在体外药理测试中表现出显著抑制人肝癌细胞SMMC-7721的增长活性。2011年,Chen等[13]首次从拟海桑的树皮中共分离3个化合物(43~45),其中化合物44对双特异性磷酸酶CDC25B显现出强烈的抑制作用,IC50值为6.44 μmol/L。2014年,程灿玲等[14]从海南文昌采集的拟海桑枝干的甲醇提取物中共分离鉴定出10个化合物(7,46~54),发现其中化合物53对4种肿瘤细胞都具有抑制作用。2015年,曹雷雷等[15]从新鲜的无瓣海桑果实分离得到16个化合物(7~8,53~67),其中包含3个新化合物。
|
|
|
|
国外对海桑属红树植物的研究要早于国内,Chaudhry等[16]首次对海桑(S.caesolaris)的枝干进行化学成分的分析,从中发现2个醌类化合物archin (1)和archin (2)。Ganguly等[17]从无瓣海桑树枝中分离鉴定出3个赤霉素terahydrogibberlilin A1-A3 (82~84)。Bunyapraphatsara等[18]从海桑枝条中分离得到一个硝基烯类化合物(69)。Mazumder等[19]从无瓣海桑枝干中分离得到5个化合物(27, 38, 46~47, 68)。Jaimini等[20]从无瓣海桑的叶子中分离并鉴定3个甾醇类化合物(10, 27, 68)。Sadhu等[21]从海桑的叶子中得到木犀草素和木犀草素7-O-β-葡萄糖苷(29~30),结果测试显示两个化合物都具有抗氧化性。Tiwari等[22]从海桑果实中发现3个化合物(30,38,70),其中化合物20在体外药理试验显现出对α-葡萄糖苷酶具有抑制作用,体内药理实验发现其有利于小鼠血糖的降低。Nguyen等[23]从卵叶海桑的叶子中分离并鉴定得到3个新的酚类化合物sonnerphenolics A (71~73)、1个脂类化合物sonnercerebroside (74)、9个木脂素化合物(75~83)、2个甾醇类化合物(84~85),2个三萜化合物(86~87),3个没食子酸衍生物(88~90)、2个酚类衍生物(75, 91)和1-O-benzyl-β-D-glucopyranose (92),活性研究发现化合物91对乙酰胆碱酯酶有抑制作用,IC50为(96.1±14.5)μmol/L,化合物73, 75和76对MCF-7细胞表现出细胞毒性,IC50分别为(112.8±9.4)μmol/L、(146.9±9.0)μmol/L和(14.5±7.2)μmol/L。
3 展望海桑属红树植物次生代谢产物结构类型丰富多样,主要包含脂肪酸类、酚酸类、黄酮类、萜类、甾醇类、生物碱类化合物等,其中有一部分化合物被发现具有良好的生物活性。目前关于海桑属植物的研究,主要聚焦点在于海桑属植物与环境的关系及海桑属植物引种情况,关于海桑属植物次生代谢产物极其生物活性的研究报道极少,相比其它红树物种的相关研究少很多[24],从中也可以看出海桑属植物的化学研究深度还不够,海桑属植物的药用和食用研究还存在广阔的空间等待着学者们的探索。同时,也只有少量化合物单体进行了体内细胞活性测试,大部分还停留在体外活性测试,加快活性单体的体内细胞测试及临床测试也是今后研究的重点之一。
| [1] |
林鹏. 红树林[M]. 北京: 海洋出版社, 1984: 24. LIN P. Mangrove[M]. Beijing: Marine Press, 1984: 24. |
| [2] |
周涵韬, 林鹏. 海桑属红树植物遗传多样性和引种关系研究[J]. 海洋学报, 2002, 24(5): 98-106. ZHOU H T, LIN P. Analysis on genetic diversity of mangrove species of Sonneratia and relationship to plant introduction[J]. Acta Oceanologica Sinica, 2002, 24(5): 98-106. |
| [3] |
王瑞江, 陈忠毅. 海桑科的系统进化及地理分布[J]. 广西植物, 2002, 22(3): 214-219. WANG R J, CHEN Z Y. Systematics and biogeography study on the family Sonneratiaceae[J]. Guihaia, 2002, 22(3): 214-219. |
| [4] |
王瑞江, 陈忠毅, 陈二英, 等. 国产海桑属植物的两个杂交种[J]. 广西植物, 1999, 19(3): 199-204. WANG R J, CHEN Z Y, CHEN E Y, et al. Two hybrids of the genus Sonneratia (Sonneratiaceae) from China[J]. Guihaia, 1999, 19(3): 199-204. |
| [5] |
林海生, 宋文东, 吴婕, 等. 无瓣海桑叶子和果实中脂肪酸成分的检测分析[J]. 福建分析测试, 2009, 18(3): 5-9. LIN H S, SONG W D, WU J, et al. Analysis of fatty acids constituents in the leaves and fruits of Sonneratia apetala[J]. Fujian Analysis & Testing, 2009, 18(3): 5-9. |
| [6] |
林海生, 宋文东. 无瓣海桑叶子和果实中氨基酸成分的检测分析[J]. 氨基酸和生物资源, 2009, 31(2): 76-78, 83. LIN H S, SONG W D. Study on amino acids of leaves and fruits of Sonneratia apetala by HPIC-IPAD[J]. Amino Acids & Biotic Resources, 2009, 31(2): 76-78, 83. |
| [7] |
邵长伦, 傅秀梅, 王长云, 等. 中国红树林资源状况及其药用调查Ⅲ.民间药用与药物研究状况[J]. 中国海洋大学学报, 2009, 39(4): 712-718. SHAO C L, FU X M, WANG C Y, et al. Investigation on the status of mangrove resources and medicinal research in China Ⅲ.Status of folk medicinal usage and medicinal research[J]. Periodical of Ocean University of China, 2009, 39(4): 712-718. |
| [8] |
BANDARANAYAKE W M. Traditional and medicinal uses of mangroves[J]. Mangroves and Salt Marshes, 1998, 2(3): 133-148. DOI:10.1023/A:1009988607044 |
| [9] |
KONISHI T, YAMAZOE K, KONOSHIMA T, et al. Seco-labdane type diterpenes from Excoecaria agallocha[J]. Phytochemistry, 2003, 64(4): 835-840. DOI:10.1016/j.phytochem.2003.09.001 |
| [10] |
郑喆.中国南海红树林植物卵叶海桑的化学成分研究[D].沈阳:沈阳药科大学, 2007. ZHENG J.Chemical Constituents of Mangrove Plant Sonneratia ovata from Southern China Sea[D].Shenyang:Shenyang Pharmaceutical University, 2007. |
| [11] |
WU S B, WEN Y, LI X W, et al. Chemical constituents from the fruits of Sonneratia caseolaris and Sonneratia ovata (Sonneratiaceae)[J]. Biochemical Systematics and Ecology, 2009, 37(1): 1-5. DOI:10.1016/j.bse.2009.01.002 |
| [12] |
TIAN M Q, DAI H F, LI X M, et al. Chemical constituents of marine medicinal mangrove plant Sonneratia caseolaris[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(2): 288-296. DOI:10.1007/s00343-009-9138-7 |
| [13] |
CHEN X L, LIU H L, LI J, et al. Paracaseolide A, first α-alkylbutenolide dimer with an unusual tetraquinane oxa-cage bislactone skeleton from Chinese Mangrove Sonneratia paracaseolaris[J]. Organic Letters, 2011, 13(19): 5032-5035. DOI:10.1021/ol201809q |
| [14] |
程灿玲, 宫凯凯, 李平林, 等. 红树植物拟海桑(Sonneratia paracaseolaris)化学成分研究[J]. 中国海洋药物, 2014, 33(1): 53-57. CHENG C L, GONG K K, LI P L, et al. Studies on chemical constituents of Sonneratia paracaseolaris[J]. Chinese Journal of Marine Drugs, 2014, 33(1): 53-57. |
| [15] |
曹雷雷, 田海妍, 王友绍, 等. 红树植物无瓣海桑果实的化学成分研究[J]. 热带海洋学报, 2015, 34(1): 77-82. CAO L L, TIAN H Y, WANG Y S, et al. Chemical constituents in the fruits of mangrove plant Sonneratia apetala Buch.Ham[J]. Journal of Tropical Oceanography, 2015, 34(1): 77-82. |
| [16] |
CHAUDHRY G R, SIDDIQUI S. Chemical examination of archa (Sonneratia acida L.).Part I:Isolation of three crystalline products from the wood[J]. Journal of Scientific and Industrial Research, 1950(5): 118-120. |
| [17] |
GANGULY S N, SIRCAR S M. Gibberellins from mangrove plants[J]. Phytochemistry, 1974, 13(9): 1911-1913. DOI:10.1016/0031-9422(74)85113-7 |
| [18] |
BUNYAPRAPHATSARA N, JUTIVIBOONSUK A, SORNLEK P, et al. Pharmacological studies of plants in the mangrove forest[J]. Thai Journal of Phytopharmacy, 2003, 10(2): 1-12. |
| [19] |
MAZUMDER M E H, RAHMAN S. Pharmacological evaluation of Bangladeshi medicinal plants for antioxidant activity[J]. Pharmaceutical Biology, 2008, 46(10/11): 704-709. |
| [20] |
JAIMINI D, SARKAR C, SHABNAM A A, et al. SHABNAM A A, et al.Evaluation of antibacterial properties of mangrove plant Sonneratia apetala Buch.Ham leaf[J]. World Applied Sciences Journal, 2011, 14(11): 1683-1686. |
| [21] |
SADHU S K, AHMED F, OHTSUKI T, et al. Flavo-noids from Sonneratia caseolaris[J]. Journal of Natural Medicines, 2006, 60(3): 264-265. DOI:10.1007/s11418-006-0029-3 |
| [22] |
TIWARI A K, VISWANADH V, GOWRI P M, et al. Oleanolic acid-an-α-Glucosidase inhibitory and antihyperglycemic active compound from the fruits of Sonneratia caseolaris[J]. Journal of Medicinal and Aromatic Plants, 2010, 1(1): 19-23. |
| [23] |
NGUYEN T H T, PHAM H V T, PHAM N K T, et al. Chemical constituents from Sonneratia ovata backer and their in vitro cytotoxicity and acetylcholinesterase inhibitory activities[J]. Bioorganic & Medicinal Chemistry Letters, 2015, 25(11): 2366-2371. |
| [24] |
WU J, XIAO Q, XU J, et al. Natural products from true mangrove flora:Source, chemistry and bioactivities[J]. Natural Product Reports, 2008, 25(5): 955-981. DOI:10.1039/b807365a |
 2016, Vol. 32
2016, Vol. 32 


