【研究意义】随着工厂化密度养殖的迅速发展,大量残饵、粪便严重破坏了养殖水体水质,从而造成养殖生物病害频发。微生态制剂因其对水质中有机质及氨氮等降解效果良好,能增强养殖生物免疫力,并且无污染、无残留等优势,逐渐被人们所接受并在各方面使用[1-4]。芽孢杆菌(Bacillus)的稳定性使其广泛应用于水产养殖中。【前人研究进展】研究人员发现,用地衣芽孢杆菌(Bacillus lincheniformis)对草鱼(Ctenopharyngodon idellus)进行投喂,草鱼的肠道胰蛋白酶、淀粉酶和脂肪酶活性都比对照组显著提高[5-6];应用枯草芽孢杆菌(Bacillus subtilis),硝化细菌(Nitrifying bacteria)与巨大芽孢杆菌(Bacillus megaterium)于养殖水体中,对水体中的氨氮、有机质、有机磷、亚硝态氮等有明显的降低效果[7-10]。【本研究切入点】单一菌株的降解性能已无法满足实际应用。【拟解决的关键问题】将刺参(Stichopus japonicus)养殖池塘中获得的单菌株分别以2株菌或3株菌进行组合,研究不同组合对COD的降解效果,以期获得在COD降解方面优于单菌株的菌株组合,对实践应用进行一定程度的指导。
1 材料和方法 1.1 材料菌株来源:从即墨盐厂刺参养殖池塘中分离得到16株芽孢杆菌(表 1),保种于-80℃冰箱中。使用前用灭菌的接种针接种于液体培养基,在28℃,160 r/min条件下培养24 h,得到种子液。
| 表 1 16株芽孢杆菌的来源 Table 1 The resources of 16 bacterial strains |
固体培养基:蛋白胨10 g,牛肉膏3.5 g,氯化钠5 g,溶于1 000 mL的海水中,调节pH值为8.2,并加入12 g琼脂,121℃下灭菌15 min。
刺参饵料液体培养基:取20 g刺参饵料装于1 L过滤海水中,静置过夜,过滤,取滤液定容至1 L,在121℃下灭菌15 min。
1.2 方法 1.2.1 单菌株降解效果研究将-80℃超低温保存的16株菌活化划线接种于营养琼脂斜面培养基上,28℃下培养24 h,用无菌生理盐水将平板菌落洗入灭菌的富集培养基,于振荡培养箱内振荡培养2 d后,将菌株依次接种于装有100 mL刺参饵料培养基的250 mL锥形瓶中,以血球计数板计数,使菌株初始浓度都为1×106 cfu/mL。于28℃下,160 r/min振荡培养6 d,每天记录饵料中COD含量的变化。
1.2.2 菌株拮抗效果研究采用平板十字交叉划线法,将降解效果良好的菌株培养于固体平板培养基中。28℃、160 r/min条件下培养48 h后,查看其拮抗效果。
1.2.3 组合菌株的降解效果研究综合考虑单菌株的降解效果及菌株间的拮抗作用,取2株菌或3菌株进行组合,各菌株按照密度比1∶1或1∶1∶1比例接种于刺参饵料培养基内,采用血球计数板计数使培养基中各组合菌体总浓度为1×106 cfu/mL。在28℃、160 r/min摇床振荡培养,分别于第1天、第2天和第6天测定培养基中的COD含量。
1.2.4 最优组合菌株的鉴定菌株生理生化指标的测定:采用北京陆桥技术有限责任公司生产的细菌微量生化鉴定管对菌株的生理生化指标进行测定,具体操作方法参照说明书。按照《伯杰细菌鉴定手册》[11],对菌株进行鉴定。
菌株16S rDNA序列分析:采用水煮法[12]提取细菌基因组DNA后,进行扩增,选择正向引物:5′-AGAGTTTGATCCTGGCTCAG-3′(E.coli 27F),反向引物:5′-TACGGCTACCTTGTTACGACTT-3′(E.coli 1492R)。PCR 产物(1.5 kb 左右)由上海生工生物工程股份有限公司进行测序。将测序结果在NCBI库中进行Blast,得到与目标菌株相似性高的序列,再用CLUSTAL X程序进行比对,最后采用MEGA 4.1工具构建Neighbor-Joining树[13]。
综合菌株的生理生化指标及16S rDNA序列分析,鉴定菌株。
2 结果与分析 2.1 单菌株降解效果从图 1可以看出,16株菌对于培养液中COD的降解均有明显效果,菌株在第1~2天时,对培养液中COD降解效果比较明显,大部分菌株在第2天时,使培养液中COD含量达到相对比较低的点,少部分菌株在第3 天时达到这个低点。这应该与菌株的对数生长期有关。到第6天时,对COD的降解趋于平稳。在后续的试验时,选择第2天与第6天作为取样时间点。

|
图 1 16株菌株培养液中COD含量变化 Fig.1 The change of COD content in culture solution with strain B1,strain B2,…stain B16 |
表 2显示,部分菌株在第2天时对于COD的降解能达到最终降解率的80%以上(B1,B2,B3,B6,B8),部分菌株在第2天时达到最终降解率的50%以上(B4,B5,B7,B9,B12,B13,B15,B16),从而看出菌株在液体培养基的扩繁速率。对比菌株第6天和第1天的降解率,部分菌株(B3,B4,B5,B6,B7)降解率达50%以上,其中B7降解率最高为65.84%。综合考虑菌株的生长速率与第6天的降解率,最终确定初筛菌株B1,B2,B3,B4,B5,B6,B7,B9,B11,B12进行后续实验。
| 表 2 16株菌株的降解率(%) Table 2 The degradation rate of strain B1,strain B2,… strain B16(%) |
根据表 3结果,选取相互之间没有生长抑制作用的菌株进行后期组合实验。
| 表 3 10株菌间拮抗作用结果 |
综合表 2和表 3的结果,对菌株进行组合,具体设计见表 4。从表 5可以看出,并不是所有3株菌组合降解效果优于2株菌组合。但2株菌组合第6天时COD含量的均值为422.57 mg/L,标准差为63.85,3株菌组合第6天时COD含量的均值为365.61 mg/L,标准差为67.63。这说明,3株菌组合的整体降解效果比2株菌组合的好,且更容易获得降解效率高的组合。
| 表 4 菌株组合设计 Table 4 The design of combinations of strains |
| 表 5 组合菌株COD变化规律(mg/L) Table 5 Variation law of COD of combined strains |
根据表 6结果,确定最优菌株组合为C14(B2,B6,B11),COD降解率为64.29%。
| 表 6 菌株组合降解率(%) Table 6 The degradation rate of strain combinations |
结果显示:菌株B2,革兰氏阳性,有芽孢,杆状,菌落圆形,边缘不整齐,表面隆起呈白色,VP反应阳性,接触酶阳性,可水解淀粉;菌株B6,革兰氏阳性,有芽孢,杆状,菌落白色,边缘整齐,表面光滑,凸状隆起,VP反应阴性,可水解淀粉;菌株B11,革兰氏阳性,有芽孢,杆状,圆头,菌落白色,表面粗糙,边缘不整齐,接触酶阳性,水解淀粉,VP反应阳性。
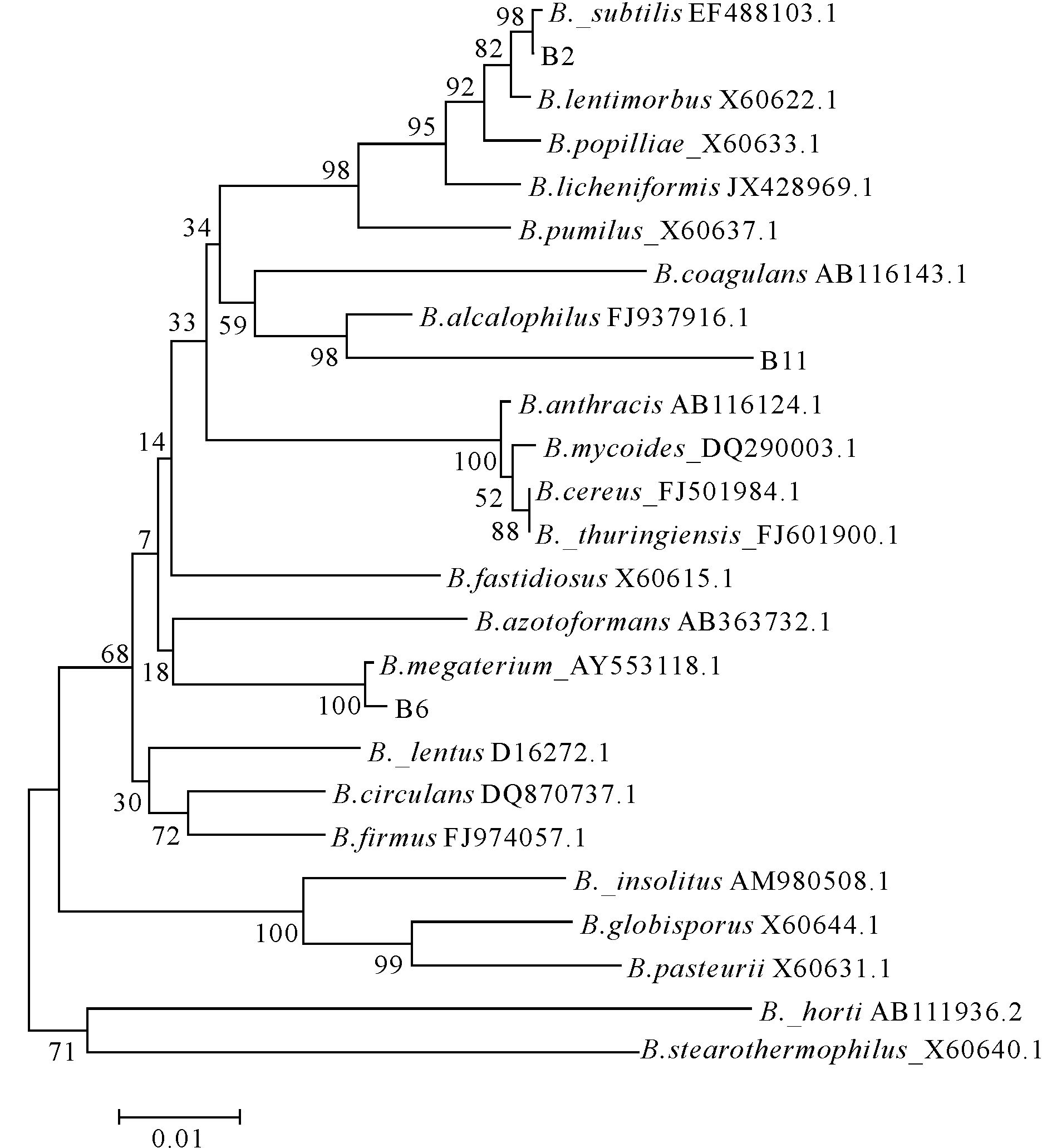
2.4.2 菌株的系统发育树从图 2可以看出,菌株B2与枯草芽孢杆菌(Bacillus subtilis)的亲缘关系最近,菌株B6与巨大芽孢杆菌(Bacillus megaterium)的亲缘关系最近,菌株B11与嗜碱性芽孢杆菌(Bacillus alcalophilus)的亲缘关系最近。综合考虑菌株的生理生化指标结果,最终确定菌株B2为枯草芽孢杆菌,菌株B6为巨大芽孢杆菌,菌株B11为嗜碱性芽孢杆菌。
|
图 2 菌株B2、B6、B11系统发育树 Fig.2 The phylogenetic tree of strain B2,strain B6,strain B11 |
单菌株对COD的降解与菌株的生长曲线存在相关性,在第1~2天时,菌株处于对数期间,随着菌浓度的直线增长,COD的含量也直线下降,当菌株达到稳定期后,COD的含量变化也趋于平稳。当菌株达到衰亡期时,因细胞代谢产物的积累,死亡细胞裂解,造成培养基内的COD含量升高。
不同菌株间存在拮抗作用,综合考虑其拮抗作用及其降解特性进行菌株组合设计,得到的结果显示,并不是所有3株菌的组合降解效果优于2株菌的组合,但2株菌的组合第6天时COD含量的均值为422.57 g/mL,标准差为63.85,3株菌的组合第6天时COD含量的均值为365.61 g/mL,标准差为67.63,这说明,3株菌的组合整体降解效果比2株菌的组合要好,且更容易获得降解效率高的组合。
最终确定最优菌株组合为C14(B2,B6,B11),对COD降解率为64.29%。经鉴定,菌株B2为枯草芽孢杆菌,菌株B6为巨大芽孢杆菌,菌株B11为嗜碱性芽孢杆菌,为今后在利用菌株组合进行工厂化密度养殖水体水质改善时,提供一定的参考和指导。
| [1] |
辛美丽, 吕芳, 孙福新, 等. 一株具有降解性能的巨大芽孢杆菌的鉴定与发酵条件优化[J]. 广西科学院学报, 2015, 31(4): 247-252. XIN M L, LV F, SUN F X, et al. Identification and optimization of fermentation condition for Bacillus megaterium from sea cucumber ponds[J]. Journal of Guangxi Academy of Sciences, 2015, 31(4): 247-252. |
| [2] |
樊海平, 曾占壮, 林煜, 等. 养殖鳗鲡肠道益生菌的筛选[J]. 水产学报, 2006, 30(1): 97-102. FAN H P, ZENG Z Z, LIN Y, et al. Selection of probiotics from intestinal tract of cultured eel[J]. Journal of Fisheries of China, 2006, 30(1): 97-102. |
| [3] |
孙云章, 杨红玲, 马如龙, 等. 斜带石斑鱼消化道乳酸菌在模拟胃肠道环境中的存活[J]. 中国水产科学, 2010, 17(1): 128-135. SUN Y Z, YANG H L, MA R L, et al. Survival of lactic acid bacteria isolated from gut of Epinephelus coioides in mimic gastrointestinal environments[J]. Journal of Fishery Sciences of China, 2010, 17(1): 128-135. |
| [4] |
曹煜成, 李卓佳, 林黑着, 等. 地衣芽孢杆菌De在优质草鱼养殖中的应用研究[J]. 南方水产, 2008, 4(3): 15-19. CAO Y C, LI Z J, LIN H Z, et al. Applied research of Bacillus licheniformis De in grass carp (Ctenopharyngodon idellus) culture[J]. South China Fisheries Science, 2008, 4(3): 15-19. |
| [5] |
姚东林, 邹青, 刘文斌, 等. 地衣芽孢杆菌和低聚木糖对草鱼生长性能肠道菌群和消化酶活性的影响[J]. 大连海洋大学学报, 2014, 29(2): 136-140. YAO D L, ZOU Q, LIU W B, et al. Effects of Bacillus licheniformis and xylo-oligosaccharide on growth performance,intestinal microflora and enzyme activities in grass carp Ctenopharyngodon idella[J]. Journal of Dalian Ocean University, 2014, 29(2): 136-140. |
| [6] |
田相利, 赵坤, 王军, 等. 泼洒和投喂芽孢杆菌对刺参生长以及消化和免疫相关酶活性的影响[J]. 中国海洋大学学报, 2015, 45(1): 18-25. TIAN X L, ZHAO K, WANG J, et al. Influence of water additive and feed supplementary Bacillus cereus on the growth and activity of digestive and immune relating enzyme of sea cucumber[J]. Periodical of Ocean University of China, 2015, 45(1): 18-25. |
| [7] |
高金伟, 张海红, 陈瑞楠, 等. 硝化细菌与枯草芽孢杆菌对养殖水质调控作用研究[J]. 天津农学院学报, 2014, 21(1): 5-8. GAO J W, ZHANG H H, CHEN R N, et al. Effects of Nitrifying bacteria and Bacillus subtilis on controlling aquaculture water qualities[J]. Journal of Tianjin Agricultural University, 2014, 21(1): 5-8. |
| [8] |
汤保贵, 徐中文, 张金燕, 等. 枯草芽孢杆菌的培养条件及对水质的净化作用[J]. 淡水渔业, 2007, 37(3): 45-48. TANG B G, XU Z W, ZHANG J Y, et al. Cultivation conditions and application in water purification effect of Bacillus subtilis[J]. Freshwater Fisheries, 2007, 37(3): 45-48. |
| [9] |
李卫芬, 邓斌, 陈南南, 等. 芽孢杆菌对草鱼生长和肠粘膜抗氧化功能及养殖水质的影响[J]. 水生态学杂志, 2012, 33(1): 65-70. LI W F, DENG B, CHEN N N, et al. Effects of Bacillus on water quality,growth and antioxidant activity of intestinal mucosa of Ctenopharyngodon idellus[J]. Journal of Hydroecology, 2012, 33(1): 65-70. |
| [10] |
李永芹, 许乐乐, 陈克卫. 1株芽孢杆菌的筛选鉴定及其净水效果研究[J]. 水生态学杂志, 2013, 34(1): 96-100. LI Y Q, XU L L, CHEN K W. Screening,identification and water purification effects of Bacillus subtilis[J]. Journal of Hydroecology, 2013, 34(1): 96-100. |
| [11] |
布坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 北京: 科学出版社, 1984: 729-794. BUCHANAN R E, GIBBONS N E. Bergey’s Manual of Determinative Bacteriology[M]. Beijing: Science Press, 1984: 729-794. |
| [12] |
赵伟伟, 王秀华, 孙振, 等. 一株产絮凝剂芽孢杆菌的分离鉴定及絮凝剂特性分析[J]. 中国水产科学, 2012, 19(4): 647-653. ZHAO W W, WANG X H, SUN Z, et al. Isolation and identification of a flocculant-producing Bacillus sp.and analysis of the properties of the bioflocculant[J]. Journal of Fishery Sciences of China, 2012, 19(4): 647-653. |
| [13] |
陶天申, 杨瑞馥, 东秀珠. 原核生物系统学[M]. 北京: 化学工业出版社, 2007. TAO T S, YANG R F, DONG X Z. Systematics of Prokaryotes[M]. Beijing: Chemical Industry Press, 2007. |
 2016, Vol. 32
2016, Vol. 32 


