海洋蕴含着丰富的微生物资源,但相比陆生微生物,海洋微生物相关的研究及利用较少。海洋微生物包括真核微生物、原核微生物等,其生物量占海洋总生物量的90%[1]。海洋真菌能够产生结构新颖独特的次级代谢产物,是天然药物的重要来源之一[2]。包括烟曲霉(Asperigillus fumigatus)在内的曲霉属(Asperigillus)真菌代谢产物丰富,其结构类型包括生物碱类、内酯类、聚酮类等[3],并且具有抗菌、抗炎、抗肿瘤等活性。冯婷等[4]从烟曲霉中发现了具有抗菌活性的次级代谢产物6-methoxyspirotryprostatin B和fumitremorgin C,最小抑菌浓度(Minimal Inhibitory Concentration, MIC)分别为64、8 μg·mL-1。王宇等[5]从烟曲霉的提取物中分离到具有抗肿瘤活性的一系列化合物,分别为fumiquinazoline A、fumiquinazoline F、fumiquinazoline G、fumiquinazoline J,这些化合物对人单核细胞白血病细胞(U937)的半数抑制浓度(Half maximal Inhibitory Concentration,IC50)分别为87.1、16.4、33.3、8.6 μmol·L-1。
天然海洋盐场拥有高盐度、高渗透压的极端环境。这种极端环境可能激活海洋微生物的沉默基因,从而产生特殊的次级代谢产物。因此,天然海洋盐场是发现新颖微生物结构活性化合物的重要来源。北海竹林盐场是广西最大的海晶盐生产基地,其年生产能力3-4万吨。目前,北海竹林盐场来源海洋微生物及其活性成分的相关研究较少。陈显强等[6]从北海竹林盐场中分离得到11种真菌,隶属于3科4属。其中,真菌Epicoccum sorghinum GXIMD02001的提取物对FGFR2过表达的乳腺癌细胞MDA-MB-231-(S252W)增殖有较强的抑制作用,其IC50为11.02 μg·mL-1;真菌Aspergillus versicolor GXIMD02004、Penicillium citrinum GXIMD02009对乳腺癌细胞MDA-MB-231和MDA-MB-231(S252W)增殖抑制的IC50为11.94-16.41 μg·mL-1。本课题组前期也从竹林盐场分离了16株海洋真菌,鉴定为6科6属12种,部分菌株具有较好的抗菌活性[7-8]。
本研究拟在前期研究基础上,以一株具有抗菌活性的竹林盐场来源烟曲霉GXIMD 00544为研究对象,挖掘并阐明其抗菌活性的物质基础。本研究将结合菌株的发酵、提取、分离和化合物结构鉴定,并以人类致病菌耐甲氧西林金黄色葡萄球菌(Methicillin-Resistant Staphylococcus aureus,MRSA)、海洋污损细菌轮虫弧菌(Vibrio rotiferianus)和海弧菌(V. pelagius)为指示菌,测定其次级代谢产物的抗菌活性。
1 材料与方法 1.1 仪器与试剂Bruker Ascend 500型超导核磁共振仪(美国布鲁克有限公司),Prominence LC-2030C 3D型高效液相色谱仪(日本株式会社岛津制作所),NanoChrom C-18型色谱柱(10 mm×250 mm, 5 μm,苏州纳谱分析技术有限公司),中压制备色谱仪(赛谱锐思北京科技有限公司),MLS-3781L-PC型高压蒸汽灭菌锅(日本PHC株式会社),ZYJ-S型超净工作台(苏州净化设备有限公司),Eyelan-1100V-W型旋转蒸发仪(日本东京理化株式会社),ZWYR-2102型立式恒温培养振荡器(上海智城分析仪器制造有限公司),VICTOR Nivo型酶标仪(美国珀金埃尔默股份有限公司),薄层色谱及柱色谱用硅胶(100-200目、200-300目,烟台江友硅胶开发有限公司),石油醚、乙酸乙酯、甲醇(分析纯,上海泰坦科技股份有限公司), 乙腈(ACN, 色谱纯,上海星可高纯溶剂有限公司)。
1.2 菌株菌株GXIMD 00544分离自北海竹林盐场池水样品,保存于广西中医药大学海洋药物研究院北部湾海洋微生物资源库。经过ITS测序和Blast分析,该菌株被鉴定为烟曲霉,Genbank保藏号为OR492492。
人类致病菌MRSA、海洋污损细菌轮虫弧菌和海弧菌,均由华南农业大学海洋学院张晓勇副教授惠赠。
1.3 菌株发酵菌株GXIMD 00544经活化后接种于马铃薯葡萄糖培养基(PDB培养基, 土豆提取粉1.2 g、葡萄糖4 g、海盐6 g、水200 mL)的1 L锥形瓶中,置于振荡培养箱(180 r·min-1)中室温培养72 h,得种子液。再取适量种子液接种到100瓶灭菌(121 ℃,20 min)后的大米培养基(80 g大米、酵母膏0.4 g、葡萄糖0.4 g、海盐3.6 g、水120 mL)中,25 ℃下静置发酵30 d,得发酵产物。
1.4 次级代谢产物提取与分离在发酵产物中加入等体积的乙酸乙酯后,捣碎大米并超声萃取3次,减压浓缩得到提取物浸膏170 g。浸膏中加100-200目硅胶拌样后,经200-300目正相硅胶柱色谱进行梯度洗脱(石油醚∶乙酸乙酯=100∶0-95∶5-90∶10-80∶20-70∶30-50∶50-30∶70-0∶100)、薄层色谱(TLC)分析,合并相似馏分后得到12个组分Fr.1-Fr.12。Fr.4(4 g)组分经反相硅胶(ODS)柱色谱进行梯度洗脱(ACN∶H2O=15∶85-98∶2)得到23个亚组分sFr.4-1-sFr.4-23,sFr.4-22经高效液相色谱(HPLC,ACN∶H2O=60∶40)纯化得到化合物3 (tR=33.1 min,5.2 mg),sFr.4-13经HPLC (ACN∶H2O=25∶75)纯化得到化合物5 (tR=21.9 min,15.5 mg),sFr.4-20经HPLC (ACN∶H2O=57∶43)纯化得到化合物6(tR=30.2 min, 6.6 mg),sFr.4-17经HPLC(ACN∶H2O=47∶53)纯化得到化合物8 (tR=27.2 min,17.1 mg),sFr.4-15经HPLC (ACN∶H2O=33∶67)纯化得到化合物9 (tR=24.4 min,9.1 mg)。Fr.5 (5.6 g)组分经ODS反相柱色谱梯度洗脱(ACN∶H2O=10∶90-98∶2)得到24个亚组分sFr.5-1-sFr.5-24,其中sFr.5-20经HPLC (ACN∶H2O=55∶45)纯化得到化合物2 (tR=31.5 min,17.8 mg)和化合物4 (tR=31.1 min,25.6 mg)。Fr.6 (1.6 g)组分经ODS反相柱色谱梯度洗脱(ACN∶H2O=15∶85-95∶5)得到17个亚组分sFr.6-1-sFr.6-17,sFr.6-16经HPLC(ACN∶H2O=50∶50)纯化得到化合物1 (tR=32.1 min,10.3 mg),sFr.6-12经HPLC (ACN∶H2O=46∶54)纯化得到化合物7 (tR=25.6 min, 9.3 mg)和化合物11(tR=26.0 min, 2.4 mg),sFr.6-13经HPLC (ACN∶H2O=40∶60)纯化得到化合物10 (tR=26.8 min, 7.3 mg)。以上比值均为体积比。
1.5 化合物抗菌活性测定参照陆春菊等[9]的抗菌实验方法,以MRSA、轮虫弧菌和海弧菌为指示菌,采用96孔板法测定化合物的抗菌活性及其MIC。以青霉素和氯霉素为阳性对照。
2 结果与分析 2.1 化合物结构鉴定从北海竹林盐场来源烟曲霉GXIMD 00544的乙酸乙酯萃取物中分离得到4个烟曲霉酸类化合物(1-4)和7个酚酸类化合物(5-11),它们的结构如图 1所示。
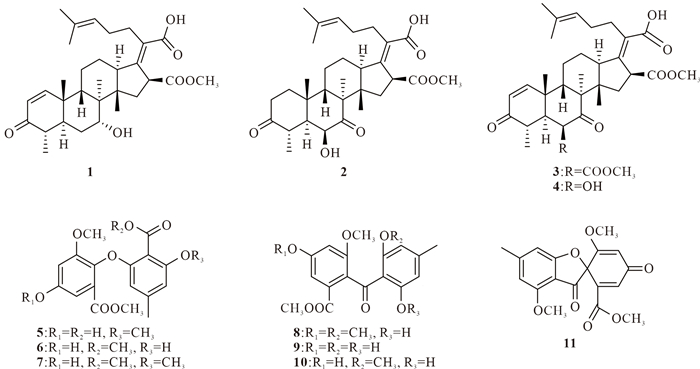
|
| 图 1 化合物1-11的化学结构 Fig. 1 Chemical structures of compounds 1-11 |
化合物1:白色固体。1H NMR (500 MHz, CDCl3) δ:7.28 (s, 1H, H-1), 5.86 (d, J=8.3 Hz, 1H, H-2), 5.84 (d, J=10.1 Hz, 1H, H-16), 5.09 (t, J=7.3 Hz, 1H, H-24), 4.15 (dd, J=7.5, 2.8 Hz, 1H, H-7), 2.77-2.70 (m, 1H, H-22β), 2.53-2.48 (m, 1H, H-13), 2.37-2.32 (overlapped, 4H, H-4, H-5, H-12α, H-22α), 2.26-2.18 (m, 1H, H-15α), 1.98 (s, 3H, H-31), 1.95 (overlapped, 1H, H-11α), 1.87 (m, 1H, H-6β), 1.75-1.70 (m, 1H, H-12β), 1.68 (s, 3H, H-27), 1.66 (overlapped, 1H, H-9), 1.61-1.57 (overlapped, 2H, H-6α, H-11β), 1.59 (s, 3H, H-26), 1.50-1.45 (m, 1H, H-15β), 1.17 (s, 3H, H-19), 1.12 (d, J=3.5 Hz, 3H, H-28), 1.01 (s, 3H, H-18), 0.96 (s, 3H, H-29)。13C NMR (125 MHz, CDCl3) δ:202.37 (C-3), 174.43 (C-30), 170.79 (C-21), 158.75 (C-1), 149.06 (C-17), 132.88 (C-20), 132.86 (C-25), 127.86 (C-2), 123.06 (C-24), 74.35 (C-16), 69.32 (C-7), 49.36 (C-13), 48.28 (C-8), 44.59 (C-9), 44.00 (C-14), 42.66 (C-4), 42.08 (C-5), 41.34 (C-15), 38.82 (C-10), 33.19 (C-6), 28.84 (C-22), 28.39 (C-23), 25.88 (C-12), 25.85 (C-11), 25.74 (C-27), 25.25 (C-19), 20.74 (C-31), 18.87 (C-18), 17.89 (C-26), 12.82 (C-28), 12.31 (C-29)。以上核磁数据与Zaman等[10]报道的基本一致,该化合物鉴定为maunakeanolic acid A。
化合物2:黄色固体。1H NMR (500 MHz, CDCl3) δ:5.85 (d, J=8.5 Hz, 1H, H-16), 5.09 (d, J=7.3 Hz, 1H, H-24), 3.92 (s, 1H, H-6), 2.89 (dq, J=13.4, 6.8 Hz, 1H, H-4), 2.60 (d, J=13.2 Hz, 1H, H-9), 2.53 (overlapped, 1H, H-13), 2.52 (overlapped, 2H, H-2), 2.52 (overlapped, 1H, H-22α), 2.43 (m, 1H, H-22β), 2.32 (m, 1H, H-12α), 2.29 (m, 1H, H-15α), 2.10 (overlapped, 2H, H-23), 2.04 (overlapped, 1H, H-1α), 1.95 (s, 3H, H-31), 1.87 (overlapped, 1H, H-5), 1.85 (overlapped, 1H, H-11α), 1.82 (overlapped, 1H, H-15β), 1.76 (dd, J=12.5, 3.5 Hz, 1H, H-12β), 1.67 (s, 3H, H-27), 1.66 (overlapped, 1H, H-1β), 1.59 (s, 3H, H-26), 1.44 (m, 1H, H-11β), 1.39 (s, 3H, H-19), 1.23 (s, 3H, H-29), 1.09 (d, J=6.6 Hz, 3H, H-28), 0.93 (s, 3H, H-18)。13C NMR (125 MHz, CDCl3) δ:216.1 (C-3), 213.4 (C-7), 174.7 (C-30), 170.8 (C-21), 148.7 (C-17), 132.9 (C-20), 130.4 (C-25), 122.9 (C-24), 74.0 (C-16), 73.5 (C-6), 52.7 (C-8), 49.4 (C-13), 46.8 (C-14), 46.0 (C-5), 41.8 (C-4), 41.1 (C-9), 40.8 (C-15), 37.4 (C-2), 35.1 (C-10), 33.8 (C-1), 28.6 (C-22), 28.5 (C-23), 26.2 (C-12), 25.8 (C-27), 24.0 (C-19), 23.0 (C-11), 20.6 (C-31), 18.4 (C-18), 17.9 (C-26), 17.2 (C-29), 12.5 (C-28)。以上核磁数据与Zaman等[10]报道的基本一致,该化合物鉴定为6-deacetyl-1,2-dihydrohelvolic acid。
化合物3:白色固体。1H NMR (500 MHz, CDCl3) δ:7.30 (d, J=10.0 Hz, 1H, H-1), 5.87 (dd, J=9.9, 5.5 Hz, 2H, H-2, H-16), 5.23 (s, 1H, H-6), 5.10 (m, 1H, H-24), 2.82-2.72 (m, 1H, H-4), 2.62 (d, J=12.9 Hz, 1H, H-9), 2.59 (t, J=3.5 Hz, 1H, H-13), 2.57-2.45 (m, 2H, H-22), 2.45-2.39 (m, 1H, H-12α), 2.30-2.17 (m, 2H, H-23), 2.28 (d, J=12.3 Hz, 1H, H-5), 2.24 (d, J=12.2 Hz, 1H, H-15α), 2.15 (m, 1H, H-11α), 2.11 (s, 3H, 32-COCH3), 1.94 (s, 3H, H-31), 1.92 (d, J=15.0 Hz, 1H, H-15β), 1.85-1.78 (m, 1H, H-12β), 1.69 (s, 3H, H-27), 1.61 (s, 3H, H-26), 1.60-1.52 (m, 1H, H-11β), 1.45 (s, 3H, H-19), 1.28 (d, J=6.8 Hz, 3H, H-28), 1.18 (s, 3H, H-29), 0.92 (s, 3H, H-18)。13C NMR (125 MHz, CDCl3) δ:208.9 (C-7), 201.5 (C-3), 174.2 (C-21), 170.3 (C-30), 169.0 (32-COCH3), 157.4 (C-1), 148.0 (C-17), 133.1 (C-25), 130.4 (C-20), 128.0 (C-2), 122.9 (C-24), 73.9 (C-6), 73.6 (C-16), 52.8 (C-8), 49.6 (C-13), 47.4 (C-5), 46.7 (C-14), 41.9 (C-9), 40.8 (C-15), 40.5 (C-4), 38.3 (C-10), 28.7 (C-22), 28.5 (C-23), 27.7 (C-19), 26.1 (C-12), 25.9 (C-27), 24.1 (C-11), 20.9 (32-COCH3), 20.6 (C-31), 18.5 (C-29), 18.1 (C-18), 17.9 (C-26), 13.2 (C-28)。以上核磁数据与孙世伟等[11]报道的基本一致,该化合物鉴定为helvolic acid(烟曲霉酸)。
化合物4:白色固体粉末。1H NMR (500 MHz, CDCl3) δ:7.32 (d, J=10.0 Hz, 1H, H-1), 5.84 (d, J=9.3 Hz, 1H, H-2), 5.84 (d, J=9.3 Hz, 1H, H-16), 5.08 (d, J=7.5 Hz, 1H, H-24), 3.97 (s, 1H, H-6), 3.02 (m, 1H, H-4), 2.66 (d, J=12.9 Hz, 1H, H-9), 2.55 (d, J=12.6 Hz, 1H, H-13), 2.52-2.41 (m, 2H, H-22), 2.37 (d, J=12.7 Hz, 1H, H-12a), 2.22 (dd, J=15.1, 8.8 Hz, 1H, H-15a), 2.13 (d, J=12.1 Hz, 1H, H-5), 2.10-2.02 (m, H-23a), 1.96 (s, 3H, H-31), 1.93 (m, 1H, H-11α), 1.88 (d, J=14.8 Hz, 1H, H-15β), 1.80 (d, J=12.6 Hz, 1H, H-12β), 1.67 (s, 3H, H-26), 1.62 (m, 1H, H-23β), 1.59 (s, 3H, H-27), 1.55(m, 1H, H-11β), 1.53 (s, 3H, H-19), 1.20 (d, J=6.7 Hz, 3H, H-28), 1.11 (s, 3H, H-29), 0.93 (s, 3H, H-18)。13C NMR (125 MHz, CDCl3) δ:215.6 (C-7), 202.6 (C-3), 173.9 (C-21), 171.0 (C-30), 158.6 (C-1), 147.5 (C-17), 132.9 (C-25), 130.7 (C-20), 127.6 (C-2), 122.9 (C-24), 73.9 (C-6), 73.8 (C-16), 52.5 (C-8), 50.8 (C-13), 47.2 (C-5), 46.5 (C-14), 41.5 (C-9), 40.9 (C-15), 40.0 (C-4), 38.4 (C-10), 28.6 (C-22), 28.4 (C-23), 28.2 (C-19), 26.0 (C-27), 25.8 (C-12), 24.2 (C-11), 20.6 (C-31), 18.3 (C-29), 18.0 (C-18), 17.9 (C-26), 12.5 (C-28)。以上核磁数据与Zhang等[12]报道的基本一致,该化合物鉴定为helvolinic acid。
化合物5:淡黄色固体。1H NMR (500 MHz, DMSO-d6) δ:6.77 (d, J=2.8 Hz, 1H, H-5), 6.74 (d, J=2.7 Hz, 1H, H-3), 6.47 (s, 1H, H-4′), 5.76 (s, 1H, H-6′), 3.75 (s, 3H, H-8′), 3.68 (s, 3H, H-8), 3.61 (s, 3H, H-9), 2.14 (s, 3H, H-9′)。13C NMR (125 MHz, DMSO-d6) δ:166.7 (C-7′), 165.5 (C-7), 156.3 (C-3′), 155.5 (C-1′), 155.2 (C-4), 153.5 (C-2), 139.5 (C-5′), 133.6 (C-1), 125.9 (C-6), 107.4 (C-5), 105.7 (C-6′), 105.2 (C-4′), 104.8 (C-3), 56.0 (C-9), 55.7 (C-8′), 52.1 (C-8), 21.6 (C-9′)。以上核磁数据与Xie等[13]报道的数据基本一致,该化合物鉴定为8′-O-methylasterric acid。
化合物6:白色固体粉末。1H NMR (500 MHz, CDCl3) δ:6.98 (d, J=2.9 Hz, 1H, H-5), 6.71 (d, J=3.0 Hz, 1H, H-3), 6.35 (s, 1H, H-4′), 5.84 (s, 1H, H-6′), 3.91 (s, 3H, H-8′), 3.85 (s, 3H, H-10), 3.82 (s, 3H, H-9′), 3.75 (s, 3H, H-8), 3.75 (s, 3H, H-9), 2.19 (s, 3H, H-10′)。13C NMR (126 MHz, CDCl3) δ:166.9 (C-7′), 166.4 (C-7), 157.5 (C-3′), 157.1 (C-1′), 156.7 (C-2), 154.2 (C-4), 141.4 (C-5′), 136.9 (C-1), 126.2 (C-6), 110.3 (C-2′), 106.6 (C-5), 105.3 (C-4′), 105.3 (C-6′), 105.2 (C-3), 56.7 (C-9), 56.1 (C-9′), 55.9 (C-10), 52.6 (C-8), 52.4 (C-8′), 22.3 (C-10′)。以上核磁数据与Lee等[14]报道的基本一致,该化合物鉴定为methylated asterric acid。
化合物7:黄色固体粉末。1H NMR (500 MHz, CDCl3) δ:6.98 (d, J=2.8 Hz, 1H, H-5), 6.69 (d, J=2.8 Hz, 1H, H-3), 6.35 (s, 1H, H-4′), 5.85 (s, 1H, H-6′), 3.91 (s, 3H, H-8′), 3.81 (s, 3H, H-9′), 3.72 (s, 3H, H-8), 3.70 (s, 3H, H-9), 2.18 (s, 3H, H-10′)。13C NMR (125 MHz, CDCl3) δ:167.3 (C-7′), 166.6 (C-7), 157.5 (C-3′), 156.8 (C-1′), 154.3 (C-2), 154.0 (C-4), 141.6 (C-5′), 136.1 (C-1), 126.0 (C-6), 110.0 (C-2′), 108.7 (C-5), 106.6 (C-6′), 105.3 (C-3), 105.3 (C-4′), 56.5 (C-9), 56.1 (C-9′), 52.6 (C-8), 52.6 (C-8′), 22.3 (C-10′)。以上核磁数据与Liu等[15]报道的基本一致,该化合物鉴定为dimethyl 2, 3′-dimethylosoate。
化合物8:淡红色固体粉末。1H NMR (500 MHz, CDCl3) δ:12.98 (s, 1H, 2′-OH), 7.00 (d, J=2.3 Hz, 1H, H-5), 6.60 (d, J=2.3 Hz, 1H, H-3), 6.45 (s, 1H, H-5′), 6.06 (s, 1H, H-3′), 3.69 (s, 3H, H-9), 3.67 (s, 3H, H-8), 3.49 (s, 3H, H-11), 3.37 (s, 3H, H-7′), 2.28 (s, 3H, H-8′)。13C NMR (125 MHz, CDCl3) δ:199.8 (C-10), 166.4 (C-7), 164.4 (C-6′), 161.1 (C-2′), 157.2 (C-2), 156.7 (C-4), 148.1 (C-4′), 128.5 (C-6), 127.9 (C-1), 111.1 (C-1′), 110.6 (C-5′), 108.0 (C-5), 103.4 (C-3′), 103.1 (C-3), 56.3 (C-9), 55.8 (C-7′), 52.4 (C-8), 51.0 (C-11), 22.6 (C-8′)。以上核磁数据与Hamasaki等[16]报道的基本一致,该化合物鉴定为dimethylsoluchrin。
化合物9:黄色固体粉末。1H NMR (500 MHz, DMSO-d6) δ:6.90 (d, J=2.8 Hz, 1H, H-5), 6.68 (d, J=2.1 Hz, 1H, H-3), 6.07 (s, 2H, H-3′, H-5′), 3.64 (s, 3H, H-9), 3.63 (s, 3H, H-8), 2.14 (s, 3H, H-7′)。13C NMR (125 MHz, DMSO-d6) δ:199.7 (C-10), 165.7 (C-7), 161.7 (C-2′, C-6′), 158.2 (C-4), 156.8 (C-2), 147.4 (C-4′), 127.9 (C-6), 126.2 (C-1), 109.2 (C-1′), 107.5 (C-3′, C-5′), 107.2 (C-5), 103.4 (C-3), 56.0 (C-9), 52.0 (C-8), 21.6 (C-8′)。以上核磁数据与Ohashi等[17]报道的基本一致,该化合物鉴定为sulochrin。
化合物10:黄色固体粉末。1H NMR (500 MHz, CDCl3) δ:12.98 (s, 1H, 2′-OH), 7.01 (s, 1H, H-5), 6.59 (s, 1H, H-3), 6.45 (s, 1H, H-5′), 6.06 (d, J=1.4 Hz, 1H, H-3′), 3.67 (s, 6H, H-9, H-8), 3.50 (s, 1H, 4-OH), 3.37 (s, 3H, H-7′), 2.29 (s, 3H, H-8′)。13C NMR (125 MHz, CDCl3) δ:199.9 (C-10), 166.4 (C-7), 164.4 (C-6′), 161.1 (C-2′), 157.2 (C-2), 156.6 (C-4), 148.3 (C-4′), 128.5 (C-6), 127.9 (C-1), 111.1 (C-1′), 110.5 (C-5′), 108.1 (C-5), 103.4 (C-3′), 103.1 (C-3), 56.3 (C-9), 55.8 (C-7′), 52.4 (C-8), 22.6 (C-8′)。以上核磁数据与Liu等[15]、张志杰等[18]报道的基本一致,该化合物鉴定为monomethylsulochrin。
化合物11:黄色固体粉末。1H NMR (500 MHz, CDCl3) δ:7.11 (d, J=1.5 Hz, 1H, H-2′), 6.55 (s, 1H, H-7), 6.37 (s, 1H, H-5), 5.77 (d, J=1.5 Hz, 1H, H-4′), 3.95 (s, 3H, 4-OCH3), 3.69 (s, 3H, 1′-COOCH3), 3.66 (s, 3H, 5′-OCH3), 2.44 (s, 3H, H-6a)。13C NMR (125 MHz, CDCl3) δ:190.6 (C-3), 185.8 (C-3′), 174.5 (C-7a), 169.6 (C-5′), 163.6 (1′-COOCH3), 158.5 (C-4), 152.3 (C-6), 138.4 (C-1′), 137.3 (C-2′), 108.5 (C-3a), 105.7 (C-7), 105.5 (C-5), 104.1 (C-4′), 84.0 (C-2), 56.9 (5′-OCH3), 56.2 (4-OCH3), 52.9 (1′-COOCH3), 23.3 (C-6a)。以上核磁数据与鲁春华等[19]报道的基本一致,该化合物鉴定为trypacidin。
2.2 抗菌活性为进一步了解烟曲霉GXIMD 00544次级代谢产物的抗菌活性,对其MIC进行测定(表 1)。烟曲霉酸类化合物1-4均具有较强的广谱抗菌活性。化合物1-4对海弧菌具有抑制作用,MIC分别为51.20、52.80、28.40、52.60 μg·mL-1。其中,化合物1、3、4对轮虫弧菌具有较强的抑制作用,MIC分别为6.40、7.10、13.15 μg·mL-1,与阳性对照药物活性相当。化合物1、3、4对MRSA也具有较强的抑制作用,MIC分别为5.12、5.68、2.63 μg·mL-1,与阳性对照氯霉素活性相当。
| Unit: μg·mL-1 | |||||||||||||||||||||||||||||
| 化合物 Compound |
耐甲氧西林金黄色葡萄球菌 MRSA |
海弧菌 V. pelagius |
轮虫弧菌 V.rotiferianus |
||||||||||||||||||||||||||
| 1 | 5.12 | 51.20 | 6.40 | ||||||||||||||||||||||||||
| 2 | 13.20 | 52.80 | 26.40 | ||||||||||||||||||||||||||
| 3 | 5.68 | 28.40 | 7.10 | ||||||||||||||||||||||||||
| 4 | 2.63 | 52.60 | 13.15 | ||||||||||||||||||||||||||
| 11 | 34.40 | - | - | ||||||||||||||||||||||||||
| Penicillin | 0.85 | 15.37 | 13.70 | ||||||||||||||||||||||||||
| Chloramphenicol | 3.54 | 4.36 | 6.87 | ||||||||||||||||||||||||||
3 讨论
烟曲霉酸是一类四环三萜类化合物,该类化合物具有较好的抗真菌、抗细菌活性。Zaman等[10]发现烟曲霉酸衍生物maunakeanolic acid A、maunakeanolic acid B对金黄色葡萄球菌均有抑制作用,MIC均为6.25 μmol·L-1,与本研究中的活性数据相当。Ávila-Hernández等[20]报道了3个烟曲酸类化合物,分别为16-O-propionyl-16-O-deacetylhelvolic acid、6-O-propionyl-6-O-deacetylhelvolic acid和helvolic acid,均对无乳链球菌(Steptococcus agalactiae)有抑制作用,MIC分别为16、2、8 μmol·L-1。本研究报道了烟曲霉酸类化合物maunakeanolic acid A (1)、6-deacytyl-1,2-dihydrohelvolic acid (2)、helvolic acid (3)、helvolinic acid (4)的抗海洋弧菌活性, 为高盐环境微生物的开发和利用提供了参考。
简单酚酸类化合物是含有一个或多个酚性羟基苯环的化合物,包括二苯醚、二苯酮、缩酚酸等,常见于植物和微生物,具有多种生物活性。Guo等[21]发现两个具有细胞毒性的酚酸类化合物,分别为chloroisosulochrin和pestalotether D,其中chloroisosulochrin对细胞株人类宫颈癌(HeLa)表现出适度的细胞毒性,IC50为35.2 μmol·L-1;pestalotether D对HeLa和人类乳腺癌细胞系(MCF-7)也有细胞毒性,IC50分别为60.8、22.6 μmol·L-1。本研究发现酚酸类化合物11对MRSA也有一定的抑制作用,但未进一步进行细胞毒性相关的研究。
4 结论本研究从一株北海竹林盐场来源烟曲霉GXIMD 00544中分离得到11个化合物,经鉴定分别为4个烟曲霉酸类化合物(1-4)以及7个酚酸类化合物(5-11),烟曲霉酸类化合物1-4均具有较强的广谱抗菌活性,对3株测试菌株均有抑制作用。
| [1] |
徐新亚, 杨宏, 宁小清, 等. 北部湾海洋微生物物种多样性与化学多样性研究进展[J]. 广西科学, 2020, 27(5): 433-450, 461. DOI:10.13656/j.cnki.gxkx.20201217.001 |
| [2] |
安昶亮, 孔凡栋, 马青云, 等. 海洋真菌Aspergillus sp. SCS-KFD66的次级代谢产物研究[J]. 中草药, 2019, 50(13): 3001-3007. DOI:10.7501/j.issn.0253-2670.2019.13.002 |
| [3] |
雷丹丹, 刘俊, 龙星美, 等. 内生菌Aspergillus terreus PC-038次生代谢产物中抗菌化学成分研究[J]. 化学试剂, 2021, 43(8): 1143-1150. |
| [4] |
冯婷, 孙建, 王玉妃, 等. 北部湾海洋真菌Aspergillus fumigatus DL-p0m-g2的化学成分及药理活性研究[J]. 热带海洋学报, 2024, 43(1): 154-166. |
| [5] |
王宇, 李占林, 白皎, 等. 海洋真菌烟曲霉Aspergillus fumigatus YK-7次级代谢产物的分离鉴定及抗肿瘤活性[J]. 中国药物化学杂志, 2017, 27(5): 382-387. |
| [6] |
陈显强, 邢楠楠, 黄亮华, 等. 嗜盐真菌多样性及其抗肿瘤活性研究[J]. 广西科学, 2020, 27(5): 526-531. DOI:10.13656/j.cnki.gxkx.20201231.01 |
| [7] |
李海艳, 陆春菊, 张耿思, 等. 北海竹林盐场极端嗜盐真菌的多样性及其抑菌活性研究[J]. 广西科学, 30(3): 478-484. DOI:10.13656/j.cnki.gxkx.20230710.006 |
| [8] |
WANG J M, QIN Y N, LIN M P, et al. Marine natural products from the Beibu Gulf: sources, chemistry, and bioactivities[J]. Marine Drugs, 2023, 21(2): 63. DOI:10.3390/md21020063 |
| [9] |
陆春菊, 陆玫霖, 刘昕明, 等. 广西涠洲岛柳珊瑚共附生真菌多样性及其抑菌活性[J]. 热带海洋学报, 2021, 40(5): 45-52. |
| [10] |
ZAMAN K A U, HU Z Q, WU X H, et al. NF-κB inhibitory and antibacterial helvolic and fumagillin derivatives from Aspergillus terreus[J]. Journal of Natural Products, 2020, 83(3): 730-737. DOI:10.1021/acs.jnatprod.9b01190 |
| [11] |
孙世伟, 付娟, 周会楠, 等. 红树林来源黑曲霉Aspergillus niger ZHN2-20次级代谢产物的研究[J]. 中国海洋药物, 2014, 33(6): 1-7. |
| [12] |
ZHANG Z B, DU S Y, JI B, et al. New helvolic acid derivatives with antibacterial activities from Sarocladium oryzae DX-THL3, an endophytic fungus from Dongxiang wild rice (Oryza rufipogon Griff.)[J]. Molecule, 2021, 26(7): 1828. DOI:10.3390/molecules26071828 |
| [13] |
XIE F, LI X B, ZHOU J C, et al. Secondary metabolites from Aspergillus fumigatus, an endophytic fungus from the liverwort Heteroscyphus tener (Steph.) Schiffn[J]. Chemistry & Biodiversity, 2015, 12(9): 1313-1321. |
| [14] |
LEE H J, LEE J H, HWANG B Y, et al. Fungal metabolites, asterric acid derivatives inhibit vascular endothelial growth factor (VEGF)-induced tube formation of HUVECs[J]. The Journal of Antibiotics, 2002, 55(6): 552-556. DOI:10.7164/antibiotics.55.552 |
| [15] |
LIU R, ZHU W M, ZHANG Y P, et al. A new diphenyl ether from marine-derived fungus Aspergillus sp. B-F-2[J]. The Journal of Antibiotics, 2006, 59(6): 362-365. DOI:10.1038/ja.2006.52 |
| [16] |
HAMASAKI T, KIMURA Y. Isolation and structures of four new metabolites from Aspergillus wentii[J]. Agricultural and Biological Chemistry, 1983, 47(1): 163-165. |
| [17] |
OHASHI H, ISHIKAWA M, ITO J, et al. Sulochrin inhibits eosinophil degranulation[J]. The Journal of Antibiotics, 1997, 50(11): 972-974. DOI:10.7164/antibiotics.50.972 |
| [18] |
张志杰, 屈凌波, 周雨朦, 等. 植物内生真菌SIPI3.0550的分类鉴定及代谢产物研究[J]. 中国新药杂志, 2010, 19(16): 1402-1406. |
| [19] |
鲁春华, 黄耀坚, 沈月毛. 真菌Aspergillus fumigatus var. fumigatus的次生代谢产物[J]. 中国天然药物, 2005, 3(5): 269-271. |
| [20] |
ÁVILA-HERNÁNDEZ J G, AGUILAR-ZÁRATE P, CARRILLO-INUNGARAY M L, et al. The secondary metabolites from Beauveria bassiana PQ2 inhibit the growth and spore germination of Gibberella moniliformis LIA[J]. Brazilian Journal of Microbiology, 2022, 53(1): 143-152. DOI:10.1007/s42770-021-00668-z |
| [21] |
GUO L F, LIN J, NIU S B, et al. Pestalotiones A-D: four new secondary metabolites from the plant endophytic fungus Pestalotiopsis theae[J]. Molecules, 2020, 25(3): 470. DOI:10.3390/molecules25030470 |



