2. 中国科学院南海海洋研究所,热带海洋生物资源与生态重点实验室,广东广州 510301
2. Key Laboratory of Tropical Marine Bio-Resources and Ecology, South China Sea Institute of Oceanography, Chinese Academy of Sciences, Guangzhou, Guangdong, 510301, China
海洋栖息地由于其独特的环境条件和广阔的地域,孕育着比陆地环境更为丰富的生物资源。海洋生物物种的多样性为开发结构独特、活性优良的天然产物提供了丰富的资源基础[1]。近年来,海洋天然产物在药物开发中的应用取得了新的突破,已有20种海洋来源的药物正在被临床使用[2]。因此,海洋来源共附生真菌产生的次级代谢产物是具有发展潜力的药物研发对象。北部湾是位于南海西北部的一个半封闭海湾,是全球生物多样性中心,也是海洋生物多样性中心[3]。珊瑚是生物多样性最高的珊瑚礁的主要组成部分,其组织、骨骼和黏液中有着高度多样和丰富的微生物共生体,是具有物种特异性的核心成员[4]。研究北部湾珊瑚对维护区域海洋生态系统平衡、保护生物多样性以及开发新型海洋药物资源具有重要的科学价值和实践意义。枝孢菌属(Cladosporium sp.)真菌是一类资源丰富的真菌,其次生代谢产物中化学成分结构类型多样、生物活性突出,包括生物碱类、聚酮类、大环内酯类、甾体和萜类等化合物,具有抗菌、抗病毒和抗细胞毒等生物活性[5],为候选药物分子库提供了重要来源。Silber等[6]从一株海洋枝孢菌属中分离出4个马来他汀化合物A-D,其对人致病性真菌红色毛癣菌(Trichophyton rubrum)均具有中等的生物活性,半数抑制浓度(IC50)值为28.3-37.9 μmol/L;Zhu等[7]从海洋来源枝孢菌属真菌中分离出一种新的杂交聚酮类物质cladodien,其对MCF-7、HeLa、HCT-116和HL-60人癌细胞株具有细胞毒活性,IC50值分别为18.7、19.1、17.9、9.1 μmol/L;Gu等[8]运用高速逆流色谱法从一株海洋来源枝孢菌属真菌中分离出3个含硫的二酮哌嗪类化合物,均表现出抑制肝癌HepG2细胞增殖的作用。目前,国内外对北部湾来源的枝孢菌属真菌的相关报道较少。因此,本研究基于单菌多次级代谢产物(OSMAC)策略对一株北部湾珊瑚共附生真菌Cladosporium sp. SCSIO41206的次级代谢产物进行挖掘和探索,旨在丰富北部湾来源真菌次级代谢产物的多样性以及发掘具有药物开发潜力的活性分子,为新药创制奠定物质基础。
1 材料与方法 1.1 菌株来源菌株(图 1)采集于广西北部湾地区,保存于中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室。

|
| 图 1 菌株Cladosporium sp. SCSIO41206 Fig. 1 Strain Cladosporium sp. SCSIO41206 |
1.2 菌株鉴定
将菌株样品进行DNA提取,使用ITS (Internal Transcribed Spacer)通用引物进行扩增测序,将测序结果与美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中的结果进行比对,鉴定该菌株为枝孢菌属(Cladosporium sp.),与Cladosporium oxysporum同源性达100%,编号为SCSIO41206。
1.3 仪器与试剂旋转蒸发仪(EYELAN-1100V-W型,日本东京理化器械株式会社),核磁共振波谱仪(AV500型、AV600型、AV-700型,德国Bruker公司),半制备高效液相色谱仪(半制备HPLC,HITACHI L-2400型,ChromCore 120 C18,5 μmol/L,10×250 mm,日本日立公司),超净工作台(ZYJ-S型,苏州净化设备有限公司),中压制备色谱仪(C615/605型,瑞士Buchi公司),高分辨电喷雾电离质谱(德国Brucker公司),96孔细胞培养板(美国Corning公司);葡聚糖凝胶(Sephadex LH-20,美国Pharmacia公司);他克林(Tacrine,批号Lot#07220AV,美国Aldrich公司);奥利司他(Orlistat,批号Lot#C14422849,山东科源生化有限公司)。
薄层色谱硅胶(青岛海洋化工有限公司),正相硅胶(100-200目、300-400目,烟台江友硅胶开发有限公司),反相硅胶(Spherical C18,20-45 μm,常州三泰科技有限公司),马铃薯葡萄糖肉汤(PDB)干粉培养基(广东环凯微生物科技有限公司),乙酸乙酯(广州化学试剂厂)、甲醇(天津市富宇精细化工有限公司)均为分析纯,甲酸(上海麦克林生化科技股份有限公司)。
1.4 菌株活化和发酵菌株活化和种子液发酵培养步骤参照文献[9]。首先菌株从保藏在4 ℃的MB斜面培养基(配方:麦芽提取粉15 g,粗海盐24 g,琼脂15 g,蒸馏水1 L,pH值7.0)试管中(每个试管倒入20 mL)接种至MB平板培养基(配方: 麦芽提取粉15 g,粗海盐24 g,琼脂15 g,蒸馏水1 L,pH值7.0)中活化,每个灭菌平板倒入25 mL;然后接种至MB液体培养基(配方:麦芽提取粉15 g,粗海盐24 g,蒸馏水1 L,pH值7.0)中发酵;最后在28 ℃、180 r/min的摇床中培养即获得种子培养液。将培养好的种子液分别接种至200瓶已灭菌的PDB液体培养基(配方:PDB培养基干粉4.8 g,200 mL纯水)中,于25 ℃静置培养30 d。
1.5 菌株提取与分离在含有菌株的PDB液体培养基中加入同等体积的乙酸乙酯超声30 min (40 kHz、360 W),使菌株中的次级代谢产物被萃取到乙酸乙酯层,经浸泡过夜后重复提取5次,浓缩后得到乙酸乙酯相浸膏28.5 g。粗提物浸膏采用中压正相硅胶柱进行分离,用300-400目的硅胶拌样,梯度洗脱的溶剂体系为V石油醚∶V乙酸乙酯=100∶0-9∶1-4∶1-3∶1-2∶1-1∶1,V石油醚∶V乙酸乙酯∶V甲醇=20∶20∶1-10∶10∶1-5∶5∶1-3∶3∶1-2∶2∶1-0∶0∶100,流速为100 mL·min-1,每个梯度需洗脱4个柱体积,再通过薄层层析点板进行分析,合并得到7个流分Fr 1-Fr 7。
亚组分Fr 4.2(156.8 mg)经半制备HPLC(V甲醇∶V酸水=16∶84,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到化合物8 (46.01 mg,tR=9 min)。Fr 5 (1.2 g)经半制备HPLC (V甲醇∶V酸水=18∶82,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到化合物1 (43.25 mg,tR=15 min)和化合物2 (27 mg,tR=18 min)。其中,亚组分Fr 5.3(18.8 mg)经半制备HPLC (V甲醇∶V酸水=20∶80,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到化合物5 (2.01 mg,tR=7.5 min)、化合物6 (2.17 mg,tR=9 min)和化合物7 (2.73 mg,tR=12 min);亚组分Fr 5.2(10 mg)经半制备HPLC (V甲醇∶V酸水=20∶80,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到化合物9 (3.31 mg,tR=8.6 min)。流分Fr 6经中压制备柱色谱仪中Sepaflash色谱柱,用20%、40%、60%、80%和100%的甲醇-水体系进行梯度洗脱,合并为6个组分Fr 6.1-Fr 6.6。Fr 6.1 (200 mg)经半制备HPLC (V甲醇∶V酸水=60∶40,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到Fr 6.1.2和化合物4 (34.79 mg,tR=12 min);将亚组分Fr 6.1.2 (72.1 mg)再经半制备HPLC (V甲醇∶V酸水=50∶50,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到化合物3 (21.49 mg,tR=15 min);Fr 7(500 mg)经半制备HPLC (V乙腈∶V酸水=40∶60,含甲酸量为0.04%,流速为3 mL·min-1)纯化后得到化合物10 (2.78 mg,tR=10 min)和化合物11 (2.45 mg,tR=10.5 min)。
1.6 活性测试 1.6.1 乙酰胆碱酶抑制活性参照Ellman等[10]和蔡健等[11]的方法评价化合物对乙酰胆碱酯酶的抑制活性。分别设置实验组、阴性对照组、阳性对照组、背景对照组、空白对照组,每组设置3个复孔,以二甲基亚砜(DMSO)作为阴性对照,他克林(Tacrine)作为阳性对照,浓度均配制为1 mg/mL。在96孔板中,实验组中加入10 μL化合物溶液、110 μL pH值为8.0的PBS缓冲溶液和40 μL 0.1 U/mL (200 U=1 g)的乙酰胆碱酯酶溶液;阴性对照组中加入10 μL 2% DMSO的PBS溶液、110 μL pH值为8.0的PBS缓冲溶液和40 μL 0.1 U/mL的乙酰胆碱酯酶溶液;阳性对照组加入10 μL 6.66 μmol/L他克林溶液、110 μL pH值为8.0的PBS缓冲溶液和40 μL 0.1 U/mL的乙酰胆碱酯酶溶液;背景对照组中加入10 μL化合物溶液和150 μL pH值为8.0的PBS缓冲溶液;空白对照组加入10 μL 2% DMSO的PBS溶液和150 μL pH值为8.0的PBS缓冲溶液。将96孔板置于30 ℃烘箱中孵育20 min,然后向各组加入40 μL等体积混合的、物质的量浓度为6.25 mmol/L的5, 5-二硫代双(2-硝基苯甲酸)溶液和硫代乙酰胆碱溶液,再次将96孔板置于30 ℃烘箱中孵育30 min,于405 nm波长下测定每孔的光密度(OD)值,并计算化合物对乙酰胆碱酯酶的抑制活性。抑制率(M1,%)的计算公式如下:
| $ \begin{aligned} \;\;\;\;M_1 & =\frac{\left(\mathrm{B}_{O D_{405}}-\mathrm{A}_{O D_{405}}\right)-\left(\mathrm{D}_{O D_{405}}-\mathrm{C}_{O D_{405}}\right)}{\mathrm{B}_{O D_{405}}-\mathrm{A}_{O D_{405}}} \times \\ 100 \% & \end{aligned} $ |
式中,A为空白对照组,B为阴性对照组,C为背景对照组,D为实验组。
1.6.2 胰脂肪酶抑制活性参照Abdallah等[12]的实验步骤对化合物的胰脂肪酶抑制活性进行评价。分别采用DMSO和奥利司他(Orlistat)作为阴性对照和阳性对照,浓度均为1 mg·mL-1。在96孔板中,实验组中加入50 μL 2.5 mg·mL-1的胰脂肪酶溶液和10 μL的化合物溶液;背景对照组中加入50 μL pH值为8.4的Tris-HCl缓冲溶液和10 μL的化合物溶液;阴性对照组中加入50 μL胰脂肪酶溶液和10 μL DMSO;空白对照组中加入50 μL pH值为8.4的Tris-HCl缓冲溶液和10 μL DMSO,每组设置3个复孔,于37 ℃烘箱中孵育10 min后,均加入130 μL的助溶剂和10 μL 1.89 mg·mL-1的对硝基苯棕榈酸酯溶液,再放置于37 ℃烘箱中孵育10 min, 于405 nm波长下测定每孔的OD值,并计算化合物对胰脂肪酶的抑制活性。抑制率(M2,%)的计算公式如下:
| $ M_2=\frac{1-\left(\mathrm{B}_{O D_{405}}^{\prime}-\mathrm{A}_{O D_{405}}^{\prime}\right)}{\mathrm{C}_{O D_{405}}^{\prime}-\mathrm{D}_{O D_{405}}^{\prime}} \times 100 \%, $ |
式中,A′为实验组,B′为背景对照组,C′为阴性对照组,D′为空白对照组。
1.6.3 抗菌活性采用K-B圆盘琼脂扩散法[13]测定化合物1-11对金黄色葡萄球菌(Staphylococcus aureus,ATCC 29213)、粪肠球菌(Enterococcus faecalis,ATCC 29212)、肺炎克雷伯菌(Klebsiella pneumoniae,ATCC 13883)、大肠杆菌(Escherichia coli,ATCC 25922)和耐甲氧西林金黄色葡萄球菌(Methicillin- Resistant Staphylococcus aureus,MRSA) 5种病原菌的抑菌活性,其中以氨苄西林和庆大霉素分别作为革兰氏阳性菌和革兰氏阴性菌的阳性对照。
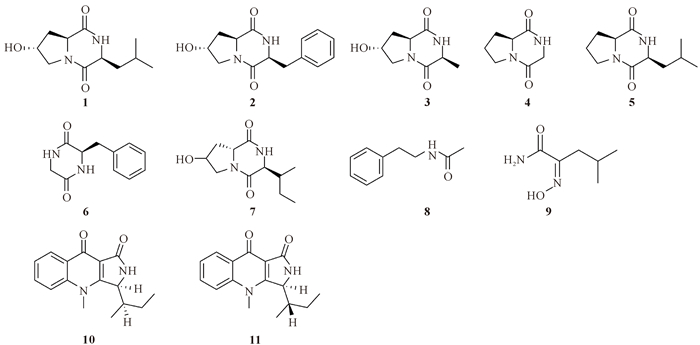
2 结果与分析 2.1 化合物结构从北部湾珊瑚共附生真菌Cladosporium sp. SCSIO41206次级代谢产物中共分离鉴定出11个化合物,结构如图 2所示。
|
| 图 2 化合物1-11的结构式 Fig. 2 Structures of compounds 1-11 |
2.2 化合物结构鉴定结果
化合物1:白色粉末,43.25 mg。ESI-MS m/z:227.5 [M+H]+。1H-NMR (500 MHz, DMSO-d6)δ: 8.00 (1H, s, 2-NH), 5.13 (1H, s, 7-OH), 4.39 (1H, dd, J=10.7, 6.6 Hz, H-7), 4.28 (1H, t, J=4.4 Hz, H-3), 4.07-4.02 (1H, m, H-9), 3.48 (1H, dd, J=12.4, 4.4 Hz, H-6a), 3.23 (1H, d, J=12.4 Hz, H-6b), 2.04 (1H, ddt, J=13.1, 6.7, 1.6 Hz, H-8a), 1.90 (2H, dddd, J=25.5, 12.7, 9.5, 5.3 Hz, H-10), 1.34 (1H, ddd, J=13.7, 7.5, 5.9 Hz, H-8b), 0.87 (3H, d, J=3.5 Hz, H-12), 0.85 (3H, d, J=3.6 Hz, H-13);13C-NMR (125 MHz, DMSO-d6) δ: 170.8 (C-4), 166.7 (C-1), 67.1 (C-7), 57.1 (C-9), 53.8 (C-6), 52.6 (C-3), 37.8 (C-10), 36.7 (C-8), 24.1 (C-11), 22.9 (C-13), 21.9 (C-12)。以上数据与文献[14-15]报道一致,故鉴定化合物1结构为3-isobutylhexahydropyrrolo (1,2-a) pyrazine-1,4-dione。
化合物2:白色粉末,27 mg。ESI-MS m/z:261.6 [M+H]+。1H-NMR (500 MHz, DMSO-d6)δ: 7.99 (1H, s, 4-OH), 7.29-7.23 (4H, m, H-2′, 3′, 5′, 6′), 7.20-7.16 (1H, m, H-4′), 5.10 (1H, s, 8-NH), 4.40 (1H, t, J=5.2 Hz, H-4), 4.31 (1H, ddd, J=11.3, 6.3, 1.6 Hz, H-6), 4.19 (1H, t, J=4.7 Hz, H-9), 3.52 (1H, dd, J=12.5, 4.8 Hz, H-3), 3.16 (1H, d, J=12.5 Hz, H-3), 3.11-2.97 (2H, m, H-10), 1.94 (1H, ddt, J=13.0, 6.4, 1.5 Hz, H-5), 1.52 (1H, ddd, J=12.8, 11.2, 4.5 Hz, H-5);13C-NMR (125 MHz, DMSO-d6) δ: 169.6 (C-1), 165.3 (C-7), 137.3 (C-1′), 129.8 (C-2′, C-6′), 128.0 (C-3′, 5′), 126.4 (C-4′), 66.8 (C-4), 57.0 (C-6), 55.7 (C-9), 53.9 (C-3), 37.2 (C-5), 35.2 (C-10)。以上数据与文献[15]报道一致,故鉴定化合物2结构为3-benzyl-7-hydroxyhexahydropyrrolo (1,2-a) pyrazine-1,4-dione。
化合物3:无色针状结晶,21.49 mg。ESI-MS m/z:185.3 [M+H]+。1H-NMR (500 MHz, DMSO-d6) δ: 8.14 (1H, s, 4-NH), 5.10 (1H, s, 8-OH), 4.37 (1H, ddd, J=11.0, 6.6, 1.5 Hz, H-6), 4.28 (1H, t, J=4.4 Hz, H-8), 4.17-4.08 (1H, m, H-3), 3.50 (1H, dd, J=12.4, 4.5 Hz, H-9), 3.22 (1H, d, J=12.4 Hz, H-9), 2.04 (1H, ddt, J=13.0, 6.6, 1.5 Hz, H-7), 1.91 (1H, ddd, J=12.9, 10.9, 4.3 Hz, H-7), 1.21 (3H, d, J=6.9 Hz, H-10);13C-NMR (125 MHz, DMSO-d6) δ: 170.4 (C-2), 166.7 (C-5), 67.1 (C-8), 57.3 (C-3), 53.8 (C-7), 50.1 (C-6), 36.9 (C-9), 15.3 (C-10)。以上数据与文献[16]报道一致,故鉴定化合物3结构为环(L-丙氨酸-L-4-羟基-脯氨酸)二肽。
化合物4:无色针状结晶,34.79 mg。ESI-MS m/z:155.2 [M+H]+。1H-NMR (500 MHz, DMSO-d6) δ: 8.06 (1H, s, 7-NH), 4.15-4.08 (1H, m, H-3), 3.99 (1H, dd, J=16.4, 1.8 Hz, H-3), 3.50 (1H, dd, J=16.4, 4.5 Hz, H-7), 3.41 (1H, dt, J=11.3, 7.7 Hz, H-5), 3.33 (1H, ddd, J=11.6, 8.2, 3.3 Hz, H-5), 2.16-2.10 (1H, m, H-3), 1.89-1.75 (2H, m, H-4);13C-NMR (125 MHz, DMSO-d6) δ: 169.3 (C-1), 163.9 (C-6), 58.0 (C-2), 45.9 (C-5), 44.7 (C-7), 27.9 (C-3), 22.1 (C-4)。以上数据与文献[17]报道一致,故鉴定化合物4结构为环(L-脯氨酸-甘氨酸)二肽。
化合物5:白色固体,2.01 mg。ESI-MS m/z:211.1 [M+H]+。1H-NMR (600 MHz, DMSO-d6) δ: 7.96 (1H, s, 8-NH), 4.11 (1H, td, J=7.1, 6.6, 3.6 Hz, H-6), 3.92 (1H, s, H-9), 2.34 (1H, pd, J=7.1, 2.5 Hz, H-10), 2.16-2.11 (1H, m, H-5), 1.90-1.74 (2H, m, H-4), 1.01 (3H, d, J=7.2 Hz, H-12), 0.85 (3H, d, J=6.9 Hz, H-13);13C-NMR (150 MHz, DMSO-d6) δ: 170.3 (C-1), 165.3 (C-7), 59.5 (C-6), 58.3 (C-9), 44.6 (C-3), 27.9 (C-10), 27.7 (C-5), 22.1 (C-4), 18.3 (C-13), 16.4 (C-12)。以上数据与文献[15]报道一致,故鉴定化合物5结构为cyclo(D)-Pro-(D)-Ile。
化合物6:白色固体,2.17 mg。ESI-MS m/z:204.1 [M+H]+。1H-NMR (600 MHz, DMSO-d6) δ: 8.15 (1H, d, J=2.7 Hz, 5-NH), 7.89 (1H, s, 2-NH), 7.30-7.23 (3H, m, H-2′, 4′, 6′), 7.18-7.15 (2H, m, H-3′, 5′), 4.06 (1H, q, J=4.2, 3.1 Hz, H-6), 3.09 (1H, dd, J=13.5, 4.5 Hz, H-7), 2.88 (1H, dd, J=13.5, 5.0 Hz, H-7), 2.76 (1H, d, J=17.3 Hz, H-3);13C-NMR (150 MHz, DMSO-d6) δ: 167.6 (C-1), 166.1 (C-4), 136.4 (C-1′), 130.5 (C-2′), 128.6 (C-3′), 127.2 (C-4′), 56.0 (C-5), 44.1 (C-3), 40.5 (C-7)。以上数据与文献[18]报道一致,故鉴定化合物6结构为环(L-苯丙-甘)二肽。
化合物7:白色固体,2.73 mg。ESI-MS m/z:226.13 [M+H]+。1H-NMR (600 MHz, DMSO-d6) δ: 7.96 (1H, s, 8-NH), 4.32 (1H, ddd, J=11.2, 6.3, 1.7 Hz, H-6), 4.28 (1H, t, J=4.4 Hz, H-4), 4.00 (1H, s, H-9), 3.52 (1H, dd, J=12.5, 4.6 Hz, H-3), 3.21 (1H, d, J=12.5 Hz, H-3), 2.03 (2H, dddd, J=18.7, 9.5, 5.4, 1.9 Hz, H-5 and H-10), 1.88 (1H, ddd, J=12.9, 11.2, 4.4 Hz, H-5), 1.34 (1H, dtd, J=15.1, 7.5, 4.5 Hz, H-11), 1.29-1.22 (1H, m, H-11), 0.98 (3H, d, J=7.1 Hz, H-13), 0.82 (3H, t, J=7.4 Hz, H-12);13C-NMR (150 MHz, DMSO-d6) δ: 170.5 (C-7), 165.4 (C-1), 66.9 (C-4), 59.1 (C-9), 56.7 (C-6), 53.8 (C-3), 37.2 (C-5), 34.8 (C-10), 23.9 (C-11), 15.0 (C-13), 12.3 (C-12)。以上数据与文献[19]报道一致,故鉴定化合物7结构为cyclo-(4-S-hydroxy-R-proline-R-isoleucine)。
化合物8:棕色油状,46.01 mg。ESI-MS m/z:164.2 [M+H]+。1H-NMR (500 MHz, DMSO-d6) δ: 7.93 (1H, s, NH), 7.32-7.25 (2H, m, H-3, 5), 7.20 (3H, d, J=7.4 Hz, H-2, 4, 6), 3.28-3.23 (2H, m, H-8), 2.70 (1H, t, J=7.5 Hz, H-7), 1.79 (3H, s, H-10);13C-NMR (125 MHz, DMSO-d6) δ: 169.2 (C-9), 139.6 (C-1), 128.6 (C-3, 5), 128.3 (C-2, 6), 126.1 (C-4), 40.3 (C-8), 35.2 (C-7), 22.6 (C-10)。以上数据与文献[20]报道一致,故鉴定化合物8结构为N-phenethylacetamide。
化合物9:白色固体,3.31 mg。ESI-MS m/z:114.09 [M+H]+。1H-NMR (600 MHz, DMSO-d6) δ: 11.53 (1H, s, 2-N-OH), 7.15 (2H, d, J=75.5 Hz, 1-NH), 2.35 (2H, d, J=7.4 Hz, H-3), 1.91 (1H, hept, J=6.9 Hz, H-4), 0.83 (6H, d, J=6.7 Hz, H-5, 6);13C-NMR (150 MHz, DMSO-d6) δ: 165.9 (C-1), 153.4 (C-2), 31.6 (C-3), 25.9 (C-4), 22.7 (C-5, 6)。以上数据与文献[21]报道一致,故鉴定化合物9结构为N-hydroxy-2-(hydroxyimino)-4-methylpentanamide。
化合物10:黄色油状,2.45 mg。ESI-MS m/z:271.1 [M+H]+。1H-NMR (500 MHz, DMSO-d6) δ: 8.26 (1H, d, J=7.7 Hz, H-8), 7.83(2H, d, J=1.7 Hz, H-5, 6), 7.49 (1H, t, J=8.0 Hz, H-7), 4.91 (1H, s, H-3), 3.85 (3H, s, N-CH3), 2.18 (1H, tt, J=7.1, 3.6 Hz, H-1′), 1.28-1.20 (2H, m, H-2′), 1.01 (3H, t, J=7.4 Hz, H-2′-CH3), 0.44 (3H, d, J=6.9 Hz, H-1′-CH3); 13C-NMR (125 MHz, DMSO-d6) δ: 171.6 (C-9), 168.5 (C-1), 164.2 (C-3a), 141.3 (C-4a), 132.6 (C-6), 128.0 (C-8a), 125.9 (C-8), 124.4 (C-7), 117.2 (C-5), 110.3 (C-9a), 56.9 (C-3), 36.1 (N-CH3), 35.7 (C-1′), 27.3 (C-2′), 12.0 (2′-CH3), 11.5 (1′-CH3)。以上数据与文献[22-23]报道一致,故鉴定化合物10结构为quinolactacin A1。
化合物11:黄色油状,2.45 mg。ESI-MS m/z:271.1 [M+H]+。1H-NMR (500 MHz, DMSO-d6) δ: 8.26 (1H, d, J=7.7 Hz, H-8), 7.83 (2H, d, J=1.7 Hz, H-5, 6), 7.49 (1H, t, J=8.0 Hz, H-7), 4.83 (1H, s, H-3), 3.82 (3H, s, N-CH3), 2.18 (1H, tt, J=7.1, 3.6 Hz, H-1′), 1.13 (3H, d, J=6.9 Hz, H-1′-CH3), 0.86 (2H, td, J=7.3, 2.8 Hz, H-2′), 0.66 (3H, t, J=7.4 Hz, H-2′-CH3); 13C-NMR (125 MHz, DMSO-d6) δ: 171.6 (C-9), 168.7 (C-1), 164.6 (C-3a), 141.3 (C-4a), 132.6 (C-6), 128.0 (C-8a), 125.9 (C-8), 124.4 (C-7), 117.2 (C-5), 110.3 (C-9a), 59.0 (C-3), 36.1 (N-CH3), 35.8 (C-1′), 20.9 (C-2′), 17.6 (1′-CH3), 11.6 (2′-CH3)。以上数据与文献[22-23]报道一致,故鉴定化合物11结构为quinolactacin A2。
2.3 活性测试结果 2.3.1 乙酰胆碱酯酶抑制活性化合物对乙酰胆碱酯酶抑制活性的评价结果如表 1所示。当化合物终浓度为0.05 μg·μL-1时,化合物2、3、4、8、10和11对乙酰胆碱酯酶的抑制率分别为17.45%、18.93%、13.97%、14.13%、16.78%和32.30%,具有弱的抑制活性。当化合物终浓度为6.60×10-5μg·μL-1时,阳性对照药物他克林对乙酰胆碱酯酶的抑制率为72.20%。
| Unit: % | |||||||||||||||||||||||||||||
| 化合物 Compound |
抑制率 Inhibition rate |
化合物 Compound |
抑制率 Inhibition rate |
||||||||||||||||||||||||||
| 1 | 2.29 | 7 | 7.33 | ||||||||||||||||||||||||||
| 2 | 17.45 | 8 | 14.13 | ||||||||||||||||||||||||||
| 3 | 18.93 | 9 | 9.21 | ||||||||||||||||||||||||||
| 4 | 13.97 | 10 | 16.78 | ||||||||||||||||||||||||||
| 5 | 4.13 | 11 | 32.30 | ||||||||||||||||||||||||||
| 6 | 5.67 | ||||||||||||||||||||||||||||
2.3.2 胰脂肪酶抑制活性
化合物对胰脂肪酶抑制活性的评价结果如表 2所示。当化合物终浓度为0.05 μg·μL-1时,化合物4、8对胰脂肪酶具有较弱的抑制活性;化合物1-3、5、7、9-11对胰脂肪酶具有弱的抑制活性;化合物6对胰脂肪酶具有中等的抑制活性。当化合物终浓度为1.24×10-4 μg·μL-1时,阳性对照药物奥利司他对胰脂肪酶的抑制率为94.37%。
| Unit: % | |||||||||||||||||||||||||||||
| 化合物 Compound |
抑制率 Inhibition rate |
化合物 Compound |
抑制率 Inhibition rate |
||||||||||||||||||||||||||
| 1 | 12.47 | 7 | 18.59 | ||||||||||||||||||||||||||
| 2 | 29.34 | 8 | 9.40 | ||||||||||||||||||||||||||
| 3 | 12.27 | 9 | 14.45 | ||||||||||||||||||||||||||
| 4 | 3.71 | 10 | 24.47 | ||||||||||||||||||||||||||
| 5 | 29.51 | 11 | 33.39 | ||||||||||||||||||||||||||
| 6 | 42.45 | ||||||||||||||||||||||||||||
2.3.3 抗菌活性
对分离得到的11个化合物进行抑菌活性筛选,发现化合物1-11对金黄色葡萄球菌、粪肠球菌、肺炎克雷伯菌、大肠杆菌和耐甲氧西林金黄色葡萄球菌等5种致病菌均无抑制活性。
3 讨论北部湾虽然具有丰富的海洋微生物资源,但是相关研究起步较晚,目前对北部湾海洋微生物的新物种、新基因、新化学成分的研究还处于早期阶段[24]。为填补这一研究空白并挖掘北部湾特色海洋微生物资源,本研究对北部湾珊瑚来源的共附生真菌Cladosporium sp. SCSIO41206的次级代谢产物进行挖掘和探索,共分离得到11个生物碱类化合物,经文献检索证实,这些化合物均为首次从北部湾珊瑚共附生真菌中分离获得,为海洋微生物资源的药物开发提供了新的候选分子。
邢楠楠等[25]、Chen等[26]研究发现2,5-二酮哌嗪六元环是一种重要的药效基团,含有该药效基团的化合物不仅表现出良好的生物活性,还因其结构稳定性和可修饰性而具备显著的药物开发潜力。本研究中化合物1-7含有该药效基团,可作为创新药物候选分子或先导化合物进行后续的构效关系研究和结构优化。据已有文献报道,该类化合物对乙酰胆碱酯酶和胰脂肪酶具有抑制活性[27-30]。乙酰胆碱酯酶作为神经系统中关键的代谢酶,其主要通过高效水解神经递质乙酰胆碱,从而终止神经冲动的传递,对细胞和神经元的发育具有关键作用,并能确保神经信号在生物体内高效传递。本研究发现,化合物2-4、8、10、11对乙酰胆碱酯酶有弱的抑制活性,其中化合物11对乙酰胆碱酯酶的抑制活性明显强于化合物10。值得注意的是,化合物10与化合物11是一对仅在C-12位构型不同的非对映异构体,这表明C-12位的立体构型可能对乙酰胆碱酯酶的抑制活性具有重要影响。胰脂肪酶又称三酰基甘油酰基水解酶,负责水解胃肠道中50%-70%的膳食脂肪,是预防和治疗肥胖的关键蛋白[31]。本研究对分离得到的11个化合物进行胰脂肪酶抑制活性测试,其中化合物6的抑制活性强于其他化合物,可能是由于化合物6形成的2,5-二酮哌嗪结构只由丙氨酸形成,分子量较该类型其他化合物(1-5、7)小,从而表现出更高的反应活性和特定的构象稳定性。此外,本研究对11个化合物进行5种致病菌的抗菌活性筛选,结果发现所有化合物并未筛查到抑菌活性。本研究丰富了北部湾珊瑚来源枝孢菌属次级代谢产物的多样性,为肥胖症药物先导化合物的发现奠定了理论基础。
4 结论本研究以北部湾珊瑚来源共附生真菌Cladosporium sp. SCSIO41206为研究对象,通过系统分析其次级代谢产物,成功分离鉴定出11个新型小分子化合物,包括环二肽类及喹啉类生物碱,这些化合物均为首次从北部湾珊瑚来源枝孢菌属中分离获得。活性测试结果表明,化合物2-4、8、10和11对乙酰胆碱酯酶有弱的抑制活性;化合物4、8对胰脂肪酶具有较弱的抑制活性,化合物1-3、5、7、9-11对胰脂肪酶有弱的抑制活性,化合物6对胰脂肪酶具有中等的抑制活性;所有化合物均未有抑菌活性。本研究通过系统分析北部湾珊瑚来源枝孢菌属的次级代谢产物,不仅拓展了该属真菌天然产物的结构多样性谱系,更深入揭示了其生物活性特征,为开发新型药物先导化合物提供了重要的资源基础和理论依据。
| [1] |
SONG C G, YANG J, ZHANG M Z, et al. Marine natural products: the important resource of biological insecticide[J]. Chemistry & Biodiversity, 2021, 18(5): e2001020.. |
| [2] |
HAQUE N, PARVEEN S, TANG T T, et al. Marine natural products in clinical use[J]. Marine Drugs, 2022, 20(8): 528. DOI:10.3390/md20080528 |
| [3] |
WANG W Q, TANG K H, WANG P X, et al. The coral pathogen Vibrio coralliilyticus kills non-pathogenic holobiont competitors by triggering prophage induction[J]. Nature Ecology & Evolution, 2022, 6(8): 1132-1144. |
| [4] |
CHEN Y, PANG X Y, HE Y C, et al. Secondary metabolites from coral-associated fungi: source, chemistry and bioactivities[J]. Journal of Fungi, 2022, 8(10): 1043. DOI:10.3390/jof8101043 |
| [5] |
董锦润, 李靖, 陈玉惠, 等. 枝孢属真菌次生代谢产物中化学成分及其生物活性的研究进展[J]. 中草药, 2021, 52(19): 6076-6087. |
| [6] |
SILBER J, OHLENDORF B, LABES A, et al. Malettinin E, an antibacterial and antifungal tropolone produced by a marine Cladosporium strain[J]. Frontiers in Marine Science, 2014, 1: 35. |
| [7] |
ZHU G L, KONG F D, WANG Y, et al. Cladodionen, a cytotoxic hybrid polyketide from the marine-derived Cladosporium sp. OUCMDZ-1635[J]. Marine Drugs, 2018, 16(2): 71. DOI:10.3390/md16020071 |
| [8] |
GU B B, ZHANG Y Y, DING L J, et al. Preparative separation of sulfur-containing diketopiperazines from marine fungus Cladosporium sp.using high-speed counter-current chromatography in stepwise elution mode[J]. Marine Drugs, 2015, 13(1): 354-365. DOI:10.3390/md13010354 |
| [9] |
SHE J L, CHEN Y, YE Y X, et al. New carboxamides and a new polyketide from the sponge-derived fungus Arthrinium sp. SCSIO 4142[J]. Marine Drugs, 2022, 20(8): 475. DOI:10.3390/md20080475 |
| [10] |
ELLMAN G L, COURTNEY K D, ANDRES V JR, et al. A new and rapid colorimetric determination of acetylcholinesterase activity[J]. Biochemical Pharmacology, 1961, 7(2): 88-95. DOI:10.1016/0006-2952(61)90145-9 |
| [11] |
蔡健, 梁曼颖, 王健娇, 等. 长棘海星中含氮类化学成分研究[J]. 中国海洋药物, 2021, 40(4): 45-49. |
| [12] |
ABDALLAH R M, HAMMODA H M, EL-GAZZAR N S, et al. Exploring the anti-obesity bioactive compounds of Thymelaea hirsuta and Ziziphus spina-chr- isti through integration of lipase inhibition screening and molecular docking analysis[J]. RSC Advances, 2023, 13(39): 27167-27173. DOI:10.1039/D3RA05826C |
| [13] |
YE Y X, LIANG J Q, SHE J L, et al. Two new alkaloids and a new butenolide derivative from the Beibu Gulf sponge-derived fungus Penicillium sp. SCSIO 41413[J]. Marine Drugs, 2022, 21(1): 27. DOI:10.3390/md21010027 |
| [14] |
SUN S, TIAN L, WANG Y, et al. A novel natural product from the fermentation liquid of marine fungus Trichoderma atroviride G20-12[J]. Asian Journal of Traditional Medicines, 2009, 4: 123-7. |
| [15] |
FDHILA F, VÁZQUEZ V, SÁNCHEZ J L, et al. Dd-diketopiperazines: antibiotics active against Vibrio anguillarum isolated from marine bacteria associated with cultures of Pecten maximus[J]. Journal of Natural Products, 2003, 66(10): 1299-1301. DOI:10.1021/np030233e |
| [16] |
王越, 张玉琴, 徐喆菲, 等. 红榄李内生真菌Aspergillus terreus HT-1二酮哌嗪类次级代谢产物研究[J]. 中国海洋药物, 2022, 41(6): 10-16. |
| [17] |
唐金山, 高昊, 洪葵, 等. 红树林细菌Bacillus sp.次生代谢产物研究[J]. 中国药物化学杂, 2008, 18(3): 206-209. |
| [18] |
曲承蕾, 杨雪, 张淑敏, 等. 海洋源放线菌Streptomyces sp.223中二酮哌嗪类成分的研究[J]. 中国海洋药物, 2015, 34(3): 23-28. |
| [19] |
KOUCHAKSARAEE R M, FARIMANI M M, LI F J, et al. Integrating molecular networking and 1H NMR spectroscopy for isolation of bioactive metabolites from the Persian Gulf sponge Axinella sinoxea[J]. Marine Drugs, 2020, 18(7): 366. DOI:10.3390/md18070366 |
| [20] |
曹阳, 董升, 李博腾, 等. 蝙蝠蛾拟青霉菌丝体化学成分的分离与鉴定(Ⅱ)[J]. 中国药物化学杂志, 2020, 30(7): 423-427. |
| [21] |
SU Z Q, LI K L, LUO X W, et al. Aromatic acids and leucine derivatives produced from the deep-sea actinomycetes Streptomyces chumphonensis SCSIO15079 with antihyperlipidemic activities[J]. Marine Drugs, 2022, 20(4): 259. DOI:10.3390/md20040259 |
| [22] |
KOZLOVSKY A G, ZHELIFONOVA V P, ANTIPOVA T V, et al. Quinocitrinines A and B, new quinoline alkaloids from Penicillium citrinum Thom 1910, a permafrost fungus[J]. The Journal of Antibiotics, 2003, 56(5): 488-491. DOI:10.7164/antibiotics.56.488 |
| [23] |
KIM W G, SONG N K, YOO I D. Cheminform ab- stract: quinolactacins A1 and A2, new acetylcholinesterase inhibitors from Penicillium citrinum[J]. Journal of Antibiotics, 2001, 54(10): 831-835. DOI:10.7164/antibiotics.54.831 |
| [24] |
徐新亚, 杨宏, 宁小清, 等. 北部湾海洋微生物物种多样性与化学多样性研究进展[J]. 广西科学, 2020, 27(5): 433-450, 461. DOI:10.13656/j.cnki.gxkx.20201217.001 |
| [25] |
邢楠楠, 任润馨, 唐振洲, 等. 涠洲岛海洋沉积物来源真菌Aspergillus sp. GXIMD02003的代谢产物研究[J]. 热带海洋学报, 2023, 42(5): 154-160. |
| [26] |
CHEN X Q, ZHAO J, CHEN L X, et al. Lanostane triterpenes from the mushroom Ganoderma resinaceum and their inhibitory activities against α-glucosidase[J]. Phytochemistry, 2018, 149: 103-115. DOI:10.1016/j.phytochem.2018.01.007 |
| [27] |
廖升荣, 许华炎, 李晓琳, 等. 新型葡萄糖-2,5-二酮哌嗪衍生物的设计、合成与细胞毒活性[J]. 热带海洋学报, 2023, 42(3): 174-185. |
| [28] |
刘云, 胡梦雅, 张文静, 等. 角茴香中1个新的吡嗪类生物碱[J]. 药学学报, 2024, 59(1): 183-187. |
| [29] |
张莲, 邹峥嵘. 来源于天然产物的生物碱类乙酰胆碱酯酶抑制剂研究进展[J]. 中草药, 2020, 51(2): 522-530. |
| [30] |
姜运耀, 吕国英, 李燕飞, 等. 植物来源的胰脂肪酶抑制剂研究进展[J]. 中国生化药物杂志, 2012, 32(2): 199-202. |
| [31] |
林娈, 柳雯郡, 黄俊媛, 等. 蛋白核小球藻胰脂肪酶抑制肽的分离纯化、鉴定及其降脂活性[J]. 食品科学, 2023, 44(24): 155-163. |



