2. 南宁学院食品与质量工程学院,广西南宁 530200;
3. 广西科学院生物科学与技术研究所,非粮生物质技术全国重点实验室,广西南宁 530007
2. College of Food and Quality Engineering, Nanning University, Nanning, Guangxi, 530200, China;
3. National Key Laboratory of Non-Food Biomass Technology, Institute of Biological Sciences and Technology, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China
甘蔗是我国乃至世界主要的糖料作物之一。蔗糖的产量在我国糖产业中占据主导地位[1]。我国的甘蔗种植主要分布在广西、云南、广东和海南等地,其中广西是我国甘蔗的主产区,甘蔗种植面积占全国总种植面积的60%以上[2],蔗糖产业是广西第一大支柱产业。甘蔗的作用广泛,除了作为糖料作物,还可生产乙醇作为能源替代品,蔗渣能用于造纸、饲料加工、燃料生产等领域。甘蔗梢腐病(Pokkah boeng disease)是一种世界性的真菌病害,其主要致病菌为轮枝镰刀菌(Fusarium verticillioides)和层出镰孢菌(F. proliferatum)[3-4]。此病于1890年在爪哇首次被报道,对种植甘蔗的国家和地区都造成了巨大的经济损失。甘蔗感染该病后最初表现为心叶褪绿、变黄,严重时梢部幼嫩心叶会出现坏死、腐烂,病株节间短小甚至整株枯萎死亡[5-6],并且甘蔗梢腐病病菌会迅速扩散,平均病株率为81.1%,严重时病株率达100.0%,实测甘蔗产量损失率为30.2%-48.5%,糖分下降2.63%-5.21%[7]。甘蔗梢腐病病菌喜高温高湿,在这样的环境下,易感病品种发病率高达90%,抗病品种的发病率也有5%-30%[8]。甘蔗的梢腐病发病概率越来越高,对蔗糖产业造成了巨大影响。
目前甘蔗梢腐病的防治方法主要为喷洒农药,这类化学方法对环境的污染较严重,长久使用还会使病原菌产生抗药性。随着人们环保意识的加强,生物防治作为植物病害防治的重要组成部分,被认为是较具发展潜力的防治方法之一。生物防治具有环境友好、安全健康、不污染环境、成本低廉等特征,这些特征使其近年来成为国内外病害综合防治的研究热点[9]。2002年,张桂英[10]通过分离土壤中的细菌,筛选出301株对甘蔗黑穗病菌(Ustilago scitaminea)有拮抗作用的菌株,其中有18株菌株的拮抗能力强。2018年,Karim等[11]从香蕉植株根际中分离筛选出4株具有良好体外抑制香蕉枯萎病菌(Musa paradisiaca)生长潜力的细菌:B6、B8、B2、B1,其抑制率分别为80.47%、80.17%、78.78%、77.74%。2019年,徐伟慧等[12]筛选出拮抗菌株WC,该菌株对西瓜专化型尖孢镰刀菌(F. oxysporum)具有较强的拮抗作用。2020年,Gaya Karunasinghe等[13]从番茄根际土壤中分离出24株形态上明显不同的耐盐细菌,并对瓜果腐霉(Pythium aphanidermatum)进行了体外抑菌试验,其中对瓜果腐霉病菌菌丝生长有抑制效果的细菌有5株。2021年,张俊庆等[14]筛选出8株能够有效抑制辣椒枯萎病致病菌的生防菌株。这些研究结果均表明植物病原菌的拮抗细菌具有良好的生防潜力,其已成为植物病害生物防治的优良菌源之一。
广西北部湾红树林的生态环境中含有丰富的海洋细菌,近年来研究者们发现海洋细菌资源在防治植物病害方面具有开发潜力,但目前将其应用于生物防治甘蔗梢腐病的研究较少。本研究以来自广西北部湾红树林的海洋细菌为材料,筛选出对甘蔗梢腐病病菌具有防治作用的拮抗菌株,并对拮抗能力较强的菌株进行分子生物学鉴定,旨在为甘蔗梢腐病生物防治研究提供优质菌源,为研发有效防治甘蔗梢腐病的生物农药提供科学依据和物质基础。
1 材料与方法 1.1 材料 1.1.1 菌种海洋细菌由广西海洋天然产物与组合生物合成化学重点实验室菌种资源库提供,置于-80 ℃冰箱保藏备用。甘蔗梢腐病病菌株分离自广西崇左市甘蔗种植地采集的甘蔗梢腐病植株样品,采集的植株样品分装在密封袋中,置于-4 ℃冰箱保藏备用。
1.1.2 主要试剂和仪器主要使用的试剂:葡萄糖,蔗糖,通用引物[生工生物工程(上海)股份有限公司],胰蛋白胨、酵母粉(英国OXOID公司),2×Taq酶(南京诺唯赞生物科技股份有限公司),TIANamp Bacteria DNA Kit细菌基因组DNA提取试剂盒[天根生化科技(北京)有限公司],DL 2000 DNA Marker(南宁捷尼斯生物科技有限公司),6×Loading buffer[宝日医生物技术(北京)有限公司],1×TAE电泳缓冲液储备液,40 mg/mL链霉素等。
主要使用的仪器:SW-CJ-1D单人洁净工作台(苏州安泰空气技术有限公司)、PH-070A生化培养箱(上海一恒科学仪器有限公司)、YS100生物显微镜(上海蔡康光学仪器有限公司)、VB-55高压灭菌锅(上海书俊仪器设备有限公司)、Nanodorp 2000C超微量高精度紫外/可见分光光度计(山东优云谱光电科技有限公司)、IS-RDV3立式恒温振荡器(苏州捷美电子有限公司)、Biometra Tadvanced PCR仪[哲罗姆生物科技(中国)有限公司]、Hettich Mikro220R高速冷冻离心机[莱比信(中国)科技发展有限公司]、JY92-IIDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、PowerPac Universal核酸电泳仪[赛默飞世尔(上海)仪器有限公司]、APLEGEN Omega fluor凝胶成像系统(环亚生物科技有限公司)等。
1.1.3 培养基马铃薯葡萄糖琼脂(PDA)培养基:将200 g马铃薯切成小块,加入约300 mL的双蒸水,使用玻璃棒搅拌。沸水水浴加热30 min后用纱布过滤,得到马铃薯汁液。称量20 g葡萄糖置入马铃薯汁液,用双蒸水定容至1 L,pH值自然,制成液体培养基。每100 mL液体培养基加入2 g琼脂粉,制成固体培养基。高压蒸汽(121 ℃,103.4 kPa)灭菌20 min。
马铃薯蔗糖琼脂(PSA)培养基:将200 g马铃薯切成小块,加入约300 mL的双蒸水,使用玻璃棒搅拌。沸水水浴加热30 min后用纱布过滤,得到马铃薯汁液。称量20 g蔗糖置入马铃薯汁液,用双蒸水定容至1 L,pH值自然,制成液体培养基。每100 mL液体培养基加入2 g琼脂粉,制成固体培养基。高压蒸汽(121 ℃,103.4 kPa)灭菌20 min。
溶菌肉汤(LB)培养基:将10 g氯化钠、5 g酵母粉、10 g胰蛋白胨用双蒸水定容至1 L,制成液体培养基。每100 mL液体培养基加入2 g琼脂粉,制成固体培养基。高压蒸汽(121 ℃,103.4 kPa)灭菌20 min。
1.2 方法 1.2.1 培养条件细菌平板培养温度为28-30 ℃,培养2-3 d。真菌平板培养温度为28-30 ℃,培养3-5 d。设定细菌菌体恒温振荡器的温度为30 ℃,转速为200 r/min,振荡培养细菌菌体2-3 d。设定真菌菌体恒温振荡器温度为30 ℃、转速为200 r/min,振荡培养真菌菌体3-4 d。拮抗实验平板培养温度为28-30 ℃,培养3-5 d。
1.2.2 甘蔗梢腐病病菌的分离、纯化将采集的植株样品使用已灭菌的剪刀剪成小块,置于无菌双蒸水中进行梯度稀释,浓度分别为10-1、10-2、10-3、10-4,共4个浓度梯度。在每100 mL的PDA培养基中加入100 μL 40 mg/mL链霉素,摇匀后倒平板。使用接种环按浓度梯度顺序依次蘸取稀释液后,在含有链霉素的PDA培养基上进行S型划线,每个浓度梯度做2个平行实验。在28-30 ℃培养2 d后观察菌丝生长情况,挑选每个浓度上明显的单菌落真菌,沾菌丝接种至普通PDA培养基平板上,28-30 ℃培养。
1.2.3 拮抗海洋细菌的筛选(1) 海洋细菌菌株的活化、保藏
将冷冻保藏的海洋细菌菌株用四区划线法接种至LB培养基平板上进行活化处理,培养温度为28-30 ℃,培养时间为2-3 d。将活化后的单菌落接种至含有LB液体培养基的离心管中,在恒温振荡器振荡培养2-3 d后,一部分吸取900 μL 40%甘油和900 μL菌液,置于2 mL的菌种保藏管中,放入-80 ℃低温箱保存;另一部分吸取1 mL菌液,接种至含有LB液体培养基的锥形瓶中,恒温振荡器振荡培养2-3 d后,对菌液进行离心处理,取菌种至50 mL的离心管中放入-80 ℃低温箱保存,划线的平板保存在-4 ℃的冰箱中,待需要时使用。
(2) 拮抗细菌的筛选
在PDA培养基的中间位置接种, 经分离、纯化得到甘蔗梢腐病病菌,分别在以甘蔗梢腐病病菌为中心的四边形的4个角上接种活化后的海洋细菌单菌落,进行拮抗筛选,培养温度为28-30 ℃,培养时间为4-5 d。根据接种细菌菌落至甘蔗梢腐病病菌外缘的间距(拮抗带)来确定拮抗程度。将拮抗带大于1 mm的菌株标记为有拮抗能力的菌株,拮抗带大于5 mm的菌株标记为拮抗能力强的菌株,并将其选为拮抗菌,进行后续分析。
(3) 革兰氏染色
通过革兰氏染色法可以将细菌分为革兰氏阳性菌(Positive)和革兰氏阴性菌(Negative)两大类。包括以下步骤:涂片固定;滴加草酸铵结晶紫染色1 min,蒸馏水冲洗;滴加碘液覆盖涂面染色1 min,蒸馏水冲洗,用吸水纸吸去水分;加95%酒精数滴,并轻轻摇动进行脱色,20 s后蒸馏水冲洗,用吸水纸吸去水分;滴加番红染色液(稀)染色1 min,蒸馏水冲洗;干燥,镜检。
1.2.4 海洋细菌的种属鉴定(1) 待鉴定菌株破胞
将待鉴定种属的菌株接种至LB液体培养基中,在恒温振荡器振荡培养数天后(参照1.2.1节的培养条件),离心取出沉淀菌种至50 mL的离心管中,加入缓冲液(20 mmol/L Tris,300 mmol/L氯化钠,pH值为7.5),悬浮放置在装有冰水混合液的烧杯中,放入超声波细胞破碎机中进行破胞,功率450 W,超声开启时间2 s,超声关闭时间2 s,温度4 ℃,破胞15 min。
(2) 待鉴定菌株基因组DNA提取、PCR扩增和琼脂糖电泳分析
使用细菌基因组DNA提取试剂盒,参照说明书提取菌株样品的DNA。使用超微量高精度紫外/可见分光光度仪检测提取的DNA含量,移液枪吸取1 μL双蒸水清洗仪器3次后再进行检测,图像有明显的峰状时,表示DNA提取液合格,可以进行PCR扩增。
对提取的DNA使用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。反应体系为2×Taq酶12.5 μL,上游引物0.5 μL,下游引物0.5 μL,DNA模板1 μL,双蒸水10.5 μL,总体积25 μL。扩增反应程序如下:95 ℃预变性7 min; 95 ℃变性30 s,58 ℃退火1 min,72 ℃延伸1 min 30 s,进行35个循环;72 ℃延伸7 min,4 ℃保存PCR产物。
称取0.25 g琼脂糖粉与25 mL 1×TAE电泳缓冲液储备液混合,配成1.0%浓度的溶液,加热至琼脂糖粉完全溶化且溶液呈清亮透明后,加入1.5 μL绿如蓝核酸染料,趁热倒入组装好的制胶槽中静置凝固,制成1.5%浓度的琼脂糖凝胶。待凝胶冷却成形后,拔去卡槽上样梳,将凝胶及其卡槽底座放入电泳槽中。在凝胶的上样孔中从左到右依次加入4 μL DL 2000 DNA Marker和PCR样液(由5 μL PCR产物与1 μL 6×Loading Buffer混合制成)后进行电泳。保持电流50 mA,电泳25 min。电泳结束后,将琼脂糖凝胶从卡槽中移出并置于光学凝胶成像系统中,完成成像并保存图片。
(3) 菌株16S rDNA序列分析、系统发育树的构建
根据琼脂糖凝胶成像图片上的图谱分析结果,选择具有特征性条带清晰的PCR产物,送至生工生物工程(上海)股份有限公司进行DNA序列的测定。序列测定结果在NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比较分析,下载同源性较高的序列,利用MEGA 7.0软件,使用邻接法(Neighbor-Joining method)构建系统发育树,Bootstraps值设为1 000。
2 结果与分析 2.1 甘蔗梢腐病病菌的分离及纯培养将经过分离、纯化所得的甘蔗梢腐病病菌分别接种至PDA培养基、PSA培养基、LB培养基上。在PDA培养基上,甘蔗梢腐病病菌生长速度较快,菌落中间部分呈紫色,气生菌丝发达密生,为白色[图 1(a)];菌落背面初期为黄白色,5 d后呈紫色[图 1(b)]。菌落初为圆形,后扩大为不规则形,一般培养3 d后菌落直径可达到4.5 cm,培养5-7 d后,菌丝布满平板。在PSA培养基上,甘蔗梢腐病病菌生长速度与PDA培养基相比较慢,菌落中间有明显的紫色,气生菌丝发达密生,为白色[图 1(c)];菌落背面初期为黄白色,5 d后呈紫色[图 1(d)]。菌落初为圆形,后扩大为不规则形,一般培养3 d后菌落直径可达到4.5 cm,培养6-7 d后,菌丝布满平板。在LB培养基上,甘蔗梢腐病病菌生长速度较慢,菌落中间没有紫色,气生菌丝与另外2个培养基相比较短且疏,为白色[图 1(e)];菌落背面为黄白色[图 1(f)]。菌落初为圆形,后扩大为不规则形,一般培养3 d后菌落直径可达到4 cm,培养7-8 d后,菌丝布满平板。
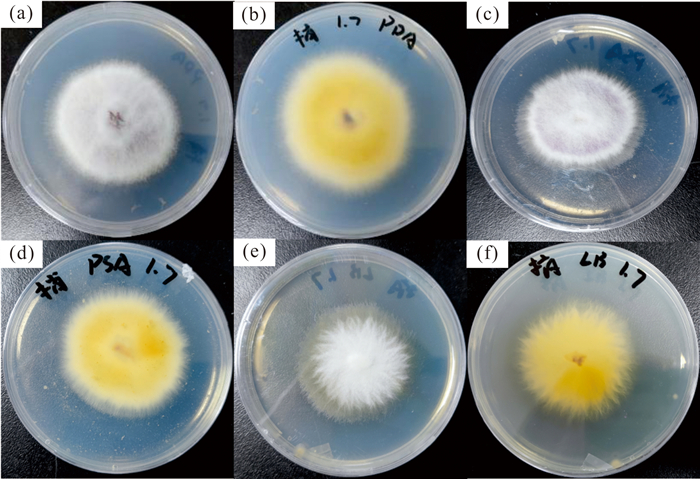
|
| 图 1 甘蔗梢腐病病菌在3种不同培养基下的生长形态 Fig. 1 Colony morphology of pokkah boeng disease pathogen in three different media |
将在PDA培养基上培养的病菌菌丝放在显微镜下观察,结果显示其分生孢子分布密集,独立生长,菌丝分枝不规则[图 2:(a)、(b)],有分隔。菌丝的形态有2种,大的分生孢子呈镰刀状[图 2:(c)、(d)],小的分生孢子呈卵状[图 2:(a)、(d)]。
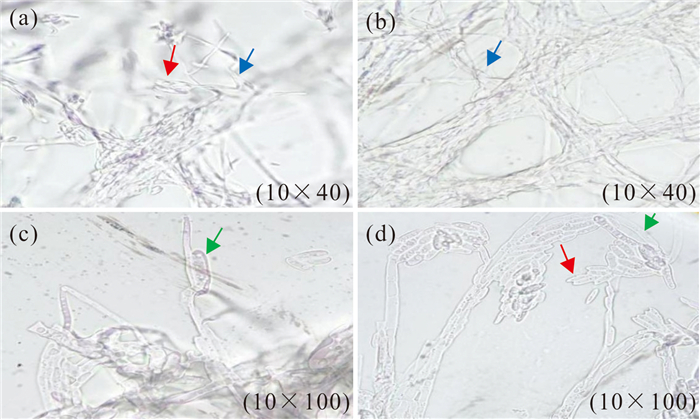
|
| Red arrows indicate ovate conidia; blue arrows indicate irregular hypha branching; green arrows indicate sickle-shaped conidia. 图 2 甘蔗梢腐病病菌在显微镜下的形态 Fig. 2 Cell morphology of pokkah boeng disease pathogen under microscope |
2.2 甘蔗梢腐病病菌拮抗海洋细菌的筛选
将选取的214株海洋细菌进行平板拮抗筛选,统计对甘蔗梢腐病病菌有拮抗能力的细菌菌株,统计结果显示,没有拮抗能力的细菌菌株有139个,占65%;具有拮抗能力的细菌菌株有75个,占35%,其中略有拮抗能力(拮抗带>0.1-5.0 mm)的菌株69个,占32.2%,拮抗能力中等(拮抗带>5.0-10 mm)的菌株有5个,分别为菌株28S16、IP4、N6S07、2N5、5N5,占2.3%;拮抗能力强的菌株(拮抗带>10 mm)有1个,为菌株8N5,占0.5%(图 3)。

|
| 图 3 海洋细菌菌株对甘蔗梢腐病病菌的拮抗作用 Fig. 3 Inhibitory effect of marine bacteria on pokkah boeng disease pathogen |
2.3 甘蔗梢腐病病菌拮抗海洋细菌的鉴定
对拮抗能力中等和强的海洋细菌(共6株菌株)进行种属鉴定,并基于16S rDNA序列构建系统发育树,结果如表 1和图 4所示。有2株菌株隶属于链霉菌属(Streptomyces sp.),分别是浅紫链霉菌(Streptomyces violascens)和S.atriruber菌,相似度在99%以上。有2株菌株隶属于芽孢杆菌属(Bacillus sp.),分别是威氏芽孢杆菌(Bacillus wiedmannii)和暹罗芽孢杆菌(B.siamensis),相似度在99%以上。有1株菌株隶属于假单胞菌属(Pseudomonas sp.),是铜绿假单胞菌(Pseudomonas aeruginosa),相似度100%。有1株为沙雷氏菌属(Serratia sp.),是黏质沙雷氏菌(Serratia marcescens),相似度99.85%。
| 菌种编号 Strain number |
鉴定种 Species identification |
革兰氏染色 Gram staining |
| 28S16 | Streptomyces violascens | Positive |
| 2N5 | S. atriruber | Positive |
| N6S07 | Bacillus siamensis | Positive |
| IP4 | B. wiedmannii | Positive |
| 8N5 | Pseudomonas aeruginosa | Negative |
| 5N5 | Serratia marcescens | Negative |
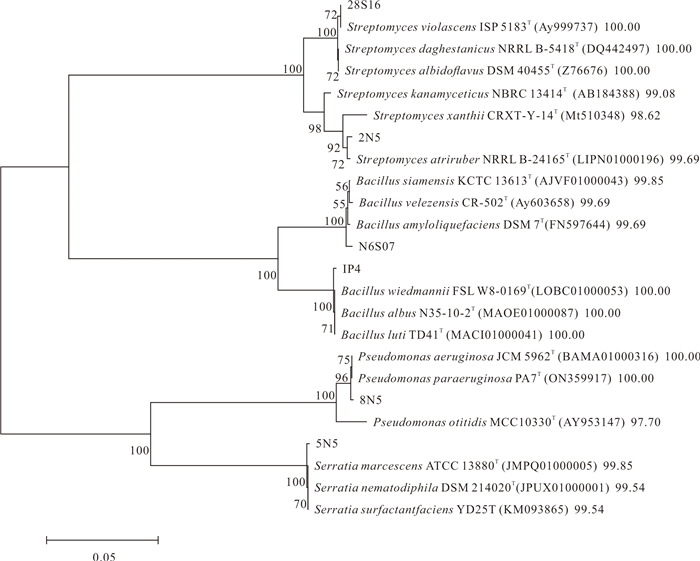
|
| 图 4 菌株28S16、2N5、N6S07、IP4、8N5、5N5基于16s rDNA序列的系统发育树 Fig. 4 Phylogenetic tree of strains 28S16, 2N5, N6S07, IP4, 8N5, and 5N5 based on 16s rDNA sequences |
3 讨论
链霉菌对甘蔗梢腐病病菌具有拮抗作用,其原因在于链霉菌会产生一些次生代谢产物或生物活性物质,对与病原菌生理代谢途径相关的代谢酶系和病原菌的总葡萄糖含量、总丙酮酸含量、己糖激酶等产生影响[15-17],从而改变细胞膜透性和病菌的菌丝形态,抑制菌丝生长量,减缓菌丝生长速率[18]。芽孢杆菌产生的抑菌物质主要为细菌素、聚酮类物质、脂肽类物质[19],这些物质能够通过与细胞壁上的受体结合,破坏细胞壁或细胞膜的正常结构,引起菌丝粗细不均、断裂及畸形等变化,起到抑制病菌菌丝生长的效果[20-21];此外,芽孢杆菌次级代谢物中的活性物质如细胞壁水解酶等,对病菌的孢子壁产生了溶解作用,致使孢子壁穿孔,产生畸变,从而抑制甘蔗梢腐病病菌孢子的萌发[19-21]。因此,芽孢杆菌对甘蔗梢腐病病菌产生了一定的拮抗作用。假单胞菌在生长过程中会产生许多具有拮抗活性成分的物质,这些物质包括酶类、挥发性有机物(如丙酮、2,3-丁二醇)和非挥发性成分(如绿脓素、荧光素和脂多糖)等[22-23],这些成分通过抑制病菌菌丝的正常生长,导致菌丝消融,孢子细胞壁融解,造成原生质泄露致使孢子死亡[24],从而有效抑制甘蔗梢腐病病原菌的生长。沙雷氏菌通过多维度机制协同抑制甘蔗梢腐病病菌,包括直接抑菌、铁竞争、酶解作用、诱导抗性及生态位竞争等。沙雷氏菌可产生多种抗生素和抗菌代谢物,如灵菌红素(Prodigiosin)、吡咯菌素(Pyrrolnitrin)和沙雷氏蛋白酶(Serralysin),直接抑制病原菌的生长和繁殖[25]。其分泌的铁载体(如Serratibactin)可高效螯合环境中的铁离子,限制病原菌获取铁元素,从而抑制其生长[26]。沙雷氏菌作为甘蔗内生菌,可在植物组织内高效定殖,抢占病原菌的生存空间和营养资源。这些因素共同作用,使得沙雷氏菌能够有效地抑制甘蔗梢腐病病菌的生长,从而减少病害的发生。
海洋的微生物资源丰富,应用范围十分广泛。本研究对甘蔗梢腐病病菌拮抗海洋细菌的筛选结果表明,只有极少部分海洋细菌(2.8%)对甘蔗梢腐病病菌有强拮抗作用且生长良好。关于这些细菌在防治其他植物真菌性病害方面已有较多报道,但是在甘蔗梢腐病防治应用方面却鲜有报道。本研究目前只对214株海洋细菌进行了拮抗筛选,后续还需要对其他海洋细菌进行筛选,选出对甘蔗梢腐病病菌具有更好拮抗作用的海洋细菌。
尽管本研究对筛选的拮抗菌株进行了拮抗能力检验,但是对其抗病机制尚未进行充分解析和验证。拮抗菌株的抗病机制非常复杂,包括产生抗菌物质、竞争铁元素或生态位、降解致病因子等直接作用,以及诱导植物抗性、营养竞争等间接作用,这些作用通过协同、连续、综合互作的方式对病原菌进行抑制[27]。厘清生物防治微生物复杂的抗病机制,是其得以充分发挥作用的关键,因此,探究拮抗细菌的抗病机制是下一步工作的重点,可为甘蔗梢腐病的生物防治提供重要的资源和理论支撑,从而推动广西甘蔗产业的发展。
4 结论本研究从214株海洋细菌中筛选出75株对甘蔗梢腐病病菌具有拮抗性的细菌菌株,其中有6株细菌的拮抗能力比较显著,说明红树植物内生的海洋细菌是植物病害生物防治不可多得的资源。对这6株拮抗能力较为显著且生长良好的海洋细菌进行种属鉴定,其中有2株菌株隶属于链霉菌属,2株菌株隶属于芽孢杆菌属,1株菌株隶属于假单胞菌属,1株菌株隶属于沙雷氏菌属。甘蔗梢腐病病菌拮抗菌株以链霉菌、芽孢杆菌、假单胞菌为主,初步判断这些拮抗菌株的拮抗机制为分泌具有拮抗活性成分的物质或者次级代谢产物,从而使得甘蔗梢腐病病菌的细胞壁溶解、菌丝变形,进而达到抑制生长的效果。其中假单胞菌8N5拮抗能力最强,是甘蔗梢腐病病害的潜在生物防治菌株。
| [1] |
魏栋栋, 李梦茜, 张振旺. 甘蔗真菌病病害及生物防治的研究进展[J]. 大众科技, 2017, 19(5): 100-103. |
| [2] |
任庆肖, 张金旭, 张木清. 甘蔗根腐病及其致病镰刀菌研究进展[J]. 甘蔗糖业, 2021, 50(3): 49-57. |
| [3] |
OREN L, EZRATI S, COHEN D, et al. Early events in the Fusarium verticillioides-maize interaction characterized by using a green fluorescent protein-expressing transgenic isolate[J]. Applied and Environmental Microbiology, 2003, 69(3): 1695-1701. DOI:10.1128/AEM.69.3.1695-1701.2003 |
| [4] |
龙盛风, 李文教, 韦绍龙, 等. 不同种植模式下甘蔗梢腐病和香蕉枯萎病病害调查及其病原真菌分离鉴定[J]. 南方农业学报, 2019, 50(2): 292-298. |
| [5] |
郭强, 马文清, 陈海生, 等. 广西崇左市甘蔗梢腐病病原菌的分离鉴定及生物学特性测定[J]. 南方农业学报, 2019, 50(8): 1728-1734. |
| [6] |
刘丹丹, 姚姿婷, 赖小群, 等. 甘蔗梢腐病轮枝镰刀菌侵染甘蔗叶片的显微观察[J]. 中国糖料, 2019, 41(4): 41-45. |
| [7] |
单红丽, 李文凤, 张荣跃, 等. 甘蔗梢腐病暴发流行原因及产量糖分损失测定[J]. 中国糖料, 2018, 40(3): 40-42, 45. |
| [8] |
张玉娟. 甘蔗梢腐病病原分子检测及甘蔗组合、品种的抗病性评价[D]. 福州: 福建农林大学, 2009.
|
| [9] |
肖钦之, 邓斌, 邹海露, 等. 植物病毒病生物防治研究进展[J]. 南方农业, 2021, 15(34): 64-69. |
| [10] |
张桂英. 甘蔗黑穗病拮抗细菌的分离筛选鉴定及拮抗机制的研究[D]. 南宁: 广西大学, 2002.
|
| [11] |
KARIM H, HAMKA L, KURNIA N, et al. Effectivity of anatagonistic bacteria in controlling of Fusarium wilt diseases of banana (Musa paradisiaca) by in vitro[J]. Journal of Physics: Conference Series, 2018, 1028(1): 012014. |
| [12] |
徐伟慧, 王恒煦, 赵井明, 等. 西瓜枯萎病拮抗菌筛选及其拮抗性能研究[J]. 农业生物技术学报, 2019, 27(12): 2238-2247. |
| [13] |
GAYA KARUNASINGHE T, HASHIL AL-MAHMOOLI I, AL-SADI A M, et al. The effect of salt-tolerant antagonistic bacteria from tomato rhizosphere on plant growth promotion and damping-off disease suppression under salt-stress conditions[J]. Acta Agriculturae Scandinavica, Section B: Soil & Plant Science, 2020, 70(1): 69-75. |
| [14] |
张俊庆, 郑安科, 高立红, 等. 辣椒枯萎病主要致病菌的分离鉴定及农用拮抗菌筛选[J]. 安徽农业科学, 2021, 49(8): 134-137. |
| [15] |
丁芮涵. 一株链霉菌(CX3)筛选鉴定及其对蓝莓溃疡病菌生防作用的研究[D]. 沈阳: 辽宁大学, 2020.
|
| [16] |
陶宗, 王海华, 申权, 等. 链霉菌和芽孢杆菌的生防机理及抗菌活性产物[J]. 农业与技术, 2019, 39(14): 1-5. |
| [17] |
毛良居, 毛赫. 链霉菌生物防治研究进展[J]. 安徽农业科学, 2017, 45(1): 145-147. |
| [18] |
路丹丹. 一株拮抗链霉菌的筛选及活性物质鉴定[D]. 杭州: 中国计量大学, 2016.
|
| [19] |
邓丽, 孙冉, 姚蒋庞, 等. 贝莱斯芽孢杆菌粗提物对金黄色葡萄球菌的抑菌机制[J]. 食品与发酵科技, 2021, 57(3): 1-9. |
| [20] |
田辉. 贝莱斯芽孢杆菌遗传转化体系的建立及抑菌物质鉴定[D]. 北京: 中国农业科学院, 2021.
|
| [21] |
兰成忠. 黄瓜枯萎病菌LAMP检测及贝莱斯芽孢杆菌FJ17-4生防机制研究[D]. 南昌: 江西农业大学, 2021.
|
| [22] |
徐令清. 铜绿假单胞菌对微生物的抑制作用及机理探讨[D]. 武汉: 华中科技大学, 2014.
|
| [23] |
徐令清, 汪峰, 侯红艳, 等. 铜绿假单胞菌对致病真菌的抑制作用[J]. 重庆医学, 2014, 43(7): 769-771, 778. |
| [24] |
钟小燕, 梁妙芬, 甄锡壮, 等. 假单胞菌对香蕉枯萎病菌的抑制作用[J]. 植物保护, 2009, 35(1): 86-89. |
| [25] |
LIN D J, ZHOU J X, ALI A, et al. Biocontrol efficiency and characterization of insecticidal protein from sugarcane endophytic Serratia marcescens (SM) against oriental armyworm Mythimna separata (Walker)[J]. International Journal of Biological Macromolecules, 2024, 262(P2): 129978. |
| [26] |
YIN L Y, HUANG Z, ZHOU Y M, et al. Enhanced resistance to pokkah boeng disease in sugarcane through host-induced gene silencing targeting FsCYP51 in Fusarium sacchari[J]. Plant, Cell & Environment, 2025, 48(6): 3861-3874. |
| [27] |
王超, 郭坚华, 席运官, 等. 拮抗细菌在植物病害生物防治中应用的研究进展[J]. 江苏农业科学, 2017, 45(18): 1-6. |



