红树林是分布在热带、亚热带海岸潮间带河口、海湾,以红树植物为主的常绿灌木或乔木组成的木本植物群落,在防风护岸、净化海水、保护海岸带生物多样性和促淤造陆等方面有着重要的生态功能和极高的生态服务价值[1-3]。处于海陆交错带的红树林生态系统不仅在海洋生态过程和生物资源方面有着重要地位,而且在海洋与陆地之间的物质交换过程中起着关键性作用[4-5]。
1960年以来,围海造田、围塘养殖及城市建设等促进沿海经济发展的举措直接或间接破坏了大片沿海红树林,导致我国沿海红树林面积从4万hm2锐减至1.4万hm2[3]。从红树林资源日趋减少和大量红树林宜林滩涂亟待绿化的现状,以及沿海防护林体系建设的需要出发,恢复红树林的工作已受到国内外广泛重视,然而天然红树林远远不能满足生态恢复的需求,因此开展大规模红树林造林迫在眉睫[6]。近年来,我国学者在红树林造林与抚育技术上开展了系统性研究,使我国沿海红树林生态恢复取得了显著成绩,推动沿海红树林面积实现了历史性增长,但是红树林造林成活率低的问题仍未解决。据统计,我国红树林造林成活率非常低,仅为20%-30%,多地红树林生态系统已呈现出明显退化态势,部分区域甚至出现了全面退化的现象[7-8]。由于围海造田使原来适合红树林生长的中高潮带滩涂损失殆尽,导致目前红树林造林多在中低潮带滩涂,而且是在逆境条件下的特种造林。大量造林实践表明,潮汐浸淹时间和海水盐度是影响红树林造林的重要限制因子,因此开展红树植物对淹水胁迫和水体盐度的适应性研究,可为红树林恢复提供理论和实践依据[7, 9-11]。
广西沿海地区位于我国沿海西南端、北部湾北部,具有我国典型的、少有的、独特的全日潮岸段[12-13]。广西沿海地区的潮汐主要由太平洋潮波传入南海,经北部湾口进入北部湾后,受地貌、河口、径流等因素的综合影响,构成了不同于东部沿海(广东、福建和海南)红树林分布区的独特潮汐规律[14]。与半日潮相比,全日潮海区经造林的红树林苗木受浸淹的频率相对较低,但单个潮日内连续受浸淹时间较长[15],因此在全日潮海区进行红树林造林有别于其他海区。目前,国内外研究者对淹水-盐度交互处理下红树林植物的生长[8, 16-17]、生理[18-20]、根系发育及形态[21]等方面进行了大量研究。但这些研究主要集中于模拟半日潮淹水和单因素胁迫等方面,且研究对象为1-2个树种[17, 22],而模拟全日潮下淹水-盐度交互处理对红树林幼苗生理影响的相关研究较少。另外,当红树林受淹水或盐度胁迫时均会导致植物细胞内产生过多的活性氧化物质,如超氧自由基和过氧化氢(H2O2),这些物质会对细胞膜、蛋白质和核酸造成损伤,引发细胞死亡,而抗氧化酶能够清除这些活性氧化物质,减少其对细胞的损害,维持细胞稳定和活性,从而提高细胞在恶劣环境下的生存能力。
蜡烛果(Aegiceras corniculatum)、海榄雌(Avicennia marina)、木榄(Bruguiera gymnorhiza)、秋茄(Kandelia obovata)和红海兰(Rhizophora stylosa)是我国常见的5种红树植物,也是红树林修复及造林过程中首选的树种。鉴于此,本研究采用室内潮汐自动控制系统模拟北部湾全日潮潮汐规律,对上述5种红树林幼苗进行淹水-盐度交互处理实验,拟探讨红树林幼苗叶片抗氧化酶活性对全日潮淹水-盐度交互处理的生理适应策略,可为恢复和保护红树林、提高红树林造林成活率提供理论依据和实践指导。
1 材料与方法 1.1 材料于2022年1月5日从广西八桂种苗高科技集团股份有限公司育苗基地获取蜡烛果(AC)、海榄雌(AM)、木榄(BG)、秋茄(KO)和红海兰(RS)人工幼苗,育苗基地海水的平均盐度为15±3,平均淹水时间为(5±1) h,选取无病虫害、发育良好、林龄相仿(1-2 a)、苗高相近[(30±5) cm]的幼苗。培养基采自广西科学院广西海洋科学院(广西红树林研究中心)滨海生态保育与利用创新基地的泥沙质培养基,并确保其理化性质基本一致。
1.2 方法 1.2.1 潮汐自动控制系统概况整个模拟实验在广西科学院广西海洋科学院(广西红树林研究中心)室内潮汐自动控制系统[图 1]中进行,模拟北部湾全日潮潮汐规律,对红树林幼苗进行淹水实验。该系统主要由9个模拟槽(长×宽×高为160 cm×76 cm×100 cm,玻璃厚度为1.5 cm)和9个储水桶(容量为1.2 t)组成,储水桶内为人工配置海水,用功率为20 W的水泵将模拟槽与储水桶连接起来。模拟定时器控制涨潮时间和退潮时间,每个模拟槽设置每天潮汐涨退1次,即模拟全日潮。每日检查水体盐度并及时补充淡水以保持盐度稳定。

|
| 图 1 全日潮潮汐自动控制系统 Fig. 1 Diurnal tide automatic control system |
于2022年1月8日将红树林幼苗移入装有培养基的培养槽(长×宽×高为45.5 cm×31.5 cm×13.0 cm)中,共5个培养槽,每个培养槽种植1种红树林幼苗,每种红树林幼苗种植15株,随后将5个培养槽放入同一个潮汐模拟槽内进行培养,其余模拟槽采用同样的种植方法。
实验时间为2022年1月8日至11月8日,使用HOBO探头(U20-001-0X-Ti,Onset Computer Corporation,USA)记录实验期间室内及海水温度,室内最高气温为(57.46 ±2.01) ℃,最低气温为(7.46±1.57) ℃,平均气温为(30.04±7.28) ℃,平均光照强度为(2 130.35±261.01) μmol·m-2·s-1,实验海水平均温度为(30.06±7.38) ℃。
1.2.2 实验设置将幼苗放入潮汐自动控制系统进行为期4个月的适应性培养(2022年1月8日至5月8日),设置海水盐度为15,全日潮下每日淹水时间为5 h,水位刚好没过培养基5 cm,期间如发现死亡或枯萎的植株需及时更换备用植株。
适应性培养结束后进行淹水-盐度交互处理实验。根据已有研究资料,发现大多数研究淹水时间下限为0-4 h·d-1,上限为10-16 h·d-1,淹水递增时间为2-6 h;而盐度下限为0-5,上限为35-40,盐度递增为5-15[23-26]。综合文献资料及北部湾海水盐度的实际情况,本研究设置3个水平的盐度,分别为5、15、30;不同盐度梯度下设置完全被淹没(潮汐没过红树林幼苗顶部)的时间分别为4、7、10 h,共9个处理(图 2)。各处理每天淹浸1个全日潮,且每日涨潮时间和退潮时间并非固定于某一时刻,而是每日顺延1-2 h,以更贴近广西北部湾实际的潮汐变化。正式胁迫实验时长为6个月,实验总时长为10个月。
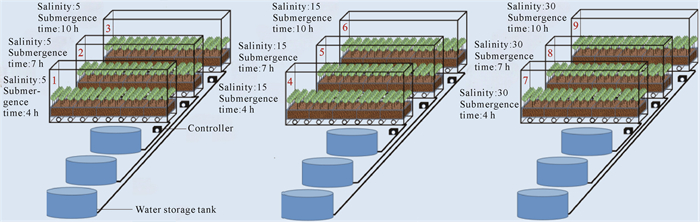
|
| 图 2 潮汐自动控制系统模拟装置示意图 Fig. 2 Schematic diagram of the simulation device for tide automatic control system |
1.2.3 样品采集与预处理
适应性培养结束时,在各淹水-盐度交互处理条件下,每个树种随机挑选3株,每株采集第2对成熟、无病虫害、健康的叶片2片,用纯水洗净后装入带编号的密封袋,并置于提前放有冰袋的泡沫箱中保温,待所有处理的叶片采集完成后,立即放入-80 ℃超低温冰箱中保存,用于红树林幼苗叶片酶活性的测定。往后6-11月每月8日重复上述的样品采集和保存步骤,共采集到1 890片叶片。
用电子分析天平(精度为0.000 1 g)称量0.1 g鲜重叶片放入2 mL离心管内(离心管内先放入钢珠),滴入200 μL提取液后,迅速置于碎冰中保存。待样品全部准备完毕,再转至冰冻好的研磨仪孔板(MM400,南京中科科学器材有限公司)上,以振动频率为25次·s-1研磨2 min,研磨结束后取出并置于冰盒上滴加800 μL提取液,振荡混匀。随后,转入离心机(3-18KS,杭州奥盛仪器有限公司)以12 000 r·min-1的转速离心10 min,使沉淀与上清液完全分离。最后,用移液枪吸取上清液转至新的离心管中待测。
1.2.4 抗氧化酶活性测定红树林幼苗抗氧化酶活性测定的指标主要有过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性和过氧化物酶(POD)活性。采用多功能酶标仪(Synergy HTX,美国伯腾仪器有限公司)测定酶活性,按照各试剂盒的步骤进行操作,试剂盒均购自苏州格锐思生物科技有限公司。其中,CAT活性按照过氧化氢酶试剂盒(G0105W)中的方法进行测定,CAT催化H2O2生成H2O和O2,剩余的H2O2与新型探针显色,在510 nm波长处有最大吸收峰;SOD活性按照超氧化物歧化酶试剂盒(G0101W)中的WST-8法进行测定;POD活性按照过氧化物酶试剂盒(G0107W)中的方法进行测定,POD催化H2O2氧化特定底物,生成的红棕色产物在470 nm波长处有最大吸收峰[23]。
1.3 数据处理与分析采用Microsoft Excel 2010软件对数据进行初步整理,结果以均值±标准差的形式表示。采用R 4.3.1软件中的ggplot2和factoextra程序包绘图,并进行主成分分析(PCA)。
2 结果与分析 2.1 不同淹水时间下盐度对红树林幼苗抗氧化酶活性的影响不同淹水时间下,盐度对蜡烛果和海榄雌的抗氧化酶活性影响较大,而对其他树种影响较小(图 3)。当淹水时间为4 h时,随着盐度的增加,蜡烛果的CAT活性呈上升趋势,而海榄雌、木榄、秋茄和红海兰变化不明显[图 3(a)];蜡烛果的SOD活性和海榄雌的POD活性呈下降趋势[图 3: (b)、(c)]。当淹水时间为7 h时,随着盐度的增加,蜡烛果的CAT活性呈上升趋势,SOD活性呈下降趋势,海榄雌、木榄、秋茄和红海兰变化不明显[图 3:(d)、(e)];海榄雌的POD活性呈上升趋势,秋茄的POD活性呈下降趋势,而蜡烛果、木榄和红海兰变化不明显[图 3(f)]。当淹水时间为10 h时,随着盐度的增加,蜡烛果、海榄雌和红海兰的CAT活性呈上升趋势,而木榄和秋茄变化不明显[图 3(g)];蜡烛果的SOD活性呈下降趋势,海榄雌的POD活性呈上升趋势,其他树种变化不明显[图 3: (h)、(i)]。
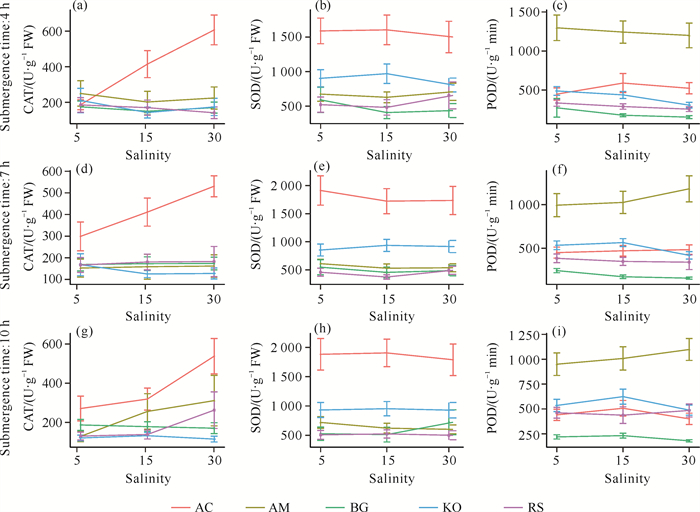
|
| 图 3 不同淹水时间下盐度对红树林幼苗抗氧化酶活性的影响 Fig. 3 Effects of salinity on antioxidant enzyme activities in mangrove seedlings under different submergence times |
2.2 不同盐度下淹水时间对红树林幼苗抗氧化酶活性的影响
不同盐度条件下,淹水时间对蜡烛果和海榄雌的抗氧化酶活性影响较大,而对其他树种影响较小(图 4)。当盐度为5时,随着淹水时间的增加,蜡烛果的CAT活性呈先上升后下降的趋势,海榄雌、秋茄和红海兰呈下降趋势,而木榄变化不明显[图 4(a)];蜡烛果的SOD活性呈先上升后下降的趋势,而海榄雌、木榄、秋茄和红海兰变化不明显[图 4(b)];海榄雌的POD活性呈下降趋势,蜡烛果、木榄、秋茄和红海兰变化不明显[图 4(c)]。当盐度为15时,蜡烛果的CAT活性和POD活性呈下降趋势,SOD活性呈上升趋势;海榄雌的CAT活性呈先下降后上升的趋势,POD活性呈下降趋势,而木榄、秋茄和红海兰变化不明显[图 4:(d)—(f)]。当盐度为30时,蜡烛果的CAT活性和POD活性呈下降趋势,SOD活性呈上升趋势;海榄雌的CAT活性呈先下降后上升的趋势,SOD活性和POD活性呈下降趋势[图 4:(g)-(i)]。
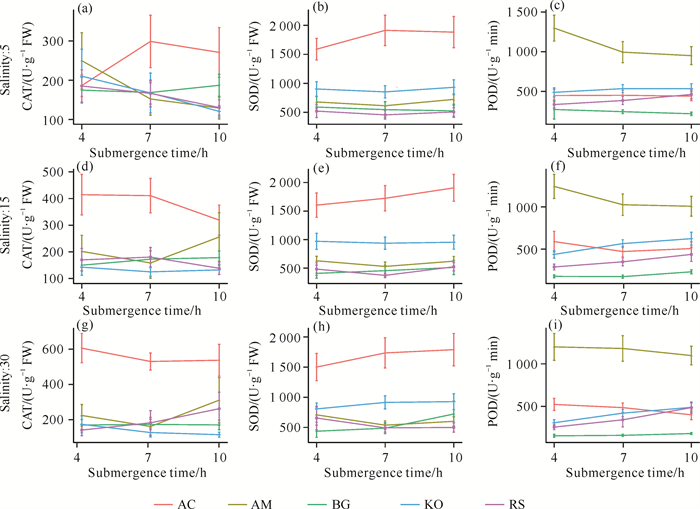
|
| 图 4 不同盐度下淹水时间对红树林幼苗抗氧化酶活性的影响 Fig. 4 Effects of submergence time on antioxidant enzyme activities in mangrove seedlings under different salinities |
2.3 淹水-盐度交互处理对红树林幼苗抗氧化酶活性的影响
如图 5所示,除淹水时间分别为4、7、10 h, 盐度为15的交互处理下,以及淹水时间为10 h、盐度为30的交互处理下蜡烛果的CAT活性随着时间推移呈先上升后下降再上升的趋势外,总体上蜡烛果的CAT、SOD、POD活性呈先上升后下降的趋势。不同淹水-盐度交互处理条件下海榄雌、木榄、秋茄和红海兰的CAT活性随着时间推移总体均呈下降趋势, SOD活性总体呈先上升后下降的趋势;海榄雌的POD活性总体均呈先上升后下降再上升的趋势;而木榄、秋茄和红海兰的POD活性受淹水-盐度交互处理的影响较小。

|
| 图 5 不同淹水-盐度交互处理对红树林幼苗抗氧化酶活性的影响 Fig. 5 Effects of different submergence-salinity interaction treatments on antioxidant enzyme activities in mangrove seedlings |
2.4 淹水-盐度交互处理对红树林幼苗抗氧化酶活性影响的主成分分析
淹水-盐度交互处理对海榄雌的POD活性,以及对蜡烛果的CAT活性和SOD活性影响较大,而对木榄、秋茄和红海兰影响较小[图 6(a)]。前两个主成分(PC1、PC2)的累计解释方差比例为53.7%[图 6(b)],表明红树林幼苗抗氧化酶系统在前两个排序轴的载荷值较高。总体来说淹水-盐度交互处理对蜡烛果和海榄雌的影响较为明显,而对其他树种影响不大。
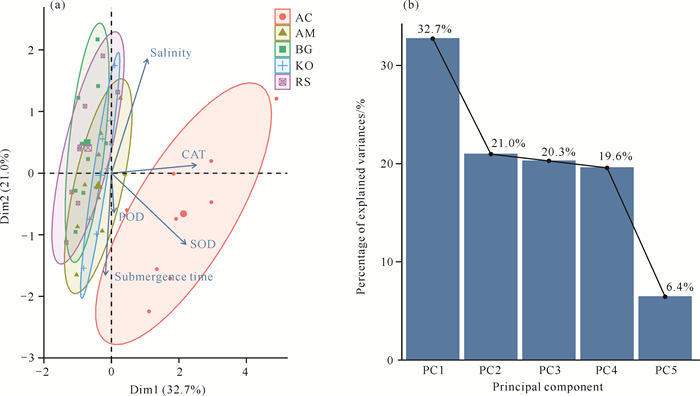
|
| 图 6 淹水-盐度交互处理对红树林幼苗抗氧化酶活性影响的主成分分析 Fig. 6 Principal component analysis of the effects of submergence-salinity interaction treatments on antioxidant enzyme activities in mangrove seedlings |
3 讨论 3.1 盐度处理对红树林幼苗抗氧化酶活性的影响
抗氧化酶系统通过减轻或阻断细胞膜脂质过氧化作用,保护其免受过氧化损伤,从而增强植物对逆境处理的适应能力,即清除植物细胞内过量的H2O2、超氧自由基等有害物质,以维持细胞氧化还原平衡和正常的生理功能,保护细胞膜的完整性[27-29]。本研究结果显示,当淹水时间不变时,随着盐度的增加,蜡烛果的CAT活性呈上升趋势;除淹水时间为4 h外,海榄雌的POD活性呈上升趋势。这表明盐度胁迫会使红树林幼苗体内H2O2和超氧阴离子等活性氧物质的积累增加,导致细胞内离子平衡受到破坏,当胁迫的盐度在红树林幼苗的耐受范围内时,红树林幼苗会通过增加CAT和POD活性来清除活性氧等物质,以维持细胞内氧化还原平衡[30]。研究表明,CAT和POD主要参与催化细胞内产生的H2O2分解成H2O和O2,以减少细胞内的氧化应激和氧化损伤[31-32]。另外,POD还能参与催化苯酚类物质的氧化聚合反应,促进植物细胞壁的合成,以及催化过氧化物酶参与细胞分裂、细胞伸长等重要的生理过程,以适应盐度胁迫[28, 33]。随着盐度的增加, 蜡烛果的SOD活性呈下降趋势,可能是由于SOD是植物抗氧化系统的第一道防线,在植物受到环境胁迫时能够将细胞内产生的超氧自由基转化为较稳定的H2O2和O2,从而减轻氧化应激带来的损伤[34]。因此,在红树林幼苗的耐受范围内,适度增加盐度可以刺激红树林幼苗的生长和代谢活动,促进抗氧化酶的合成和活性增加,以维持细胞氧化还原平衡和保护细胞完整性[24]。
3.2 淹水处理对红树林幼苗抗氧化酶活性的影响除盐度外,淹水时间也是影响红树林幼苗成活的关键因素。本研究发现,当盐度不变时,随着淹水时间的增加蜡烛果的CAT活性和海榄雌的POD活性总体呈下降趋势;除盐度为5外,蜡烛果的SOD活性呈上升趋势,海榄雌的CAT活性总体呈先上升后下降的趋势(图 4)。在淹水条件下植物根系无法获得足够的O2,CAT和POD是依赖O2参与催化反应的酶,当O2供应不足时,CAT和POD的活性会下降,导致CAT和POD无法正常清除细胞内的过氧化物[35]。Zhang等[36]研究表明,淹水植物可通过提高抗氧化酶活性来避免植物细胞发生氧化应激,从而维持细胞氧化还原平衡,但随着淹水时间增加,红树林幼苗通气受到限制,导致红树林幼苗根系缺氧,阻碍了POD的合成和积累。蜡烛果的SOD活性和海榄雌的CAT活性总体呈增加的趋势可能与植物激素的调控有关,植物在淹水条件下其体内的激素水平会发生变化,例如淹水可促进乙烯和脱落酸等激素积累,而这些激素可以通过调节抗氧化酶的合成和活性来增加红树林幼苗的抗氧化能力[37]。而部分红树林物种的抗氧化酶活性则随着淹水时间的增加逐渐降低,这可能与物种差异和外界环境有关[38-39]。
3.3 淹水-盐度交互处理对红树林幼苗抗氧化酶活性的影响本研究结果显示,不同的淹水-盐度交互处理对海榄雌的POD活性,以及对蜡烛果的CAT活性和SOD活性影响较大,而对木榄、秋茄和红海兰影响较小[图 6(a)]。其中,海榄雌的POD活性呈上升趋势(图 5),表明POD在植物的生长、发育以及应对外界逆境过程中发挥着重要作用。POD含量变化可以反映植物在遭受外界胁迫时的生理适应能力,同时也能体现植物在逆境条件下的自我保护机制,减轻植物损害[36, 38],说明海榄雌在淹水-盐度交互处理下比其他树种更具有优势。而淹水-盐度交互处理对蜡烛果的CAT活性和SOD活性的影响总体呈先上升后下降的趋势(图 5),说明蜡烛果在受到淹水-盐度交互处理时植物体内供氧缺乏,导致细胞内产生大量的活性氧自由基,引发氧化应激反应。CAT和SOD作为植物体内主要的抗氧化酶,能够有效减轻活性氧自由基的积累,缓解氧化应激对细胞的损伤。研究表明,CAT和SOD通过清除过量的活性氧,帮助植物维持细胞的氧化还原平衡,从而增强植物应对逆境的能力[31, 35]。因此,在胁迫初期,为适应外界的环境压力,蜡烛果合成和积累的CAT和SOD逐渐增加,以应对淹水-盐度交互处理造成的损伤。而随着胁迫时间的持续或延长,植物细胞受到的损伤逐渐加剧,严重时则表现为细胞膜破坏和蛋白质降解,导致细胞内合成抗氧化酶的结构和功能遭受无法修复的损伤,使CAT和SOD的合成受阻[35],因此,在胁迫后期蜡烛果细胞内的CAT和SOD活性呈下降趋势。
4 结论本研究通过在室内模拟北部湾全日潮潮汐规律,探究淹水-盐度交互处理对蜡烛果、海榄雌、木榄、秋茄和红海兰这5种红树林幼苗抗氧化酶活性的影响。结果发现,淹水-盐度交互处理对蜡烛果和海榄雌抗氧化酶活性的影响较大,两者的CAT、SOD、POD活性均处于较高水平;而淹水-盐度交互处理对木榄、秋茄和红海兰的抗氧化酶活性影响不明显,表明蜡烛果和海榄雌具有较强的耐盐和耐淹生物学特性。随着实验的进行,海榄雌的POD活性整体处于上升趋势,表明在同样的处理条件下海榄雌具有更强的适应性。不同的红树林树种应对淹水-盐度处理所表现出的生理响应不同,因此,在实际红树林造林过程中应根据各红树林树种对盐度和潮位高低的生理适应特征来选择合适的树种。本研究的不足之处主要体现在实验时间较短,且缺乏与野外实验的对比研究,研究主要集中在全日潮淹水-盐度交互作用下红树林幼苗抗氧化酶活性的变化上,未涉及长时间尺度和其他生态指标的综合分析。未来的研究可通过延长实验时间,并与野外实验进行对比分析,同时结合叶片功能性状和生物量等指标,进一步探讨不同红树林物种的适应机制和抗逆性。
| [1] |
DUKE N C, MEYNECKE J O, DITTMANN S, et al. A world without mangroves?[J]. Science, 2007, 317(5834): 41-42. |
| [2] |
DASGUPTA R, SHAW R. Participatory mangrove management in a changing climate mangrove: perspectives from the Asia-Pacific[M]. Tokyo: Springer, 2017.
|
| [3] |
范航清, 王文卿. 中国红树林保育的若干重要问题[J]. 厦门大学学报(自然科学版), 2017, 56(3): 323-330. |
| [4] |
阚志毅, 陈光程, 陈彬, 等. 热带气旋对红树林的影响研究进展: 基于文献计量分析[J]. 生态学报, 2023, 43(18): 7796-7806. |
| [5] |
王友绍. 全球气候变化对红树林生态系统的影响、挑战与机遇[J]. 热带海洋学报, 2021, 40(3): 1-14. |
| [6] |
邹鑫睿. 红树林育苗造林技术[J]. 现代园艺, 2023(16): 56-58. |
| [7] |
廖宝文, 郑德璋, 郑松发, 等. 我国华南沿海红树林造林现状及其展望[J]. 防护林科技, 1996(4): 30-34. |
| [8] |
陈鹭真, 王文卿, 林鹏. 潮汐淹水时间对秋茄幼苗生长的影响[J]. 海洋学报, 2005, 27(2): 141-147. |
| [9] |
庞国涛, 杨源祯, 张晓磊, 等. 广西珍珠湾红树林湿地沉积物烃类物质的分布及来源解析[J]. 海洋地质前沿, 2023, 39(8): 70-77. |
| [10] |
陈玉军, 陈文沛, 郑松发, 等. 广东番禺红树林造林研究[J]. 生态科学, 2001, 20(Z1): 25-31. |
| [11] |
KITAYA Y, JINTANA V, PIRIYAYOTHA S, et al. Early growth of seven mangrove species planted at different elevations in a Thai estuary[J]. Trees, 2002, 16(2): 150-154. |
| [12] |
张桂宏. 广西沿海地区潮汐特性分析[J]. 人民珠江, 2009, 30(1): 29-30. |
| [13] |
赵玖强, 张艳伟, 刘志飞, 等. 南海北部深海潮汐的季节性变化特征[J]. 中国科学: 地球科学, 2019, 49(4): 717-730. |
| [14] |
张伯虎, 陈沈良, 谷国传. 广西沿岸重点港湾的潮型与潮汐特征[J]. 海洋学研究, 2010, 28(3): 9-16. |
| [15] |
何斌源. 全日潮海区红树林造林关键技术的生理生态基础研究[D]. 厦门: 厦门大学, 2009.
|
| [16] |
CLARKE L D, HANNON N J. The mangrove swamp and salt marsh communities of the Sydney district: Ⅰ. vegetation, soils and climate[J]. The Journal of Ecology, 1967, 55(3): 753-771. DOI:10.2307/2258423 |
| [17] |
廖宝文, 邱凤英, 张留恩, 等. 红树植物白骨壤小苗对模拟潮汐淹浸时间的生长适应性[J]. 环境科学, 2010, 31(5): 1345-1351. |
| [18] |
SUNITI M A, CHOUDHURY A, GHOSH A, et al. The role of hydrophobic substances in leaves in adaptation of plants to periodic submersion by tidal water in a mangrove ecosystem[J]. Journal of Ecology, 1984, 42: 134-141. |
| [19] |
谭芳林, 游惠明, 黄丽, 等. 秋茄幼苗对盐度-淹水双胁迫的生理适应[J]. 热带作物学报, 2014, 35(11): 2179-2184. |
| [20] |
黄丽, 谭芳林, 林捷, 等. 木榄幼苗对淹水-盐胁迫的生理响应[J]. 防护林科技, 2018(12): 1-4, 15. |
| [21] |
ASHFORD A E, ALLAWAY W G. There is a continuum of gas space in young plants of Avicennia marina[J]. Hydrobiologia, 1995, 295(1): 5-11. |
| [22] |
游惠明. 秋茄幼苗对盐度、淹水环境的生长适应[J]. 应用生态学报, 2015, 26(3): 675-680. |
| [23] |
权佳惠. 贝克喜盐草对Zn、Cd胁迫的生理响应[D]. 南宁: 广西大学, 2022.
|
| [24] |
吕晓波. 海南岛六种红树植物幼苗对光照、盐度和淹水时间的生理适应性研究[D]. 海口: 海南大学, 2019.
|
| [25] |
韦宇静. 逆境胁迫对桐花树幼苗光合及生理特性影响的研究[D]. 桂林: 广西师范大学, 2015.
|
| [26] |
廖宝文. 三种红树植物对潮水淹浸与水体盐度适应能力的研究[D]. 北京: 中国林业科学研究院, 2010.
|
| [27] |
潘德灼, 林伟彬, 谭芳林, 等. 红树植物秋茄查尔酮合酶基因克隆及其在盐胁迫下的表达分析[J]. 福建农林大学学报(自然科学版), 2017, 46(2): 180-186. |
| [28] |
YE Y, TAM N F Y, LU C Y, et al. Effects of salinity on germination, seedling growth and physiology of three salt-secreting mangrove species[J]. Aquatic Botany, 2005, 83(3): 193-205. DOI:10.1016/j.aquabot.2005.06.006 |
| [29] |
ANJUM N A, SHARMA P, GILL S S, et al. Catalase and ascorbate peroxidase-representative H2O2-detoxifying heme enzymes in plants[J]. Environmental Science and Pollution Research, 2016, 23: 19002-19029. DOI:10.1007/s11356-016-7309-6 |
| [30] |
陈英华, 严重玲, 李裕红, 等. 盐胁迫下红海榄脯氨酸与活性氧代谢特征研究[J]. 厦门大学学报(自然科学版), 2004, 43(3): 402-405. |
| [31] |
孟德云, 侯林琳, 杨莎, 等. 外源多胺对盆栽花生盐胁迫的缓解作用[J]. 植物生态学报, 2015, 39(12): 1209-1215. |
| [32] |
ZHANG H, HAN B, WANG T, et al. Mechanisms of plant salt response: insights from proteomics[J]. Journal of Proteome Research, 2012, 11(1): 49-67. DOI:10.1021/pr200861w |
| [33] |
MA L, YANG S C. Growth and physiological response of Kandelia obovata and Bruguiera sexangula seedlings to aluminum stress[J]. Environmental Science and Pollution Research, 2022, 29: 43251-43266. |
| [34] |
MITTLER R, VANDERAUWERA S, GOLLERY M, et al. Reactive oxygen gene network of plants[J]. Trends in Plant Science, 2004, 9(10): 490-498. |
| [35] |
苏柏予, 张维仕, 王友绍. 三种红树根部组织抗氧化酶活性对水淹胁迫的响应[J]. 热带海洋学报, 2022, 41(6): 35-43. |
| [36] |
ZHANG X, LI X, HUANG G, et al. Interactive effects of salinity and flooding on photosynthesis, growth, and biomass allocation of two mangrove plant species[J]. Frontiers in Plant Science, 2016, 7: 1091-1098. |
| [37] |
MITTLER R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. |
| [38] |
ZHANG L N, ZHANG L C, XIA C, et al. The novel wheat transcription factor TaNAC47 enhances multiple abiotic stress tolerances in transgenic plants[J]. Frontiers in Plant Science, 2016, 6: 1174. |
| [39] |
HUANG B, CHEN Y E, ZHAO Y Q, et al. Exogenous melatonin alleviates oxidative damages and protects photosystem Ⅱ in maize seedlings under drought stress[J]. Frontiers in Plant Science, 2019, 10: 677. |



