2. 广西壮族自治区药用植物园,广西中药材良种繁育技术创新中心,广西南宁 530023;
3. 广西壮族自治区药用植物园,国家中医药传承创新中心,广西南宁 530023;
4. 广西壮族自治区药用植物园,西南濒危药材资源开发国家工程研究中心,广西南宁 530023
2. Guangxi Traditional Chinese Medicine Breeding Technology Innovation Center, Guangxi Botanical Garden of Medicinal Plants, Nanning, Guangxi, 530023, China;
3. National Center for TCM (Traditional Chinese Medicine) Inheritance and Innovation, Guangxi Botanical Garden of Medicinal Plants, Nanning, Guangxi, 530023, China;
4. National Engineering Research Center for the Development of Southwestern Endangered Medicinal Materials, Guangxi Botanical Garden of Medicinal Plants, Nanning, Guangxi, 530023, China
钩藤(Uncaria rhynchophylla)是茜草科(Rubiaceae)钩藤属(Uncaria)常绿藤本植物,其作为中药材始载于梁代陶弘景的《名医别录》,具有悠久的用药历史,也是我国常用大宗中药材之一[1]。据《中华人民共和国药典:一部》(2020年版)[2]记载:“钩藤味甘、性凉,具息风定惊、清热平肝等功效,用于肝风内动、惊痫抽搐、高热惊厥、感冒夹惊、小儿惊啼、妊娠子痫、头痛眩晕等症。”历代的本草古籍及各个版本的《中华人民共和国药典》均将带钩藤茎作为钩藤的主要药用部位,相比于钩藤的其他组织器官,其被认为具有更好的药理作用[3]。《本草纲目》(明代)[4]记载:“钓藤,其刺曲如钓钩,故名。或作吊,从简尔。状如葡萄藤而有钩,紫色。古方多用皮,后世多用钩,取其力锐尔。”《本草从新》(清代)[5]对钩藤品质的记载:“藤细多钩者良(去梗、纯用嫩钩、其功十倍)。”因此,在中药材市场上,钩藤的茎钩与茎之比决定钩藤药材价格,比例越高价格越高[6]。
钩藤作为一种攀缘藤本植物,其茎钩就是着生在叶腋处的攀缘器官。不同植物攀缘器官的起源不同[7],葫芦科(Cucurbitaceae)的卷须被认为是改良的侧枝[8-9],豌豆的卷须起源于小叶[10],而葡萄的卷须被鉴定为改良的花序[11]。与葡萄的卷须一样,钩藤的茎钩与其花序梗属同源器官[12]。钩藤的茎钩由花序梗败育而成,花序梗是植物花器官的组成部分之一,即花序的柄。钩藤营养生长时,枝条叶腋处发育为茎钩,而钩藤生殖生长时,大部分新长出来的枝条叶腋处则发育为花序梗进入花期,而生殖枝条和转变成的花序梗是不能作为钩藤药材商品的,导致钩藤药材产量降低,影响钩藤种植药农的经济效益。由此可见,钩藤茎钩、花序梗的形成和发育与钩藤药材的质量和产量密切相关,然而,迄今为止钩藤茎钩同源转化为花序梗的发育机制尚不清楚。
营养生长和生殖生长是植物生命周期中两个重要的生长阶段,两者的转换在于植物花芽分化能力的获得与丧失[13]。植物花芽分化及花的发育与植物内源激素含量变化和平衡密切相关[14],通过调控植物内源激素含量和平衡可实现营养生长和生殖生长的转换[15],如赤霉素(Gibberellic Acid,GA)处理提升了甘蓝型油菜内源GA、细胞分裂素含量, 从而促进初花期提前[16];外源24-表油菜素内酯处理改变了苹果内源生长素、GA3和脱落酸之间的平衡进而促进花芽分化[17];激素处理对葡萄花芽分化的研究表明,细胞分裂素促进花序从原基中发育,赤霉素则抑制原基分化成花序而形成卷须[18]。因此,本研究拟采用液相色谱-质谱(LC-MS)联用方法对钩藤营养生长时期的茎钩和生殖生长时期的花序梗两种同源但形态截然不同的组织器官的内源激素进行测定和分析,深入了解钩藤茎钩、花序梗在生长发育过程中内源激素的动态变化规律,以期为生产实践中精准调控钩藤的茎钩和花序梗发育提供理论依据。
1 材料与方法 1.1 材料实验材料为处于生殖生长阶段的钩藤植株,此时钩藤植株同时存在营养枝条和生殖枝条,营养枝条上的茎钩和生殖枝条上的花序梗是钩藤的同源器官,为研究同源器官不同发育形态的内源激素含量变化与比较提供了理想的材料。因此,本研究以3个不同发育阶段的钩藤茎钩和花序梗为研究对象,其中在钩藤营养枝条采集第1茎节(FAH)、第3茎节(SAH)和第5茎节(TAH)处的茎钩作为不同发育时期的茎钩样品(AH)[图 1(a)];而在钩藤生殖枝条上采集处于花蕾期(FFH)、半开花期(SFH)、盛花期(TFH)时的花序梗作为不同发育时期的花序梗样品(FH)[图 1(b)]。

|
| 图 1 钩藤不同发育时期的AH(a)与FH(b) Fig. 1 AH (a) and FH (b) of Uncaria rhynchophylla at different developmental stages |
采集5株钩藤植株营养枝条上的AH和生殖枝条上的FH作为一个样品,将同一类型同一时期的样品均匀混合,并随机分成3份作生物学重复。所有植物材料用铝箔包裹,然后立即放入液氮中,在-80 ℃超低温冰箱中保存备用。
1.2 内源激素测定 1.2.1 标准曲线绘制本研究预检测的植物内源激素包括8大类21种常见植物内源激素及其合成前体的水平,分别为赤霉素类(GA1、GA3、GA4、GA7),茉莉酸类[Jasmonic Acid (JA)、Jasmonic Acid-Isoleucine (JA-ILe)、cis-Oxo-Phytodienotic Acid (cis-OPDA)],脱落酸类(Abscisic Acid, ABA),水杨酸类(Salicy Acid, SA),细胞分裂素类[isopentenyladenine (iP)、isopentenyladenine Riboside (iPR)、trans-Zeatin (tZ)、trans-zeatin Riboside (tzR)、cis-Zeatin (cZ)、cis-zeatin Riboside (czR)、Dihydrozeatin (DHZ)],油菜素内酯类[Brassinolide (BL)、Typhasterol (TY)、Castasterone (CS)],乙烯类(1-Aminocyclopropane-1-Carboxylate,ACC)和生长素类(Indole-3-Acetic Acid,IAA)。将以上21种植物内源激素的标准品溶于甲醇水溶液中,并稀释为系列浓度的标准溶液,采用同位素内标法建立标准曲线。
1.2.2 内源激素提取从-80 ℃超低温冰箱中取出样品,用液氮研磨成粉末状后称量100 mg于2 mL离心管中,加入50 μL内标溶液,加入1 mL的乙腈∶水∶甲酸(80∶19∶1, V∶V∶V)提取液,涡旋60 s,低温超声30 min,-20 ℃放置12 h沉淀蛋白,然后在4 ℃条件下,以14 000 r/min离心20 min,收集上清液,将上清液移至Ostro25 mg 96孔去磷脂板中,使用正压装置进行过滤,再向孔中加入200 μL上述提取液洗脱,将滤液氮气吹干。用200 μL的乙腈∶水(1∶1, V∶V)复溶,14 000 r/min离心10 min,取上清液,采用液相色谱-质谱(LC-MS)联用方法对内源激素进行测定分析。
1.2.3 液相色谱-质谱联用分析(1) 色谱条件。样品采用超高效液相色谱系统(I-Class, 美国Waters公司)进行分离。流动相:A液为0.05%甲酸水溶液,B液为0.05%甲酸乙腈溶液。样品置于4 ℃自动进样器中,柱温为45 ℃,流速为400 μL/min,进样量为2 μL。相关液相梯度:0-10.0 min,B液从2%线性变化至98%;10.0-10.1 min,B液从98%线性变化至2%;11.1-13.0 min,B液维持在2%。样本队列中每间隔一定数量的实验样本设置一个质量控制样本(Quality Control Sample, QC样本),用于检测和评价系统的稳定性及重复性。
(2) 质谱分析。采用三重四极杆-线性离子阱质谱仪(5500 QTRAP,上海爱博才思分析仪器贸易有限公司)在正/负离子模式下进行质谱分析。离子源温度为500 ℃,离子源气体1(Gas1)压力为45 psi (1 psi≈6.9 kPa),离子源气体2(Gas2)压力为45 psi,帘气(CUR)压力为30 psi,离子喷雾电压(ISVF)为-4 500 V;采用质谱多反应监测(MRM)技术检测待测离子对。
1.3 数据处理与分析 1.3.1 样品分析所有待测样品等量混合制备成QC样本,利用QC样本考察检测过程的稳定性。
样品的液相色谱-质谱联用分析结果采用Multiquant 3.0.2软件提取色谱峰面积及保留时间,再根据标准曲线计算样品中内源激素的含量。
根据各内源激素含量水平,对钩藤茎钩和花序梗3个时期所有样品进行主成分分析(Principal Components Analysis,PCA),以确定同一时期3个生物重复之间的一致性和不同时期的分离情况。
1.3.2 数据统计与作图使用SPSS 22.0软件对各内源激素含量在不同发育时期进行P<0.05的显著性检验和多重比较(Duncan法),使用Origin 9.1软件绘制图片;使用R语言拓展工具RStudio对数据进行相关性分析,并对分析结果中相关系数大于0.60的内源激素间相互作用网络采用Cytoscape 3.8.0软件进行可视化处理。
2 结果与分析 2.1 标准曲线方程本研究共制备了8大类21种常见植物内源激素及其合成前体的系列浓度标准溶液。通过拟合各植物内源激素的线性回归标准曲线, 得到的方程相关系数均大于0.998 00(表 1),表明各植物内源激素在线性范围内的线性关系良好。
| 序号 No. |
激素 Phytohormone |
保留时间/min Retention time/min |
线性回归方程 Linear regression equation |
相关系数 R |
| 1 | GA1 | 4.839 943 429 | y=0.01322x+0.06398 | 0.999 10 |
| 2 | GA3 | 4.683 440 909 | y=0.03063x+0.07908 | 0.999 62 |
| 3 | GA4 | 8.393 337 080 | y=0.01285x+0.05922 | 0.999 58 |
| 4 | GA7 | 8.307 594 251 | y=0.00266x+0.00247 | 0.999 36 |
| 5 | JA | 7.741 639 097 | y=1645.40128x+15141.91835 | 0.998 13 |
| 6 | JA-ILe | 8.679 623 696 | y=5485.09333x-3056.92177 | 0.999 82 |
| 7 | cis-OPDA | 10.055 795 970 | y=134.38095x-440.05946 | 0.998 52 |
| 8 | ABA | 7.046 657 044 | y=(6.15342e-4)x+(3.82379e-4) | 0.999 00 |
| 9 | SA | 5.437 658 831 | y=0.05588x+1.54731 | 0.999 43 |
| 10 | tZ | 2.072 113 670 | y=0.10422x+0.04679 | 0.999 45 |
| 11 | cZ | 2.071 792 352 | y=50982.9x-2714.47695 | 0.999 35 |
| 12 | DHZ | 2.130 534 557 | y=0.03759x+0.16195 | 0.998 14 |
| 13 | tzR | 2.635 750 599 | y=0.06858x+0.01031 | 0.999 17 |
| 14 | iPR | 5.372 830 099 | y=0.07339x-0.03511 | 0.999 73 |
| 15 | iP | 3.974 821 600 | y=0.04281x-0.01182 | 0.998 57 |
| 16 | BL | 9.305 570 744 | y=0.00692x+0.07270 | 0.998 43 |
| 17 | CS | 9.597 368 516 | y=0.02092x+0.15375 | 0.998 80 |
| 18 | TY | 10.898 216 670 | y=2247.01687x+11832.36899 | 0.999 92 |
| 19 | ACC | 0.656 154 440 | y=0.01457x-0.01228 | 0.999 38 |
| 20 | IAA | 5.848 231 155 | y=0.00254x-0.00717 | 0.998 38 |
| 21 | czR | 2.628 033 333 | y=0.06801x+0.00531 | 0.999 78 |
2.2 样品质控评价
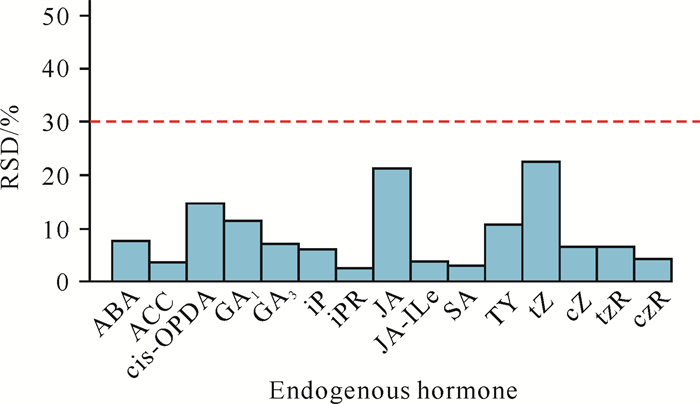
为考察检测过程的稳定性,将所有样品等量混合制备QC样品。由图 2可知,从QC样品中共检出15种内源激素,且各内源激素的相对标准偏差(Relative Standard Deviation, RSD)均小于30%,说明实验数据稳定可靠。
|
| 图 2 所有待测样品等量混制QC样品内源激素的RSD分布 Fig. 2 RSD distribution of endogenous phytohormones in QC samples mixed with equal amounts of all samples to be tested |
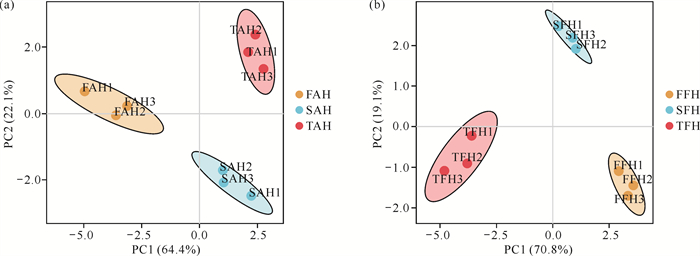
钩藤AH和FH不同发育时期内源激素的PCA结果如图 3所示。同一发育时期3次生物学重复样品聚类在一起,表明所得数据具有良好的重复性和较高的可靠性;而不同发育时期则显示明显的分离,表明不同发育时期AH和FH中内源激素变化具有显著差异。AH和FH中内源激素变化在第一主成分均沿着发育时期呈现。对于AH的内源激素数据集,FAH与SAH、TAH的区分更为明显,PC1解释了64.4%[图 3(a)];而对于FH的内源激素数据集,TFH与FFH、SFH的区分则更为明显,PC1解释了70.8%[图 3(b)],这也表明AH的内源激素显著变化主要发生在发育前期,而FH的内源激素显著变化则集中在后期。
|
| 图 3 钩藤不同发育时期AH(a)和FH(b)内源激素的PCA Fig. 3 PCA of endogenous phytohormones in AH (a) and FH (b) of Uncaria rhynchophylla at different developmental stages |
2.3 内源激素含量动态变化
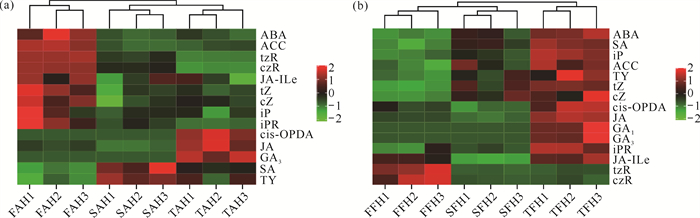
AH检测到14种内源激素中有9种(ABA、ACC、tzR、czR、JA-ILe、tZ、cZ、iP、iPR)在发育前期含量最高,只有3种(cis-OPDA、JA、GA3)在发育后期含量最高[图 4(a)];而FH检测到15种内源激素中除2种(tzR、czR)在发育前期含量最高外,其余13种(ABA、SA、iP、ACC、TY、tZ、cZ、cis-OPDA、JA、GA1、GA3、iPR、JA-ILe)在发育后期含量最高[图 4(b)]。可见,不同发育时期AH和FH内源激素的聚类热图与其PCA结果一致。
|
| 图 4 钩藤不同发育时期AH(a)和FH(b)内源激素的聚类热图 Fig. 4 Cluster heat map of endogenous phytohormones in AH (a) and FH (b) of Uncaria rhynchophylla at different developmental stages |
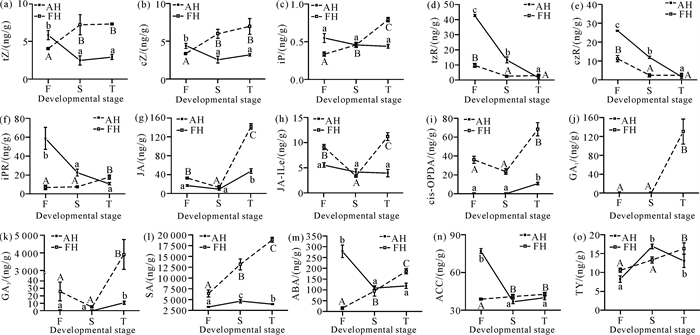
钩藤不同发育时期AH和FH内源激素的含量变化见图 5。AH发育过程中,tZ、cZ、iPR、ABA、ACC的含量变化趋势相似,在发育前期(F)显著高于发育中期(S)和后期(T);tzR和czR的含量变化趋势相似,随发育时间显著下降;但JA、cis-OPDA、GA3的含量则在发育后期显著高于发育前期和中期。FH发育过程中,tZ、cZ、ACC的含量变化趋势与AH正好相反,在发育前期显著低于发育中期和后期;tzR、czR的含量变化趋势则与AH相似,随发育时间下降,且在发育前期和中期显著低于AH;JA、JA-ILe、cis-OPDA、GA3的含量变化趋势相似,呈先下降后显著上升至最高值;而iPR、GA1、SA、ABA、ACC、TY的含量呈逐渐上升的趋势。钩藤AH和FH二者相比,FH内源激素的含量在发育后期均高于AH。
|
| Different lowercase letters indicate significant differences among AH groups, while different uppercase letters indicate significant differences among FH groups (P < 0.05). 图 5 钩藤不同发育时期AH和FH内源激素的含量变化 Fig. 5 Concentration changes of endogenous phytohormones in AH and FH of Uncaria rhynchophylla at different developmental stages |
2.4 植物内源激素间的相互作用
钩藤AH和FH发育过程中的内源激素相关性分析结果见图 6。AH发育过程中,检测到的14种内源激素根据相关程度可聚成4类[图 6(a)],即tZ、cZ、ABA、ACC聚为一类,两两之间的相关系数均高于0.71,其水平均呈先降低后趋于平稳的变化趋势[图 5:(a)、(b)、(m)、(n)];tzR、czR、iPR聚为一类,两两之间的相关系数均高于0.88,其水平随发育时间显著下降[图 5:(d)-(f)];JA、cis-OPDA、GA3聚为一类,两两之间的相关系数均高于0.89,其水平呈先稳定后骤升的变化趋势[图 5:(g)、(i)、(k)];SA和TY聚为一类,二者的相关系数为0.90,其水平呈先升高后降低的变化趋势[图 5:(l)、(o)]。FH发育过程中,检测到的15种内源激素根据相关程度也可聚成4类[图 6(b)],即iPR、JA、cis-OPDA、GA1、GA3聚为一类,两两之间的相关系数均高于0.78,其水平均呈先稳定后骤升的变化趋势[图 5:(f)、(g)、(i)、(j)、(k)];iP、SA、ABA、ACC、TY聚为一类,其水平随发育时间显著上升[图 5:(c)、(l)、(m)、(n)、(o)];tZ、cZ,tzR、czR分别聚为一类,但这两类的变化趋势正好相反,tZ、cZ呈先升高后趋于平稳的变化趋势[图 5:(a)、(b)],tzR、czR则呈先降低后趋于平稳的变化趋势[图 5:(d)、(e)]。
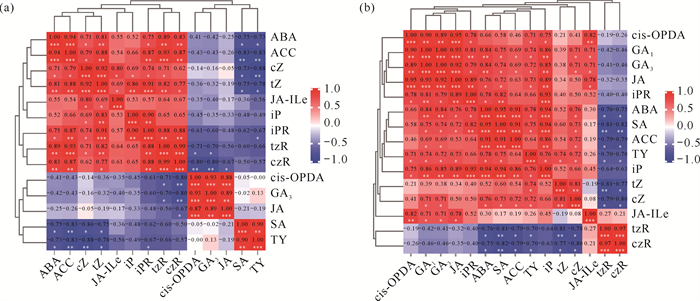
|
| 图 6 钩藤的AH(a)和FH(b)内源激素间的相关性分析 Fig. 6 Correlation analysis of endogenous phytohormones in AH (a) and FH (b) of Uncaria rhynchophylla |
进一步进行相互作用网络分析,并尝试确定其中的关键内源激素,结果表明tZ、cZ为AH发育过程中的节点内源激素,在AH发育中期和后期其水平显著下降,可能影响AH的进一步生长发育[图 7(a)]。FH发育过程中的节点内源激素为GA1、GA3、SA、ABA、TY,其在FH发育后期均显著升高[图 7(b)]。
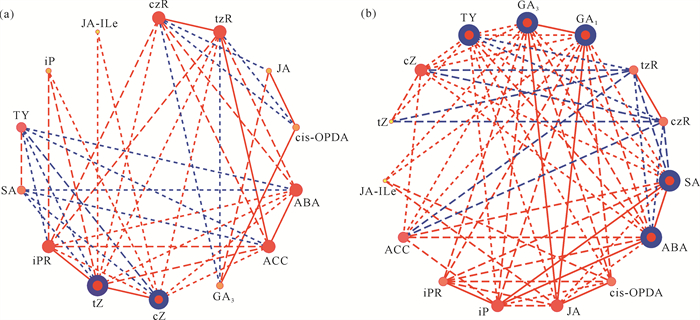
|
| The circle size is positively correlated with the phytohormone level.Red and blue connecting lines indicate positive and negative correlations, respectively, between phytohormones.Blue-framed red circles indicate core phytohormones. 图 7 钩藤AH(a)和FH(b)内源激素的相互作用网络图 Fig. 7 Interaction network diagram of endogenous phytohormones in AH (a) and FH (b) of Uncaria rhynchophylla |
3 讨论
内源激素是植物体内产生的具有生理活性的有机化合物,在植物响应外部环境变化及调节自身生长过程中发挥重要作用[19]。然而,其在植物体内含量极低,且易受环境因素和其他化合物干扰,稳定性较差[20],因此对植物内源激素进行精确测定十分困难。目前,测定内源激素的主要方法包括生物鉴定法、免疫学方法、理化检测法、色谱法和液相色谱-质谱联用方法等[21]。其中,液相色谱-质谱联用方法因其操作简便快速、专属性强、灵敏度高、分子离子峰丰度大等优势,能够获得高质量的定性和定量数据,已逐渐成为检测植物内源激素的理想方法[22]。本研究采用液相色谱-质谱联用方法同时测定钩藤茎钩和花序梗中的多种内源激素,所有目标内源激素在线性范围内均呈现良好的线性关系,相关系数均大于0.998 00(表 1);从QC样品中共检测出15种内源激素,各内源激素的RSD均小于30%(图 2),符合方法学验证要求。因此,本研究建立的液相色谱-质谱联用方法适用于钩藤茎钩和花序梗中多种内源激素的快速、准确检测。
钩藤的茎钩是营养生长期着生于叶腋处的攀缘器官,与生殖生长期的花序梗为同源器官[12]。可见,钩藤的茎钩与花序梗属同一花器官组织的不同形态表现,而植物的花芽分化及发育过程与内源激素变化密切相关[14]。本研究通过检测钩藤茎钩和花序梗不同发育时期的内源激素,发现二者所含内源激素种类相似但存在差异,茎钩中检出14种内源激素,花序梗则多检出GA1,共15种(图 4);部分内源激素变化规律具有相似性,相关性分析显示JA、cis-OPDA、GA3在茎钩和花序梗中均呈先稳定后骤升的变化趋势,但花序梗中这3种内源激素含量始终高于茎钩(图 6)。然而,二者在发育过程中的内源激素含量及动态变化存在显著差异:(1)PCA结果表明茎钩的内源激素显著变化主要发生在发育前期,而花序梗则集中在发育后期(图 3);(2)聚类分析和含量变化曲线显示,tZ、cZ、iP、iPR、ABA和ACC等内源激素在茎钩与花序梗发育过程中呈近乎相反的变化趋势,茎钩在发育前期含量最高,而花序梗则在发育后期达到峰值(图 4、图 5);(3)相关性分析发现,ABA、ACC,cZ、tZ,tzR、czR,SA、TY这4组内源激素无论在茎钩还是花序梗中均呈高度正相关(图 6),但其动态变化迥异,如SA和TY的含量在茎钩中呈先升高后降低的趋势,而在花序梗中随发育时间逐渐上升;(4)相互作用网络分析进一步揭示,茎钩发育的节点内源激素为tZ、cZ,而花序梗则为GA1、GA3、SA、ABA、TY(图 7)。由此可见,钩藤茎钩和花序梗中不同发育时期内源激素的含量和变化规律显著不同,表明其差异发育受内源激素的显著影响。
细胞分裂素类在调控植物营养生长和生殖生长的转换过程中发挥着重要作用[23]。作为一类内源激素,细胞分裂素能促进植物细胞分裂。研究表明,细胞分裂素可通过调节植物分生组织活性来诱导花芽分化并促进开花[24]。例如,在无花果花芽分化过程中,玉米素核苷(Zeatin Ribosides, ZRs)含量逐渐升高[25];同样,在苹果花芽生理分化期,ZRs含量也维持在较高水平[26]。本研究在钩藤茎钩和花序梗中共检测到iP、iPR、tz、tzR、cz、czR 6类细胞分裂素类内源激素,其中iP、iPR、tz、cz在钩藤茎钩和花序梗发育过程中的变化趋势近乎是相反的,随着发育进程,这些激素在茎钩中呈下降趋势(可能抑制细胞分裂和增大),而在花序梗中则呈上升趋势(图 4、图 5)。这一结果与细胞分裂素介导葡萄卷须向花序转化的研究结论相似[27]。从分子水平来看,细胞分裂素可通过激活FT的等位基因TSF和编码TSF的伴侣蛋白FD,并诱导下游基因SOC1的过度表达来促进开花[28]。因此,笔者推测较高水平的细胞分裂素类内源激素可能有利于钩藤的花芽分化和花器官发育。
ABA是调控植物开花的重要激素之一[24]。研究表明,高水平的ABA能促进花芽分化及开花[29]。例如,在樱花品种“十月樱”(Cerasus subhirtella ‘Autumnalis’)中,ABA可促进植株从营养生长向生殖生长转变,并加速花芽分化进程[30]。这一机制可能与ABA能促进细胞分裂素、淀粉和糖类等物质积累有关,从而有利于成花[31]。本研究发现,ABA是花序梗发育过程中的节点内源激素之一[图 7(b)],其含量随发育进程呈显著上升趋势[图 5(m)]。这表明花序梗中ABA含量升高对钩藤花发育与成熟具有促进作用。
赤霉素与植物成花调控紧密相关,但其对不同植物花芽分化的影响存在差异[32]。例如,赤霉素会抑制杧果(Mangifera indica)[33]和荔枝(Litchi chinensis)[34]的花芽分化和开花过程,却能促进棉花(Gossypium hirsutum)[35]和木芙蓉(Hibiscus mutabilis)[36]的花芽分化。本研究发现,钩藤花序梗中的GA1和GA3含量在花蕾期和半开花期较低,但在盛花期迅速升高[图 5:(j)、(k)],这一现象与胡桃楸(Juglans mandshurica)[37]和巴山木竹(Bashania fargesii)[38]中的表现一致。已有研究表明,花诱导后,赤霉素对花器官细胞的增殖和伸长起着关键作用,尤其是雄蕊、花瓣与子房[39]。例如,赤霉素合成缺陷突变体(ga1-3,ga1-6)的拟南芥(Arabidopsis thaliana)表现出花瓣、雄蕊和花丝生长受抑制的表型[40]。因此,笔者推测钩藤花序梗在盛花期赤霉素含量的迅速升高可能与其花器官发育有关。
4 结论本研究采用液相色谱-质谱联用方法建立了一种高效、准确的钩藤茎钩和花序梗内源激素测定方法,并分析了二者在不同发育时期内源激素的变化规律。结果表明:在钩藤茎钩形成和发育过程中,细胞分裂素类内源激素含量显著下降,而花序梗中的iP、iPR、tz、cz等细胞分裂素类内源激素则在发育过程中明显上升,说明细胞分裂素是调控钩藤茎钩和花序梗差异发育的关键内源激素。此外,花序梗发育过程中ABA含量上升,特别是在盛花期GA1和GA3显著增加,对促进钩藤花器官生长与发育具有重要作用。由此可见,虽然钩藤茎钩和花序梗具有相同起源,但最终分化形成不同形态,这一过程中内源激素调控起着关键作用。然而,关于内源激素调控茎钩和花序梗发育的具体机制仍需进一步深入研究。
| [1] |
穆德添, 万凌云, 韦树根, 等. 钩藤不同部位总RNA提取及UrSTR基因的克隆与表达分析[J]. 农业生物技术学报, 2022, 30(9): 1737-1746. |
| [2] |
国家药典委员会. 中华人民共和国药典: 一部[M]. 2020年版. 北京: 中国医药科技出版社, 2020.
|
| [3] |
WAN L Y, PAN L M, SONG L S, et al. Transcriptional analysis reveals formation of axillary solitary hook in vine plant Uncaria rhynchophylla[J]. Plant Biotechnology Reports, 2023, 17(5): 701-713. DOI:10.1007/s11816-022-00808-3 |
| [4] |
李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1982: 1319.
|
| [5] |
吴仪洛. 本草从新[M]. 北京: 人民卫生出版社, 1990: 321.
|
| [6] |
HOU J J, FENG R H, ZHANG Y B, et al. Characteristic chromatogram: a method of discriminate and quantitative analysis for quality evaluation of Uncaria stem with hooks[J]. Planta Medica, 2018, 84(6/7): 449-456. |
| [7] |
CHEN P H, CHUNG A C, LIN H C, et al. Climbing strategies of Taiwan climbers[J]. Botanical Studies, 2023, 64(1): 26. DOI:10.1186/s40529-023-00399-4 |
| [8] |
HONG Z H, WANG X R, YANG A Y, et al. Tendril morphogenesis is regulated by a CsaTEN-CsaUFO module in cucumber[J]. New Phytologist, 2023, 239(1): 364-373. DOI:10.1111/nph.18908 |
| [9] |
曾康, 汪淑雯, 周冰莹, 等. 葫芦科园艺作物卷须发生的研究进展[J]. 浙江农林大学学报, 2020, 37(6): 1216-1223. |
| [10] |
SHUBHA K, DHAR S, MAITY A, et al. Infuence of leaf architecture on morpho-phenological and yield related traits of garden pea[J]. Indian Journal of Horticulture, 2021, 78(2): 155-162. DOI:10.5958/0974-0112.2021.00022.0 |
| [11] |
ARRO J, YANG Y, SONG G Q, et al. Transcriptome analysis unveils a potential novel role of VvAP1 in regulating the developmental fate of primordia in grapevine[J]. Fruit Research, 2024, 4(1): e011. |
| [12] |
SPEROTTO P, ACEVEDO-RODRÍGUEZ P, VAS-CONCELOS T N C, et al. Towards a standardization of terminology of the climbing habit in plants[J]. The Botanical Review, 2020, 86(3): 180-210. |
| [13] |
郑婷, 张克坤, 张培安, 等. 葡萄营养生长与生殖生长间的转变研究进展[J]. 植物生理学报, 2020, 56(7): 1361-1372. |
| [14] |
BLÁZQUEZ M A, FERRÁNDIZ C, MADUEÑO F, et al. How floral meristems are built[J]. Plant Molecular Biology, 2006, 60(6): 855-870. DOI:10.1007/s11103-006-0013-z |
| [15] |
罗颀, 林哲, 黄政档, 等. 三角梅开花早期不同分化时期的激素水平与相关性分析[J]. 厦门大学学报(自然科学版), 2022, 61(1): 122-129. |
| [16] |
章虹. 外源激素对甘蓝型油菜花期调控的影响研究[D]. 合肥: 安徽农业大学, 2022.
|
| [17] |
杨天一. 外源24-表油菜素内酯对苹果树体生长及花芽分化的影响[D]. 杨凌: 西北农林科技大学, 2022.
|
| [18] |
张彦苹, 慕茜, 李晓鹏, 等. 葡萄卷须及其相关研究[J]. 植物生理学报, 2013, 49(3): 234-240. |
| [19] |
黎家, 李传友. 新中国成立70年来植物激素研究进展[J]. 中国科学: 生命科学, 2019, 49(10): 1227-1281. |
| [20] |
李健健, 尹广鹍, 叶双全, 等. 基于UPLC-MS/MS分析刺梨种子萌发过程中几种内源激素含量变化[J]. 湖北民族大学学报(自然科学版), 2021, 39(2): 128-133, 138. |
| [21] |
智绪, 金桂花, 吴桐彬, 等. 高效液相色谱串联质谱法测定黄芩中的植物内源激素[J]. 印染助剂, 2023, 40(1): 51-56. |
| [22] |
XU J, ZHANG Q F, ZHENG J, et al. Mass spectrometry-based fecal metabolome analysis[J]. TrAC Trends in Analytical Chemistry, 2019, 112: 161-174. DOI:10.1016/j.trac.2018.12.027 |
| [23] |
BARBOSA N C S, DORNELAS M C. The roles of gibberellins and cytokinins in plant phase transitions[J]. Tropical Plant Biology, 2021, 14(1): 11-21. DOI:10.1007/s12042-020-09272-1 |
| [24] |
江海都, 孙菲菲, 秦惠珍, 等. 四季花金花茶花芽分化进程及叶片内源激素变化[J]. 广西植物, 2024, 44(1): 56-67. |
| [25] |
罗羽洧, 解卫华, 马凯. 无花果花芽分化与内源激素含量的关系[J]. 西北植物学报, 2007, 27(7): 1399-1404. |
| [26] |
曹尚银, 张俊昌, 魏立华. 苹果花芽孕育过程中内源激素的变化[J]. 果树科学, 2000, 17(4): 244-248. |
| [27] |
MONTEIRO A I, MALHEIRO A C, BACELAR E A. Morphology, physiology and analysis techniques of grapevine bud fruitfulness: a review[J]. Agriculture, 2021, 11(2): 127. DOI:10.3390/agriculture11020127 |
| [28] |
D'ALOIA M, BONHOMME D, BOUCHÉ F, et al. Cytokinin promotes flowering of Arabidopsis via transcriptional activation of the FT paralogue TSF[J]. The Plant Journal, 2011, 65(6): 972-979. DOI:10.1111/j.1365-313X.2011.04482.x |
| [29] |
赵家昱, 潘远智, 李永红. 外源ABA对叶子花开花及内源ABA合成关键酶的影响[J]. 园艺学报, 2014, 41(10): 2085-2093. |
| [30] |
杜立言, 郑娜, 李静静, 等. 樱花品种'十月樱'花芽分化期内源激素含量变化[J]. 森林与环境学报, 2021, 41(1): 51-59. |
| [31] |
王玉华, 范崇辉, 沈向, 等. 大樱桃花芽分化期内源激素含量的变化[J]. 西北农业学报, 2002, 11(1): 64-67. |
| [32] |
WILKIE J D, SEDGLEY M, OLESEN T. Regulation of floral initiation in horticultural trees[J]. Journal of Experimental Botany, 2008, 59(12): 3215-3228. DOI:10.1093/jxb/ern188 |
| [33] |
NAKAGAWA M, HONSHO C, KANZAKI S, et al. Isolation and expression analysis of FLOWERING LOCUS T-like and gibberellin metabolism genes in biennial-bearing mango trees[J]. Scientia Horticulturae, 2012, 139: 108-117. DOI:10.1016/j.scienta.2012.03.005 |
| [34] |
吴志祥, 周兆德, 陶忠良, 等. 妃子笑与鹅蛋荔枝花芽分化期间内源激素的变化[J]. 热带作物学报, 2005, 26(4): 42-45. |
| [35] |
任桂杰, 董合忠, 陈永喆, 等. 棉花花芽分化时期茎尖内源激素的变化[J]. 西北植物学报, 2002, 22(2): 113-118. |
| [36] |
朱章顺, 王强锋, 李芹, 等. 木芙蓉花期不同阶段主要器官内源激素含量的变化[J]. 西部林业科学, 2021, 50(6): 16-23. |
| [37] |
秦柏婷, 蔡佳友, 傅靖棋, 等. 胡桃楸不同发育器官内源激素的动态变化[J]. 分子植物育种, 2022, 20(15): 5130-5137. |
| [38] |
杜喜春, 何祥博, 赵银萍, 等. 巴山木竹开花前后植物内源激素变化研究[J]. 云南大学学报(自然科学版), 2022, 44(3): 612-618. |
| [39] |
李巧峡, 张丽, 王玉, 等. 赤霉素调控植物开花及花器官发育的研究进展[J]. 中国细胞生物学学报, 2019, 41(4): 746-758. |
| [40] |
BROCK M T, KOVER P X, WEINIG C. Natural variation in GA1 associates with floral morphology in Arabidopsis thaliana[J]. New Phytologist, 2012, 195(1): 58-70. |



