2. 西安交通大学等离子体生物医学研究中心,陕西西安 710049
2. Center for Plasma Biomedicine, Xi′an Jiaotong University, Xi′an, Shaanxi, 710049, China
金黄色葡萄球菌(Staphylococcus aureus)是一种广泛存在于自然环境中的革兰氏阳性菌,同时也是人类和动物的重要病原菌之一。它不仅能够引起皮肤和软组织感染,还可能导致严重的全身性感染,如败血症、肺炎和心内膜炎等[1]。近年来,随着抗生素的广泛使用,金黄色葡萄球菌的耐药性问题日益凸显,尤其是耐甲氧西林金黄色葡萄球菌(MRSA)的出现,使得传统抗生素治疗面临巨大挑战[2]。MRSA的流行不仅增加了治疗的难度,还显著提高了患者的死亡率和医疗成本[3]。因此,开发新型、高效的杀菌技术对于控制金黄色葡萄球菌感染具有重要意义。
近年来,等离子体技术作为一种新兴的物理杀菌方法,受到了广泛关注。等离子体是物质的第四态,由离子、电子、自由基和激发态分子等组成,具有高活性、低温和环境友好等特点[4]。研究表明,等离子体能够通过产生活性氧物种(Reactive Oxygen Species, ROS)和活性氮物种(Reactive Nitrogen Species, RNS)等化学物质,破坏细菌的细胞膜、蛋白质和DNA,从而达到高效的杀菌效果[5]。等离子体技术在杀菌方面的应用已取得了显著进展,尤其是在食品消毒、医疗器械灭菌和伤口处理等领域[6-8]。例如,Liu等[9]研究发现,等离子体处理能够显著降低金黄色葡萄球菌的存活率,且不会对周围组织产生明显的热损伤。等离子体活化水(Plasma-Activated Water, PAW)作为一种新型的杀菌介质,具有操作简便、无化学残留等优点,近年来在微生物灭活领域得到了广泛应用[10-11]。
尽管等离子体技术在杀菌方面表现出显著的优势,然而其对细菌的具体作用机制仍不够明确,尤其是在分子水平上的调控机制尚需进一步探索。转录组学测序技术作为一种高通量的基因表达分析手段,被广泛应用于差异基因筛选及功能注释研究中。通过转录组测序,可以全面、系统地分析细菌在特定处理条件下的基因表达变化,揭示其代谢途径和信号通路的调控机制[12]。常用的基因功能数据库[基因本体论(Gene Ontology, GO)]和基因代谢通路数据库[京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)]能够对差异表达基因进行功能注释和通路分析,进而从整体水平上解析基因的结构和功能[13]。例如,Ni等[14]通过转录组学技术发现,冷等离子体中的活性氧氮物种(Reactive Oxygen and Nitrogen Species, RONS)通过激活荧光假单胞菌(Pseudomonas fluorescens)的抗氧化防御系统,并调控氨基酸代谢和能量代谢相关基因的表达,进而干扰细胞过程与催化活性,最终导致细菌灭活。本研究利用转录组学技术,从基因表达水平探究等离子体活化水对金黄色葡萄球菌的作用机制,旨在为等离子体技术的杀菌机制提供理论依据。通过蛋白直系同源簇(Clusters of Orthologous Groups of proteins,COG)、GO和KEGG功能注释及富集分析,本研究系统分析等离子体活化水处理后的金黄色葡萄球菌基因表达变化,为揭示等离子体活化水的杀菌机制提供重要的分子生物学依据。
1 材料与方法 1.1 材料 1.1.1 菌株金黄色葡萄球菌(Staphylococcus aureus ATCC 25923),实验室保存。
1.1.2 主要试剂和仪器胰蛋白酶大豆肉汤(Trypticase Soy Broth, TSB)培养基和琼脂粉购于美国BD公司,氯化钠、氯化钾、磷酸二氢钾、磷酸二氢钠购于国药集团化学试剂有限公司,RNA Purification Kit试剂盒购于上海美吉生物医药科技有限公司,QIAzolLysis Reagent购于德国Qiagen公司,Biowest Agarose购于法国Biowest公司,SMART-Seq V4 Ultra Low Input RNA Kit for Sequencing购于美国Clontech公司。
粉碎研磨仪(TL-48R)购自上海万柏生物科技有限公司,小型离心机(ABSON MiFly-6)购自合肥艾本森科学仪器有限公司,高速台式冷冻离心机(Eppendorf5424R)购自德国Eppendorf公司,电泳仪(Dyy-6C)购自北京六一生物科技有限公司,超微量分光光度计(NanoDrop2000)和荧光定量仪(Qubit 4.0)购自赛默飞世尔科技(中国)有限公司,生物分析仪(Agilent 5300)购自安捷伦科技有限公司,PCR仪(T100 Thermal Cycler)购自美国BIO-RAD公司,测序仪(NovaSeq X Plus)购自美国Illumina公司。
1.2 方法 1.2.1 等离子体活化水的制备等离子体活化水通过表面介质阻挡放电(SDBD)系统制备[15]。SDBD系统由高压铜电极(4 cm×4 cm)、网状地电极及Al2O3陶瓷绝缘层(1 mm厚)构成,施加20 kHz正弦高压(峰峰值0-20 kV)产生等离子体(80 mm×80 mm),放电功率密度0.2 W/cm2 (图 1)。合成空气(79% N2+21% O2)以4 L/min流速通入反应腔,电压及电流信号通过高压探头和霍尔电流传感器采集,并由示波器(500 MHz带宽,250 MS/s采样率)积分计算放电功率。将2 mL生理盐水(0.85%氯化钠)置于石英培养皿(35 mm×35 mm×1 mm)中,培养皿置于等离子体放电面的正下方,液面与等离子体地电极之间的距离约为10 mm,处理不同时间得到等离子体活化水。
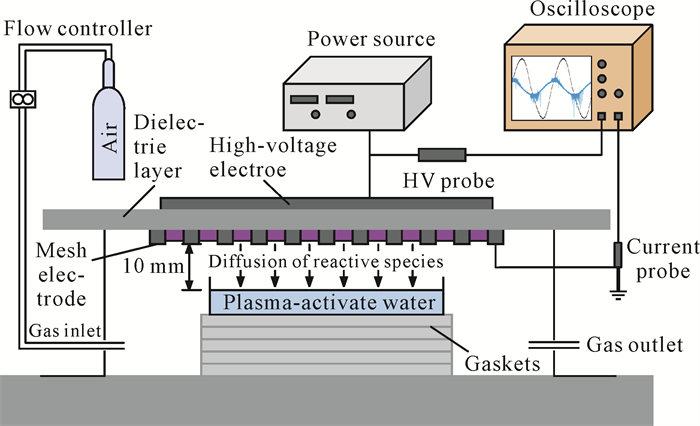
|
| 图 1 等离子体活化水制备示意图 Fig. 1 Diagram of the preparation of plasma-activated water |
1.2.2 病原微生物的培养
挑取金黄色葡萄球菌的单菌落至TSB培养基内,在37 ℃的恒温摇床中以225 r/min的转速培养过夜,所得菌液作为原菌备用。将培养后的菌液按1∶100的体积比转接到新鲜TSB培养基内,再次放入摇床中以上述条件振荡3 h进行扩大培养。将扩大培养完成的菌液在4 ℃条件下5 000 r/min离心5 min,倒去上清液,将菌体沉淀用生理盐水(0.85% 氯化钠)重悬并洗涤2次,之后再用生理盐水悬浮菌体并调节菌液浓度至600 nm波长处,吸光值(OD600)为5.0左右。
1.2.3 金黄色葡萄球菌的灭活分别将处理1、2、3、4、5 min的等离子体活化水,按等离子体活化水∶细菌悬液=9∶1(体积比)的比例混合,静置30 min后用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)连续稀释,并采用平板计数法测定金黄色葡萄球菌存活数量,存活数量检出下限为100 CFU/mL。
1.2.4 RNA提取及文库构建根据等离子体活化水对金黄色葡萄球菌的灭活结果,选取细菌被灭活至检出限以下的处理组,将处理后的细菌离心,去除上清液,将收集到的菌体速冻后于-80 ℃保存;干冰保存送样。每组进行生物学重复各3次。转录组测序和分析交由上海美吉生物医药科技有限公司进行,测序平台为Illumina Novaseq 6000。将质控后的原始数据,即高质量序列(Clean reads),与参考基因组进行比对,获得用于后续分析的mapped data (Reads),同时对本次转录组测序的比对结果进行质量评估,主要包括测序饱和度、基因覆盖度、Reads在参考基因组不同区域分布以及Reads在不同染色体分布分析。
1.2.5 表达差异分析使用DESeq软件进行分析,筛选显著差异表达基因(Differentially Expressed Genes, DEGs),筛选条件:qvalue≤0.05且|log2Fold Change|≥1。此处的qvalue为校正后的P值。筛选出样本间差异表达的基因,并进行统计用于后续研究差异表达基因的功能。对差异表达基因进行GO、COG、KEGG功能聚类分析,以明确差异表达基因在功能上的分布与主要涉及的代谢通路或信号转导机制。
2 结果与分析 2.1 等离子体活化水对金黄色葡萄球菌的灭活等离子体活化水对金黄色葡萄球菌具有良好的灭活效果,含有金黄色葡萄球菌的生理盐水经过SDBD系统处理5 min后,存活细菌数量由7.88个数量级下降至检出限以下(图 2)。因此,选取该条件进行下一步实验,以分析等离子体活化水对金黄色葡萄球菌转录组的影响。
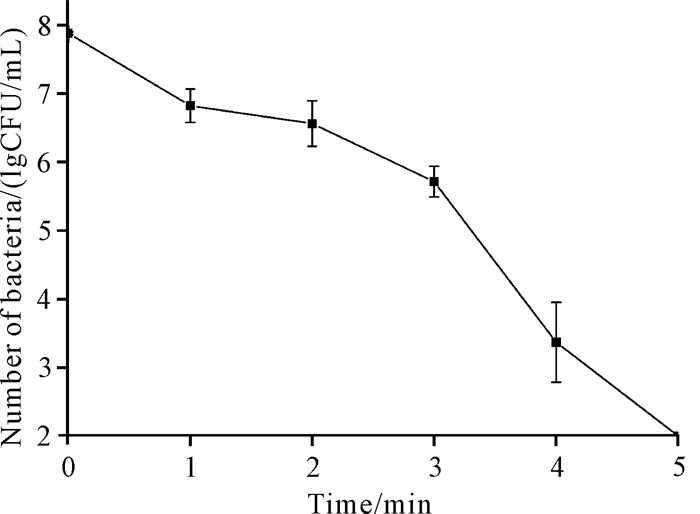
|
| 图 2 等离子体活化水对金黄色葡萄球菌的灭活 Fig. 2 Inactivation of Staphylococcus aureus by plasma-activated water |
2.2 数据质控报告
根据等离子体对金黄色葡萄球菌的灭活效果,对原始数据进行过滤之后,获得超过2×109 bp的高质量序列,处理组和对照组共6个样品的转录组原始数据过滤后,Q20(质量值>20的碱基比例)均达到97%以上,Q30(质量值>30的碱基比例)达到91%以上,符合进一步分析要求(表 1)。
| 样品
Sample |
原始序列/bp Raw reads/bp |
高质量序列/bp Clean reads/bp |
Q20/% | Q30/% |
| Control group 1 | 2 995 119 300 | 2 958 609 526 | 97.24 | 91.94 |
| Control group 2 | 2 998 524 000 | 2 960 614 073 | 97.28 | 91.98 |
| Control group 3 | 2 206 059 600 | 2 184 873 872 | 97.64 | 92.78 |
| Treated group 1 | 2 954 010 900 | 2 915 343 526 | 97.15 | 91.74 |
| Treated group 2 | 2 436 834 000 | 2 410 518 476 | 97.58 | 92.67 |
| Treated group 3 | 2 794 722 000 | 2 760 823 385 | 97.50 | 92.51 |
2.3 差异表达基因的筛选
与未处理组相比,经过等离子体活化水处理后的金黄色葡萄球菌中有577个差异表达基因,其中上调表达基因有317个,下调表达基因有260个(图 3)。

|
| 图 3 处理组和对照组的基因表达差异散点图 Fig. 3 Scatterplot of DEGs between treatment and control groups |
2.4 层级聚类分析
聚类分析用于判断基因在不同条件下的表达模式,表达模式类似的基因可能会有相同或者相似的功能,或者在同一个代谢过程、细胞活动中发挥相似的功能。通过层级聚类分析的方法对基因进行表达模式聚类分析,结果如图 4所示,每一列代表一个样本,每一行代表一个基因,A1-A3代表对照组,B1-B3代表处理组。颜色代表基因在样本中的表达量,其中红色代表表达量较高,蓝色代表表达量较低。左侧为基因聚类的树状图和子聚类的模块图,两个基因分支离得越近,说明它们的表达量越接近;上方为样本聚类的树状图,下方为样本的名称,两个样本分支离的越近,说明这两个样本所有基因的表达模式越接近,即基因表达量变化趋势越接近。图 4中等离子体处理组与未处理组的基因表现出显著的差异性聚集,表明等离子体活化水处理对金黄色葡萄球菌的基因表达产生很大的影响,进而影响金黄色葡萄球菌的生命活动。
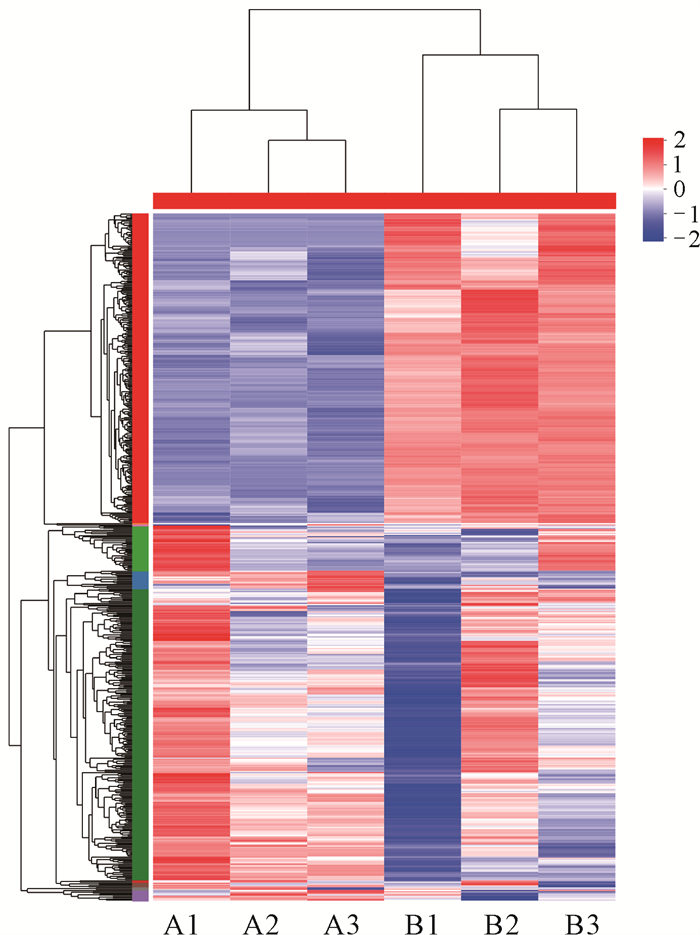
|
| 图 4 基因集聚类分析热图 Fig. 4 Heat map for gene set clustering analysis |
2.5 差异表达基因COG功能注释和GO富集分析
COG数据库是基于基因直系同源关系的注释系统,可根据COG的分类对差异表达基因的功能进行预测。根据序列同源比对结果,338个基因获得功能注释。COG分类显示这些基因归属于17个功能类别,其中占比最高的3个类别依次为翻译及核糖体结构相关基因(41个,占比12.13%)、氨基酸转运与代谢相关基因(39个,占比11.54%)、碳水化合物转运与代谢相关基因(38个,占比11.24%)。接下来依次为蛋白质翻译后修饰、无机离子转运与代谢相关基因(占比8.58%),转录相关基因(占比8.28%),能量产生与转化相关基因(占比6.80%),复制、重组和修复相关基因(占比6.51%),细胞膜生物过程相关基因(占比5.62%),核苷酸代谢相关基因(占比55.33%)。差异表达基因主要涉及翻译、转录、翻译后修饰及物质转运等功能,表明等离子体活化水处理可能干扰细菌的基因表达和代谢运输过程。GOG功能注释分析主要包括3部分:分子功能(Molecular Function, MF)、细胞组成(Cellular Component, CC)和生物过程(Biological Process, BP)。差异表达基因在MF类别中主要参与催化活性(Catalytic activity)和结合(Binding);在CC类别中差异表达基因显著富集于细胞器(Organelle)、细胞部分(Cell part)和细胞(Cell)等结构中;在BP类别中差异表达基因主要参与单一生物体过程(Single-organism process)、代谢过程(Metabolic process)和细胞过程(Cellular process)等基本生命活动过程(图 5)。
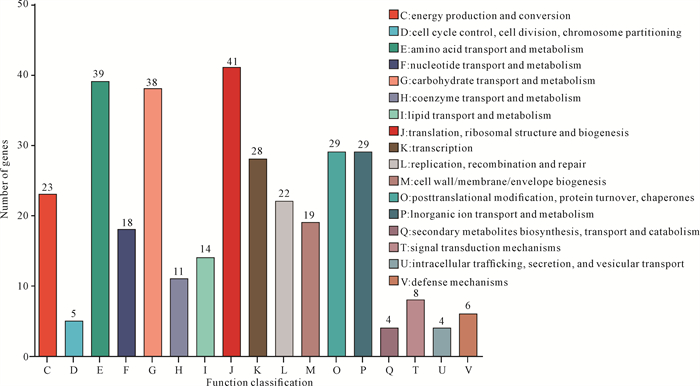
|
| 图 5 COG功能注释 Fig. 5 COG functional annotation |
对差异表达基因中的上调基因和下调基因分别进行GO富集分析,结果如图 6所示。纵轴表示GO term,横轴表示Rich factor(Rich factor = Sample number/Background number)。Rich factor越大,表示富集的程度越大。点的大小表示该基因在此GO term中的基因个数,点的颜色对应不同的P值。上调基因和下调基因分别对应不同的生命活动,在上调基因中富集程度较大的是细胞质核糖体(Cytosolic small ribosomal subunit,GO:0.83)、细胞膜(Cytosolic part,GO:0.60)、核糖体(Ribosomal subunit,GO:0.58)和细胞器(Intracellular organelle part,GO:0.53)相关的部分基因[图 6(a)];在下调基因中富集程度较大的是氨基酸转运(Amino acid transport,GO:0.58)、有机酸转运(Organic acid transport,GO:0.58)、羧酸转运(Carboxylic acid transport,GO:0.58)、羧酸跨膜转运蛋白活性(Carboxylic acid transmembrane transporter activity,GO:0.54)、有机酸跨膜转运蛋白活性(Organic acid transmembrane transporter activity,GO:0.54)、有机阴离子运输(Organic anion transport,GO:0.53)相关的部分基因[图 6(b)]。
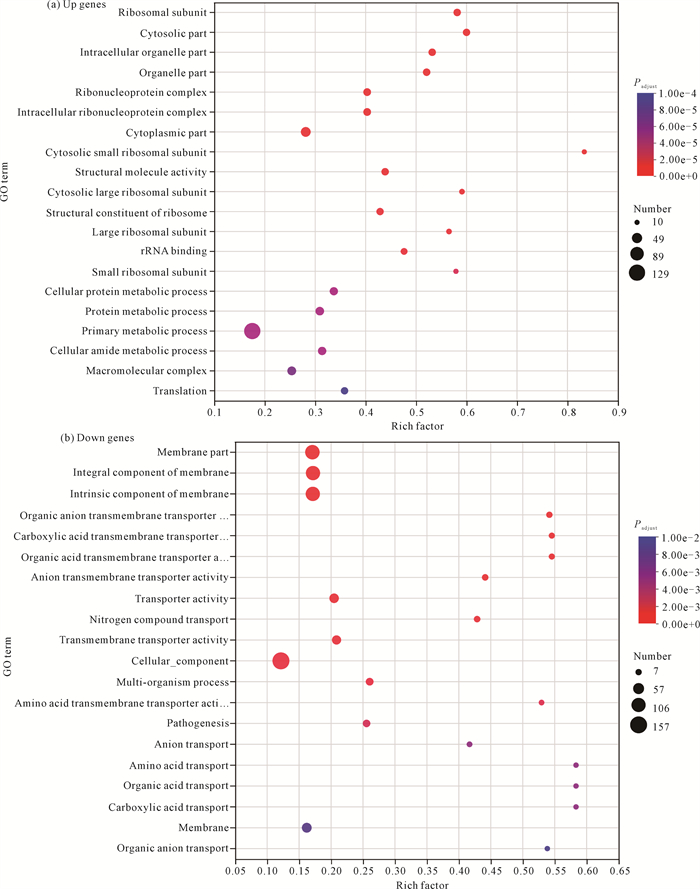
|
| 图 6 GO富集分析气泡图 Fig. 6 Bubble diagram of GO enrichment analysis |
2.6 差异表达基因KEGG功能注释分析
KEGG功能注释分析结果显示,获得功能注释的基因主要归属于代谢(Metabolism)、遗传信息处理(Genetic information processing)、环境信息处理(Environmental information processing)、细胞过程(Cellular processes)、生物体系统(Organismal systems)、人类疾病(Human diseases)和药物开发(Drug development) 7个功能类别。处理组与对照组的差异表达基因,无论是上调基因还是下调基因,均主要归属于前6个功能类别,药物开发相关基因变化不显著(图 7)。对于上调基因数目,占比最高的3个类别依次为碳水化合物代谢相关基因(34个,占比16.83%)、翻译相关基因(27个,占比13.37%)、氨基酸代谢相关基因(24个,占比11.88%);随后为核苷酸代谢和能量代谢相关基因,分别有19个和18个基因。对于下调基因数目,占比最高的3个类别依次为膜运输相关基因(26个,占比23.21%)、细菌传染性相关基因(15个,占比13.39%)、细菌群落相关基因(14个,占比12.50%)。差异表达基因主要涉及代谢、翻译和跨膜运输等功能。
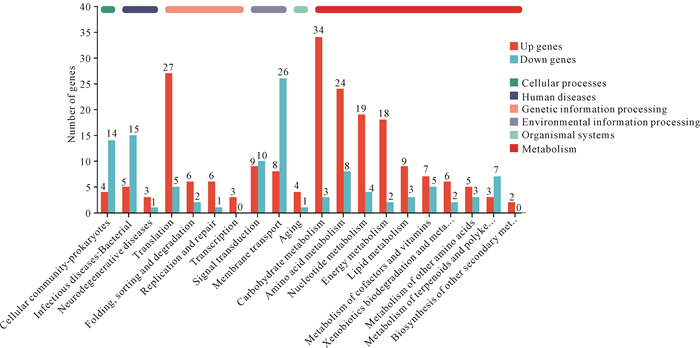
|
| 图 7 差异基因表达KEGG功能注释图 Fig. 7 KEGG functional annotation of DEGs |
对差异表达基因中的上调基因和下调基因分别进行KEGG功能富集分析,结果如图 8所示。在上调基因中富集程度较大的是阿特拉津降解(Atrazine degradation)、酮体的合成与降解(Synthesis and degradation of ketone bodies)、肺结核(Tuberculosis)、长寿调节通路(Longevity regulating pathway)、光合生物中的碳固定(Carbon fixation in photosynthetic organisms)、MAPK信号通路(MAPK signaling pathway)、RNA聚合酶(RNA polymerase)和核糖体(Ribosome)等生命过程相关的基因[图 8(a)],其中在核糖体相关基因集中的基因个数最多;在下调基因中富集程度较大的是铁载体群非核糖体肽的生物合成(Biosynthesis of siderophore group nonribosomal peptides)、类胡萝卜素生物合成(Carotenoid biosynthesis)、β-内酰胺抗性(beta-Lactam resistance)、磷脂酰肌醇信号系统(Phosphatidylinositol signaling system)、MAPK信号通路(MAPK signaling pathway)和金黄色葡萄球菌感染(Staphylococcus aureus infection)相关的基因[图 8(b)],其中在金黄色葡萄球菌感染相关的基因集中的基因个数最多。
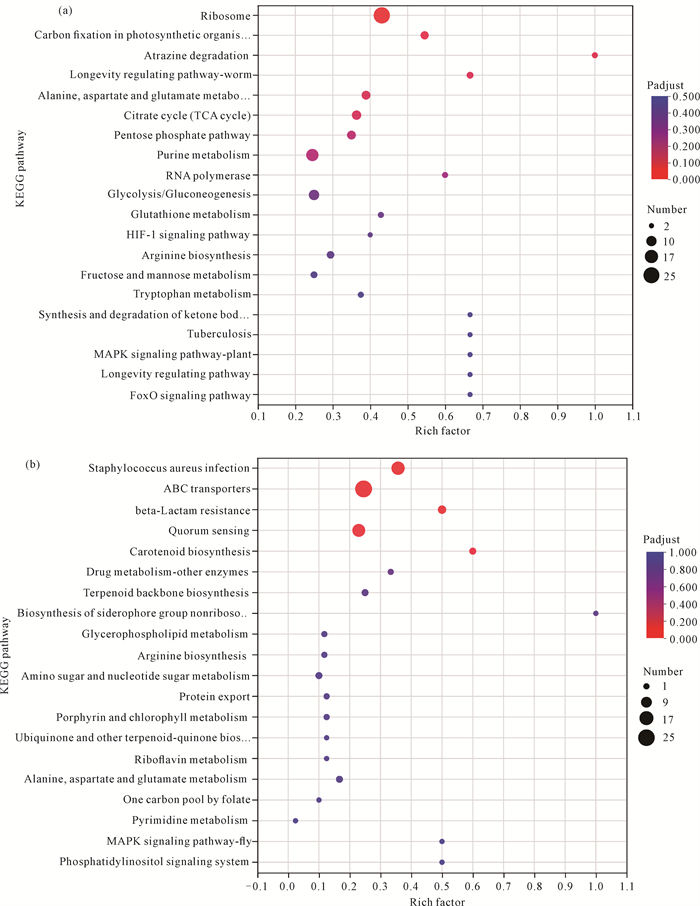
|
| 图 8 KEGG富集分析气泡图 Fig. 8 Bubble diagram of KEGG enrichment analysis |
2.7 差异表达基因分析
对等离子体活化水处理组和对照组的转录组数据进行分析,筛选出显著差异表达的基因,并统计表达量上调前10和下调前10的基因(表 2)。结果显示,等离子体活化水处理显著影响了金黄色葡萄球菌的基因表达模式。在表达下调的基因中,sek(K型葡萄球菌肠毒素)的差异倍数(Fold Change,FC)为0.001,log2(FC)为-10.028 811 92,表明其表达量显著降低。类似地,sak(葡萄球菌激酶)、seq(Q型葡萄球菌肠毒素)和sea(A型葡萄球菌肠毒素)等与毒力因子相关的基因也显著下调,FC分别为0.002、0.003和0.006,log2(FC)分别为-8.796 836 605、-8.208 933 912和-7.491 991 016。这些结果表明,等离子体活化水处理可能通过抑制金黄色葡萄球菌的毒力因子表达来削弱其致病性。此外,与蛋白质合成和修复相关的基因,如MW_RS10545(含螺旋转螺旋结构域的蛋白质)和MW_RS10465(含DnaD结构域的蛋白质)也显著下调,FC分别为0.001和0.002,log2(FC)分别为-9.909 882 574和-8.964 295 878,提示等离子体活化水处理可能通过破坏细菌的蛋白质合成和修复机制来抑制其生长和繁殖。
| 基因名称
Gene name |
差异倍数
Fold Change (FC) |
差异倍数以2为底的对数值
log2(FC) |
上下调情况
Regulation |
基因表述
Gene description |
| sek | 0.001 | -10.028 811 92 | Down | Staphylococcal enterotoxin type K |
| MW_RS10545 | 0.001 | -9.909 882 574 | Down | Helix-turn-helix domain-containing protein |
| MW_RS10485 | 0.002 | -9.285 340 256 | Down | AAA family ATPase |
| MW_RS10465 | 0.002 | -8.964 295 878 | Down | DnaD domain-containing protein |
| sak | 0.002 | -8.796 836 605 | Down | Staphylokinase |
| MW_RS10560 | 0.003 | -8.465 480 251 | Down | Site-specific integrase |
| seq | 0.003 | -8.208 933 912 | Down | Staphylococcal enterotoxin type Q |
| MW_RS10480 | 0.003 | -8.162 289 01 | Down | Recombinase |
| MW_RS10270 | 0.004 | -8.055 449 713 | Down | Peptidoglycan hydrolase |
| sea | 0.006 | -7.491 991 016 | Down | Staphylococcal enterotoxin type A |
| ureG | 13.750 | 3.781 390 772 | Up | Urease accessory protein UreG |
| czrA | 11.398 | 3.510 646 986 | Up | Zn(Ⅱ)-responsive metalloregulatory transcriptional repressor CzrA |
| sceD | 10.049 | 3.329 010 362 | Up | Lytic transglycosylase SceD |
| MW_RS11985 | 9.964 | 3.316 708 479 | Up | Urease subunit beta |
| MW_RS12830 | 8.297 | 3.052 659 649 | Up | NAD(P)-dependent oxidoreductase |
| MW_RS04650 | 7.946 | 2.990 235 200 | Up | MAP domain-containing protein |
| MW_RS02000 | 7.921 | 2.985 607 618 | Up | DUF1304 domain-containing protein |
| MW_RS02005 | 7.508 | 2.908 389 332 | Up | SDR family oxidoreductase |
| MW_RS11575 | 6.789 | 2.763 301 305 | Up | Aldo/keto reductase |
| MW_RS08400 | 6.746 | 2.754 089 576 | Up | LLM class flavin-dependent oxidoreductase |
在表达上调的基因中,ureG(脲酶附属蛋白基因)的FC为13.750,log2(FC)为3.781 90 772,表明其表达量显著增加。此外,czrA(金属调控转录抑制因子)和sceD(裂解转糖基化酶基因)等基因也显著上调,FC分别为11.398和10.049,log2(FC)分别为3.510 646 986和3.329 010 362。值得注意的是,多个与氧化还原反应相关的基因,如MW_RS12830[NAD(P)-依赖性氧化还原酶]、MW_RS02005(SDR家族氧化还原酶)和MW_RS08400(LLM类黄素依赖性氧化还原酶)也显著上调,FC分别为8.297、7.508和6.746,log2(FC)分别为3.052 659 649、2.908 389 332和2.754 089 576。这些基因的上调反映了细菌在受到等离子体活化水处理后,试图通过激活氧化还原酶系统来应对等离子体活化水产生的活性氧物种和氧化应激。总体而言,这些差异表达基因的变化表明,等离子体活化水处理通过多途径影响金黄色葡萄球菌的基因表达,特别是通过抑制毒力因子和蛋白质合成相关基因的表达,同时激活氧化还原酶系统来应对氧化应激,进而抑制金黄色葡萄球菌的生长和毒力。
3 讨论本研究通过转录组学技术,系统分析了等离子体活化水对金黄色葡萄球菌的灭活机制,揭示了其在基因表达水平上的调控作用。本研究中,转录组分析结果显示,经等离子体活化水处理后,金黄色葡萄球菌中与细胞膜合成相关的基因表达显著下调,结合其他研究利用透射电镜观察到的细胞膜破裂现象,表明细胞膜结构完整性丧失是导致细菌死亡的关键因素[16-18]。ATP合酶基因簇(MW_RS10485)的显著下调进一步佐证了能量代谢崩溃的机制,这与其他研究中检测到的ATP含量下降直接相关[19-20]。此外,与DNA修复和蛋白质合成相关的基因也发生了显著变化,进一步支持了等离子体活化水通过破坏细菌的DNA和蛋白质结构来实现杀菌的假设。等离子体活化水中的活性氧分子会对细菌细胞膜的膜脂和膜蛋白产生氧化修饰,导致不同细胞膜之间发生反应并形成共价交联,促进它们的相互聚合。与此同时,这些活性氧的氧化作用也可能触发细胞膜脂质的过氧化反应,从而改变细胞膜的特性,例如降低膜的通透性[21]。
COG和KEGG功能注释分析结果表明,差异表达基因主要富集在翻译、氨基酸代谢、碳水化合物代谢和跨膜运输等生物过程中。特别是与核糖体结构和翻译相关的基因表达上调,表明等离子体活化水可能通过干扰细菌的蛋白质合成过程来抑制其生长[22]。相似的,有研究使用冷等离子体对铜绿假单胞菌(P.aeruginosa)进行灭菌,发现受影响最大的基因涉及抗氧化剂产生、转录调节因子、核糖体形成、转运体、趋化作用和细胞运动[23]。此外,与跨膜运输相关的基因表达下调,提示等离子体活化水可能影响了细菌膜的通透性和物质运输功能,进一步加剧了细菌的代谢紊乱[24]。
KEGG功能注释分析结果显示,等离子体活化水处理后的金黄色葡萄球菌中,与碳水化合物代谢、氨基酸代谢和核苷酸代谢相关的基因表达发生了显著变化。这些代谢途径的紊乱可能导致细菌能量供应不足,进而影响其生长和繁殖。特别是与能量代谢相关的基因表达下调,表明等离子体活化水可能通过抑制细菌的能量代谢途径来实现杀菌效果。
本研究发现,与肠毒素相关的基因(如sek、sak、seq和sea)显著下调,表明等离子体活化水可能通过抑制细菌的毒力因子表达来减弱其致病性。肠毒素是金黄色葡萄球菌的重要毒力因子,能够引起食物中毒和感染[25]。研究表明,等离子体活化水处理能够有效灭活金黄色葡萄球肠毒素B[26]。蛋白质合成及核酸代谢相关的基因(如MW_RS10545和MW_RS10465)表达显著下调,这表明等离子体活化水可能通过干扰细菌的蛋白质和核酸代谢过程来抑制其生长和繁殖。蛋白质合成与核酸代谢是细菌生长所必需的关键过程,因此对这些过程的任何干扰都可能导致细菌死亡[27-29]。与此同时,与氧化还原反应相关的多个基因表达明显上调,说明细菌试图通过激活氧化还原酶系统应对等离子体活化水引发的活性氧物种和氧化应激,但最终因氧化损伤不可逆而死亡。有研究表明,等离子体活化水处理能够显著诱导细菌产生氧化应激反应,金黄色葡萄球菌中编码超氧化物歧化酶(SodA)、过氧化氢酶(KatE)和烷基过氧化氢还原酶(AhpC)的基因在等离子体活化水处理30 min后上调[30]。另一项关于大肠杆菌的研究显示,过氧化氢酶(KatE)、烷基过氧化氢还原酶(AhpC和AphC)、SodA、硫氧还蛋白(TrxC)和谷草转氨酶(GrxA)均出现差异表达基因[31]。这些发现与本研究的结论一致,进一步支持了等离子体活化水通过诱导氧化应激来抑制细菌生长的假设。
尽管本研究揭示了等离子体活化水对金黄色葡萄球菌基因表达的广泛影响,但其具体作用机制仍需进一步探索。未来的研究可以进一步探讨等离子体活化水对其他病原微生物的杀菌效果及其作用机制,以拓展其应用范围。此外,结合蛋白质组学和代谢组学技术,可以更全面地揭示等离子体活化水的杀菌机制。
4 结论本研究通过转录组学分析揭示了等离子体活化水对金黄色葡萄球菌的灭活机制。实验结果表明,处理5 min后细菌存活量降至检出限以下。功能富集分析显示,等离子体活化水显著抑制了细菌的翻译、氨基酸代谢、碳水化合物代谢及跨膜运输相关基因(如MW_RS10545)的表达,同时下调毒力因子(sek、sak、seq、sea)的表达,削弱其致病性。此外,氧化还原反应相关基因(如MW_RS12830)显著上调,提示细菌通过激活抗氧化系统应对活性氧物种的氧化应激。等离子体活化水通过多途径干扰基因表达,破坏蛋白质合成、核酸代谢及毒力因子生成,最终抑制细菌生长与致病性,本研究为其在食品、医疗等领域的杀菌应用提供了理论依据。
| [1] |
GUO Y L, SONG G H, SUN M L, et al. Prevalence and therapies of antibiotic-resistance in Staphylococcus aureus[J]. Frontiers in Cellular and Infection Microbiology, 2020, 10: 107. DOI:10.3389/fcimb.2020.00107 |
| [2] |
LI B Y, WEBSTER T J. Bacteria antibiotic resistance: new challenges and opportunities for implant-associated orthopedic infections[J]. Journal of Orthopaedic Research, 2018, 36(1): 22-32. DOI:10.1002/jor.23656 |
| [3] |
CRAFT K M, NGUYEN J M, BERG L J, et al. Methicillin-resistant Staphylococcus aureus (MRSA): antibiotic-resistance and the biofilm phenotype[J]. MedChemComm, 2019, 10(8): 1231-1241. DOI:10.1039/C9MD00044E |
| [4] |
LU X P, NAIDIS G V, LAROUSSI M, et al. Reactive species in non-equilibrium atmospheric-pressure plasmas: generation, transport, and biological effects[J]. Physics Reports, 2016, 630: 1-84. DOI:10.1016/j.physrep.2016.03.003 |
| [5] |
HAN L, PATIL S, BOEHM D, et al. Mechanisms of inactivation by high-voltage atmospheric cold plasma differ for Escherichia coli and Staphylococcus aureus[J]. Applied and Environmental Microbiology, 2016, 82(2): 450-458. DOI:10.1128/AEM.02660-15 |
| [6] |
DOMONKOS M, TICHÁ P, TREJBAL J, et al. Applications of cold atmospheric pressure plasma technology in medicine, agriculture and food industry[J]. Applied Sciences, 2021, 11(11): 4809. DOI:10.3390/app11114809 |
| [7] |
魏丽娜, 张艳, 吴玉茜, 等. 不同气源低温等离子体在食品杀菌及毒素降解领域的应用研究进展[J]. 食品安全质量检测学报, 2023, 14(15): 269-277. |
| [8] |
LI X, FARID M. A review on recent development in non-conventional food sterilization technologies[J]. Journal of Food Engineering, 2016, 182: 33-45. DOI:10.1016/j.jfoodeng.2016.02.026 |
| [9] |
LIU X H, HONG F, GUO Y, et al. Sterilization of Staphylococcus aureus by an atmospheric non-thermal plasma jet[J]. Plasma Science and Technology, 2013, 15(5): 439-442. DOI:10.1088/1009-0630/15/5/09 |
| [10] |
郭莉, 赵鹏瑜, 黄玲玲, 等. 等离子体活化水用于微生物消杀的意义和现状[J]. 高电压技术, 2024, 50(7): 2955-2971. |
| [11] |
ZHOU R W, ZHOU R S, WANG P Y, et al. Plasma-activated water: generation, origin of reactive species and biological applications[J]. Journal of Physics D: Applied Physics, 2020, 53(30): 303001. DOI:10.1088/1361-6463/ab81cf |
| [12] |
王跃, 毛开云, 王恒哲, 等. 转录组学测序技术应用与市场分析[J]. 生物产业技术, 2017(5): 11-17. |
| [13] |
浦智婷, 唐霄, 尹铁球. 基于转录组测序分析绿原酸对铜绿假单胞菌的作用机制[J]. 华夏医学, 2023, 36(3): 30-36. |
| [14] |
NI J B, DING C J, ZHANG J S, et al. Insight into the surface discharge cold plasma efficient inactivation of Pseudomonas fluorescens in water based on exogenous reactive oxygen and nitrogen species: synergistic mechanism and energy benefits[J]. Journal of Hazardous Materials, 2024, 476: 134984. DOI:10.1016/j.jhazmat.2024.134984 |
| [15] |
HUANG L L, GUO L, ZHAO P Y, et al. Bactericidal effects of plasma-activated saline prepared by surface dielectric barrier discharge with different dielectric layers and working gases[J]. Plasma Processes and Polymers, 2023, 20(1): 2200110. DOI:10.1002/ppap.202200110 |
| [16] |
KAUSHIK N K, GHIMIRE B, LI Y, et al. Biological and medical applications of plasma-activated media, water and solutions[J]. Biological Chemistry, 2018, 400(1): 39-62. DOI:10.1515/hsz-2018-0226 |
| [17] |
LIAO X Y, BAI Y, MUHAMMAD A I, et al. The application of plasma-activated water combined with mild heat for the decontamination of Bacillus cereus spores in rice (Oryza sativa L. ssp. japonica)[J]. Journal of Physics D: Applied Physics, 2020, 53(6): 064003. DOI:10.1088/1361-6463/ab573a |
| [18] |
SONG Z Q, JIANG Y W, CHEN C, et al. Effect of plasma-activated water on the cellulase-producing strain Aspergillus niger A32[J]. Journal of Fungi, 2024, 10(8): 568. DOI:10.3390/jof10080568 |
| [19] |
SUN Y H, GAO R, LIAO X Y, et al. Stress response of Salmonella newport with various sequence types toward plasma-activated water: viable but nonculturable state formation and outer membrane vesicle production[J]. Current Research in Food Science, 2024, 8: 100764. DOI:10.1016/j.crfs.2024.100764 |
| [20] |
HU Z Y, XU H W, CHENG J, et al. Catalyst-free regeneration of plasma-activated water via ultrasonic cavitation: removing aggregation concealment of antibiotic-resistant bacteria with enhanced wastewater sustainability[J]. Journal of Hazardous Materials, 2024, 479: 135705. DOI:10.1016/j.jhazmat.2024.135705 |
| [21] |
JOSHI S G, COOPER M, YOST A, et al. Nonthermal dielectric-barrier discharge plasma-induced inactivation involves oxidative DNA damage and membrane lipid peroxidation in Escherichia coli[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(3): 1053-1062. DOI:10.1128/AAC.01002-10 |
| [22] |
PERKINS A, NELSON K J, PARSONAGE D, et al. Peroxiredoxins: guardians against oxidative stress and modulators of peroxide signaling[J]. Trends in Biochemical Sciences, 2015, 40(8): 435-445. DOI:10.1016/j.tibs.2015.05.001 |
| [23] |
LIEW K J, ZHANG X H, CAI X H, et al. Transcriptome study of cold plasma treated Pseudomonas aeruginosa[J]. Chiang Mai Journal of Science, 2023, 50(2): 1-19. |
| [24] |
ZHANG Q, LIANG Y D, FENG H Q, et al. A study of oxidative stress induced by non-thermal plasma-activated water for bacterial damage[J]. Applied Physics Letters, 2013, 102(20): 203701. DOI:10.1063/1.4807133 |
| [25] |
罗曼, 刘倩. 食源性金黄色葡萄球菌耐药机制分析[J]. 中国病原生物学杂志, 2022, 17(6): 685-688. |
| [26] |
潘迪, 张大革, 孙运金, 等. 低温等离子体对金黄色葡萄球菌肠毒素B的灭活作用[J]. 食品工业科技, 2020, 41(10): 192-195, 202. |
| [27] |
MAYBIN J A, THOMPSON T P, FLYNN P B, et al. Cold atmospheric pressure plasma-antibiotic synergy in Pseudomonas aeruginosa biofilms is mediated via oxidative stress response[J]. Biofilm, 2023, 5: 100122. DOI:10.1016/j.bioflm.2023.100122 |
| [28] |
MOLS M, MASTWIJK H, NIEROP GROOT M, et al. Physiological and transcriptional response of Bacillus cereus treated with low-temperature nitrogen gas plasma[J]. Journal of Applied Microbiology, 2013, 115(3): 689-702. DOI:10.1111/jam.12278 |
| [29] |
DAVIES M J. Protein oxidation and peroxidation[J]. Biochemical Journal, 2016, 473(7): 805-825. DOI:10.1042/BJ20151227 |
| [30] |
XU Z M, WEI J, SHEN J, et al. Genetic effects of an air discharge plasma on Staphylococcus aureus at the gene transcription level[J]. Applied Physics Letters, 2015, 106(21): 213701. DOI:10.1063/1.4921754 |
| [31] |
JOSHI S G, YOST A, JOSHI S S, et al. Microarray analysis of transcriptomic response of Escherichia coli to nonthermal plasma-treated PBS solution[J]. Advances in Bioscience and Biotechnology, 2015, 6(2): 49-62. DOI:10.4236/abb.2015.62006 |



