2. 广西壮族自治区中国科学院广西植物研究所,广西桂林 541006
2. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China
生态化学计量学是衡量生态系统中多种元素平衡关系的重要工具,为元素间的耦合提供了综合性的研究方法[1]。其中,植物生态化学计量学为该领域的重要分支,重点探讨植物各器官的元素含量特征及其与环境因子、群落结构和生态系统功能之间的关系,这一研究为理解植物个体到生态系统的统一理论构建提供了新的视角[1, 2]。叶片是绿色植物合成大多数化合物的关键器官之一,具有与其他结构储藏器官不同的元素分配能力[3]。这种差异使得叶片在植物中扮演了重要角色。叶片养分含量稳定假说认为,作为植物主要的养分吸收器官,其养分含量相较于根和茎更稳定[4]。
碳(C)、氮(N)、磷(P)是最常见的生物元素,其中C是构成生物体的基本元素,N和P参与控制生命过程、携带遗传信息以及控制能量储存和释放[5]。生物体中还存在其他元素,这些元素能满足生物的特定需求。在生态化学计量研究中,引入这些元素能够将个体和物种的元素组成与其生态特征联系起来。例如,植物叶片的抗旱性、细胞壁的稳定性及光合作用色素的形成分别与钾(K)、钙(Ca)和镁(Mg)元素相关[6, 7]。此外,根据不同的生态策略,各物种对这些生物元素的使用程度也存在差异。因此,生态化学计量研究中应考虑更多的生物元素。C、N、P元素的计量比具有重要的指示意义。植物叶片中的C∶N、C∶P反映了其N和P的利用效率以及吸收营养元素所同化C的能力[8],而生长速率假说则研究了生物体N∶P与其生长速率之间的关系[9]。N∶P阈值假说认为,N∶P可以指示植物生长所需养分是否受到外界环境的限制[10]。因此,这些生物元素在不同程度上对生物体的功能发挥着重要作用。
植物的生长型在植物物种与其环境之间创造了一种平衡模式,使不同植物能够适应其特定的环境[11]。在全球范围内,蕨类植物、草本植物、禾本科植物和木本植物的N和P吸收能力明显不同[12-15]。不同生长型植物之间的养分吸收效率存在显著差异,这种差异主要受气候等环境因素的影响。此外,植物的养分吸收效率以及C、N、P、K、Ca、Mg含量不仅与生长型相关,还会随着气候等环境因子的变化而发生显著改变,而不同生长型植物叶片的元素含量具有显著的差异[16]。
植物系统发育是指植物物种的进化历史,即植物体在整个进化历程中所处的位置及其与其他生物体之间的亲缘关系。通过分析系统发育关系,可以预测不同物种间功能性状的相关性,从而检验功能性状的系统发育信号[17]。研究表明,植物的系统发育显著影响其功能性状[11, 15]。例如,在欧洲木本植物中,叶片的N、P、K、硫(S)、Ca、Mg含量,以及N∶Ca、N∶Mg、P∶Ca、P∶Mg、P∶S、K∶Ca、K∶S均受到其系统发育历史的显著影响,这些共同祖先解释了叶片养分及其比值变异的60%-94%,而气候、大气氮沉降和土壤类型等环境因素仅解释了1%-7%[18]。因此,在研究植物叶片元素含量关系时,应考虑不同进化历史对物种的影响。然而,目前尚不清楚桂林会仙喀斯特湿地植物叶片元素含量及其C、N、P化学计量比是否受植物遗传背景的影响。生态位保守理论认为,亲缘关系越近的物种,生态特征越相似[19]。因此,推测亲缘关系越近的植物,其叶片元素含量及其C、N、P化学计量比也越相似,表现出系统发育上的保守性。
湿地植物是湿地生态系统的重要组成部分,研究其叶片化学计量特征是了解植物生长状况与适应策略的有效途径[20]。桂林会仙喀斯特湿地是中国最大的岩溶湿地,具有涵养水源、调节气候和保护物种多样性等重要功能[21]。本研究选取桂林会仙喀斯特湿地中的27种常见植物,测定其叶片碳(LC)、叶片氮(LN)、叶片磷(LP)、叶片钾(LK)、叶片钙(LCa)、叶片镁(LMg)含量及C∶N、C∶P、N∶P,旨在探究不同生长型植物叶片元素含量及其C、N、P化学计量比的差异和相关性,并分析这些差异的特征及其与系统发育的关系,为揭示不同生长型植物在桂林会仙喀斯特湿地生境的适应机制和湿地植被恢复实践提供科学依据。
1 材料与方法 1.1 研究区域概况桂林会仙喀斯特湿地位于桂林市临桂区会仙镇、四塘镇,雁山区东部,是以督龙湖为中心、面积约120 km2的大型喀斯特湿地[22]。地理位置为25°01′30″-25°11′15″N,110°08′15″-110°18′00″E。该湿地位于低纬度地区,气候温暖湿润,属于亚热带季风气候,年平均气温为16.5-20.5 ℃;年平均降水量为1 890.4 mm[23]。生物多样性丰富,分布着39科79属133种植物,其中被子植物占绝对优势(128种)。植物生长茂盛,盖度常在80%-95%,土壤主要为红黄壤和红壤,主要分布在洼地、平原和缓坡,土壤层较薄,部分地区甚至出现基岩裸露的现象[24]。
1.2 方法 1.2.1 样品采集和处理2021年7月,在桂林会仙喀斯特湿地中心区域采用样带法和样方法采集植物叶片。样带法针对陆生植物,选择典型堤岸(总长度300 m、宽度1.5-2.0 m)进行采集;样方法则在5个相互独立的水域(包括面积不小于100 m2的池塘和河流)采集植物叶片。此次采集共涉及27个植物物种(表 1),包括乔木(6种)、灌木(7种)和草本(14种)等3种不同生长型植物,其中陆生植物23种,水生植物4种。采集叶片时,每种植物均随机选取3个以上的植株(丛),从不同方向及不同部位(上、中、下)采集成熟、无病虫害、形态正常且完整的叶片20-30片,贴好标签后装入密封袋带回实验室。样品用蒸馏水冲洗,在75 ℃烘箱烘干至恒重,研磨后过筛(筛孔直径0.149 mm)。LC和LN含量使用元素分析仪(Vario MAX CN,德国Elementar公司)测定,LP、LK、LCa和LMg含量使用电感耦合等离子体发射光谱(iCAP Qc,美国Thermo Fisher Scientific公司)测定[25]。每份样品均重复测定3次,取平均值。
| 序号No. | 种名Species | 属Genus | 科Family | 生长型Life form |
| 1 | Camphora officinarum | Camphora | Lauraceae | Tree |
| 2 | Triadica sebifera | Triadica | Euphorbiaceae | Tree |
| 3 | Lagerstroemia speciosa | Lagerstroemia | Lythraceae | Tree |
| 4 | Salix chaenomeloides | Salix | Salicaceae | Tree |
| 5 | Pterocarya stenoptera | Pterocarya | Juglandaceae | Tree |
| 6 | Broussonetia monoica | Broussonetia | Moraceae | Tree |
| 7 | Paederia foetida | Paederia | Rubiaceae | Shrub |
| 8 | Flueggea virosa | Flueggea | Phyllanthaceae | Shrub |
| 9 | Gardenia jasminoides | Gardenia | Rubiaceae | Shrub |
| 10 | Vitex negundo | Vitex | Lamiaceae | Shrub |
| 11 | Celastrus orbiculatus | Celastrus | Celastraceae | Shrub |
| 12 | Pyracantha fortuneana | Pyracantha | Rosaceae | Shrub |
| 13 | Ficus pandurata | Ficus | Moraceae | Shrub |
| 14 | Persicaria hydropiper* | Persicaria | Polygonaceae | Herb |
| 15 | Nelumbo nucifera* | Nelumbo | Nelumbonaceae | Herb |
| 16 | Saccharum fallax | Saccharum | Poaceae | Herb |
| 17 | Microstegium fasciculatum | Microstegium | Poaceae | Herb |
| 18 | Blechnopsis orientalis | Blechnopsis | Blechnaceae | Herb |
| 19 | Floscopa scandens | Floscopa | Commelinaceae | Herb |
| 20 | Ophiopogon bodinieri | Ophiopogon | Asparagaceae | Herb |
| 21 | Arundo donax | Arundo | Poaceae | Herb |
| 22 | Pontederia crassipes* | Pontederia | Pontederiaceae | Herb |
| 23 | Myriophyllum verticillatum* | Myriophyllum | Haloragaceae | Herb |
| 24 | Alternanthera philoxeroides | Alternanthera | Amaranthaceae | Herb |
| 25 | Cyperus rotundus | Cyperus | Cyperaceae | Herb |
| 26 | Sacciolepis indica | Sacciolepis | Poaceae | Herb |
| 27 | Lygodium japonicum | Lygodium | Lygodiaceae | Herb |
| Note: * represents aquatic plants. | ||||
1.2.2 数据分析
采用单因素方差分析(One-Way ANOVA)及多重显著性比较检验(LSD)方法比较不同生长型植物的叶片元素含量及C、N、P化学计量比的差异。采用Pearson相关性分析法分析不同生长型植物叶片元素含量之间的相关性。数据处理和可视化采用软件SPSS 25.0和Origin 2021完成。
根据APGⅢ分类系统构建系统发育树[26],依据《中国植物志》对调查的27种植物进行科、属和种的分类。通过在线网站(http://www.theplantlist.org)对植物拉丁学名进行核对校正,确保植物命名与国际一致。最后使用R软件中的V.Phylogmaker软件包构建系统发育树[27]。K值(Blomberg′s K)是用于量化系统发育信号的统计指标, 它基于布朗运动模型来评估性状在系统发育树上的分布模式。K值反映了性状的变异与物种间系统发育关系一致的程度。K>1表明性状在进化过程中受到遗传或功能约束, 亲缘关系较近的物种在性状上更加相似, 具有较强的系统发育信号;K=1表示性状的变异完全符合布朗运动模型的预期, 即性状的变异与系统发育关系一致, 具有强系统发育信号;0<K < 1表明性状的变异可能受到环境选择或其他随机因素的影响, 具有较弱的系统发育信号;K<0表明性状进化与系统发育无关[28]。数据处理和可视化采用软件R 4.2.1。
2 结果与分析 2.1 不同生长型植物叶片元素含量及C、N、P化学计量比27种植物叶片元素含量平均值依次为LC>LN>LCa>LK>LMg>LP(表 2),乔木植物LC含量显著高于灌木和草本植物,乔木和灌木植物的LN、LCa含量、C∶P和N∶P均显著高于草本植物,草本植物LP和LK含量显著高于乔木和灌木植物,乔木、灌木和草本植物之间的LMg含量和C∶N差异显著,其中乔木植物LMg含量显著高于灌木和草本植物,草本植物叶片C∶N显著高于乔木和灌木植物。此外,乔木和灌木植物叶片N∶P>14,而草本植物叶片N∶P < 14(表 2)。
| 生长型Growth form | LC | LN | LP | LK | LCa | LMg | C∶N | C∶P | N∶P |
| Tree | 441.65± 36.15a | 27.78± 2.96a | 1.89± 0.81b | 9.37± 6.94b | 17.37± 8.57a | 4.38± 4.14a | 16.13± 2.75c | 280.72± 141.70a | 16.92± 7.05a |
| Shrub | 416.59± 18.87b | 25.02± 5.03a | 1.59± 0.43b | 9.56± 3.53b | 17.94± 9.63a | 3.79± 3.06b | 17.10± 2.70b | 277.42± 64.15a | 16.34± 3.15a |
| Herb | 414.26± 17.97b | 19.19± 5.59b | 2.38± 0.62a | 15.99± 9.09a | 11.21± 9.48b | 2.77± 2.66c | 22.95± 5.82a | 188.20± 60.45b | 8.51± 2.80b |
| Mean | 420.95± 24.96 | 22.61± 6.10 | 2.07± 0.70 | 12.85± 8.03 | 14.32± 9.56 | 3.39± 3.08 | 19.92± 5.52 | 231.89± 93.67 | 12.41± 5.73 |
| Note: different lowercase letters in the same row represent significant differences among different growth forms at the 0.05 level. | |||||||||
2.2 不同生长型植物叶片元素含量及C、N、P化学计量比之间的Pearson相关性
桂林会仙喀斯特湿地中植物叶片各元素含量的Pearson相关性不一致(图 1),LC与LP、LK含量呈显著负相关,与叶片C∶P、N∶P呈显著正相关;LN含量与叶片C∶N呈显著负相关,与叶片N∶P呈显著正相关。植物LP含量与叶片C∶P、N∶P呈显著负相关,但与LK含量及呈显著正相关。LK含量与叶片C∶P、N∶P也显示出显著负相关。此外,LCa与LMg含量呈显著正相关;叶片C∶N与N∶P呈显著负相关;叶片C∶P与N∶P呈显著正相关。
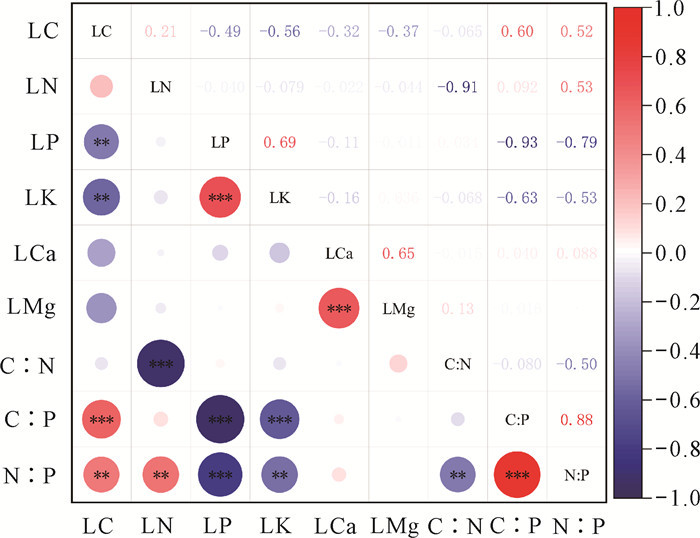
|
| The depth of the colors in the figure represents the intensity of correlation.Red and blue represent positive and negative correlations, respectively. *P < 0.05, **P < 0.01, ***P < 0.001. 图 1 桂林会仙喀斯特湿地植物叶片6种元素含量及C、N、P化学计量比之间的Pearson相关性 Fig. 1 Pearson correlation between the content of 6 elements and the stoichiometric ratios of C, N, P of the leaves of plants in Huixian Karst Wetland of Guilin |
2.3 不同生长型植物叶片元素含量及C、N、P化学计量比的系统发育信号
在系统进化水平上, 草本、灌木、乔木植物的元素含量及其比值的性状分布与系统发育关系表现不一致。其中, 草本植物的叶片元素含量及C、N、P化学计量比, 灌木植物的LC、LN、LP、LK含量及C、N、P化学计量比, 乔木植物的LK、LCa含量及N∶P的K值均为0 < K < 1, 表明其性状分布的系统发育信号较弱。乔木和灌木植物叶片元素含量的K值均高于草本植物, 乔木植物的LC、LN、LP、LK含量及C、N、P化学计量比的K值均高于灌木植物, 乔木植物LN、LMg含量、C∶N、C∶P以及灌木植物的LCa、LMg含量的K值均大于1, 且乔木植物的LC、LP含量的K值等于1, 表明在该区域乔木植物LN、LMg含量及C∶N、C∶P,灌木植物LCa、LMg含量表现出较强的系统发育保守性, 草本、灌木、乔木植物叶片元素及其C、N、P化学计量比系统发育保守性存在差异。草本植物的叶片元素含量及C、N、P化学计量比, 灌木植物的LC、LN、LP、LK含量及C、N、P化学计量比, 乔木植物的LK、LCa含量及N∶P表现出较弱(表 3、图 2)。
| 项目Item | 草本Herb | 灌木Shurb | 乔木Tree | |||||
| K | P | K | P | K | P | |||
| LC | 0.34 | 0.17 | 0.82 | 0.68 | 1.00 | 0.24 | ||
| LN | 0.57 | 0.11 | 0.60 | 0.93 | 1.06 | 0.11 | ||
| LP | 0.15 | 0.73 | 0.74 | 0.68 | 1.00 | 0.43 | ||
| LK | 0.23 | 0.45 | 0.70 | 0.89 | 0.94 | 0.73 | ||
| LCa | 0.43 | 0.07 | 1.37 | 0.03 | 0.96 | 0.56 | ||
| LMg | 0.21 | 0.55 | 1.02 | 0.23 | 1.01 | 0.41 | ||
| C∶N | 0.46 | 0.16 | 0.58 | 0.92 | 1.08 | 0.18 | ||
| C∶P | 0.16 | 0.65 | 0.70 | 0.74 | 1.01 | 0.40 | ||
| N∶P | 0.30 | 0.22 | 0.92 | 0.46 | 0.99 | 0.43 | ||
| Note: K represents the phylogeny signal of the system; P represents the significance of phylogenetic signals at the 0.05 level. | ||||||||

|
| 图 2 不同生长型植物系统发育进化树 Fig. 2 Phylogenetic tree of plants with different growth forms |
3 讨论 3.1 不同生长型植物叶片元素含量及C、N、P化学计量比特征
植物叶片含有植物生长发育所需的多种元素,其元素平衡特征及养分利用状况可以反映植物物种的化学特征[15]。在本研究中,不同生长型植物的LC含量低于武夷山人工湿地植物的LC含量[29]和中国莱州湾滨海湿地柽柳(Tamarix chinensis Lour.)植物的LC含量[30],这与植物体内基本元素受环境影响较小、含量相对稳定的特点有关。这一发现表明,桂林会仙喀斯特湿地不同生长型植物的碳储存能力较弱。同时,不同生长型植物的LN含量低于敦煌阳关湿地生长季芦苇(Phragmites australis)的LN含量[31],而LP含量均高于黄河兰州段湿地甘蒙柽柳(Tamarix austromongolica)植物的LC含量[32]。这一现象与滨海湿地植物N、P供应条件下含量显著提高不一致[33],这可能与植物的物种特性有关,即输入量不足以打破并改变不同生长型植物的LN阈值[10]。此外,不同生长型植物的LK含量高于九段沙上沙湿地植物[34]和黔产青钱柳(Cyclocarya paliurus)的LK含量[35],表明桂林会仙喀斯特湿地不同生长型植物的LK富集现象相对显著。桂林会仙喀斯特湿地植物的LCa含量显著低于西双版纳喀斯特地区植物[36],表明不同地区的喀斯特土壤环境中Ca含量存在显著差异,进而影响植物中Ca的吸收利用能力。本研究还发现,不同生长型植物的LMg含量与Watanabe等[37]对北海道大学植物园植物的LMg的研究结果相似,表明不同区域和不同生长型植物对资源的利用可能存在一定的共性[38]。
不同生长型植物叶片的C∶N、C∶P、N∶P的平均值分别为19.92、231.89、12.41。桂林会仙喀斯特湿地不同生长型植物叶片的C∶N与海南地区不同生长型植物叶片C∶N (19.90)相当[39]。根据生长速率假说,植物的生长速率越高,其C∶P和N∶P越小[9]。本研究结果显示,不同生长型植物叶片的C∶P、N∶P均低于博斯腾湖湖滨湿地优势植物的C∶P(223.61)、N∶P (15.43)[40],并且低于中国莱州湾滨海湿地植物生长中后期的植物叶片C∶P (326.99)、N∶P (17.51)[30],表明桂林会仙喀斯特湿地不同生长型植物具有较高的生长速率。根据N∶P阈值假说,N∶P可反映植物生长所需养分受外界环境限制的情况[10]。在本研究中,草本植物叶片N∶P < 14,与王怀宾等[41]对城市园林不同生活型植物叶片N∶P的研究结果相似,表明桂林会仙喀斯特湿地草本植物生长受N限制。乔木和灌木植物叶片N∶P>14,与聂磊超等[20]对盐城滨海湿地柽柳N∶P的研究结果相似,表明桂林会仙喀斯特湿地乔木和灌木植物生长受P限制。
3.2 不同生长型植物叶片元素含量及C、N、P化学计量比之间的Pearson相关性植物叶片中的元素相关性反映了植物体内营养元素间的内在耦合机制[13]。在本研究中,植物的LC与LP、LK呈显著负相关,同时与C∶P、N∶P呈显著正相关,表明LC含量高的植物普遍具有较低的LP、LK含量,且具有较高的叶片化学计量比,这与熊星烁等[42]的研究结果一致。在本研究中,植物的LC与LN并未表现出显著的相关性,而是通过C∶N、C∶P、N∶P体现C、N、P之间的耦合关系。这种耦合关系由LN和LP主导,该结果与李鸿博等[43]的研究结果相符。此外,本研究发现,植物的LN与C∶N呈显著负相关。覃张芬等[44]的研究表明,热带珊瑚岛不同生活型植物叶片的C∶N与N含量呈显著负相关,与本研究结果相似。本研究观察到植物的LP和LK之间呈显著的正相关。相比之下,热带喀斯特季节雨林植物[12]的LP和LK之间无显著相关性,表明不同地区植物的LP和LK之间的相关性可能存在差异。此外,本研究显示,LCa和LMg呈显著正相关,这与Bai等[25]的研究结果一致,表明LCa和LMg在维持叶片细胞壁化学稳定性方面起着关键作用[6]。综上所述,植物叶片元素含量之间的内在关联性体现了桂林会仙喀斯特湿地植被存在营养物质分配和生长策略间的权衡关系。
3.3 不同生长型植物叶片元素含量及C、N、P化学计量比的系统发育信号不同生长型植物叶片元素含量及其C∶N、C∶P、N∶P的系统发育信号表明,叶片元素含量及C、N、P化学计量比,灌木植物的LC、LN、LP、LK含量及C、N、P化学计量比, 乔木植物的LK、LCa含量及N∶P的系统发育信号。这与王诗韵等[45]对艾比湖典型植物群落的研究结果相似,同时与Metali等[46]对文莱58种热带植物的LN、LP、LK、LCa和LMg系统发育保守性的研究结果一致。艾比湖和文莱植物的LC、LN、LP、LK、LCa和LMg不具有进化的保守性,不受系统发育历史的显著影响。这进一步表明,在桂林会仙喀斯特湿地中,草本植物的乔木植物的LN、LMg、C∶N、C∶P及灌木植物的LCa、LMg含量在植物系统进化的过程中并不保守,这一结果不支持生态位保守理论的预测,即亲缘关系较近的植物其叶片内的元素含量相似。然而,对该区域的系统发育保守性研究的结果表明,草本植物都不具备系统发育保守性。表现出显著的系统发育信号,与Bai等[25]对洞穴植物LCa的研究结果一致,这一结果支持生态位保守理论的预测。乔木植物的LN、LMg、C∶N、C∶P及灌木植物的LCa、LMg含量这可能是由于叶片化学计量受植物生长型的影响,而草本植物叶片元素含量在不同环境因子的作用下相对于乔木和灌木植物显示出较大的变异性,因此不具备系统发育保守性[45, 47]。造成上述差异的原因可能包括两方面:一方面,在多数情况下,植物叶片元素含量未表现出显著系统发育保守性可能与样本量低有关[12]。另一方面,在局域尺度上,有限的资源和生物种群之间的竞争会导致功能性状的趋同适应,环境过滤和生物竞争共同影响物种的共存模式和生态系统的稳定性[48];同时,亲缘关系近的物种在某些功能性状上的趋异分化可能是环境异质性所引起的[28]。因此,本研究中不同生长型植物可能存在不同的性状以适应分化。
4 结论桂林会仙喀斯特湿地不同生长型植物叶片元素含量及其C、N、P化学计量比的分析结果表明,不同生长型植物的元素含量不同,且养分利用能力存在差异。不同生长型植物的LMg含量、C∶N之间存在显著差异,而其他叶片化学计量之间则存在一定的差异,这表明植物叶片元素及其C∶N、C∶P、N∶P之间具有较强的耦合关系。乔木和灌木植物叶片N∶P>14,表明其生长受P的限制;而草本植物叶片N∶P < 14,指示其生长受N的限制。此外,草本植物的叶片元素含量及其C、N、P化学计量比, 灌木植物的LC、LN、LP、LK含量及其C、N、P化学计量比, 乔木植物的LK、LCa含量及N∶P未表现出显著的系统发育保守性。因此,在植物的进化背景下,桂林会仙喀斯特湿地不同生长型植物叶片元素含量及其C、N、P化学计量比可能更多地受到环境变化的影响,而不具备系统发育的保守性。
| [1] |
贺金生, 韩兴国. 生态化学计量学: 探索从个体到生态系统的统一化理论[J]. 植物生态学报, 2010, 34(1): 2-6. DOI:10.3773/j.issn.1005-264x.2010.01.002 |
| [2] |
田地, 严正兵, 方精云. 植物生态化学计量特征及其主要假说[J]. 植物生态学报, 2021, 45(7): 682-713. |
| [3] |
SARDANS J, PEÑUELAS J. Climate and taxonomy underlie different elemental concentrations and stoichiometries of forest species: the optimum "biogeochemical niche"[J]. Plant Ecology, 2014, 215(4): 441-455. DOI:10.1007/s11258-014-0314-2 |
| [4] |
TANG Z Y, XU W T, ZHOU G Y, et al. Patterns of plant carbon, nitrogen, and phosphorus concentration in relation to productivity in China's terrestrial ecosystems[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(16): 4033-4038. |
| [5] |
程滨, 赵永军, 张文广, 等. 生态化学计量学研究进展[J]. 生态学报, 2010, 30(6): 1628-1637. |
| [6] |
NEUGEBAUER K, BROADLEY M R, EL-SEREHY H A, et al. Variation in the angiosperm ionome[J]. Physiologia Plantarum, 2018, 163(3): 306-322. DOI:10.1111/ppl.12700 |
| [7] |
SARDANS J, RIVAS-UBACH A, PEÑUELAS J. Factors affecting nutrient concentration and stoichiometry of forest trees in Catalonia (NE Spain)[J]. Forest Ecology and Management, 2011, 262(11): 2024-2034. DOI:10.1016/j.foreco.2011.08.019 |
| [8] |
ÅGREN G I, WEIH M. Plant stoichiometry at different scales: element concentration patterns reflect environment more than genotype[J]. New Phytologist, 2012, 194(4): 944-952. DOI:10.1111/j.1469-8137.2012.04114.x |
| [9] |
STERNER R W, ELSER J J. Ecological stoichiometry: the biology of elements from molecules to the biosphere[M]. Princeton, NJ: Princeton University Press, 2003.
|
| [10] |
GÜSEWELL S. N∶P ratios in terrestrial plants: variation and functional significance[J]. New Phytologist, 2004, 164(2): 243-266. DOI:10.1111/j.1469-8137.2004.01192.x |
| [11] |
BAI K D, ZHOU X W, LV S H, et al. Biogeochemical niche conservatism relates to plant species diversification and life form evolution in a subtropical montane evergreen broad-leaved forest[J]. Ecology and Evolution, 2022, 12(12): e9587. DOI:10.1002/ece3.9587 |
| [12] |
BAI K D, LV S H, NING S J, et al. Leaf nutrient concentrations associated with phylogeny, leaf habit and soil chemistry in tropical karst seasonal rainforest tree species[J]. Plant and Soil, 2019, 434(1): 305-326. |
| [13] |
ELSER J J, FAGAN W F, KERKHOFF A J, et al. Biological stoichiometry of plant production: metabolism, scaling and ecological response to global change[J]. New Phytologist, 2010, 186(3): 593-608. DOI:10.1111/j.1469-8137.2010.03214.x |
| [14] |
FERNÁNDEZ-MARTÍNEZ M, PREECE C, CORBE-RA J, et al. Bryophyte C∶N∶P stoichiometry, biogeochemical niches and elementome plasticity driven by environment and coexistence[J]. Ecology Letters, 2021, 24(7): 1375-1386. DOI:10.1111/ele.13752 |
| [15] |
SARDANS J, VALLICROSA H, ZUCCARINI P, et al. Empirical support for the biogeochemical niche hypothesis in forest trees[J]. Nature Ecology & Evolution, 2021, 5(2): 184-194. |
| [16] |
VERGUTZ L, MANZONI S, PORPORATO A, et al. Global resorption efficiencies and concentrations of carbon and nutrients in leaves of terrestrial plants[J]. Ecological Monographs, 2012, 82(2): 205-220. DOI:10.1890/11-0416.1 |
| [17] |
PRINZING A, DURKA W, KLOTZ S, et al. The niche of higher plants: evidence for phylogenetic conservatism[J]. Proceedings of the Royal Society of London.Series B: Biological Sciences, 2001, 268(1483): 2383-2389. DOI:10.1098/rspb.2001.1801 |
| [18] |
SARDANS J, PEÑUELAS J, COLL M, et al. Stoichiometry of potassium is largely determined by water availability and growth in Catalonian forests[J]. Functional Ecology, 2012, 26(5): 1077-1089. DOI:10.1111/j.1365-2435.2012.02023.x |
| [19] |
FELSENSTEIN J. Phylogenies and the comparative method[J]. The American Naturalist, 1985, 125(1): 1-15. DOI:10.1086/284325 |
| [20] |
聂磊超, 崔丽娟, 刘志君, 等. 盐城滨海湿地优势植物碳氮磷生态化学计量高光谱反演[J]. 生态学报, 2023, 43(12): 5173-5185. |
| [21] |
徐广平, 李艳琼, 沈育伊, 等. 桂林会仙喀斯特湿地水位梯度下不同植物群落土壤有机碳及其组分特征[J]. 环境科学, 2019, 40(3): 1491-1503. |
| [22] |
沈育伊, 张德楠, 徐广平, 等. 会仙喀斯特湿地三种典型植物叶片碳同位素(δ13C)特征及其指示意义[J]. 广西植物, 2021, 41(5): 769-779. |
| [23] |
孙英杰, 徐广平, 沈育伊, 等. 桂林会仙喀斯特湿地芦苇群落区土壤酶活性[J]. 湿地科学, 2018, 16(2): 196-203. |
| [24] |
胡聪, 韦锋, 徐超昊, 等. 广西会仙喀斯特湿地植物群落的多样性和区系成分[J]. 湿地科学, 2024, 22(1): 82-87. |
| [25] |
BAI K D, WEI Y G, ZHANG D N, et al. Contrasting effects of light, soil chemistry and phylogeny on leaf nutrient concentrations in cave-dwelling plants[J]. Plant and Soil, 2020, 448(1): 105-120. |
| [26] |
BURNHAM K P, ANDERSON D R. Model selection and multimodel inference: a practical information-theoretic approach[M]. 2nd ed. New York: Springer-Verlag, 2002.
|
| [27] |
SMITH S A, BROWN J W. Constructing a broadly inclusive seed plant phylogeny[J]. American Journal of Botany, 2018, 105(3): 302-314. DOI:10.1002/ajb2.1019 |
| [28] |
BLOMBERG S P, GARLAND T, IVES A R. Testing for phylogenetic signal in comparative data: behavioral traits are more labile[J]. Evolution, 2003, 57(4): 717-745. |
| [29] |
郭汝凤, 刘鑫铭, 李冠军, 等. 武夷山人工湿地系统植物生长期内土壤-植物碳氮磷变化特点[J]. 应用与环境生物学报, 2020, 26(2): 433-441. |
| [30] |
RONG Q, LIU J, CAI Y, et al. Leaf carbon, nitrogen and phosphorus stoichiometry of Tamarix chinensis Lour.in the Laizhou Bay coastal wetland, China[J]. Ecological Engineering, 2015, 76: 57-65. |
| [31] |
LIU D, ZHANG J, BISWAS A, et al. Seasonal dynamics of leaf stoichiometry of Phragmites australis: a case study from Yangguan wetland, Dunhuang, China[J]. Plants, 2020, 9(10): 1323. DOI:10.3390/plants9101323 |
| [32] |
刘文兰, 孙学刚, 焦健, 等. 黄河兰州段湿地土壤与甘蒙柽柳叶片碳氮磷生态化学计量特征[J]. 北京林业大学学报, 2023, 45(6): 43-51. |
| [33] |
刘晓玲, 王光美, 于君宝, 等. 氮磷供应条件对黄河三角洲滨海湿地植物群落结构的影响[J]. 生态学杂志, 2018, 37(3): 801-809. |
| [34] |
刘长娥, 杨永兴, 杨杨. 九段沙上沙湿地植物钾元素的分布、积累与动态[J]. 湿地科学, 2008, 6(2): 185-191. |
| [35] |
柏文恋, 袁丛军, 谢涛, 等. 黔产青钱柳叶片营养元素含量特征及变异规律[J]. 中南林业科技大学学报, 2022, 42(2): 36-45. |
| [36] |
崔培鑫, 申智骅, 付培立, 等. 中国南方生长于不同基质的天然林植物叶片元素含量特征比较[J]. 生态学报, 2020, 40(24): 9148-9163. |
| [37] |
WATANABE T, AZUMA T. Ionomic variation in leaves of 819 plant species growing in the botanical garden of Hokkaido University, Japan[J]. Journal of Plant Research, 2021, 134(2): 291-304. |
| [38] |
庄伟伟, 王明明. 荒漠地区8种草本植物营养元素含量的比较分析[J]. 植物研究, 2022, 42(5): 896-909. |
| [39] |
张亚兴, 朱丽薇, 刘楠. 海南不同生活型植物叶片和根系C、N、P化学计量特征[J]. 热带亚热带植物学报, 2020, 28(2): 131-135. |
| [40] |
郁国梁, 王军强, 马紫荆, 等. 博斯腾湖湖滨湿地优势植物叶片碳、氮、磷化学计量特征的季节动态及其影响因子[J]. 植物资源与环境学报, 2022, 31(5): 9-18. |
| [41] |
王怀宾, 胥晓, 杨万勤, 等. 城市园林不同生活型植物叶片碳、氮、磷生态化学计量特征及其对台风的响应[J]. 生态学报, 2021, 41(22): 8931-8938. |
| [42] |
熊星烁, 蔡宏宇, 李耀琪, 等. 内蒙古典型草原植物叶片碳氮磷化学计量特征的季节动态[J]. 植物生态学报, 2020, 44(11): 1138-1153. |
| [43] |
李鸿博, 许云蕾, 余志祥, 等. 金沙江干热河谷典型植物叶片C、N、P生态化学计量特征研究[J]. 西北林学院学报, 2021, 36(3): 10-16. |
| [44] |
覃张芬, 汤松波, 旷远文, 等. 热带珊瑚岛不同生活型植物叶片性状及其生态适应性意义[J]. 热带亚热带植物学报, 2022, 30(6): 855-862. |
| [45] |
王诗韵, 吕光辉, 蒋腊梅, 等. 不同尺度下艾比湖典型植物群落功能多样性和系统发育多样性研究[J]. 生态环境学报, 2020, 29(5): 889-900. |
| [46] |
METALI F, SALIM K A, BURSLEM D F R P. Evidence of foliar aluminium accumulation in local, regional and global datasets of wild plants[J]. New Phytologist, 2012, 193(3): 637-649. |
| [47] |
苗乐乐, 刘旻霞, 肖音迪, 等. 不同纬度植物群落系统发育与功能性状结构研究[J]. 生态学报, 2024, 44(1): 317-329. |
| [48] |
税伟, 冯洁, 李慧, 等. 喀斯特退化天坑不同坡向植物群落系统发育与功能性状结构[J]. 生态学报, 2022, 42(19): 8050-8060. |



