2. 广西大学林学院, 广西森林生态与保育重点实验室, 广西南宁 530004
2. Guangxi Key Laboratory of Forest Ecology and Conservation, College of Forestry, Guangxi University, Nanning, Guangxi, 530004, China
光照是森林群落更新、植物存活与生长的关键限制因子,植物对不同光环境的响应和适应特性是森林群落更新及植物群落演替的重要内在驱动力[1]。一些极小种群野生植物的种群更新与光照密切相关。如高光强水平(100%光照)和深度遮阴(20%光照)均不利于极小种群野生植物云南蓝果树(Nyssa yunnanensis)幼苗的生长及光合作用,适度遮阴(60%光照)最利于其幼苗的个体发育,而天然生境中日趋干旱的土壤环境加剧了云南蓝果树幼苗对光照的敏感性,导致其野外天然更新困难[2]。因此,研究极小种群野生植物对光强的需求和适应性尤为重要。
植物可以通过改变生长量、叶片形态特征、光合色素含量和生物量分配等光合生理特征来响应光强的改变[3, 4]。目前,关于濒危植物对不同光强的响应特性的研究较多,如适度遮阴可提高珙桐(Davidia involucrata)的光合速率,改善其生长状况[5];极危种毛果木莲(Manglietia ventii)表现出强光不适应性[6]。许多濒危植物由于原生境破坏严重,种群数量急剧减少,成为极小种群野生植物。极小种群野生植物往往对生境光照和水热条件要求严格,因此有必要开展极小种群野生植物对不同光强的响应研究。
白花兜兰(Paphiopedilum emersoniii)是我国特有的兰科(Orchidaceae)兜兰属(Paphiopedilum)植物,具有极高的观赏价值[7]。白花兜兰作为栽培种中的优良种质资源,市场需求量高。目前,白花兜兰已被列为国家Ⅰ级重点保护植物,世界自然保护联盟(International Union for Conservation of Nature, IUCN)评估其为极度濒危物种,属典型的极小种群野生植物[8, 9]。白花兜兰在生长过程中遭遇了自然生境破碎、自然繁殖困难导致种群稀少等问题,再造或重建其原生境是保护白花兜兰的有效措施。综合前人野外测量结果,白花兜兰天然生境林下的光强很低,从种子萌发至植株成熟大都处于林下荫蔽环境。因此根据野生生境对光强的需求采用仿生技术栽培白花兜兰可以有效提高其个体数量。目前仿生栽培技术已运用于白及(Bletilla striata)、铁皮石斛(Dendrobium officinale)和霍山石斛(D.huoshanense)[10-12]等兰科植物的人工栽培中,成为培育兰科植物的有效技术手段。尽管研究报道白花兜兰原生境光强较低,但是不同光强对白花兜兰生长的影响不得而知。因此,本研究采用盆栽方法模拟不同光强对白花兜兰植株光合特性和生物量积累的影响,拟为白花兜兰繁育与栽培奠定生态学基础。
1 材料与方法 1.1 材料及预处理白花兜兰野生群落多分布在光照较弱的林下[13],本试验在夏季最大自然光强约为2 500 μmol·m-2·s-1基础上,通过增加遮阴网设计研究不同自然光强对白花兜兰光合生理特性和生物量积累的影响,3个不同光强处理分别标记为RI 10、RI 30和RI 50,对应的最大光合有效辐射分别为250、750、1 250 μmol·m-2·s-1。试验地点位于广西壮族自治区桂林市广西植物研究所,地理坐标为25°11′N,110°12′E,地处低纬度,属亚热带季风气候,具有明显的干湿季,夏季雨量充沛;年平均气温18.8 ℃,年平均日照1 553.09 h,日照时数最多月份为7月,平均日照时数为202.0 h,最少月份为12月,平均日照时数为28.1 h。试验材料为3年生白花兜兰栽培植株,2021年3月下旬将白花兜兰长势良好的植株移栽于内径30 cm、深25 cm的塑料花盆中,栽培基质为腐殖土∶木屑质量比为3∶1的混合土壤。进行光照处理前将所有试验材料放置于RI 10光强的遮阴棚中缓苗,5月下旬将植株随机分成4组,每组10盆,移栽至各光强的阴棚中。试验期间进行常规的浇水和病虫害防治。7月下旬进行试验指标测定。
1.2 测定指标与方法 1.2.1 光合日变化测定方法2022年8月,于晴天采用Li-6400XT便携式光合仪(北京力高泰科技有限公司)的透明叶室测量白花兜兰光合日变化,每个光强处理选择3株生长良好的植株进行测定,每株植株测定同一部位的3片叶片,测定时间为9:00-17:00,每小时测量1次,测量指标包括净光合速率(Net photosythetic rate, Pn, μmol·m-2·s-1)、胞间二氧化碳(CO2)浓度(Intercellular carbon dioxide concentration, μmol·mol-1, Ci)、气孔导度(Stomatal conductance, Gs,cm·s-1)、蒸腾速率(Transpiration rate, Tr,mmol·m-2·s-1)。测量指标均可从Li-6400XT便携式光合仪中导出,根据这些指标计算水分利用效率(Water Use Efficiency,WUE,mmol·mol-1)和气孔限制值(Limiting value of stomata,Ls)等[14]。WUE、Ls计算公式如下:
| $ \mathrm{WUE}=P_{\mathrm{n}} / T_{\mathrm{r}}, $ | (1) |
| $ L_{\mathrm{s}}=1-\left(C_{\mathrm{i}} / C_{\mathrm{a}}\right), $ | (2) |
公式(2)中Ci为叶片内环境中的胞间CO2浓度,Ca为空气中的CO2浓度。
1.2.2 光响应曲线测定方法光响应曲线采用Li-6400XT便携式光合仪LED红蓝光源叶室测定,测定时间为9:00-12:00,每个光强处理测定3株,每株选择3片生长基本一致的健康成熟叶片。光强依次设置为0、20、30、50、100、150、200、400、500、800、1 000、1 200 μmol·m-2·s-1。使用二氧化碳钢瓶控制二氧化碳浓度为400 μmol·m-2·s-1,测量前将叶片置于800 μmol·m-2·s-1光强下进行诱导[15]。
| $ P_{\mathrm{n}}=\frac{\alpha I+P_{\text {max }}-\sqrt{\left(\alpha I+P_{\max }\right)^2-4 \theta \alpha I P_{\max }}}{2 \theta}- \\ R_{\mathrm{d}} \text {, } $ | (3) |
公式(3)中,α为初始量子效率,用0-100 μmol·m-2·s-1光强下直线的斜率表示。Pmax为最大净光合速率或光饱和光合速率,Rd为暗呼吸速率,I为光合有效辐射,θ为非直角双角线的曲角。光补偿点表示净光合速率为零时的光强,即与X轴交点,光饱和点(Light Saturation Point, LSP)为Pmax对应的光强。光饱和点由直线方程(4)计算[16]。
| $ P_{\text {max }}=\alpha \times \mathrm{LSP}-R_{\mathrm{d}} \text { 。} $ | (4) |
光合作用测定结束后,将叶片取下,迅速放入装有冰块的保温箱中,带回实验室进行研磨,用80%丙酮提取,使用岛津UV-1900i紫外分光光度计(上海元析仪器有限公司)分别在663和645 nm处测定吸光值A,并按以下公式计算叶绿素a(Chl a)、叶绿素b(Chl b)和叶绿素总量(Chl a+Chl b)。
| $ \text { Chl } a=12.72 A_{663}-2.59 A_{645} \text {, } $ | (5) |
| $ \text { Chl } b=22.88 A_{645}-4.673 A_{663} \text {, } $ | (6) |
| $ \text { Chl } a+\text { Chl } b=120.29 A_{645}+8.05 A_{663} \text { 。} $ | (7) |
叶绿素测定完成后,选取每个光强处理下叶片完整的植株各10株,用枝剪在土面接触处将植株分为地上部分和地下部分,分别用信封在70 ℃烘箱烘干至恒重后,测定地上部分和地下部分干重。
1.3 数据处理与分析采用Microsoft Excel 2021进行数据筛选与整理;采用SPSS 22.0软件进行方差分析与Duncan多重比较,并对Pn和其他光合指标进行相关性分析;采用叶子飘[15]光合计算软件4.1.1进行光响应曲线拟合;采用Origin 2023b绘图。
2 结果与分析 2.1 光强对白花兜兰光合日变化的影响 2.1.1 白花兜兰叶片Pn日变化特征不同光强处理下白花兜兰叶片Pn日变化趋势基本相似,随着时间推进Pn均呈现下降趋势。上午为白花兜兰光合作用能力较强时间,表现在3个光强处理下白花兜兰叶片Pn在12:00前具有较大值,但在12:00之后3个光强处理下白花兜兰Pn均下降到1.00 μmol·m-2·s-1以下(图 1)。测定时间范围内3个光强处理下白花兜兰Pn日变化并没有呈现明显“单峰”或“双峰”曲线,原因可能是日变化开始测定时间较晚,其峰值可能在9:00及9:00以前。RI 30处理下白花兜兰叶片Pn日均值最高,其值为1.06 μmol·m-2·s-1,显著高于RI 10和RI 50 (P<0.05)(表 1)。由此可见,在一定光强范围内增加光强可以促进白花兜兰光合作用。
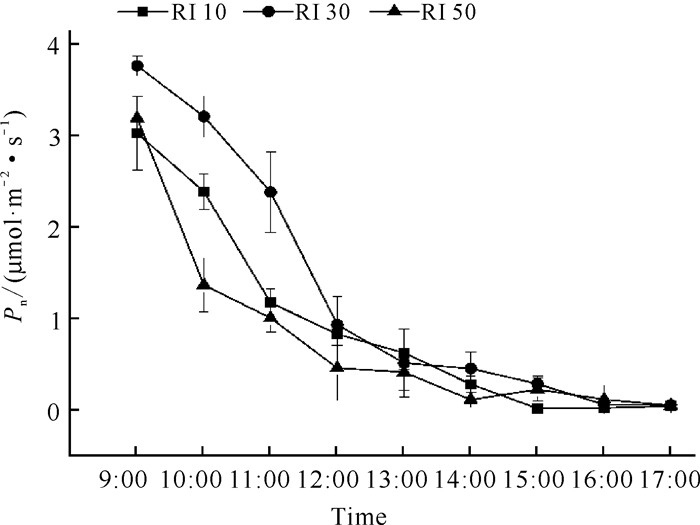
|
| 图 1 不同光强下白花兜兰叶片Pn日变化 Fig. 1 Diurnal variation of Pn of P.emersonii leaves under different light intensity |
| 光合指标 Photosynthetic index |
RI 10 | RI 30 | RI 50 |
| Pn | 0.89±0.02b | 1.06±0.06a | 0.75±0.03c |
| Gs | 0.0162±0.0.0030a | 0.0175±0.0040a | 0.0155±0.0015a |
| Ci | 259.51±6.34a | 232.15±17.5b | 274.66±6.46a |
| Tr | 0.81±0.18a | 0.57±0.06ab | 0.46±1.10b |
| WUE | 1.42±0.18b | 2.04±0.14a | 1.24±0.39b |
| Ls | 0.26±0.03b | 0.34±0.05a | 0.28±0.06b |
| Note: different letters in the same line indicate significant differences (P<0.05). | |||
2.1.2 白花兜兰叶片Gs日变化特征
不同光强处理下白花兜兰Gs日变化趋势如图 2所示,RI 10和RI 30处理基本随时间递进呈现“下降-上升-下降”趋势,RI 50处理随时间递进呈现下降趋势。3种光强处理在9:00-11:00对白花兜兰Gs影响和Pn一致,均随时间进程呈现下降趋势;RI 10处理下白花兜兰Gs在11:00-13:00随时间变化趋势与Pn变化趋势相反。不同光强处理对白花兜兰叶片Gs日均值影响与Pn日均值不同,RI 30处理下白花兜兰Gs日均值大于其他处理,但不同光强处理对白花兜兰叶片Gs无显著影响(P>0.05,表 1)。
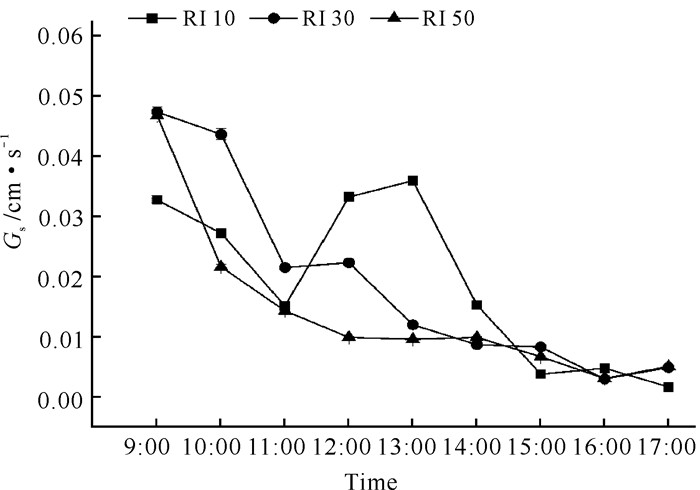
|
| 图 2 不同光强下白花兜兰叶片Gs日变化 Fig. 2 Diurnal variation of Gs of P.emersonii leaves under different light intensity |
2.1.3 白花兜兰叶片Ci日变化特征
RI 30和RI 50处理对白花兜兰Ci的影响相似,均随时间呈现“下降-上升-下降-上升”趋势,而RI 10处理在9:00-11:00时Ci变化与其他光强处理相反。3个光强处理均在12:00达到最大值,其Ci分别为324.58、302.85和318.77 μmol·mol-1(图 3),此时白花兜兰叶片气孔导度减小,进入叶片细胞用于光合作用的二氧化碳浓度较低,导致Ci较高。RI 50处理Ci日均值显著低于RI 10和RI 30处理(P<0.05, 表 1)。
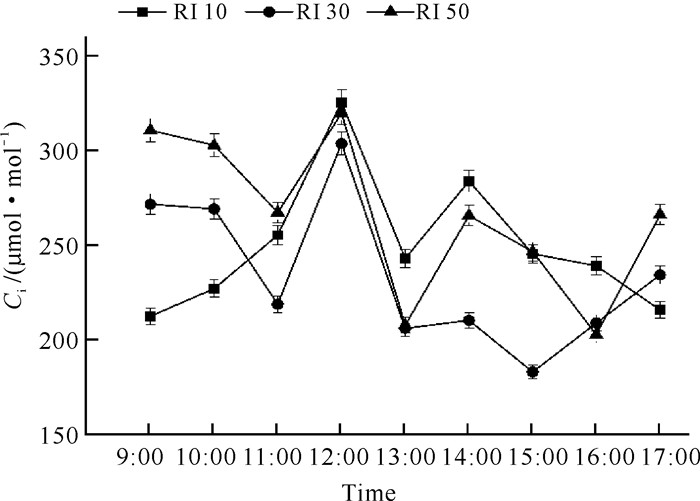
|
| 图 3 不同光强下白花兜兰叶片Ci日变化 Fig. 3 Diurnal variation of Ci of P.emersonii leaves under different light intensity |
2.1.4 白花兜兰叶片Tr日变化特征
不同光强处理下白花兜兰Tr日变化趋势不同(图 4),RI 10处理整体上具有较大的蒸腾速率,表现在12:00-14:00 Tr值明显高于其他光强处理。随着光强的增加,白花兜兰叶片Tr日均值降低,RI 30处理下白花兜兰Tr日均值仅为RI 10处理的70.37%,而RI 10处理显著高于RI 50(P<0.05, 表 1)。
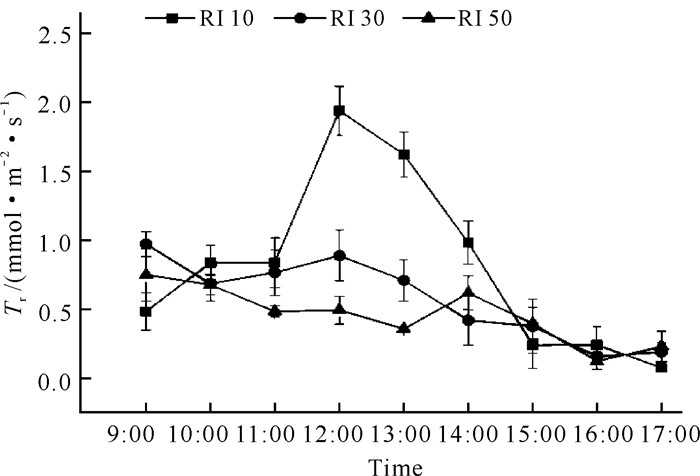
|
| 图 4 不同光强下白花兜兰叶片Tr日变化 Fig. 4 Diurnal variation of Tr of P.emersonii leaves under different light intensity |
2.1.5 白花兜兰叶片WUE日变化特征
不同光强处理对白花兜兰WUE的影响相似,与Pn日变化大致相似,基本上随时间递进呈现下降趋势,WUE均于9:00左右达到最大值,13:00以后均小于1 mmol·mol-1(图 5)。各光强处理下白花兜兰的WUE日均值大小依次为RI 30>RI 10>RI 50,RI 30处理下WUE显著高于其他处理(P<0.05, 表 1)。
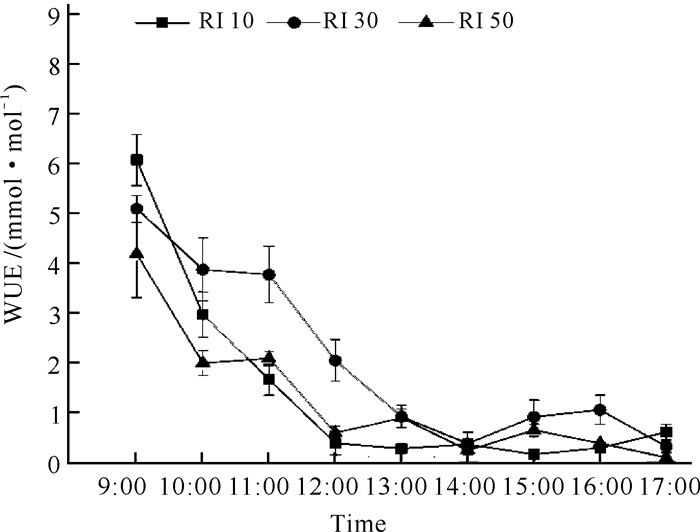
|
| 图 5 不同光强下白花兜兰叶片WUE日变化 Fig. 5 Diurnal variation of WUE of P.emersonii leaves under different light intensity |
2.1.6 白花兜兰Ls日变化特征
不同光强处理对白花兜兰Ls的影响不同,RI 30和RI 50处理随时间呈现“上升-下降-上升-下降”趋势,但出现拐点的时间不完全一致;而RI 10处理随时间递进呈现“下降-上升-下降”趋势(图 6)。中午12:00左右3个光强处理下白花兜兰叶片Ls均达到一个较低值,13:00之后不同光强处理下白花兜兰Ls变化趋势完全不一致。各处理白花兜兰的Ls日均值大小依次为RI 30>RI 50>RI 10,且RI 30处理Ls日均值显著高于其他两个处理(P<0.05, 表 1)。
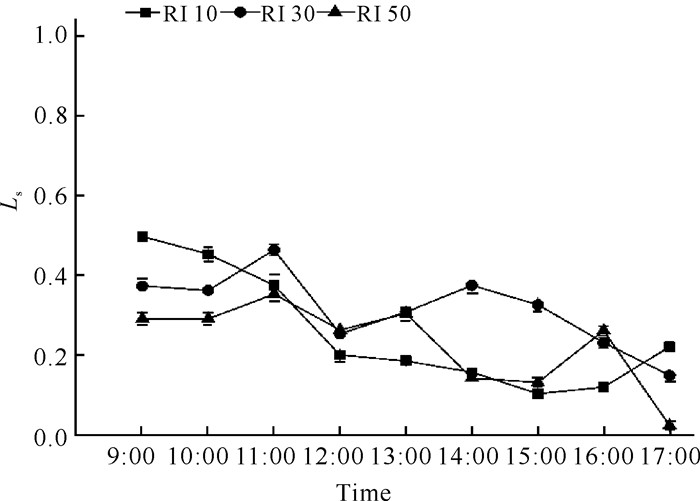
|
| 图 6 不同光强下白花兜兰叶Ls日变化 Fig. 6 Diurnal variation of Ls of P.emersonii leaves under different light intensity |
2.2 光强对白花兜兰光响应曲线的影响
白花兜兰叶片Pn对不同光强的响应相似(图 7),光强为0-800 μmol·m-2·s-1时,Pn随着光强的增加而增加,在0-200 μmol·m-2·s-1时增长速率最快,后期缓慢增长,当光强达到800 μmol·m-2·s-1时,白花兜兰叶片Pn趋于平衡,但RI 50处理出现随着光强的增加Pn呈下降的趋势,说明强光下白花兜兰光合作用出现了光抑制。
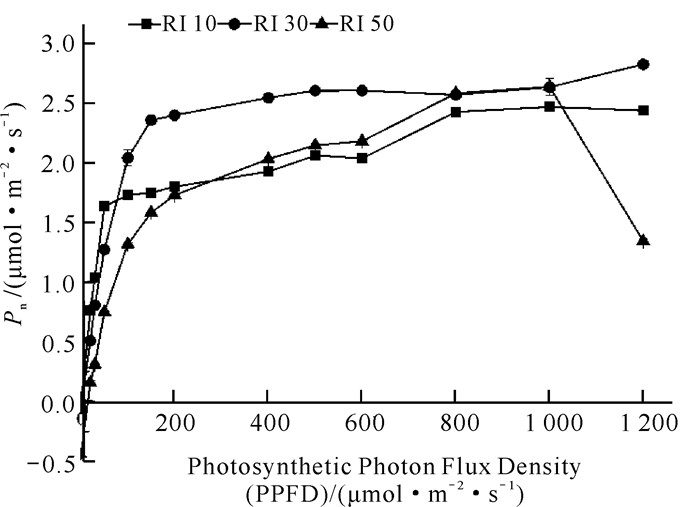
|
| 图 7 不同光强下白花兜兰叶片光响应曲线 Fig. 7 Light response curves of P.emersonii leaves under different light intensities |
由表 3可知,3种光强处理下白花兜兰叶片的光响应曲线拟合较好,均达到显著水平,其R2均在0.95以上。根据表 3中光合计算软件模拟出的Pmax可看出,RI 30处理的Pmax最大,其值为2.68 μmol·m-2·s-1,显著高于RI 50和RI 10处理。不同光强处理下模拟的光饱和点(LSP)具有显著性差异,RI 30处理下LSP最大,为839.29 μmol·m-2·s-1,其次分别为RI 50和RI 10处理,其LSP值分别为RI 30处理的87.64%和65.65%。不同光强处理下模拟的光补偿点(LCP)差异显著,RI 10处理下LCP最大,为14.55 μmol·m-2·s-1,其次分别为RI 30和RI 50处理,其LCP分别为RI 10处理的23.09%和5.63%。暗呼吸速率Rd在RI 10处理最高,其值为0.36 μmol·m-2·s-1。不同光强处理下表观量子效率(Apparent Quantum Efficiency,AQE)由大至小依次为RI 30、RI 10、RI 50。
| 处理 Treatment |
Pmax / (μmol· m-2· s-1) |
LSP/ (μmol· m-2· s-1) |
LCP/ (μmol· m-2· s-1) |
Rd/ (μmol· m-2· s-1) |
AQE/ (μmol· m-2· s-1) |
R2 |
| RI 10 | 2.28±0.01b | 551.00±1.71c | 14.55±0.19a | 0.36±0.01a | 0.011 1±0.002b | 0.952 5 |
| RI 30 | 2.68±0.03a | 839.29±172.58a | 3.36±0.26b | 0.18±0.04b | 0.014 0±0.000 5a | 0.966 2 |
| RI 50 | 2.08±0.01c | 735.53±7.10b | 0.82±0.25c | 0.06±0.02c | 0.008 1±0.000 1c | 0.950 9 |
| Note: different letters in the same column indicate significant differences. | ||||||
2.3 光强对白花兜兰叶绿素含量的影响
两个月试验结束时观察到RI 10处理下白花兜兰植株生长较好,叶片浓绿而有光泽,RI 30处理的叶色浅绿,而RI 50光强处理的叶片开始发黄,且少量叶片有日灼现象。由表 4可知,RI 10和RI 30处理下白花兜兰叶片光合色素含量显著高于RI 50处理,但RI 10和RI 30处理间无显著性差异,这说明当光强达到自然光强度的50%时,白花兜兰叶片叶绿素易遭到破坏,不利于叶绿素形成;在光强较弱条件下白花兜兰会调整其叶片叶绿素含量以便于充分吸收和利用散射光。
| 光强 Intensities |
叶绿素a Chl a/(mg·g-1FW) |
叶绿素b Chl b/(mg·g-1FW) |
叶绿素a和叶绿素b Chl(a+b)/(mg·g-1FW) |
类胡萝卜素 Car/(mg·g-1 FW) |
叶绿素a/叶绿素b Chl a/Chl b |
类胡萝卜素/叶绿素 Car/Chl |
| RI 10 | 6.63±0.87a | 2.58±0.35a | 9.20±1.22a | 1.92±0.18a | 2.67±0.07a | 0.21±0.01b |
| RI 30 | 6.41±0.41a | 2.41±0.21a | 8.82±0.61a | 1.84±0.80a | 2.57±0.44a | 0.21±0.01b |
| RI 50 | 5.28±0.81b | 2.05±0.31b | 7.33±1.11b | 1.66±0.16b | 2.58±0.07a | 0.23±0.01a |
| Note: different letters in the same column indicate significant differences. | ||||||
2.4 光强对白花兜兰生物量的影响
光强对白花兜兰地上和地下生物量积累的影响不同(图 8),RI 30处理下白花兜兰地上和地下生物量均达到最大值,分别为5.75 g和6.90 g。地上部分生物量在不同光强处理下具有显著性差异(P<0.05),地下部分干重无显著差异(P>0.05),原因可能是光强处理时间仅为2个月,时间过短无法准确反映光强处理对植株地下部分的影响。
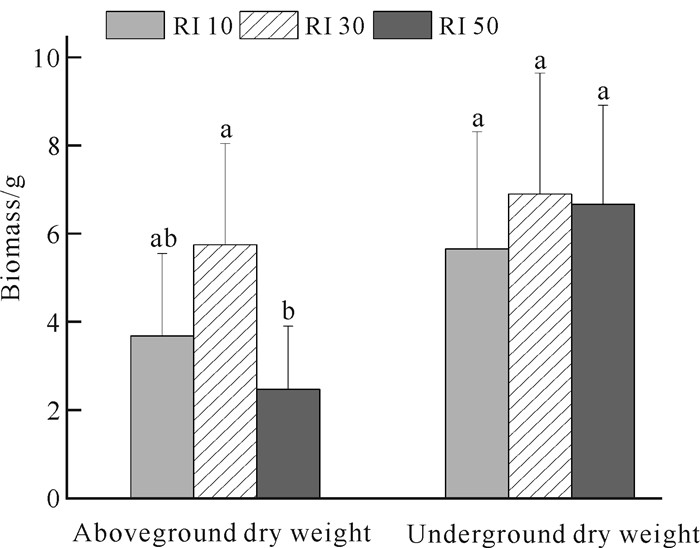
|
| Different letters of the same treatment indicate significant differences (P < 0.05). 图 8 不同光强下白花兜兰地上和地下生物量变化 Fig. 8 Changes of aboveground and underground biomass of P.emersonii under different light intensity |
3 讨论
光照是影响植物最重要的环境因素之一,不同光照条件对植物生长发育与生物量积累有重要的影响[17]。本研究结果表明,Pn、Gs、Pmax都在RI 30处理条件下达到最高,同时RI 30处理具有最高的LSP和AQE,该处理条件下水分利用效率也显著高于其他处理(表 1)。说明RI 30光强条件下白花兜兰可利用光强范围相对较广,能保持较高的生产力水平。该研究结果与香草兰(Vanilla fragrans)在75%遮阴条件达到较高光合生产力结果一致[18]。
Pn下降的影响因素大致有气孔因素与非气孔因素两种。气孔因素是由于光照、温度和湿度等环境因子等引起植物部分气孔关闭,二氧化碳进入叶片受阻而使净光合速率下降;非气孔因素主要是叶肉细胞自身羧化酶活性降低而导致净光合速率下降。根据Farquhar和Sharkey[19]的观点,只有当Pn和Ci同时减小,且Ls增大时,才可认为Pn下降主要是由气孔因素引起,否则Pn下降应归因于叶肉细胞羧化能力的降低。由Pn日变化(图 1)、Ci日变化(图 3)和Ls日变化(图 6)可知,RI 10光强处理下白花兜兰叶片在9:00-12:00和13:00-14:00时间段Ci增大,与Pn变化相反,而在12:00-13:00时间段Ci变化与Pn变化一致,可见RI 10光强处理下白花兜兰叶片Pn 9:00-12:00主要受非气孔因素限制,12:00-17:00同时受气孔和非气孔因素限制。同理可见,RI 30光强处理下白花兜兰叶片Pn在14:00前和15:00后主要受非气孔因素制约,只有在14:00-15:00时受到气孔因素制约;RI 50光强处理下白花兜兰叶片Pn在13:00前和16:00后主要受非气孔因素制约,只有在14:00-16:00时受气孔因素制约。由此可见,不同光强处理下白花兜兰Pn的降低主要是由于羧化酶活性降低引起的,原因可能是夏季温度过高,导致酶活性下降。
光强的升高在一定程度上促进了白花兜兰的光合作用,随着光强增加,白花兜兰Pmax显著升高。白花兜兰叶片对不同光强的响应不同,RI 10-RI 30光强范围内增加光强能促进其光合作用,但光强达到RI 50后,白花兜兰Pmax显著降低,原因可能是强光引起PSⅡ结构破坏,降低Rubiso酶活性,增加暗呼吸速率,诱导活性氧和光抑制的产生,从而导致叶片光合速率下降。表观量子效率AQE是度量植物对弱光利用能力的指标,在适宜的生长条件下,植物的AQE为0.03-0.05。在本研究中,白花兜兰3个光强处理下的AQE均低于0.03,原因可能有两个:一是白花兜兰自身生长特性决定其光合作用能力和对弱光的利用能力较低,这一点可以从白花兜兰的Pn日均值(表 1)和Pmax(表 3)可以看出,3个光强处理下白花兜兰的Pn日均值和Pmax均小于3 μmol·m-2·s-1;另一个原因是白花兜兰均受到一定程度的光抑制,这从光响应曲线可以看出,当光量子通量密度达到800 μmol·m-2·s-1时,白花兜兰的Pn出现下降趋势。此外,LSP和LCP反映了植物对强光和弱光的适应范围,两者的差值越大,反映其对光强的适应能力越强。本研究中,RI 30处理下白花兜兰LSP和LCP差值为835.39 μmol· m-2· s-1,明显高于RI 10处理(536.45 μmol·m-2·s-1)和RI 50处理(734.71 μmol·m-2· s-1),表明30%光强是白花兜兰最佳的生长光强,在此光强处理下白花兜兰可利用光强范围最广,光合作用能力较强。
叶绿素作为光合作用的光敏催化剂,其含量及比例是植物适应并利用光能的关键指标之一[20]。在植物光合作用过程中,光强会影响叶绿素的形成与分解。弱光条件下,植物为了弥补光强不足,通过增加单位面积色素含量以增加其对光能的利用[21];反之,强光条件下,色素含量会降低[22]。本研究中白花兜兰叶片光合色素含量随着光强降低而显著增加,这与大多数植物叶绿素对光强的响应相似[23, 24]。阴生植物通过提高Chl b的比率以适应弱光环境中的散射光,捕获更多的光能。白花兜兰在提高Chl b含量的同时也提高了Chl a的含量,使各光强下Chl a/Chl b值无显著差异,与桤木(Alnus formosana)[25]和山茶(Camellia japonica)幼苗[26]的研究结果类似,但与许多植物在遮阴环境下Chl a/Chl b降低的研究结果不同[27, 28]。此外,植物还可以根据环境因子的变化来调节胡萝卜素(Car)和两种叶绿素(Chl)的比例,Car/Chl的增加有利于增强光破坏防御能力,可减轻光合机构的损害[29]。白花兜兰叶片Car/Chl在3种光强处理中具有差异,RI 10和RI 30处理无显著性差异,但RI 50处理下Car/Chl显著升高,说明其应对强光环境启动了光破坏保护机制。
植物生物量在一定程度上表征了植物光合能力和对生长发育的贡献,适当光强有利于植物充分利用光能制造有机物,促进植物生物量积累。本研究中RI 30处理下白花兜兰具有较高的地上生物量和地下生物量,表明RI 30处理促进了白花兜兰生物量的积累,该研究结果与李浩铭对伯乐树(Bretschneidera sinensis)幼苗的研究结果相似[30]。
4 结论白花兜兰在不同光强处理下光合参数、叶绿素含量和生物量积累等的变化规律揭示了其对不同光照环境的适应和调节能力。白花兜兰为阴生植物,在RI 50光强下生长受到抑制,叶绿素含量降低,地上部生物量积累减少,生长缓慢;而在RI 30光强环境下,其叶片可以通过增大气孔导度,提高PSⅡ反应中心的开放程度与活性、减少热耗散等途径来增加PSⅡ的光化学效率,作用于光合特征参数和生长发育上,表现为Pn较高、WUE最高、地上生物量最大,生长最快。整体上白花兜兰对光强的要求较为严格,对强光具有不耐性,强光容易导致白花兜兰叶绿素合成受阻,启动光破坏保护机制。RI 30光强是白花兜兰生长的最适光强,光强达到自然光强的50%(1 250 μmol·m-2·s-1)时光合作用和生物量积累受到影响。因此在林下栽种白花兜兰时应进行遮阴处理,以免叶片被强光灼伤,在温室栽培时应注意提供合适的光强,以提高其产量和品质。
| [1] |
SANFORD N L, HARRINGTON R A, FOWNES J H. Survival and growth ofnative and alien woody seedlings in open and understory environments[J]. Forest Ecology and Management, 2003, 183(1/2/3): 377-385. |
| [2] |
张珊珊, 杨文忠, 康洪梅, 等. 光强和土壤含水量对云南蓝果树幼苗生长及光合特征的影响[J]. 东北林业大学学报, 2018, 46(3): 16-23. DOI:10.3969/j.issn.1000-5382.2018.03.004 |
| [3] |
杨小波, 王伯荪. 森林次生演替优势种苗木的光可塑性比较研究[J]. 植物学报, 1999, 16(3): 304-309. DOI:10.3969/j.issn.1674-3466.1999.03.019 |
| [4] |
XU C, YIN Y, CAI R, et al. Responses of photosynthetic characteristics and antioxidative metabolism in winter wheat to post-anthesis shading[J]. Photosynthetica, 2013, 51(1): 139-150. DOI:10.1007/s11099-013-0010-9 |
| [5] |
姜瑞芳, 刘艳红. 光照对珙桐幼苗光合与生长特性的影响[J]. 生态科学, 2017, 36(5): 114-120. |
| [6] |
徐清, 闭鸿雁, 崔光帅, 等. 珍稀濒危植物毛果木莲幼苗光合特性及对遮阴处理的响应[J]. 南京林业大学学报(自然科学版), 2019, 43(6): 46-52. |
| [7] |
王莲辉, 魏鲁明, 姜运力, 等. 白花兜兰的组织培养与快速繁殖[J]. 植物生理学通讯, 2010, 46(10): 1071-1072. |
| [8] |
王代谷, 邓克云, 魏春杰. 贵州兜兰属植物的现状及展望[J]. 安徽农业科学, 2009, 37(6): 2469-2470. DOI:10.3969/j.issn.0517-6611.2009.06.057 |
| [9] |
黄暖爱, 黄绵佳. 兰科植物保育研究概况(综述)[J]. 亚热带植物科学, 2007, 36(4): 72-76. DOI:10.3969/j.issn.1009-7791.2007.04.021 |
| [10] |
李媛媛, 邹军, 张玉武, 等. 贵州野生兰科植物引种栽培试验研究[J]. 江苏林业科技, 2014, 41(3): 19-22. DOI:10.3969/j.issn.1001-7380.2014.03.005 |
| [11] |
袁颖丹, 李志, 胡冬南, 等. 铁皮石斛仿生栽培中不同附生树种和栽培基质的效应[J]. 江苏农业科学, 2017, 45(4): 112-114. |
| [12] |
朱景武. 霍山石斛园仿生栽培应用技术[J]. 农技服务, 2020, 37(5): 76-77, 79. |
| [13] |
唐凤鸾, 盘波, 赵健, 等. 极小种群野生植物白花兜兰的分布现状及生境研究[J]. 广西科学, 2021, 28(5): 491-498. |
| [14] |
何春霞, 李吉跃, 郭明, 等. 4种乔木叶片光合特性和水分利用效率随树高的变化[J]. 生态学报, 2008, 28(7): 3008-3016. |
| [15] |
叶子飘, 于强. 光合作用光响应模型的比较[J]. 植物生态学报, 2008, 32(6): 1356-1361. DOI:10.3773/j.issn.1005-264x.2008.06.016 |
| [16] |
叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740. DOI:10.3773/j.issn.1005-264x.2010.06.012 |
| [17] |
靳红磊, 明宇, 王宏斌. 阴生和阳生植物在光合结构及功能中的差异概述[J]. 中山大学学报(自然科学版)(中英文), 2021, 60(6): 1-8. |
| [18] |
王辉, 赵青云, 朱自慧, 等. 不同遮阴处理对香草兰光合作用及花芽分化的影响[J]. 福建农业学报, 2017, 32(1): 42-46. |
| [19] |
FARQUHAR G D, SHARKEY T D. Stomatal con-ductance and photo-synthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1982, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [20] |
李西文, 陈士林. 遮阴下高原濒危药用植物川贝母(Fritillaria cirrhosa)光合作用和叶绿素荧光特征[J]. 生态学报, 2008, 28(7): 3438-3446. |
| [21] |
孟衡玲, 沈云玫, 陶宏征, 等. 不同遮阴处理对通关藤光合特性的影响[J]. 江苏农业科学, 2017, 45(16): 129-132. |
| [22] |
卢晓, 李美真, 徐智广, 等. 光照对脆江蓠生长及光合色素含量的影响[J]. 渔业科学进展, 2013, 34(1): 145-150. DOI:10.3969/j.issn.1000-7075.2013.01.022 |
| [23] |
赵鸿杰, 黄福长, 胡羡聪, 等. 不同遮阴对6种山茶科植物叶绿素和生长的影响[J]. 内蒙古农业大学学报(自然科学版), 2014, 35(3): 57-61. |
| [24] |
王艳林, 高姗姗, 何兴元, 等. 遮阴对东北地区四种可食用蕨类植物生长和光合特征的影响[J]. 生态学杂志, 2019, 38(8): 2397-2404. |
| [25] |
刘柿良, 马明东, 潘远智, 等. 不同光环境对桤木幼苗生长和光合特性的影响[J]. 应用生态学报, 2013, 24(2): 351-358. |
| [26] |
翟玫瑰, 李纪元, 徐迎春, 等. 遮阴对茶花幼苗生长及生理特性的影响[J]. 林业科学研究, 2009, 22(4): 533-537. DOI:10.3321/j.issn:1001-1498.2009.04.012 |
| [27] |
张云, 夏国华, 马凯, 等. 遮阴对堇叶紫金牛光合特性和叶绿素荧光参数的影响[J]. 应用生态学报, 2014, 25(7): 1940-1948. |
| [28] |
DAI Y J, SHEN Z G, LIU Y, et al. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J]. Environmental and Experimental Botany, 2009, 65(3): 177-182. |
| [29] |
ELSHEERY N I, CAO K.F. Gas exchange, chlorophyll fluorescence, and osmotic adjustment in two mango cultivars under drought stress[J]. Acta Physiologiae Plantarum, 2008, 30(6): 769-777. DOI:10.1007/s11738-008-0179-x |
| [30] |
李浩铭, 余著成, 陈卓, 等. 光强对伯乐树幼苗生长及相关生理指标的影响[J]. 西南林业大学学报(自然科学), 2021, 41(3): 23-30. |



