2. 广西壮族自治区中国科学院广西植物研究所, 广西桂林 541006;
3. 桂林医学院, 广西桂林 541199
2. Guangxi Institute of Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin, Guangxi, 541006, China;
3. Guilin Medical University, Guilin, Guangxi, 541199, China
光合作用是植物最基本且最重要的生理代谢之一,光合作用的强弱对植物的生长和物质积累代谢具有十分重要的影响[1]。自身因素和生态因素是影响光合作用的主要因素,植物光合作用的强弱既受自身叶片结构的影响,也受环境因子的限制[2]。叶片是植物进行光合作用的主要场所,是与外界接触最多的区域,也是对环境因子变化较为敏感且反应较大的器官[3]。植物在不同的生长时期对外界环境因子的需求不同,表现出不同的光合特性,且光合作用对植物整个生活史的生理代谢都具有重要影响[4]。因此,了解植物不同时期的光合特性,对拯救濒危植物具有重要意义。
单性木兰(Kmeria septentrionalis)隶属于木兰科(Magnoliaceae)单性木兰属(Kmeria),是我国特有的珍稀濒危植物和国家一级重点保护野生植物,具有极高的科学研究价值。目前仅分布于广西河池市环江毛南族自治县和罗城仫佬族自治县、贵州黔南布依族苗族自治州荔波县、云南文山壮族苗族自治州麻栗坡县和马关县等喀斯特石灰岩山地中,多数呈零散分布,仅于广西木论国家级自然保护区内有成片分布[5]。单性木兰有着通直的树干和椭圆形的聚合果,是材质优良的木材,且具有一定的观赏价值,其花、叶和枝条还可以提炼香油。单性木兰作为喀斯特环境特有植物,养分、水分和光照等环境因子是限制其种群扩散的主要原因。光合作用是植物生长发育和赖以生存的基础,而叶片结构则是影响植物光合速率的一个重要因素。目前已经开展了单性木兰的种子贮藏与萌发[6, 7]、组织培养[8]、群落凋落物持水特性[9]、提取工艺[10, 11]等研究,同时也对其在干旱胁迫[12]、温度胁迫和钙胁迫[13]等方面进行了探索,但对单性木兰光合作用的研究主要集中在植物间的比较或者是改变外界环境因子而产生的变化差异上,而关于其叶片结构与光合功能之间关联性的研究较少。鉴于此,本研究以单性木兰幼苗和成年植株为试验材料,分析其幼苗与成年植株叶片结构和光合特性的差异情况,并借助相关性分析和冗余分析探究其叶片结构与光合生理内在的联系,以期为单性木兰的引种栽培提供科学理论依据,为大规模培育种植提供指导。
1 材料与方法 1.1 试验地概况试验地位于广西河池市环江毛南族自治县,地处云贵高原东南麓,居广西壮族自治区西北部、河池市东北部。地理位置为北纬24°44′-25°33′,东经107°51′-108°43′。属中亚热带季风湿润气候,年平均气温20.3 ℃,年平均降水量1 399.7 mm,年平均雨日为137-187 d,年降水量约80%集中在4-8月份;冬短夏长,平均无霜期293-366 d。土壤为赤红壤。
1.2 材料以野生单性木兰幼苗和成年植株为试验对象,幼苗与成年植株皆生长状况良好且无病虫害。选取幼苗和成年植株各3株,幼苗选择林下幼苗,要求长势基本一致,每株选择位置朝向相同、大小基本一致且长势旺盛的叶片,进行重复测定。
1.3 方法 1.3.1 光合-光响应曲线测定采用便携式光合仪(Li-6400XT, 北京力高泰科技有限公司)LED红蓝光源叶室测定叶片的净光合速率(Pn),测定时间为2022年9月下旬晴朗天气的9:00-11:00,测定时选取健康、无病虫害的完整叶片,测量前将待测叶片在600 μmol·m-2·s-1光照强度下诱导15 min。使用开放气路,空气流速设为500 mL·min-1,叶片温度为28 ℃。设定的光照强度梯度分别为1 800、1 500、1 200、1 000、800、600、400、200、150、100、50、20、0 μmol·m-2·s-1,测定时每一个光照强度下停留120-200 s。以光量子通量密度(PFD)为横轴,净光合速率为纵轴绘制光合-光响应曲线。
1.3.2 光响应参数测定与计算测定方法同1.3.1节,以光量子通量密度为横轴,分别以气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)为纵轴绘制光合-光响应曲线。采用叶子飘[14]的光合计算软件4.1.1的双曲线修正模型对光合-光响应曲线进行拟合,并计算表观量子效率(AQY)、最大净光合速率(Pmax)、光饱和点(LSP)、光补偿点(LCP)和暗呼吸速率(Rd)等参数。
1.3.3 叶绿素含量测定从进行光合测定的植株上采集成熟度、叶片位置、叶片大小一致的叶片进行生理指标的测定。取0.2 g完整叶片,用95%的乙醇浸泡24 h。用紫外可见分光光度计(Alpha 1502, 上海谱元仪器有限公司)分别在470、649、665 nm的波长下测定吸光值(A),参考李合生[15]的方法计算叶绿素a (Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)的含量,以及叶绿素a与叶绿素b的比值(Chl a/Chl b)、类胡萝卜素与总叶绿素的比值[Car/Chl (a+b)]。计算公式如下:
| $ 叶绿素 a 浓度 \left(C_a, \mathrm{mg} \cdot \mathrm{L}^{-1}\right)=13.95 A_{665}- \\ 6.88 A_{649}, $ | (1) |
| $ 叶绿素 b 浓度 \left(C_b, \mathrm{mg} \cdot \mathrm{L}^{-1}\right)=24.96 A_{649}- \\ 7. 32 A_{655}, $ | (2) |
| $ 类胡萝卜素浓度 \left(C_{\mathrm{xc}}, \mathrm{mg} \cdot \mathrm{L}^{-1}\right)= \\ \frac{1000 A_{470}-2.05 C_a-114.8 C_b}{245} 。$ | (3) |
将新鲜叶片沿着横截面切成4小块,然后立即放入2.5%的戊二醛固定液中固定,固定后用乙醇进行梯度脱水(分别为30%、50%、70%、85%、90%乙醇各1次,100%乙醇2次,15 min/次),在临界点干燥脱水并镀金,在真空电子扫描镜(ZEISS EVO18,德国卡尔蔡司公司)下观察、拍照。再使用Axio Vision SE64 Rel.4.9.1扫描电镜配套软件,测定叶片厚度(Leaf Thickness,LT)、上表皮厚度(Upper Epidermal Thickness,UET)、下表皮厚度(Lower Epidermal Thickness,LET)、栅栏组织厚度(Palisade Parenchyma Thickness,PPT)、海绵组织厚度(Spongy Parenchyma Thickness,SPT)、气孔面积(Stomatal Area,SA)、气孔纵轴长度(Stomata Length,SL)、气孔横轴长度(Stomata Width,SW),并计算出栅海比(PPT/SPT)和气孔密度(Stomatal Density,SD)。其中,气孔密度=视野气孔个数(个)/视野面积(mm2)。
1.4 数据处理与分析用Excel 2016对光合-光响应曲线、叶绿素含量、叶片结构等参数进行初步分析。使用Origin 2021软件绘制图表,利用SPSS Statistics 26进行单因素方差分析,采用Canoco 5.0进行冗余分析。
2 结果与分析 2.1 单性木兰幼苗与成年植株光合-光响应曲线比较单性木兰幼苗和成年植株光合-光响应曲线变化趋势基本一致,均呈先急剧升高后趋于平缓的趋势,但最大净光合速率存在明显差异(图 1)。在各光量子通量密度下单性木兰成年植株的净光合速率整体都要高于幼苗。由表 1可知,成年植株和幼苗的光饱和点分别为915.291 1 μmol·m-2·s-1和693.840 6 μmol·m-2·s-1,当光量子通量密度超过光饱和点后,净光合速率不再升高。成年植株光饱和点显著高于幼苗,可见其对强光的利用能力远高于幼苗,而幼苗对弱光的利用能力较好。

|
| 图 1 单性木兰幼苗和成年植株的光合-光响应曲线 Fig. 1 Photosynthetic-light response curves of K.septentrionalis young and adult plants |
| 种类 Type |
表观量子效率/(mol·mol-1) AQY/(mol·mol-1) |
最大净光合速率/(μmol·m-2·s-1) Pmax/(μmol·m-2·s-1) |
光饱和点/(μmol·m-2·s-1) LSP/(μmol·m-2·s-1) |
光补偿点/(μmol·m-2·s-1) LCP/(μmol·m-2·s-1) |
暗呼吸速率/(μmol·m-2·s-1) Rd/(μmol·m-2·s-1) |
| Young plants | 0.087 6±0.009 3a | 1.164 9±0.291 3a | 693.840 6±32.727 5a | 3.794 8±0.765 6a | 0.269 6±0.021 6a |
| Adult plants | 0.102 6±0.011 7a | 2.501 6±0.128 5b | 915.291 1±8.815 8b | 3.148 8±0.087 2a | 0.291 3±0.024 1a |
| Note: different letters in the same column indicate significant differences (P<0.05). | |||||
2.2 单性木兰幼苗和成年植株光响应参数比较
单性木兰成年植株的表观量子效率、最大净光合速率、光饱和点和暗呼吸速率均高于幼苗,仅光补偿点低于幼苗(表 1)。单性木兰幼苗及成年植株的最大净光合速率和光饱和点有显著性差异,而表观量子效率、光补偿点和暗呼吸速率无显著性差异(表 1)。
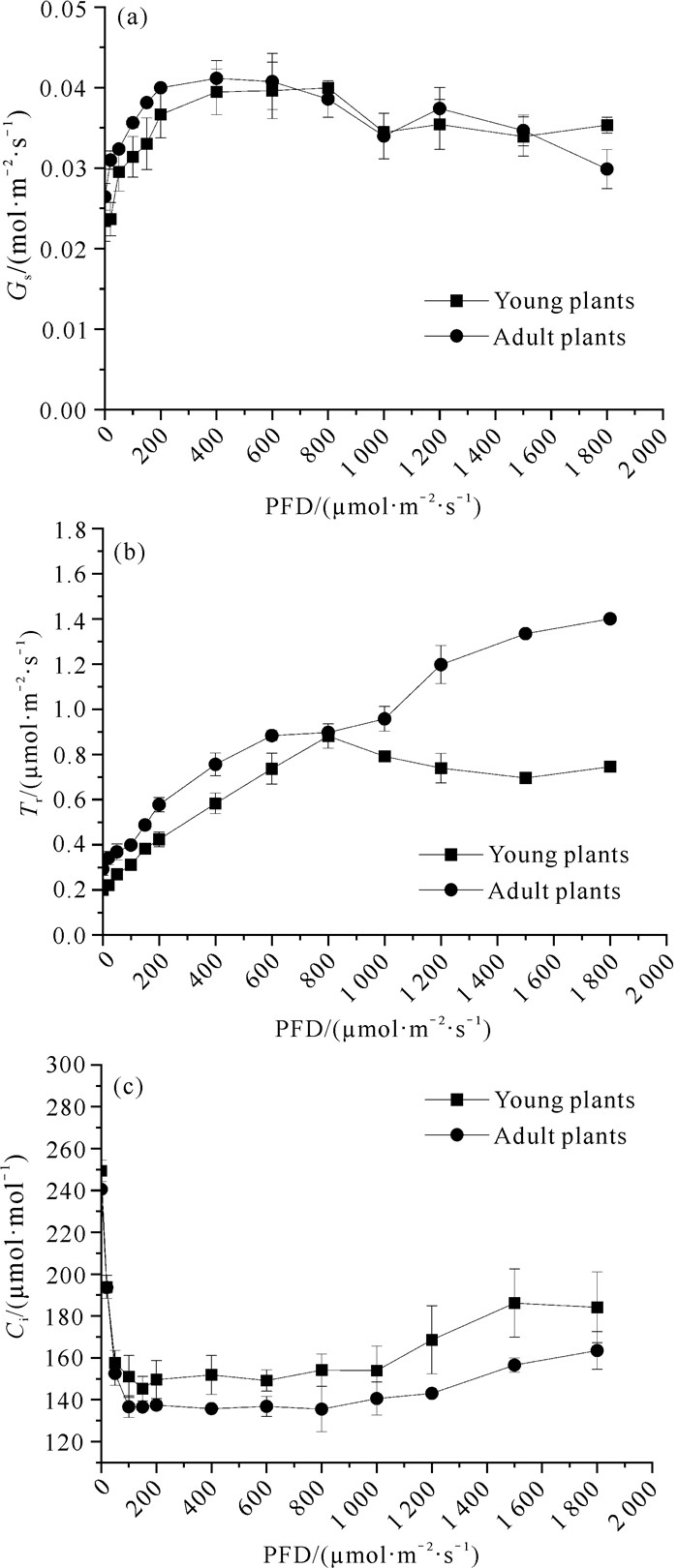
2.3 单性木兰幼苗与成年植株的Gs、Tr、Ci光合-光响应曲线单性木兰幼苗与成年植株的Gs、Tr、Ci光合-光响应曲线如图 2所示。由图 2(a)可以看出,单性木兰幼苗和成年植株的Gs光合-光响应曲线的变化趋势相似。当光量子通量密度为0-400 μmol·m-2·s-1时,幼苗和成年植株的Gs光合-光响应曲线斜率较大,说明随着光量子通量密度的增加,Gs上升幅度较大;当光量子通量密度为400-800 μmol·m-2·s-1时,Gs达到最大;当光量子通量密度超过800 μmol·m-2·s-1后,Gs整体呈下降趋势[图 2(a)]。
|
| 图 2 Gs、Tr和Ci的光合-光响应曲线 Fig. 2 Photosynthesis-light response curve of Gs, Tr and Ci |
由图 2(b)可以看出,在0-1 800 μmol·m-2·s-1的光量子通量密度下,单性木兰成年植株的蒸腾速率均高于幼苗。成年植株在0-1 800 μmol·m-2·s-1的光量子通量密度下,蒸腾速率和光合辐射成正比。幼苗在光量子通量密度为0-800 μmol·m-2·s-1时,蒸腾速率随着光量子通量密度的增强而升高;而当光量子通量密度超过800 μmol·m-2·s-1时,蒸腾速率开始下降[图 2(b)]。
由图 2(c)可以看出,在0-1 800 μmol·m-2·s-1的光量子通量密度下,单性木兰幼苗的Ci值均高于成年植株。在0 μmol·m-2·s-1光量子通量密度下,单性木兰幼苗和成年植株的Ci最大;在0-100 μmol·m-2·s-1的光量子通量密度下,响应曲线的斜率最大,Ci值急剧下降;在100-1 200 μmol·m-2·s-1光量子通量密度下,Ci变化趋于平缓。在1 200-1 800 μmol·m-2·s-1光量子通量密度下,成年植株的Ci值缓慢升高,而幼苗的Ci值呈现先升高后降低的趋势[图 2(c)]。
2.4 单性木兰幼苗与成年植株叶片叶绿素含量比较单性木兰幼苗和成年植株叶绿素含量的测定结果如表 2所示。成年植株的Chl a、Chl b和Car含量均高于幼苗。单性木兰幼苗和成年植株之间的Chl a、Chl b、Car、Chl(a+b)、Chl a/Chl b和Car/Chl(a+b)均存在显著性差异。
| 种类 Type |
叶绿素a/(mg·g-1) Chl a/(mg·g-1) |
叶绿素b/(mg·g-1) Chl b/(mg·g-1) |
类胡萝卜素/(mg·g-1) Car/(mg·g-1) |
总叶绿素/(mg·g-1) Chl(a+b)/(mg·g-1) |
叶绿素a/叶绿素b Chl a/Chl b |
类胡萝卜素/总叶绿素 Car/Chl (a+b) |
| Young plants | 0.432 0±0.010 8a | 0.187 9±0.012 6a | 0.072 5±0.004 8a | 0.619 8±0.008 9a | 2.307 6±0.192 3b | 8.579 2±0.609 4a |
| Adult plants | 1.022 7±0.021 5b | 0.582 4±0.025 9b | 0.137 2±0.011 3b | 1.605 2±0.014 6b | 1.759 3±0.113 4a | 11.749 3±0.981 7b |
| Note: different letters in the same column indicate significant differences (P<0.05). | ||||||
2.5 单性木兰幼苗和成年植株叶片结构形态特征
由单性木兰幼苗和成年植株的叶片横切结构(图 3)可以看出,叶片主要由上表皮、栅栏组织、海绵组织和下表皮构成。成年植株叶片上表皮细胞排列规整,相较于幼苗叶片,其叶肉细胞排列更紧致。在相同的放大倍数下,成年植株叶片正片有更清晰的叶脉分布。

|
| 图 3 单性木兰幼苗和成年植株的叶片结构 Fig. 3 Leaf structure of unisexual K.septentrionalis young and adult plants |
2.6 单性木兰幼苗和成年植株叶片各组织性状的比较
由表 3可知,单性木兰幼苗叶片的上表皮厚度、下表皮厚度、栅栏组织厚度、海绵组织厚度和叶片厚度以及栅海比均高于成年植株。单性木兰幼苗和成年植株的叶片厚度和栅栏组织厚度存在显著性差异,而上表皮厚度、下表皮厚度、海绵组织厚度和栅海比无显著性差异。
| 种类 Type |
叶片厚度/μm LT/μm |
上表皮厚度/μm UET/μm |
下表皮厚度/μm LET/μm |
栅栏组织厚度/μm PPT/μm |
海绵组织厚度/μm SPT/μm |
栅海比 PPT/SPT |
| Young plants | 194.822 5±15.711 9b | 14.801 1±2.300 9a | 11.322 5±2.747 4a | 27.225 0±3.292 9b | 142.632 5±19.800 7a | 0.194 8±0.042 4a |
| Adult plants | 165.662 5±15.153 6a | 12.742 5±1.214 3a | 9.497 5±1.195 9a | 18.287 5±1.665 2a | 120.605 0±13.290 2a | 0.152 1±0.009 5a |
| Note: different letters in the same column indicate significant differences (P<0.05). | ||||||
2.7 单性木兰幼苗和成年植株叶片气孔参数比较
单性木兰幼苗和成年植株气孔参数结果如表 4所示。由表 4可知,幼苗的各项气孔参数都要高于成年植株。单性木兰幼苗和成年植株的气孔面积、横轴长度和气孔密度存在显著性差异,而纵轴长度无显著性差异。
| 种类 Type |
气孔面积/μm2 Stomata area/μm2 |
纵轴长度/μm Stomata length/μm |
横轴长度/μm Stomata width/μm |
气孔密度/mm2 Stomata density/mm2 |
| Young plants | 27.510 0±2.003 3b | 7.546 7±0.452 1a | 4.816 7±0.407 7b | 735.986 1±127.146 1b |
| Adult plants | 20.183 3±0.360 2a | 7.316 7±0.878 4a | 3.033 3±0.430 2a | 325.745 5±55.144 0a |
| Note: different letters in the same column indicate significant differences (P<0.05). | ||||
2.8 单性木兰幼苗、成年植株叶片结构与光合生理的相关性分析
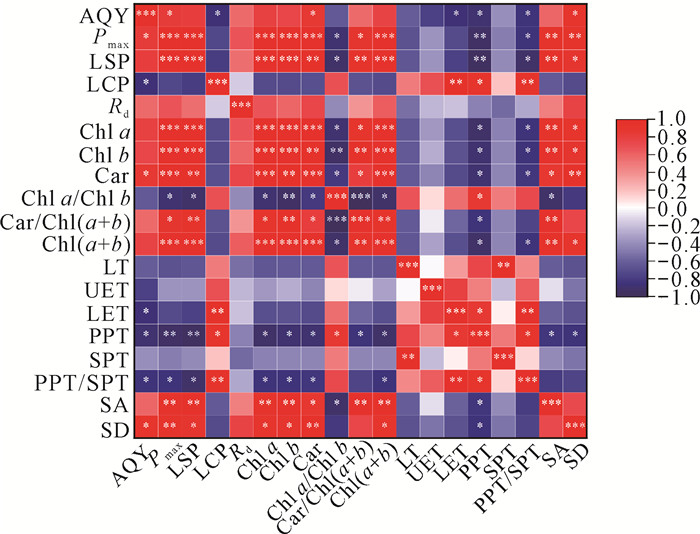
图 4为单性木兰幼苗、成年植株叶片结构和光合生理的相关性分析热图。由图 4可知,幼苗和成年植株叶片结构参数和光合生理参数之间存在较强的相关性,其中Chl a、Chl b、Car、Car/Chl(a+b)、Chl a/Chl b、Chl(a+b)与Pmax、LSP均存在显著性相关;PPT、SA与Chl a、Chl b、Car、Car/Chl(a+b)、Chl a/Chl b、Chl(a+b)均存在显著性相关;AQY、Pmax、LSP、LCP与PPT、PPT/SPT均存在显著性相关。
|
| *P<0.05, **P<0.01, ***P<0.001. 图 4 单性木兰幼苗、成年植株叶片结构与光合生理的相关性分析热图 Fig. 4 Heat map of correlation analysis between leaf structure and photosynthetic physiology of K.septentrionalis young and adult plants |
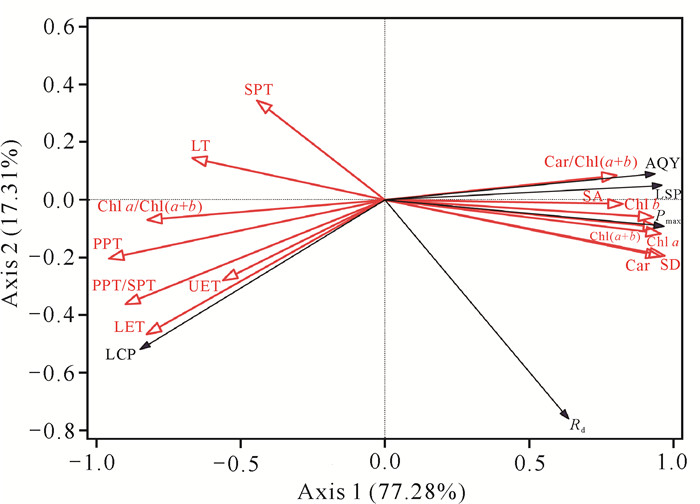
为进一步从单性木兰多个叶片结构变量中优选出对光合生理变化影响最大的指标,利用冗余分析(RDA)以14个叶片结构指标作为解释变量,5个光合生理指标作为响应变量,对两个变量组进行排序分析。由于降趋势对应分析得到的梯度长度小于3,因此选择RDA模型。通过Canoco 5.0软件对这些变量进行分析,结果显示第1轴和第2轴的解释变量分别为77.28%和17.31%,前两轴共解释了单性木兰幼苗和成年植株光合生理94.59%的变异。
由图 5可知,PPT、PPT/SPT、LET、SD和Car等5个叶片结构性状的箭头较长,表明它们能较好地解释单性木兰幼苗和成年植株光合生理的变异。Pmax与SD、Car的箭头夹角较小(锐角),表明正相关性较强;而与PPT、PPT/SPT、LET的夹角较大(钝角),表明负相关性较强。LCP与SPT、LT、Chl a/Chl(a+b)、PPT、PPT/SPT、UET、LET均呈正相关,而与Car/Chl(a+b)、SA、Chl b、Chl a、Chl(a+b)、SD和Car均呈负相关;AQY、LSP、Pmax、Rd与Car/Chl(a+b)、SA、Chl b、Chl a、Chl(a+b)、SD和Car呈正相关,与SPT、LT、Chl a/Chl(a+b)、PPT、PPT/SPT、UET和LET呈负相关。由此可见,RDA和热图分析结果具有一致性。
|
| 图 5 单性木兰幼苗、成年植株叶片结构和光合生理的RDA图 Fig. 5 RDA diagram of leaf structure and photosynthetic physiology of K.septentrionalis young and adult plants |
3 讨论
叶片是植物进行光合作用的主要器官,也是对环境变化较为敏感且反应较大的器官[3]。叶片是植物生理和外界环境联系的桥梁,植物可以通过调整叶片性状以应对不同的生境,这是植物为了适应外界环境变化的一种生存策略[16]。叶绿素是存在于高等植物体内的、能进行光合作用的一类绿色色素,其含量的高低能反映出植物光合作用的潜力[17, 18]。本研究结果表明,成年植株叶片中的叶绿素含量显著高于幼苗,且在各光量子通量密度下净光合速率也高于幼苗,说明叶绿素含量可以有效地反映植物的光合能力,这与尚三娟等[19]的研究结果一致。
AQY是反映植物光能利用效率的指标[20],本研究中单性木兰幼苗和成年植株的AQY分别为0.087 6、0.102 6 mol·mol-1,高于大部分植物[21],表明其对弱光的利用能力较强。王冉等[22]对12种珍稀树种光合生理特性进行研究,结果表明单性木兰对强光和弱光均具有较强的利用能力,较小的光补偿点和较大的光饱和点使其对光照强度的耐受范围较广,这也为其迁地保护的成功提供了重要保障。单性木兰幼苗和成年植株光合速率存在差异,可能与成年植株叶片上表皮更薄有关,薄的上表皮有利于光辐射透过叶表皮达到叶肉组织,从而提高光合能力。植物叶片结构与光合作用紧密相关,本研究中叶片SA、SD与AQY、LSP存在显著正相关性,SD与Pmax存在显著正相关性,说明气孔密度与植物叶片的最大光合速率密切相关[23],SA和SD的增加能提高植物叶片对强光的利用能力和最大净光合速率,SD的增加还会提高叶片对光能的利用效率。PPT/SPT是反映植物叶片栅栏组织发育程度的一个指标,栅栏组织的发达程度与其比值大小有关[24]。董梦宇等[25]研究结果显示,PPT/SPT对光合生理的影响最为显著,与本研究中叶片结构与光合生理的相关性分析结果存在相似之处。
本研究还发现,单性木兰成年植株LSP与Pmax显著高于幼苗。光合速率的大小直接影响着植物对有机物质的积累。在相关性分析中,Pmax与VET呈负相关,与叶绿素呈正相关,可见成年植株叶片中更高的光合色素和较薄的上表皮是造成光合速率差异的主要原因。程晶[26]在研究中指出,适度遮阴有利于单性木兰生物量的积累,低光照具有较高的表型可塑性。因此,在单性木兰的引种栽培中,建议对其进行遮阴处理,随着植株的生长可适当减小遮阴度,直至无需遮阴。
4 结论本研究对单性木兰幼苗与成年植株的叶片结构及光合生理进行基础性研究,结果表明单性木兰幼苗与成年植株的光合-光响应曲线变化趋势基本一致,在达到光饱和点后,成年植株的净光合速率是幼苗的2倍左右。幼苗与成年植株的总叶绿素、类胡萝卜素、叶片厚度、气孔面积和气孔密度均存在显著性差异。类胡萝卜素、叶绿素与光合生理特性之间具有很强的相关性,而气孔面积和气孔密度对光合生理特性的影响最为显著。总体而言,单性木兰叶片结构、色素与光合速率存在较高的相关性,同时在野外还表现出较强的光能利用能力,本研究可为单性木兰的引种栽培提供理论依据。
| [1] |
ZHU Y F, WU Y X, HU Y J, et al. Tolerance of two apple rootstocks to short-term salt stress: focus on chlorophyll degradation, photosynthesis, hormone and leaf ultrastructures[J]. Acta Physiologiae Plantarum, 2019, 41(6): 1-14. |
| [2] |
程浩, 秦浩龙, 尹琛琛, 等. 光照对浙江楠幼苗光合特性的影响[J]. 安徽林业科技, 2022, 48(5): 15-20. |
| [3] |
曹林青, 钟秋平, 邹玉玲, 等. 不同千年桐种质叶片结构及光合特性[J]. 森林与环境学报, 2022, 42(6): 592-599. |
| [4] |
刘从, 田甜, 李珊, 等. 中国木本植物幼苗生长对光照强度的响应[J]. 生态学报, 2018, 38(2): 518-527. |
| [5] |
汪国海, 潘扬, 覃国乐, 等. 喀斯特生境中濒危植物单性木兰种群结构及空间分布格局研究[J]. 林业科学研究, 2021, 34(3): 81-87. |
| [6] |
梁宁, 石雷, 杨杨. 8种木兰科植物种子的发芽、成苗试验[J]. 西部林业科学, 2006(3): 72-75. |
| [7] |
赖家业, 黄开响, 潘春柳, 等. 单性木兰种子贮藏及发芽试验[J]. 广西林业科学, 2007, 36(1): 19-21. DOI:10.3969/j.issn.1006-1126.2007.01.005 |
| [8] |
杨梅, 刘畅, 向梦迪, 等. 濒危植物单性木兰外植体启动培养[J]. 现代园艺, 2017(13): 3-4. |
| [9] |
彭玉华, 谭长强, 郑威, 等. 单性木兰生存群落凋落物及土壤水文生态效应[J]. 水土保持通报, 2016, 36(5): 119-125, 130. |
| [10] |
郑燕菲, 蓝亮美, 刘冠宏. 单性木兰叶多糖的提取及除杂工艺研究[J]. 山东化工, 2023, 52(3): 5-8. |
| [11] |
郑燕菲, 许建本, 黄秋萍, 等. 单性木兰叶多酚的稳定性及抗氧化性研究[J]. 食品工业科技, 2020, 41(14): 41-45, 51-52. |
| [12] |
吴显芝, 刘明靖. 模拟干旱胁迫下喀斯特地区4种幼苗的生理特征比较[J]. 广东农业科学, 2012, 39(15): 35-38. |
| [13] |
田淑娟, 喻理飞. 珍稀濒危植物单性木兰(Kmeria septentrionalis)胁迫条件下的种子发芽特性研究[J]. 种子, 2010, 29(3): 4-8. |
| [14] |
叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740. |
| [15] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
|
| [16] |
GARCÍA-CERVIGÓN A I, GARCÍA-LÓPEZ M A, PISTÓN N, et al. Coordination between xylem anatomy, plant architecture and leaf functional traits in response to abiotic and biotic drivers in a nurse cushion plant[J]. Annals of Botany, 2021, 127(7): 919-929. |
| [17] |
焦凌梅, 袁唯. 绿色蔬菜加工中护绿技术的研究及进展[J]. 保鲜与加工, 2004, 4(1): 11-14. |
| [18] |
石凯, 李泽, 张伟建, 等. 不同光照对油桐幼苗生长、光合日变化及叶绿素荧光参数的影响[J]. 中南林业科技大学学报, 2018, 38(8): 35-42, 50. |
| [19] |
尚三娟, 王义婧, 王楠, 等. 光照强度对紫斑牡丹生理及生长特性的影响[J]. 生态学杂志, 2020, 39(9): 2963-2973. |
| [20] |
唐星林, 金洪平, 周晨, 等. 镉胁迫对龙葵叶绿素荧光和光合生化特性的影响[J]. 中南林业科技大学学报, 2019, 39(9): 102-108. |
| [21] |
滕文军, 姜红岩, 温海峰, 等. 北京市28种地被植物光合特性的研究[J]. 草原与草坪, 2019, 39(3): 35-42. |
| [22] |
王冉, 何茜, 李吉跃, 等. 中国12种珍稀树种光合生理特性[J]. 东北林业大学学报, 2010, 38(11): 15-20. |
| [23] |
XU Z Z, ZHOU G S. Responses of leaf stomatal density to water status and its relationship with photosynthesis in a grass[J]. Journal of Experimental Botany, 2008, 59(12): 3317-3325. |
| [24] |
梁文斌, 赵丽娟, 李家湘, 等. 湖南安息香属植物的叶片比较解剖学研究[J]. 植物研究, 2014, 34(2): 148-158. |
| [25] |
董梦宇, 王金鑫, 吴萌, 等. 两种香花芥属植物叶片结构及光合特性研究[J]. 草业学报, 2022, 31(7): 172-184. |
| [26] |
程晶. 单性木兰响应于多种环境因子交互作用的表型可塑性[D]. 贵州: 贵州大学, 2021.
|



