2. 桂林医学院药学院, 广西桂林 541199
2. College of Pharmacy, Guilin Medical University, Guilin, Guangxi, 541199, China
苏铁类植物是现存种子植物中最原始的类群,是地球上古老的孑遗植物[1-3]。苏铁属(Cycas)植物目前已发现120种[2],我国共有苏铁属植物25种[4],均被列为国家一级重点保护野生植物,其中8种为濒危物种[5]。广西作为苏铁植物的主要分布区之一,区内大多数苏铁属物种都被列入极小种群野生植物(PSESP)[6, 7]。叉叶苏铁[Cycas bifida (Dyer) K.D.Hill]主要分布于中国广西以及越南北部,叶呈叉状二回羽状深裂[8, 9]。叉叶苏铁被用作苏铁科植物的现代地理分布、系统演化的研究对象,对研究中国与东南亚热带植物的区系地理、古植物和古气候以及与动物的协同进化具有重要的价值[10]。此外,现代苏铁类植物的稀有性和高观赏性,使其成为收藏家非常追捧的植物[8]。
物种的遗传多样性取决于基因突变、基因流动、遗传漂变及自然选择等引起的核苷酸序列变异[11, 12],物种基因组间存在的差异对物种的进化和保护具有重要意义[13]。目前,多种分子标记方法被用于群体遗传多样性分析,如Random Amplified Polymorphism DNA (RAPD)标记[14]、Inter-Simple Sequence Repeat (ISSR)标记[15]、Sequence-Related Amplified Polymorphism (SRAP)标记[16]和Genic Expressed Sequence Tag-Simple Sequence Repeat (EST-SSR)标记[17]等。与其他分子标记相比,Simple Sequence Repeat (SSR)标记是一种共显性标记类型,能准确估计遗传多样性。SSR标记因其具有数量大、分布广泛均匀、灵活性高、多态性丰富、成本低、易推广以及重复性好等优势而得到广泛应用[18, 19]。SSR标记被广泛应用于植物遗传多样性分析,使用SSR标记方法对叉叶苏铁遗传多样性进行分析,能准确地估计叉叶苏铁DNA水平上真实的遗传变异,从而揭示叉叶苏铁的遗传多样性和遗传变异,为叉叶苏铁的资源保护和选育提供参考[20, 21]。
目前,业界仅有关于叉叶苏铁的形态[22]、分类[23]、种群结构[24]等方面的少量研究。龚奕青[25]对广西龙州和凭祥的3个叉叶苏铁种群开展了遗传分化和谱系地理研究,而广西崇左市作为叉叶苏铁的主要分布区,对该区域内叉叶苏铁种群的遗传多样性研究还未开展。叉叶苏铁野生种群少,人为盗采严重,野生生境遭受破坏,该物种的遗传多样性遭受严重威胁,急需对其遗传多样性进行保护。迁地保护是保护野生物种种群延续的有效方法[26],桂林植物园已对崇左市左州镇排乳屯叉叶苏铁进行了迁地保护。但是,迁地保护种群的建立根本上是人为建立的小型独立种群,存在采样不全、重复引进、资源不清或种植条件差等问题,因此迁地保护的濒危植物同样面临遗传多样性下降或灭绝的危险[27]。综上所述,本研究采用SSR标记方法,选择广西崇左规模较大的叉叶苏铁野生种群和桂林植物园的迁地保护种群为研究对象,探究叉叶苏铁野生种群和迁地保护种群的遗传多样性丰富度和遗传结构,为广西崇左叉叶苏铁的遗传多样性保护提供数据支持。
1 材料与方法 1.1 材料2022年对广西崇左市4个叉叶苏铁野生种群和1个迁地保护种群进行采样(表 1),其中YCLL、MB和MALL 3个种群为位于保护区外的野外种群,PR种群为白头叶猴保护区内的野生种群,ZWS种群为桂林植物园的迁地保护种群。5个种群共采集叉叶苏铁样品109份,采集时选择完整无病虫害的叉叶苏铁叶片,放置于装有变色硅胶的密封袋中干燥保存,对每份样品做好标签,并对采样点进行GPS定位。植物样品由广西壮族自治区中国科学院广西植物研究所韦霄研究员鉴定为叉叶苏铁[Cyas bifida (Dyer) K.D.Hill]。
| 种群 Population |
种群类型 Type of population |
采样点 Sampling point |
经度 Longitude |
纬度 Latitude |
样品数量 Number of samples |
| YCLL | Wild population | Longlang Village, Taiping Town, Chongzuo City | 107°17′23″E | 22°30′01″N | 29 |
| MB | Mobu Village, Taiping Town, Chongzuo City | 107°16′19″E | 22°30′15″N | 22 | |
| MALL | Longlou Village, Taiping Town, Chongzuo City | 107°18′19″E | 22°28′59″N | 17 | |
| PR | Pairu Village, Zuozhou Town, Chongzuo City | 107°24′09″E | 22°33′19″N | 26 | |
| ZWS | Ex situ conservation population | Guilin Botanical Garden, Yanshan Town, Guilin City | 110°18′18″E | 25°04′33″N | 15 |
1.2 方法 1.2.1 DNA提取和检测
使用改良的十六烷基三甲基溴化铵(CTAB)法对叉叶苏铁叶片进行DNA提取,使用1%琼脂糖凝胶电泳检测DNA纯度,并用Nanodrop 2000微量分光光度计(赛默飞世尔科技公司)检测DNA浓度和质量,将合格的DNA样品保存于-20 ℃冰箱用于后续实验。
1.2.2 引物筛选本研究从全基因组序列中筛选得到96对引物,一共筛选出6对扩增成功、峰形良好的引物(表 2)。引物由生工生物工程(上海)股份有限公司北京合成部合成。
| 位点 Locus |
重复单元 Repeat unit |
上游引物(5′→3′) Upstream primer (5′→3′) |
下游引物(5′→3′) Downstream primer (5′→3′) |
等位基因区间 Allelic interval |
| GZST002 | (GA)6 | TGTGGAACGTGGAATGGTAA | AGGAATCCCGAAGGAAGAAA | 158-160 |
| GZST019 | (ATAA)5 | GATGAGGAAGCCTACGCAGT | GAAAGACCTCACCATCCGAG | 212-221 |
| GZST055 | (AT)6 | TCATGAAGATGGCAACCAAC | TCCCTTCCAAGCAAATGTCT | 161-184 |
| GZST013 | (GAG)5 | ACCGGTCGACTAGATGGATG | AGGTCCGAAGCTTTCCTCTC | 252-265 |
| GZST088 | (AG)7 | TGGCTTTCGATTTCCACACT | GAACGCTCGCTCTCTCTCTC | 136-159 |
| GZST065 | (CGA)5 | GCTTGGCTGTACCGTTCTTT | CGCCATTGACAACAACAGAC | 157-174 |
1.2.3 PCR扩增及测序
在Veriti 384 PCR仪上进行PCR扩增反应,反应体系(10 μL):DNA(~20 ng)1.0 μL,2×Taq PCR Master Mix 5.0 μL,ddH2O 3.0 μL,浓度10 μmol/L的上、下游引物各0.5 μL。PCR扩增反应程序:95 ℃预变性5 min;95 ℃变性30 s,62-52 ℃退火30 s,72 ℃延伸30 s,10个循环,每个循环下降1 ℃;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃末端延伸20 min,4 ℃保存。PCR产物使用1%琼脂糖凝胶电泳检测,参照ABI 3730xl上机操作流程进行荧光毛细管电泳测序。
1.3 数据分析 1.3.1 原始数据导出使用GeneMarker分析软件进行基因型数据的读取,并导出Excel基因型原始数据和PDF分型峰图文件。
1.3.2 遗传多样性及遗传分化使用软件GenAlEx version 6.501计算SSR位点以及群体的各项遗传多样性指标,包括观测等位基因数(Number of Observed Alleles, Na)、有效等位基因数(Number of Effective Alleles, Ne)、Shannon信息指数(Shannon′s Information Index, I)、观测杂合度(Observed Heterozygosity, Ho)、期望杂合度(Expected Heterozygosity, He)、遗传分化系数(Genetic Differentiation Coefficient, Fst)、固定系数(Fixed index, F)和基因流(Gene Flow, Nm),使用Powermarker v3.25计算所有位点多态性信息指数(Polymorphism Information Content, PIC)。
1.3.3 遗传结构及分子方差分析利用Structure 2.3.4对109个叉叶苏铁样本进行群体结构分析,设置K=1-20,Burn-in周期为10 000,MCMC (Markov Chain Monte Carlo)设为100 000,每个K值运行20次,并利用在线工具Structure Harvester算出最佳Delta K值(即为最佳群体分层情况)。根据最佳K值结果作图,使用Clummp和Distruct软件制图。使用GenAlEx version 6.501进行分子方差分析(AMOVA)。
1.3.4 聚类分析和主坐标分析利用Powermarker v3.25软件计算各群体间的遗传距离,利用非加权组平均法(Unweighted Pair-Group Method with Arithmetic means, UPGMA)进行聚类分析,并绘制环状聚类图和树状聚类图,使用GenAlEx version 6.501进行主坐标分析(Principal Co-ordinates Analysis, PCoA)。
2 结果与分析 2.1 SSR引物多态性分析由SSR引物多态性分析结果(表 3)可知,6对引物在109个样本中共检测出24个等位基因,其中,最小观测等位基因数为3.000,最大观测等位基因数为6.000,平均每个位点观测等位基因数为4.000。有效等位基因数总数为12.461,平均每个位点有效等位基因数为2.077。Shannon信息指数为0.286(GZST013)-1.186(GZST088),平均值为0.846。观测杂合度最大为0.679(GZST019),最小为0.000(GZST002),平均值为0.355。期望杂合度最小为0.130(GZST013),最大为0.642(GZST088),平均值为0.482。多态性信息指数为0.124(GZST013)-0.591(GZST088),平均值为0.418。6对引物中除GZST013不存在显著性差异,其余5对引物均存在显著性差异。综合来看,引物GZST088的多态性较好。
| 位点 Locus |
观测等位基因数Na | 有效等位基因数Ne | Shannon信息指数I | 观测杂合度Ho | 期望杂合度He | 多态性信息指数PIC | P 值 P value |
显著性 Significance |
| GZST002 | 3.000 | 1.998 | 0.802 | 0.000 | 0.500 | 0.413 | 0.000 | *** |
| GZST013 | 3.000 | 1.149 | 0.286 | 0.138 | 0.130 | 0.124 | 0.898 | ns |
| GZST019 | 6.000 | 2.068 | 1.016 | 0.679 | 0.516 | 0.475 | 0.017 | * |
| GZST055 | 4.000 | 2.204 | 0.874 | 0.370 | 0.546 | 0.444 | 0.001 | *** |
| GZST065 | 4.000 | 2.252 | 0.910 | 0.330 | 0.556 | 0.463 | 0.000 | *** |
| GZST088 | 4.000 | 2.790 | 1.186 | 0.615 | 0.642 | 0.591 | 0.000 | *** |
| Mean | 4.000 | 2.077 | 0.846 | 0.355 | 0.482 | 0.418 | ||
| St Dev | 1.095 | 0.533 | 0.305 | 0.263 | 0.179 | 0.156 | ||
| Note: ns means not significant, the group conforms to Hardy-Weinberg equilibrium; * means significant difference,P < 0.05, *** means significant difference,P < 0.001;Mean indicates average value; St Dev indicates standard deviation. | ||||||||
2.2 叉叶苏铁群体遗传多样性分析 2.2.1 群体间的遗传多样性分析
对叉叶苏铁群体的遗传多样性进行分析(表 4),4个野生种群中,MALL的观测等位基因数最高(3.333),PR的观测等位基因数最低(2.500),平均值为2.875。YCLL的有效等位基因数最高(1.855),PR最低(1.662),平均值为1.796。Shannon信息指数平均值为0.637,MALL的最高(0.711)。观测杂合度最高是MB(0.402),最低是PR(0.269),平均值为0.363。PR的期望杂合度最低(0.324),MALL最高(0.394),平均值为0.373。综合来看,PR的各项指标数值在4个野生种群中最低,遗传多样性水平最低。迁地保护种群(ZWS)的Shannon信息指数和期望杂合度值高于4个野生种群的平均值,但Shannon信息指数略低于MALL,而期望杂合度值略低于MALL和YCLL野生种群。
| 种群 Population |
观测等位基因数Na | 有效等位基因数Ne | Shannon信息指数I | 观测杂合度Ho | 期望杂合度He | 固定指数 F |
| MALL | 3.333 | 1.852 | 0.711 | 0.388 | 0.394 | 0.029 |
| MB | 2.833 | 1.816 | 0.638 | 0.402 | 0.379 | -0.054 |
| PR | 2.500 | 1.662 | 0.543 | 0.269 | 0.324 | 0.091 |
| YCLL | 2.833 | 1.855 | 0.657 | 0.393 | 0.393 | -0.015 |
| Mean (Wild population) | 2.875 | 1.796 | 0.637 | 0.363 | 0.373 | 0.013 |
| ZWS | 3.000 | 1.865 | 0.686 | 0.323 | 0.391 | 0.244 |
2.2.2 群体的遗传分化
对5个叉叶苏铁种群的遗传变异进行AMOVA(图 1),结果表明叉叶苏铁种群间的遗传变异占25%,个体间的遗传变异占7%,而大多数的遗传变异来源于个体内(68%)。
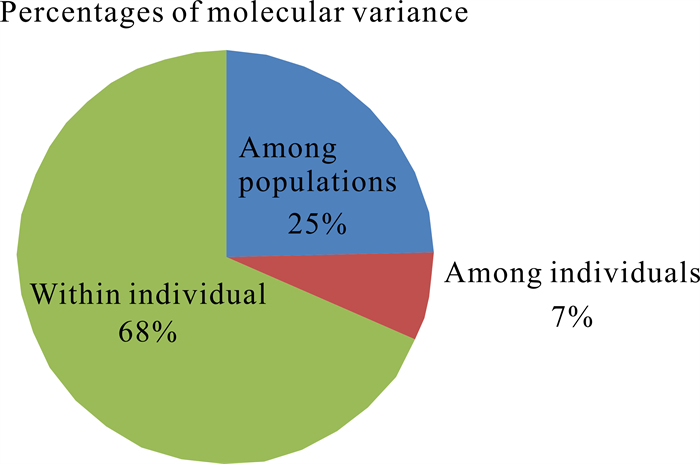
|
| 图 1 叉叶苏铁群体间分子方差分析 Fig. 1 Analysis of molecular variance among populations of C.bifida (Dyer) K.D.Hill |
对叉叶苏铁种群间的基因流和遗传分化系数(表 5)进行分析,5个种群中YCLL与MB间的基因流最大(26.635)且遗传分化系数最小(0.009),PR与MB间的基因流最小(0.952)且彼此间的遗传分化系数最大(0.208),ZWS与4个野生种群间的遗传分化系数和基因流分别为0.119-0.200和0.998-1.855。
| 群体 Population |
MALL | MB | PR | YCLL | ZWS |
| MALL | - | 5.700 | 1.009 | 7.855 | 0.998 |
| MB | 0.042 | - | 0.952 | 26.635 | 1.263 |
| PR | 0.199 | 0.208 | - | 1.037 | 1.855 |
| YCLL | 0.031 | 0.009 | 0.194 | - | 1.156 |
| ZWS | 0.200 | 0.165 | 0.119 | 0.178 | - |
2.2.3 叉叶苏铁群体遗传结构分析
对叉叶苏铁5个种群进行遗传结构分析,根据最大似然原则,当K=2时,Delta K最大(图 2)。对野生种群和迁地保护种群共109份叉叶苏铁样品进行Structure分析(图 3),本研究中的109份叉叶苏铁样品按地理位置大致分为2种基因型,其中MALL、YCLL和MB 3个野生种群基因型相近,分为一类,而ZWS与PR更为接近,二者可分为一类。
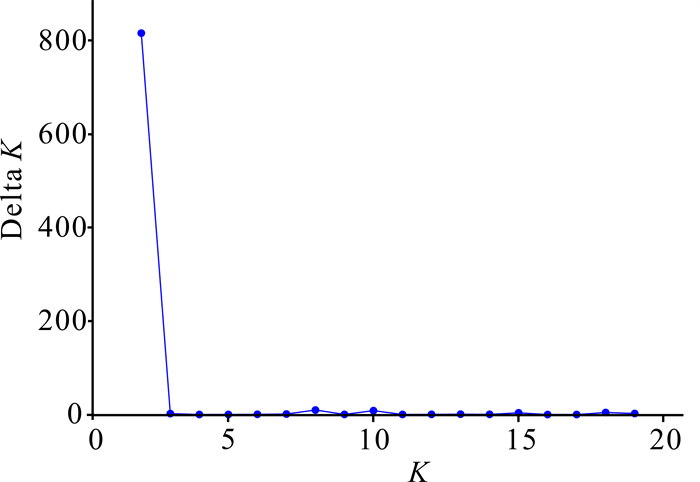
|
| 图 2 最佳类群数(K)与推断值(Delta K)的变化趋势 Fig. 2 Trend of the rational groups number K and estimated value Delta K |

|
| 图 3 叉叶苏铁的Structure分析(K=2) Fig. 3 Structure analysis of C.bifida (Dyer) K.D.Hill (K=2) |
2.2.4 叉叶苏铁的聚类分析和主坐标分析
对109份叉叶苏铁样品进行UPGMA聚类分析[图 4(a)],109份样品主要分为两大类(类1和类2),类1包含了ZWS和PR的所有样品,在类1中,多数样品按地区分类,但各有2个和1个样品穿插在彼此的分组中;类2包含MALL、YCLL和MB 3个野外种群的所有样品,在类2中,3个种群的样品相互穿插,也说明了这3个种群遗传距离更近,存在较高的基因交流现象。

|
| 图 4 叉叶苏铁的UPGMA聚类结果 Fig. 4 UPGMA clustering results of C.bifida (Dyer) K.D.Hill |
对5个叉叶苏铁种群进行UPGMA聚类分析[图 4(b)],结果显示5个种群可分为2个亚群,其中一个亚群包括ZWS和PR,这2个种群的遗传距离较近;另一个亚群包括MALL、YCLL和MB 3个野外种群,在这个亚群中,YCLL和MB种群的遗传距离最近。
对叉叶苏铁的109份样品进行PCoA(图 5),其中坐标代表个体的位点遗传变异在不同维度的差异程度。由图 5可知第一主坐标贡献率为27.42%,第二主坐标贡献率为17.92%,累积贡献率达到45.34%,可代表原始数据的主要信息。图 5中5个种群的109个样本个体可以明显分为2个组,其中MALL、YCLL和MB 3个野外种群的样品距离更近,聚为一组;而ZWS和PR距离更近,为另一个组。
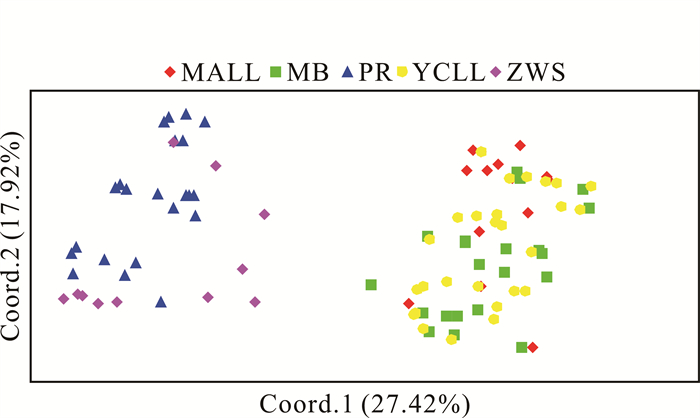
|
| 图 5 109个叉叶苏铁样本的主坐标分析 Fig. 5 PCoA of 109 C.bifida (Dyer) K.D.Hill samples |
3 讨论 3.1 叉叶苏铁遗传多样性
本研究使用6对引物对叉叶苏铁遗传多样性进行了分析,6对引物中,仅GZST013位点的多态性信息指数(0.124)是低度多态性位点(PIC≤0.25),其余5个位点均为中、高度多态性。遗传多样性能体现物种的进化潜力以及环境适应能力,物种的遗传多样性水平越高,适应环境变化的能力越强,反之越弱[28]。本研究叉叶苏铁野生种群遗传多样性分析结果显示,Shannon信息指数平均值为0.637,期望杂合度的平均值为0.373,低于龚奕青[25]的研究结果(I=1.213,He=0.446);与其他同属植物相比,叉叶苏铁期望杂合度平均值高于四川苏铁(C.szechuanensis,He=0.247)[29]和攀枝花苏铁(C.panzhihuaensis,He=0.328)[30],低于德保苏铁(C.debaoensis,He=0.484)[31]、多歧苏铁(C.multipinnata,He=0.497)[32]和台湾苏铁(C.taiwaniana,He=0.703)[33]。总体来看,崇左市叉叶苏铁遗传多样性水平较低,4个野生种群中的MALL和YCLL 2个种群的遗传多样性较高,但PR的遗传多样性较低,由于种群间的遗传多样性不平衡,部分较低的遗传多样性会使得整体的遗传多样性水平降低。
大量研究结果表明迁地保护可作为保护野生物种居群延续的有效方法[26]。本研究中PR位于广西崇左白头叶猴国家级自然保护区中,该种群的叉叶苏铁植株及其生境均已受到保护。由于迁地保护种群ZWS引种于野生种群PR,Structure分析结果也显示,ZWS与PR遗传距离非常近。在迁地保护种群和野生种群的比较中,ZWS期望杂合度值高于4个野生种群的平均值,但略低于MALL和YCLL野生种群;Shannon信息指数也高于4个野生种群的平均值但略低于野生种群MALL,说明桂林植物园对叉叶苏铁进行迁地保护在一定程度上能有效地保护其遗传多样性。但还需要继续开展其迁地保护的种质资源的收集,特别加强对遗传多样性较高的MALL和YCLL种群资源的引种工作,以加强迁地保护种群的遗传多样性水平,这对保护崇左市叉叶苏铁具有重要的指导意义。
3.2 叉叶苏铁遗传结构和遗传分化叉叶苏铁种群间的Fst平均值为0.134,ZWS与PR的遗传分化水平达到中度(0.119),与另外3个野生种群间的Fst为0.165-0.200,达到高度分化水平[34],这可能是因为引种保护地与4个野生种群地理距离较远,基因交流频率低而形成了一定程度的遗传分化。MALL、MB和YCLL 3个野生种群间的Fst为0.009-0.042,种群间分化较小,但这3个种群与PR间的Fst为0.194-0.208,均大于0.15,达到高度分化水平[34],导致这个现象的原因可能是MALL、MB和YCLL 3个野生种群间地理距离相对较近,存在基因交流的概率更大,从而使得这3个野生种群的遗传分化小,遗传距离更近。从Structure分析(图 3)来看,4个野生种群之间均存在相同的祖先,可能是经过长时间的进化加上人为砍伐和破坏导致了叉叶苏铁生境片段化,从而分化形成了2个分支,由于ZWS引种于PR,两者的遗传距离非常近,所以这两个种群的遗传结构极其相似。UPGMA结果(图 4)也显示ZWS和PR间的遗传距离非常近,两者最先汇聚成一支。PCoA分析结果(图 5)也支持以上结论,即109份叉叶苏铁样品可大致分为2类,ZWS和PR 2个种群可分为一类;而MALL、MB和YCLL 3个野生种群距离更近,为另一类。本研究中叉叶苏铁种群间的遗传变异占25%,种群内的遗传变异占75%,变异主要来源于种群内,种群水平的遗传交流较低,发生这种现象的原因可能是:(1)由于叉叶苏铁种群数量减小,导致种群内积累的遗传变异少;(2)叉叶苏铁花粉无法远距离传播,导致叉叶苏铁多为种群内杂交,种群内基因交流更为频繁[35]。
4 结论保护濒危植物的栖息地是延长该物种生命周期及恢复野生种群的主要方法之一,4个野生种群中,MALL的遗传多样性表现最高,应作为野生种群的重点保护种群,由于叉叶苏铁种群少,建议在位于保护区外的MALL、MB和YCLL 3个野生种群的所在地均建立保护小区,以此更好保护其完整的遗传多样性。同时对叉叶苏铁种群进行动态监测和小种群生存概率方面的研究工作。此外,还需继续开展崇左市叉叶苏铁迁地保护的种质资源收集工作,特别是加强MALL和YCLL种群资源的引种工作,以加强迁地保护种群的遗传多样性水平。叉叶苏铁为极小种群植物,其种质资源少,种群数量和个体都很少,需加强叉叶苏铁良种筛选、人工授粉、种苗培育、生物学特性、栽培技术方面的研究。最后,应加强叉叶苏铁野外回归引种工作,开展就地回归和异地回归试验,扩大叉叶苏铁种群数量,加大其遗传交流,从而有效提高叉叶苏铁遗传多样性。
| [1] |
王祎晴, 肖斯悦, 席辉辉, 等. 云南西南地区3种苏铁属植物的分布现状和生境特征[J]. 植物资源与环境学报, 2021, 30(1): 36-43. |
| [2] |
CALONJE M, STEVENSON D W, OSBORNE R. The world list of cycads[EB/OL]. [2023-09-20] https://www.cycadlist.org.
|
| [3] |
ZHENG Y, LIU J, GONG X. Tectonic and climatic impacts on the biota within the Red River Fault, evidence from phylogeography of Cycas dolichophylla (Cycadaceae)[J]. Scientific Reports, 2016, 6: 33540. DOI:10.1038/srep33540 |
| [4] |
国家林业和草原局, 农业农村部. 国家重点保护野生植物名录[EB/OL]. (2021-09-07)[2023-09-20]. https://www.gov.cn/zhengce/zhengceku/2021-09/09/content_5636409.htm.
|
| [5] |
国家林业局野生动植物保护与自然保护区管理司, 中国科学院植物研究所. 中国珍稀濒危植物图鉴[M]. 北京: 中国林业出版社, 2013.
|
| [6] |
管中天. 中国苏铁植物[M]. 成都: 四川科学技术出版社, 1996.
|
| [7] |
MA Y P, CHEN G, GRUMBING R E, et al. Conserving plant species with extremely small populations (PSESP) in China[J]. Biodiversity and Conservation, 2013, 22(3): 803-809. DOI:10.1007/s10531-013-0434-3 |
| [8] |
夏志宁, 马焕成, 郑艳玲. 叉叶苏铁和攀枝花苏铁对冰冻胁迫的生理生化响应[J]. 西南林业大学学报(自然科学), 2020, 40(5): 166-173. |
| [9] |
HILL K D, NGUYEN H T, LOC P K. The genus Cycas (Cycadaceae) in Vietnam[J]. The Botanical Review, 2004, 70(2): 134-193. DOI:10.1663/0006-8101(2004)070[0134:TGCCIV]2.0.CO;2 |
| [10] |
王定跃. 苏铁科形态结构、系统分类与演化研究[D]. 南京: 南京林业大学, 2000.
|
| [11] |
OLIYA B K, KIM M Y, LEE S H. Development of genic-SSR markers and genetic diversity of Indian lettuce (Lactuca indica L.) in South Korea[J]. Genes & Genomics, 2018, 40(6): 615-623. |
| [12] |
JOSHI P R, PANDEY S, MAHARJAN L, et al. Micropropagation and assessment of genetic stability of Dendrobium transparens Wall.Ex Lindl.using RAPD and ISSR markers[J]. Frontiers in Conservation Science, 2023, 3: 1083933. DOI:10.3389/fcosc.2022.1083933 |
| [13] |
ELLEGREN H, GALTIER N. Determinants of genetic diversity[J]. Nature Reviews Genetics, 2016, 17: 422-433. DOI:10.1038/nrg.2016.58 |
| [14] |
MUKKAMULA N, BEEMA N, DASARI S, et al. Assessment of genetic diversity in Maerua oblongifolia (Forssk.) A.Rich.accessions based on RAPD markers[J]. Ecological Genetics and Genomics, 2023, 27: 100171. DOI:10.1016/j.egg.2023.100171 |
| [15] |
王培育, 叶炜, 冯新, 等. 三十份野生毛花猕猴桃种质资源的ISSR遗传多样性分析[J]. 热带农业科学, 2023, 43(6): 29-33. |
| [16] |
张迎辉, 凡莉莉, 杜溶讫, 等. 31种石斛属植物及金石斛遗传多样性SRAP分析及DNA指纹图谱研究[J]. 热带作物学报, 2022, 43(10): 2030-2036. |
| [17] |
伊然, 王子玥, 刘凌云, 等. 基于EST-SSR标记的60份苇状羊茅遗传多样性分析[J]. 草地学报, 2023, 31(7): 2041-2048. |
| [18] |
伍宝朵, 高效梅, 胡丽松, 等. 基于SSR分子标记的面包果资源遗传多样性分析[J]. 热带作物学报, 2023, 44(7): 1383-1391. |
| [19] |
邹建文, 饶红欣, 陈灵, 等. 黑老虎新品系的SSR指纹图谱构建[J]. 热带作物学报, 2023, 44(4): 716-723. |
| [20] |
叶冬梅, 吴晓萌, 段国珍, 等. 基于SSR分子标记分析白杄的群体遗传多样性[J/OL]. 分子植物育种, 2023: 1-15(2023-03-29)[2023-08-11]. http://kns.cnki.net/kcms/detail/46.1068.S.20230329.1043.008.html.
|
| [21] |
张红瑞, 李鑫, 陈振夏, 等. 基于SSR分子标记的裸花紫珠种质资源遗传多样性分析及DNA指纹图谱构建[J]. 中草药, 2023, 54(12): 3971-3982. |
| [22] |
谢建光, 刘念. 苏铁属叉叶苏铁亚组国产种类的羽片比较解剖学研究[J]. 广西植物, 2012, 32(5): 587-592. |
| [23] |
黄玉源. 中国苏铁科植物的系统分类与演化研究[M]. 北京: 气象出版社, 2001.
|
| [24] |
李娟, 林建勇, 何应会, 等. 广西崇左叉叶苏铁种群结构与分布格局研究[J]. 广东农业科学, 2016, 43(12): 25-29. |
| [25] |
龚奕青. 叉叶类苏铁的遗传分化和谱系地理研究[D]. 昆明: 云南大学, 2015.
|
| [26] |
常二梅, 刘建锋, 黄跃宁, 等. 岷江柏野生居群和迁地保护居群的遗传多样性比较[J]. 植物研究, 2022, 42(5): 772-779. |
| [27] |
ZHU X L, ZOU R, QIN H Z, et al. Genome-wide diversity evaluation and core germplasm extraction in ex situ conservation: a case of golden Camellia tunghinensis[J]. Evolutionary Applications, 2023, 16(9): 1519-1530. DOI:10.1111/eva.13584 |
| [28] |
田星, 李中霁, 刘小莉, 等. 基于SSR分子标记的灯盏花遗传多样性分析[J]. 中国实验方剂学杂志, 2021, 27(18): 136-143. |
| [29] |
龚奕青. 四川苏铁的资源调查和遗传多样性研究及其保育策略[D]. 广州: 中山大学, 2012.
|
| [30] |
XIAO S Y, JI Y H, LIU J, et al. Genetic characterization of the entire range of Cycas panzhihuaensis (Cycadaceae)[J]. Plant Diversity, 2019, 42(1): 7-18. |
| [31] |
GONG Y Q, GONG X. Pollen-mediated gene flow promotes low nuclear genetic differentiation among populations of Cycas debaoensis (Cycadaceae)[J]. Tree Genetics & Genomes, 2016, 12(5): 93. |
| [32] |
GONG Y Q, ZHAN Q Q, NGUYEN K S, et al. The historical demography and genetic variation of the endangered Cycas multipinnata (Cycadaceae) in the red river region, examined by chloroplast DNA sequences and microsatellite markers[J]. PLoS One, 2015, 10(2): e0117719. DOI:10.1371/journal.pone.0117719 |
| [33] |
WANG X H, LI J, ZHANG L M, et al. Population differentiation and demographic history of the Cycas taiwaniana complex (cycadaceae) endemic to South China as indicated by DNA sequences and microsatellite markers[J]. Frontiers in Genetics, 2019, 10: 1238. DOI:10.3389/fgene.2019.01238 |
| [34] |
董丽敏, 戴亮芳, 白李唯丹, 等. 濒危羊踯躅子代幼苗遗传多样性的SSR分析[J]. 西北植物学报, 2019, 39(4): 613-619. |
| [35] |
杨泉光, 宋洪涛, 杨海娟, 等. 苏铁类植物传粉生物学研究进展[J]. 亚热带植物科学, 2012, 41(3): 83-88. |



