2. 广西海洋研究所有限责任公司, 广西北海 536000;
3. 北部湾海洋产业研究院, 广西防城港 538000;
4. 北海万博生物科技有限公司, 广西北海 536000
2. Guangxi Institute of Oceanology Co. Ltd., Beihai, Guangxi, 536000, China;
3. Beibu Gulf Marine Industry Research Institute, Fangchenggang, Guangxi, 538000, China;
4. Beihai Wanbo Biotechnology Co., Ltd., Beihai, Guangxi, 536000, China
织锦巴非蛤(Paphia textile)隶属软体动物门(Mollusca)双壳纲(Bivalvia)帘蛤目(Veneroida)帘蛤科(Veneridae)巴非蛤属(Paphia),主要分布在中国广东、广西、福建、台湾和马来西亚,该贝适应性强、养殖周期短、产量高、肉质鲜美,深受消费者的喜爱,在民间有“花甲王”之美称,非常适合人工养殖[1-3]。
织锦巴非蛤的自然资源量正逐年锐减,开展织锦巴非蛤苗种人工规模化繁育和增养殖,是决定其能否实现大规模人工养殖的关键[4],对补充其自然种群资源及丰富人民日益增长的海产品需求具有重要意义[5, 6]。单胞藻作为双壳贝类幼虫培育的重要饵料,是影响其生长速率和存活率的主要因素之一,已有研究表明,优化单胞藻投喂种类、分析单胞藻营养价值等方式均有利于提高贝类幼虫培育生长速率及其存活率[1]。
由于不同种类的微藻具有不同的营养组成[7-10],所以贝类体内的营养组分会随着饵料的变化而改变[11-14]。饵料微藻中含有大多数水产动物幼体不能自行合成的多不饱和脂肪酸(Polyunsaturated Fatty Acids,PUFAs),其中二十碳五烯酸(Eicosapentaenoic Acid,EPA)和二十二碳六烯酸(Docosahexaenoic Acid,DHA)可以促进幼体的生长发育并提高存活率[15-17],其含量是评价饵料营养价值的重要指标。饵料微藻的营养价值在一定程度上取决于脂类尤其是脂肪酸的组成,适宜的脂肪含量和平衡的脂肪酸组成对贝类幼虫的健康生长至关重要[18, 19]。
近年来,许多学者对织锦巴非蛤开展了广泛研究,主要集中在生理生态[2, 20]、食品应用[21-23]和基因表达[24, 25]等方面。广西海洋研究所有限责任公司已成功突破织锦巴非蛤的规模化人工繁育技术,在室内可控条件下,常规投喂3种优良的单细胞饵料微藻球等鞭金藻(Isochrysis galbana)、牟氏角毛藻(Chaetoceros muelleri)和青岛大扁藻(Tetrasemis helgolandica),可以批量获得大量织锦巴非蛤稚贝。本研究旨在系统地检测和鉴定织锦巴非蛤稚贝和3种常规饵料微藻的脂质组成,并分析其脂肪酸(Fatty Acids,FAs)的含量和组成特点,获得参考价值较高的FAs参数,再结合描述性统计方法评价其整体差异和自然聚类特征,比较不同饵料微藻与织锦巴非蛤脂肪酸组成的相关性,为织锦巴非蛤人工育苗生产中饵料的选择提供科学依据。
1 材料与方法 1.1 材料 1.1.1 主要仪器设备离心机(KR 25i,法国Thermo Fisher Scientific公司);旋转蒸发仪(NE-1101,日本Rikakikai公司);37种脂肪酸甲酯混标(AU28-W,美国Nu-Chek公司);气相色谱仪(GC-2010 Plus,日本Shimadzu公司);质谱仪(GC MS-TQ 8040,日本Shimadzu公司);14% BF3-CH3OH溶液(美国Alltech公司);正己烷(色谱纯,美国Tedia公司);二氯甲烷、甲醇均为分析纯,购自成都市科龙化工试剂厂。
1.1.2 织锦巴非蛤稚贝织锦巴非蛤稚贝取自广西海洋研究所有限责任公司海水增养殖试验基地。获得织锦巴菲蛤初孵幼虫(D形幼虫)后,在1-8 d投喂球等鞭金藻和牟氏角毛藻,以球等鞭金藻为主,投喂密度为5 000-10 000个/mL;孵化8 d后增加投喂青岛大扁藻,投喂密度为2 000-10 000个/mL;孵化10 d后在幼虫伸足时投放附着基,随机投喂3种单胞藻类,日投喂2-3次,以2 h内滤清为准,28 d后附着苗全部脱板,即为织锦巴非蛤稚贝。织锦巴非蛤稚贝不投饵饥饿12 h后,取出洗净,控水后分装为两部分,一部分直接浸泡提取脂溶性成分,为织锦巴非蛤(湿)样品,另一部分晒干后再提取,为织锦巴非蛤(干)样品。
1.1.3 饵料微藻饵料微藻指的是通过引种、保种后人工扩大培养采收的一种含球等鞭金藻、牟氏角毛藻和青岛大扁藻的液体。取3种海水微藻200 mL加到1 000 mL三角烧瓶中,培养液采用F/2营养液,以硅酸钠作为硅源,沙滤海水经煮沸、冷却后使用,在自然光照和温度(25-29 ℃)条件下,培养至对数期后,取1.5 L用离心机去除培养液,收集沉淀的藻泥,然后提取脂质。
1.2 方法 1.2.1 脂质的提取参照Folch等[26]的方法,置样品于250 mL具塞锥形瓶中捣碎,并加入氯仿-甲醇溶液(2∶1,V/V)混合均匀,然后用分液漏斗萃取混合液,待混合液静止分层后,收集分液漏斗底层溶液。经反复萃取直至底层溶液无色后,在提取液中加入5 g无水硫酸钠脱水,在45 ℃下用旋转蒸发仪蒸干,得浸膏。用少量溶液转移浸膏至小样品瓶中,挥干,得黄色油状脂质,保存在-20 ℃下,待分析脂质组成。
1.2.2 气相色谱-质谱联用仪(GC-MS)分析样品甲酯化:取5种脂质提取物5 mg,加入2 mL浓度为10%的三氟化硼-甲醇(V/V)溶液,于70 ℃水浴中甲酯化处理20 min,冷却后加入正己烷2 mL和蒸馏水,振荡静置10 min,分层后取上层有机相(正己烷)适当稀释,加入少量无水硫酸钠,用针筒式0.22 μm微孔滤膜过滤器过滤后,用气相色谱-质谱联用仪进样分析。
色谱条件:色谱柱为HP-88石英毛细管柱(60 m×0.25 mm×0.20 μm),载气为He,采用恒压模式,压力为76 kPa,不分流,进样量为1 μL。进样口和检测器温度为250 ℃,初始温度为80 ℃,保持1 min,程序升温至130 ℃,速度10 ℃/min,再以3 ℃/min升至150 ℃,最后以5 ℃/min升至250 ℃,并保持6 min,直至所有脂肪酸全部出峰。
质谱条件:GC-MS接口温度280 ℃,电子轰击(EI)离子源,电子能量70 eV,离子源温度230 ℃,扫描周期500次/s,质量扫描范围m/z 30-450。操作系统Xcalibur,谱库NIST 02。
1.2.3 分离与鉴定脂肪酸甲酯经气相色谱石英毛细管柱分析,记录质谱图,得到GC-MS总离子流色谱图。根据质谱图及标准品的色谱保留时间确定各种脂肪酸成分,且仅当相似度大于85%的鉴定结果才予以报道,并用面积归一化法测定其相对含量。
参照脂肪酸标准品,样品的脂质组成通过数据库检索,根据脂肪酸的色谱保留时间规律,同时结合基峰离子(基峰离子m/z 74为直链饱和脂肪酸,m/z 55为单烯脂肪酸,m/z 67为二烯脂肪酸,m/z 79为三烯及以上不饱和脂肪酸)和分子离子等特征离子进行定性分析,并按峰面积归一法进行定量。
1.2.4 数据分析用SPSS 13.0对稚贝和饵料微藻的长链脂肪酸进行聚类分析和主成分分析,分析5个样品的长链脂肪酸组成和特征。聚类分析方法为欧式距离的系统聚类法;主成分分析以特征值大于1抽取因子,用Promax法进行因子载荷矩阵的旋转。
2 结果与分析 2.1 总脂的组成5个样品的GC-MS总离子流色谱图见图 1。根据样品和标准品的质谱图确定各成分,并用面积归一法测定其相对含量。从5个样品中共鉴定出7类化合物(表 1),鉴定出的化合物占总峰面积的97%以上,主要为烷烃类化合物和脂肪酸,烷烃类化合物为织锦巴非蛤稚贝脂溶性成分中的主要成分。共鉴定出51种脂肪酸,其中包括4种短链脂肪酸(Short-Chain Fatty Acids,SCFAs)、1种中链脂肪酸(Medium-Chain Fatty Acid,MCFA)、4种支链脂肪酸(Branched-Chain Fatty Acids,BCFAs)和42种长链脂肪酸(Long-Chain Fatty Acids,LCFAs)。奇链和支链脂肪酸是由织锦巴非蛤共生菌或内生菌类产生[27],本研究的主要脂质成分是长链脂肪酸。检出的含硅组分可能是萃取头涂层或色谱柱材料的污染物,不是本研究的关键化合物,故此处不详细分析。
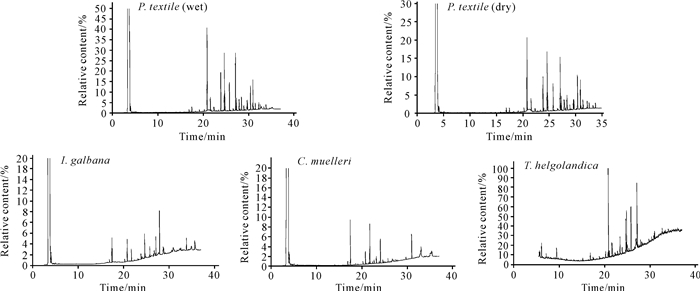
|
| 图 1 5个样品的GC-MS总离子流色谱图 Fig. 1 GC-MS total ion chromatogram of 5 samples |
| 脂质 Lipid |
织锦巴非蛤(湿) P.textile (wet) |
织锦巴非蛤(干) P.textile (dry) |
球等鞭金藻 I.galbana |
牟氏角毛藻 C.muelleri |
青岛大扁藻 T.helgolandica |
|||||||||
| 种类 Type |
相对含量/% Relative content/% |
种类 Type |
相对含量/% Relative content/% |
种类 Type |
相对含量/% Relative content/% |
种类 Type |
相对含量/% Relative content/% |
种类 Type |
相对含量/% Relative content/% |
|||||
| Fatty acids | 27 | 25.52 | 35 | 56.20 | 12 | 42.60 | 24 | 4.78 | 20 | 83.20 | ||||
| Alkanes | 4 | 55.53 | 1 | 36.32 | 1 | 47.79 | 2 | 73.86 | 2 | 3.36 | ||||
| Ethers | 2 | 6.43 | 2 | 6.60 | 2 | 7.97 | 2 | 6.64 | 1 | 1.24 | ||||
| Alcohols | 2 | 12.28 | 1 | 0.17 | 1 | 0.08 | 4 | 14.02 | - | - | ||||
| Aldehyde | - | - | 1 | 0.12 | - | - | - | - | - | - | ||||
| Aromatic hydrocarbons | 1 | 0.02 | 1 | 0.02 | 1 | 0.20 | - | - | 4 | 10.05 | ||||
| Ketones | - | - | 1 | 0.52 | 1 | 0.44 | 1 | 0.69 | - | - | ||||
| Total | 36 | 99.78 | 42 | 99.95 | 18 | 99.08 | 33 | 99.99 | 27 | 97.91 | ||||
| Note: “-” indicates no detectable or content less than 0.1%. | ||||||||||||||
从5个样品中共检测出5种短链脂肪酸和4种支链脂肪酸,短链脂肪酸占织锦巴非蛤(干)、球等鞭金藻、青岛大扁藻和牟氏角毛藻总脂的相对百分比含量分别为38.1%、37.8%、5.87%和0.02%,未在织锦巴非蛤(湿)中检测到短链脂肪酸;织锦巴非蛤(湿)、青岛大扁藻和织锦巴非蛤(干)的支链脂肪酸占总脂的相对百分比含量分别为1.11%、0.67%、0.66%,未在球等鞭金藻和牟氏角毛藻中检测到支链脂肪酸。
5个样品中长链脂肪酸的组成都比较齐全(表 2),包括饱和脂肪酸(Saturated Fatty Acids,SFAs)、单不饱和脂肪酸(Monounsaturated Fatty Acids,MUFAs)和多不饱和脂肪酸(PUFAs)。SFAs主要由C16:0和C18:0组成,MUFAs主要由C18:1组成,PUFAs主要由C18:2和C18:3组成,n3/n6 PUFAs比值基本大于2,与元冬娟等[28]的研究结果类似,牟氏角毛藻的比值最高为9.1。
| Unit: % | |||||||||||||||||||||||||||||
| 长链脂肪酸 Long-chain fatty acid |
名称 Name |
织锦巴非蛤 (湿) P.textile (wet) |
织锦巴非蛤 (干) P.textile (dry) |
球等鞭金藻 I.galbana |
牟氏角毛藻 C.muelleri |
青岛大扁藻 T.helgolandica |
|||||||||||||||||||||||
| C12:0 | Dodecanoic acid | 0.03 | 0.02 | - | 0.02 | - | |||||||||||||||||||||||
| C13:0 | Tridecanoic acid | 0.01 | 0.01 | - | - | - | |||||||||||||||||||||||
| C14:0 | Myristic acid | - | - | 0.65 | 1.18 | - | |||||||||||||||||||||||
| C15:0 | Pentadecanoic acid | 0.11 | 0.05 | - | 0.02 | - | |||||||||||||||||||||||
| C16:0 | Palmitic acid | 5.51 | 2.81 | 0.59 | 0.32 | 19.56 | |||||||||||||||||||||||
| C17:0 | Heptadecanoic acid | 0.25 | 0.10 | - | - | - | |||||||||||||||||||||||
| C18:0 | Stearic acid | 2.38 | 1.31 | 0.13 | 0.05 | 1.10 | |||||||||||||||||||||||
| C19:0 | Nonadenoic acid | 0.04 | - | - | - | - | |||||||||||||||||||||||
| C14:1n5 | 9-myristoleic acid | - | - | - | 0.04 | - | |||||||||||||||||||||||
| C16:1n5 | 11-hexadecenoicacid | - | - | - | 0.03 | - | |||||||||||||||||||||||
| C16:1n7t | Trans-9-hexadecenoic acid | - | - | - | 0.03 | 3.79 | |||||||||||||||||||||||
| C16:1n7 | Palmitoleic acid | - | 0.04 | 0.32 | 1.06 | - | |||||||||||||||||||||||
| C18:1n14 | 4-octadecenoic acid | - | - | - | 0.03 | - | |||||||||||||||||||||||
| C18:1n9 | Oleic acid | 1.06 | 0.74 | 0.11 | 0.03 | 2.08 | |||||||||||||||||||||||
| C18:1n9t | Trans-9-elaidic acid | 3.37 | 2.26 | 0.63 | 0.07 | 7.25 | |||||||||||||||||||||||
| C20:1n7 | 13-eicosenoic acid | 0.61 | 0.51 | - | - | - | |||||||||||||||||||||||
| C20:1n9 | 11-eicosenoic acid | 0.18 | 0.21 | - | - | 0.75 | |||||||||||||||||||||||
| C16:2n4 | 9, 12-hexadecadienoic acid | - | - | - | - | 0.81 | |||||||||||||||||||||||
| C16:3n6 | 4, 7, 10-hexadecatrienoic acid | - | 0.04 | - | - | 3.93 | |||||||||||||||||||||||
| C16:4n3 | 4, 7, 10, 13-hexadecatetraenoate | - | - | - | - | 9.29 | |||||||||||||||||||||||
| C18:2n6 | Linoleic acid | 1.47 | 1.0 | 0.27 | 0.09 | 9.56 | |||||||||||||||||||||||
| C18:2n6t | Trans-9, 12-linolenic acid | - | - | - | 0.01 | - | |||||||||||||||||||||||
| C18:2n7 | 9, 11-octadecadienoic acid | - | 0.02 | - | 0.18 | - | |||||||||||||||||||||||
| C18:2n9 | 6, 9-octadecadienoic acid | - | - | - | 0.08 | - | |||||||||||||||||||||||
| C18:3n3 | α-Linolenic acid | 3.17 | 1.98 | 0.51 | 0.05 | 14.37 | |||||||||||||||||||||||
| C18:3n6 | γ-linolenic acid | - | 0.07 | 0.04 | - | - | |||||||||||||||||||||||
| C18:4n3 | 6, 9, 12, 15-octadecatetraenoic acid | 0.91 | 0.32 | 1.15 | 0.04 | 1.09 | |||||||||||||||||||||||
| C20:2n6 | 11, 14-eicosadienoic acid | 0.53 | 0.54 | - | - | - | |||||||||||||||||||||||
| C20:2n7 | 10, 13-eicosadienoic acid | - | 0.38 | - | - | - | |||||||||||||||||||||||
| C20:2n7c | 11, 13-eicosadienoic acid | 0.10 | 0.08 | - | - | - | |||||||||||||||||||||||
| C20:3n3 | Eicosatrienoic acid | 0.42 | 0.35 | - | - | - | |||||||||||||||||||||||
| C20:3n6 | 5, 11, 14-eicosatrienoic acid | 0.24 | 0.18 | - | - | - | |||||||||||||||||||||||
| C20:4n3 | Omega-3-arachidonic acid | - | - | - | 0.63 | - | |||||||||||||||||||||||
| C20:4n6 | Arachidonic acid | 0.46 | 0.33 | - | 0.06 | - | |||||||||||||||||||||||
| C20:5n3 | Eicosapentaenoic acid | 1.49 | 1.02 | - | 0.64 | 1.50 | |||||||||||||||||||||||
| C21:5n3 | Heneicosapentaenoic acid | 0.28 | 0.52 | - | - | - | |||||||||||||||||||||||
| C22:2n6 | 13, 16-docosadienoic acid | - | 0.12 | - | - | - | |||||||||||||||||||||||
| C22:2n9 | 5, 13-docosadienoate | 1.34 | 1.35 | - | - | - | |||||||||||||||||||||||
| C22:4n6 | 4, 10, 13, 16-docosatetraenoic acid | 0.23 | 0.41 | - | - | - | |||||||||||||||||||||||
| C22:4n6c | 7, 10, 13, 16-docosatetraenoic acid | - | 0.11 | - | - | - | |||||||||||||||||||||||
| C22:5n3 | Docosapentaenoic acid | - | 0.20 | - | 0.03 | 1.05 | |||||||||||||||||||||||
| C22:6n3 | Docosahexaenoic acid | 0.22 | 0.37 | 0.32 | 0.07 | 0.59 | |||||||||||||||||||||||
| Total fatty acids | 24.41 | 17.45 | 4.72 | 4.76 | 76.72 | ||||||||||||||||||||||||
| Saturated fatty acids | 8.33 | 4.30 | 1.37 | 1.59 | 20.66 | ||||||||||||||||||||||||
| Monounsaturated fatty acids | 5.22 | 3.76 | 1.06 | 1.29 | 13.87 | ||||||||||||||||||||||||
| Polyunsaturated fatty acids | 10.86 | 9.39 | 2.29 | 1.88 | 42.19 | ||||||||||||||||||||||||
| n3 Polyunsaturated fatty acids | 6.49 | 4.76 | 1.98 | 1.46 | 27.89 | ||||||||||||||||||||||||
| n6 Polyunsaturated fatty acids | 2.93 | 2.80 | 0.31 | 0.16 | 13.49 | ||||||||||||||||||||||||
| n3 PUFAs/n6 PUFAs | 2.21 | 1.70 | 6.38 | 9.12 | 2.06 | ||||||||||||||||||||||||
| EPA+DHA | 1.71 | 1.39 | 0.32 | 0.71 | 2.09 | ||||||||||||||||||||||||
| Note: “-” indicates no detectable or content less than 0.1%. | |||||||||||||||||||||||||||||
2.2 长链脂肪酸的组成 2.2.1 3种饵料微藻的长链脂肪酸组成
球等鞭金藻、牟氏角毛藻和青岛大扁藻中分别鉴定出11、23和15种长链脂肪酸,相对百分比含量分别为4.7%、4.8%、76.7%,青岛大扁藻的长链脂肪酸含量在3种微藻中最高(表 2)。EPA+DHA含量最高的也是青岛大扁藻(2.09%),牟氏角毛藻和球等鞭金藻中的EPA+DHA含量较低。
球等鞭金藻的主要脂肪酸为C14:0(0.65%)、C16:0(0.59%)、C18:4n3(1.15%)和C22:6n3(0.32%),未检测到C20:4和EPA,n3PUFAs的含量高于牟氏角毛藻,尤其是对人体和动物体有益的DHA含量较高。
牟氏角毛藻的主要脂肪酸为C14:0(1.18%)、C16:0(0.32%)、C16:1n7(1.06%)和EPA(0.64%),主要特点是C16:1n7的含量高于C16:0,并有较高含量的C20:5n3即EPA,并且C18和C22不饱和脂肪酸的含量是3种饵料微藻中最低的。
青岛大扁藻的主要脂肪酸为C16:0(19.56%)、C16:4n3(9.29%)、C18:2n6(9.56%)和C18:3n3(14.37%),C16多不饱和脂肪酸(C16 PUFAs)和C18多不饱和脂肪酸(C18 PUFAs)的含量都很高,分别为14.0%和25.02%,而C20多不饱和脂肪酸(C20 PUFAs)的含量较低(1.5%)。
2.2.2 织锦巴非蛤的长链脂肪酸组成从织锦巴非蛤中共鉴定出32种长链脂肪酸(表 2),其中从晒干样品中鉴定出31种,从浸泡提取的样品中仅鉴定出24种,这两种不同提取方式的样品中有相同的长链脂肪酸23种,9种互不相同的长链脂肪酸中除了一种为饱和脂肪酸外,其他8种全部是多不饱和脂肪酸。织锦巴非蛤晒干后萃取的方式与浸泡提取相比,能鉴定出更多的长链不饱和脂肪酸种类。
虽然织锦巴非蛤浸泡提取样品中鉴定出的长链脂肪酸种类比晒干提取样品的少,但是长链脂肪酸的百分比含量都比晒干提取样品的高,特别是n3 PUFAs、n6 PUFAs和EPA+DHA的相对含量都比较高(表 2)。长链脂肪酸占总峰面积的比例跟提取方法有关,浸泡提取为24.41%,晒干后提取为17.45%,而两者的长链脂肪酸含量组成均以棕榈酸(C16:0)为最高,其次为反油酸(C18:1n9t)、亚麻酸(C18:3n3),另外还有硬脂酸(C18:0)、EPA(C20:5n3)、亚油酸(C18:2n6)和二十二碳二烯酸(C22:2n3)等(表 2)。
2.3 长链脂肪酸的聚类分析对比各样品间的欧式距离值,发现球等鞭金藻和牟氏角毛藻之间的距离值最小(3.623),青岛大扁藻和牟氏角毛藻之间的距离值最大(844.996)。基于欧式距离值,采用最小邻接法构建样品间的聚类图。如图 2所示,5个样品聚类成2个不同的组,第一组包括织锦巴非蛤(湿、干)、球等鞭金藻和牟氏角毛藻,第二组为青岛大扁藻,提示织锦巴非蛤和球等鞭金藻、牟氏角毛藻的长链脂肪酸组成较相似。

|
| 图 2 不同样品长链脂肪酸的聚类分析 Fig. 2 Cluster analysis of long-chain fatty acids in different samples |
2.4 长链脂肪酸的主成分分析及相关性分析
织锦巴非蛤和饵料微藻中长链脂肪酸的主成分分析结果见图 3,主要分为主成分1(60.8%)和主成分2(23.0%),2个主成分的累积方差贡献率为83.8%,说明提取的信息能反映原始数据大部分信息。织锦巴非蛤、球等鞭金藻、青岛大扁藻与主成分1显著相关,而球等鞭金藻、牟氏角毛藻与主成分2显著相关。一些主要的脂肪酸成分的载荷图显示,棕榈酸(C16:0)、亚麻酸(C18:3n3)、反油酸(C18:1n9t)、亚油酸(C18:2n6)、硬脂酸(C18:0)与主成分1显著正相关,这些成分可作为织锦巴非蛤和青岛大扁藻的特征脂肪酸成分,而十八碳四烯酸(C18:4n3)与主成分2显著相关,可作为球等鞭金藻和牟氏角毛藻的特征脂肪酸组分。

|
| 图 3 织锦巴非蛤和饵料微藻长链脂肪酸、主要长链脂肪酸主成分分析载荷图 Fig. 3 Principle components loading plots for P.textile and microalgae and major long-chain fatty acids with larger scores |
3 讨论
脂类是由脂肪和类脂化合物组成的一种复杂的混合物,因此想要完全将样品中的脂类提取出来是非常困难的,仅能通过采用适宜的方法将尽可能多的脂类提取出来。本研究表明,织锦巴非蛤晒干后提取的方式与浸泡提取相比,能鉴定出更多的不饱和脂肪酸种类,但是脂肪酸的百分比含量不如浸泡提取的高(晒干后提取为17.45%,浸泡提取为24.41%),特别是n3 PUFA、n6 PUFA和EPA+DHA的相对含量。
海洋微藻的脂质含量和脂肪酸组成因藻种不同而异[29],均有其特定的脂肪酸,是许多PUFAs的重要来源[30]。本研究的3种饵料微藻中,青岛大扁藻的PUFAs相对含量最高,为42.19%,球等鞭金藻和牟氏角毛藻的PUFAs相对含量差别不大,分别为2.29%和1.88%。球等鞭金藻的长链脂肪酸组成与蒋汉明等[31]和杨秀霞等[32]的研究结论类似;对牟氏角毛藻等硅藻特征脂肪酸的研究较多[32-34],其结果与本研究结果接近;青岛大扁藻的长链脂肪酸组成结果与大多数已报道的绿藻纲海藻(包括大型藻)的研究资料吻合。一般认为绿藻纲海藻脂肪酸组成的最大特点是具有高水平的C16:4n3和C18:3n3,这在其他类型微藻中较为少见,可以作为绿藻纲海藻微藻的标记脂肪酸[7];C18:3n3被认为是生物合成C20:5n3等C20 PUFAs的前体,它的积累是绿藻纲海洋微藻细胞中脂肪酸合成的一个特变,即从C18到C20的延伸过程受抑制[35]。
众所周知,食物对海洋生物的脂质组成有重要影响[36, 37]。本研究中织锦巴菲蛤总脂的组成与郝晓敏等[38]的研究结果一致,虽然织锦巴非蛤和球等鞭金藻、牟氏角毛藻的长链脂肪酸组成较相似,但是织锦巴非蛤、青岛大扁藻与主成分1显著相关,棕榈酸(C16:0)、亚麻酸(C18:3n3)、反油酸(C18:1n9t)、亚油酸(C18:2n6)和硬脂酸(C18:0)可作为其特征脂肪酸成分。结果表明,青岛大扁藻更能满足织锦巴非蛤稚贝期的脂质营养需求,是培育织锦巴非蛤稚贝的优良饵料。
对于大多数贝苗的繁育而言,牟氏角毛藻是一种优良的饵料微藻[39-41]。绝大多数贝类在育苗的浮游阶段,球等鞭金藻都是其他微藻不可替代的优质饵料[13, 14, 42],但是随着稚贝的成长,投喂球等鞭金藻的饵料效果慢慢低于投喂牟氏角毛藻或者青岛大扁藻的饵料效果,因此时的球等鞭金藻营养已经不能满足较大稚贝的生长需求,对于织锦巴非蛤稚贝的培养,建议以投喂青岛大扁藻为主的同时混合投喂牟氏角毛藻和球等鞭金藻。本研究结果为织锦巴非蛤人工育苗过程中稚贝期的饵料选择提供了可靠的科学依据。
| [1] |
赖胜琪, 尹聪, 邱炬维, 等. 北部湾沿海织锦巴非蛤不同地理群体形态差异研究[J]. 广东农业科学, 2022, 49(7): 105-112. |
| [2] |
栗志民, 刘志刚, 韩伟贤. 织锦巴非蛤稚贝盐度适应性研究[J]. 海洋科学, 2011, 35(10): 96-102. |
| [3] |
纪燕如, 林志华, 伍荣聪, 等. 我国东南沿海5个织锦巴非蛤地理群体的形态差异分析[J]. 热带生物学报, 2011, 2(3): 219-225. DOI:10.3969/j.issn.1674-7054.2011.03.006 |
| [4] |
邓正华, 姜松, 张博, 等. 合浦珠母贝对不同种类及浓度的单胞藻的摄食与消化效果研究[J]. 南方水产科学, 2016, 12(3): 112-118. DOI:10.3969/j.issn.2095-0780.2016.03.015 |
| [5] |
邓正华, 翟子钦, 魏海军, 等. 织锦巴非蛤幼虫对不同种类单胞藻的摄食和消化效果[J]. 南方农业学报, 2022, 53(5): 1448-1456. DOI:10.3969/j.issn.2095-1191.2022.05.027 |
| [6] |
陈瑞芳, 董兰芳, 许明珠. 广西特色海水养殖品种发展现状与展望[J]. 广西科学院学报, 2020, 36(3): 237-241. |
| [7] |
李荷芳, 周汉秋. 海洋微藻脂肪酸组成的比较研究[J]. 海洋与湖沼, 1999, 30(1): 34-40. |
| [8] |
VOLKMAN J K. Sterols in microorganisms[J]. Applied Microbiology and Biotechnology, 2003, 60(5): 495-506. DOI:10.1007/s00253-002-1172-8 |
| [9] |
VOLKMAN J K, BARRETT S M, BLACKBURN S I, et al. Microalgal biomarkers: a review of recent research developments[J]. Organic Geochemistry, 1998, 29(5/6/7): 1163-1179. |
| [10] |
PONIS E, PROBERT I, VERON B, et al. Nutritional value of six Pavlovophyceae for Crassostrea gigas and Pecten maximus larvae[J]. Aquaculture, 2006, 254(1/2/3/4): 544-553. |
| [11] |
NAPOLITANO G E, ACKMAN R G, SILVA-SERRA M A. Incorporation of dietary sterols by the sea scallop Placopecten magellanieus (Gmelin) fed on microalgae[J]. Marine Biology, 1993, 117(5): 647-654. |
| [12] |
BACHOK Z, MFILINGE P L, TSUCHIYA M. The diet of the mud clam Geloina coaxans (Mollusca, Bivalvia) as indicated by fatty acid markers in a subtropical mangrove forest of Okinawa, Japan[J]. Journal of Experimental Marine Biology and Ecology, 2003, 292(2): 187-197. DOI:10.1016/S0022-0981(03)00160-6 |
| [13] |
SOUDANT P. Effect of food fatty acid and sterol quality on Pecten maximus gonad composition and reproduction process[J]. Aquaculture, 1996, 143(3/4): 361-378. |
| [14] |
CHENG P F, ZHOU C X, CHU R R, et al. Effect of microalgae diet and culture system on the rearing of bivalve mollusks: nutritional properties and potential cost improvements[J]. Algal Research, 2020, 51: 102076. |
| [15] |
WHITEFIELD C R, OLIVEIRA A C M, HARDY S M. Composition of phytodetrital food resources affects reproductive success in the deposit-feeding sea cucumber, Parastichopus californicus (Stimpson 1857)[J]. Journal of Experimental Marine Biology and Ecology, 2018, 500: 1-11. |
| [16] |
陆开宏, 林霞. 13种饵料微藻的脂肪酸组成特点及在河蟹育苗种的应用[J]. 宁波大学学报(理工版), 2001, 14(3): 27-32. |
| [17] |
陈立侨, 江洪波, 周忠良, 等. ω-3HUFAa对中华绒鳌蟹幼体存活率及体脂肪酸组成的影响[J]. 水产学报, 2000, 24(5): 448-452. |
| [18] |
蒋霞敏, 郑亦周. 14种微藻总酯含量和脂肪酸组成研究[J]. 水生生物学报, 2003, 27(3): 243-247. |
| [19] |
温少红, 李叙风, 鞠宝, 等. 微藻高度不饱和脂肪酸的研究[J]. 海洋通报, 2000, 19(4): 86-91. |
| [20] |
邱清波, 李由明, 吴丽云, 等. 干露对缀锦蛤、文蛤、美女蛤和织锦巴非蛤耗氧率的影响[J]. 海南热带海洋学院学报, 2018, 25(2): 20-24. |
| [21] |
赵虹博, 邓素贞, 张静, 等. 从织锦巴非蛤提取总类胡萝卜素的两种前处理方法效果比较[J]. 海洋科学, 2019, 43(11): 62-67. |
| [22] |
邓素贞, 李庆昌, 韩芳, 等. 织锦巴非蛤不同组织及性别总类胡萝卜素含量比较分析[J]. 海洋通报, 2018, 37(2): 165-168, 208. |
| [23] |
王万东. 巴非蛤系列产品加工工艺[J]. 福建水产, 2006(1): 66-68. |
| [24] |
曾庆民, 赵虹博, 邓素贞, 等. 织锦巴非蛤不同颜色斧足的转录组[J]. 水产学报, 2022, 46(9): 1562-1571. |
| [25] |
颜成瑞, 苗菁, 叶莹莹. 14种帘蛤科贝类线粒体基因组特征与系统进化分析[J]. 浙江海洋大学学报(自然科学版), 2021, 40(4): 285-292. |
| [26] |
FOLCH J, LEES M, SLIANE-STANLEY G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509. |
| [27] |
KNUTEN T M, OLSEN H G, TAFINTSEVA V, et al. Unravelling genetic variation underlying de novo-synthesis of bovine milk fatty acids[J]. Scientific Reports, 2018, 8(1): 2179. |
| [28] |
元冬娟, 吴湃, 王璠, 等. 19种湛江地区海产贝类中脂肪酸组成GC-MS分析[J]. 中国海洋药物, 2009, 28(3): 29-33. |
| [29] |
韩毅, 邓宇. 生物柴油的发展现状及新技术[J]. 化工技术与开发, 2007, 36(3): 19-25. |
| [30] |
BEN-AMOTZ, TORNABENE T G, THOMAS W H. Chemical profiles of microalgae with emphasis on lipids[J]. Journal of Phycology, 1985, 21(1): 72-81. |
| [31] |
蒋汉明, 高坤山. 两种海洋微藻脂肪酸组成研究[J]. 科学技术与工程, 2003, 3(1): 46-48. |
| [32] |
杨秀霞, 于浩, 曾晓起. 影响微藻脂肪酸组成因素概述[J]. 海洋湖沼通报, 2001(1): 76-82. |
| [33] |
卢丽娜, 孙利芹, 田焕玲, 等. 32株海洋微藻总脂含量及其脂肪酸组成的研究[J]. 中国油脂, 2009, 34(11): 68-73. |
| [34] |
李春颖, 仇雪梅. 海洋微藻脂肪酸组成的研究进展[J]. 生物技术通报, 2008(4): 63-65. |
| [35] |
俞建江, 李荷芳, 周汉秋. 10种海洋微藻总脂、中性脂和极性脂的脂肪酸组成[J]. 水生生物学报, 1999, 23(5): 481-488. |
| [36] |
XU J L, ZHOU H B, YAN X J, et al. Effect of unialgal diets on the composition of fatty acid sand sterols in juvenile ark shell Tegillarca granosa Linnaeus[J]. Journal of Agricultural and Food Chemistry, 2012, 60(15): 3973-3980. |
| [37] |
RONQUILLO J D, FRASER J, MCCONKEY A J. Effect of mixed microalgal diets on growth and polyunsaturated fatty acid profile of European oyster (Ostrea edulis) juveniles[J]. Aquaculture, 2012, 360-361: 64-68. |
| [38] |
郝晓敏, 周启明, 谷长生, 等. 巴菲蛤壳脂溶性成分的气相色谱-质谱联用分析[J]. 安徽农业科学, 2008, 36(8): 3079-3080. |
| [39] |
LANGDON C J, ROBINSON A M. Aquaculture potential of the Suminoe oyster (Crassostrea ariakensis Fugita 1913)[J]. Aquaculture, 1996, 144(4): 321-338. |
| [40] |
PONIS E, ROBERT R T, PARISI G. Nutritional value of fresh and concentrated algal diets for larval and juvenile Pacific oysters (Crassostrea gigas)[J]. Aquaculture, 2003, 221(1/2/3/4): 491-505. |
| [41] |
NASCIMENTO I A. Growth of the larvae of Crassostrea gigas Thunberg, fed with different algal species at high cell concentrations[J]. ICES Journal of Marine Science, 1980, 39(2): 134-139. |
| [42] |
LAING I, PSIMOPOULOUS A. Hatchery cultivation of king scallop (Pecten maximus) spat with cultured and bloomed algal diets[J]. Aquaculture, 1998, 169(1/2): 55-68. |



