2. 厦门大学, 福建厦门 361001
2. Xiamen University, Xiamen, Fujian, 361001, China
近年来,随着养殖环境的日益恶化,水产养殖动物病害频发;同时由于传统抗生素具有易残留和产生耐药性等缺点,水生动物食品安全备受人们的关注[1]。中草药作为代替抗生素的一种选择,具有一定的营养、抗菌、抗病毒以及提高机体免疫力的作用[2]。牛大力是一味药食两用的中草药,为豆科(Fabaceae Lindl.)蝶形花亚科(Papilionoideae)崖豆藤属(Millettia Wight & Arn.)植物美丽崖豆藤(Millettia speciosa Champ.,MSP)的干燥根,别名九龙串珠、甜牛大力、山莲藕、牛古大力等,主要分布于广西、广东、海南等地[3]。现代药理学研究表明MSP具有提高抗氧化能力[4-9]、抗应激[10]、抗疲劳[11]、抗肿瘤[12]、保肝[13-15]以及降低血糖[16]的作用,由于其经济营养,人们更是将其做成膳食用来强身健体[17, 18]。目前,牛大力中草药研究主要集中在对小鼠免疫和疾病等方面的影响。斑马鱼(Danio rerio)作为一种常见的动物模型,近年来被广泛用于药物研究[19]。基于此,本研究将MSP水提物通过浸浴的方式添加到斑马鱼的养殖水体中,探讨MSP对斑马鱼抗氧化和免疫能力的影响,为MSP在水产养殖中的应用提供基础研究数据。
1 材料与方法 1.1 MSP水提物提取MSP购买于广州海王星辰药店,MSP水提物的提取参考文献[20],具体方法如下:准确称取MSP 10 g,切成小碎块,以20倍体积量的双纯水100 ℃回流煎煮1 h,煎煮完将溶液倒出,重复提取1次,合并两次所得滤液,浓缩为生药量的1/10 (g/mL),于4 ℃保存备用。
1.2 试验设计本试验的基础饲料为每日孵化的鲜活丰年虫,试验所用斑马鱼为3月龄野生型斑马鱼,养殖试验开始前暂养10 d。将300尾健康斑马鱼[体长(3.0±0.2)cm,体质量(0.50±0.05) g]随机分为5组,参考周楚莹等[15]的试验结果进行浓度设置,设置0(空白对照组)、5、15、25和35 mg/L MSP水提物试验组,每组60尾并设置3个平行,每个平行20尾,分别放置于含3 L水的玻璃缸(20 cm×20 cm×15 cm)中进行试验。斑马鱼饲养用水为养殖过滤水,水温控制在26-28 ℃,溶氧6.5-7.0 mg/L,同时24 h增氧,每天换水量为2/3(水体积);试验过程中采用自然光照。所有组均投喂丰年虫,每天投喂量为鱼体总质量的5%,早上9:00和下午5:00投喂,每天下午饲喂完试验组后加入相应浓度的MSP水提物,试验共进行14 d。
1.3 样品采集与攻毒试验养殖试验结束后,禁食24 h,每个平行处理组随机选取9尾鱼,冰上麻醉之后,用无菌无酶的采样工具采集肝脏、肠道和脑组织,分别放入无菌无酶的1.5 mL离心管中,其中肝脏和肠道1尾1个样,脑组织3尾混为1个样,置于液氮速冻2 h后,于-80 ℃保存用于之后的分子实验;另取鱼的肝脏和肠道,均为3尾混为1个样,分别置于无菌无酶的1.5 mL离心管中,存于-20 ℃冰箱中,用于测定组织的抗氧化酶活力。
采样结束后,从每个平行处理随机选取10尾斑马鱼,每组合计为30尾鱼,进行嗜水气单胞菌(Aeromonas hydrophila)攻毒试验。致病性嗜水气单胞菌由华南农业大学海洋学院水产养殖系提供。菌种用LB培养基在28 ℃摇床培养24 h,复壮2次后将菌体以4 000 r/min离心10 min,用生理盐水清洗收集到的沉淀菌体,再进行梯度稀释,稀释后的浓度为预试验确定的半致死浓度4.2×108 CFU/mL。攻毒试验采用斑马鱼尾部创伤感染的方法,将创伤后的斑马鱼放进半致死浓度的嗜水气单胞菌菌液中,感染3 min后转入饲养缸中,感染期间不间断充气、每天换1/2体积的水。每6 h观察一次,及时捞出死鱼,记录和统计各组死鱼的数量,攻毒试验共进行7 d。
1.4 组织生理生化指标测定采用相应的试剂盒(南京建成生物工程研究所有限公司)检测肠道和肝脏组织总抗氧化能力(Total Antioxidant Capacity, T-AOC)、丙二醛(Malondialdehyde,MDA)的含量,以及超氧化物歧化酶(Superoxide Dismutase,SOD)、溶菌酶(Lysozyme,LZM)的活性,试验步骤按试剂盒的操作说明进行。
1.5 组织免疫基因表达测定利用Trizol试剂(杭州艾科瑞生物科技有限公司)提取斑马鱼的肝脏、肠道和脑组织总RNA,用Evo M-MLV反转录预混型试剂盒(杭州艾科瑞生物科技有限公司)将提取的RNA转录成cDNA,接着用SYBR Green Pro Taq HS预混型q-PCR试剂盒(杭州艾科瑞生物科技有限公司)以β-actin为参照基因检测白细胞介素-1 (Interleukin-1)、肿瘤坏死因子α(Tumor necrosis factor α)、溶菌酶、防御素(Defensins)、核转录因子κB(Nuclear factor κB)、补体(Complement)、干扰素(Interferon)等基因(分别简写为 il-1β、tnf-α、lyz、defbl1、nfκb、c3a、ifnγ) 的相对表达量,引物序列如表 1。
| 目的基因 Target gene |
引物序列(5′→3′) Primer sequences (5′→3′) |
序列号 Accession number |
| il-1β-f | CATTTGCAGGCCGTCACA | NM_212844 |
| il-1β-r | GGACATGCTGAAGCGCACTT | NM_212844 |
| tnf-α-f | GCTGGATCTTCAAAGTCGGGTGTA | NM_212859 |
| tnf-α-r | TGTGAGTCTCAGCACACTTCCATC | NM_212859 |
| c3a-f | TCTGAGAGTCTTCAGACAATCACT | NM_131242 |
| c3a-r | TTAGCGAGCCAGAATCAGCT | NM_131242 |
| defbl1-f | TGTGCAAGTCTCAGTGGTGTTTGC | KM_655709 |
| defbl1-r | TTTGCCACAGCCTAATGGTCCGAA | KM_655709 |
| ifnγ-f | GTTTGCTGTTTTCGGGATGG | AB_15836 |
| ifnγ-r | TTCGCAGGAAGATGGGGTGT | AB_15836 |
| nfκb-f | AAAAGATGGAGCCCTCACCC | XM_005171126 |
| nfκb-r | ATCAGCCTTGCATCCCTACC | XM_005171126 |
| lyz-f | AGGCTGGCAGTGGTGTTTTT | NM_139180 |
| lyz-r | CACAGCGTCCCAGTGTCTTG | NM_139180 |
| β-actin-f | AGAGCTATGAGCTGCCTGACG | AF_057040 |
| β-actin-r | CCGCAAGATTCCATACCCA | AF_057040 |
1.6 数据处理
实验结果用均值±标准差表示,采用SPSS Statistics 19.0软件通过单因素方差分析(Duncan多重比较法)进行统计学分析,P<0.05表示具有统计学意义。
存活率(%)=(存活尾数/总尾数)×100%,
免疫保护率(%)=[(空白对照组死亡数-药物实验组死亡数)/空白对照组死亡数]×100%。
2 结果与分析 2.1 MSP水提物对斑马鱼生理生化指标的影响不同浓度MSP水提物对斑马鱼肠道和肝脏生理生化指标的影响见表 2。肠道SOD的活性在5 mg/L和15 mg/L组均显著高于空白对照组(P<0.05),分别比对照组提高60%和192%,35 mg/L组显著低于空白对照组(P<0.05);肠道MDA的含量在5 mg/L组和空白对照组间有显著性差异(P<0.05),其余各组影响较小;肠道LZM的活性随着MSP水提物浓度的增大整体上先降低后增高,在5、15、25 mg/L组均显著低于空白对照组,35 mg/L组显著高于空白对照组(P<0.05)。肝脏SOD的活性在25 mg/L组显著高于空白对照组(P<0.05),比空白对照组提高581%;肝脏LZM的活性在25 mg/L组最低,和空白对照组间有显著性差异(P<0.05);各浓度MSP水提物试验组中肝脏T-AOC均高于空白对照组,在25 mg/L组有显著性差异(P<0.05),高出空白对照组16倍。
| 牛大力水提物试验组 Test group of MSP aqueous extract |
肠道SOD活性 Activities of intestine SOD |
肠道MDA含量 Content of intestine MDA |
肠道LZM活性 Activities of intestine LZM |
肝脏SOD活性 Activities of liver SOD |
肝脏LZM活性 Activities of liver LZM |
肝脏T-AOC Liver T-AOC |
| 0 mg/L | 19.49±1.94b | 0.38±0.06a | 314.38±7.94d | 8.92±1.05a | 44.53±8.39b | 7.82±2.43a |
| 5 mg/L | 31.16±0.30c | 1.46±0.62b | 130.63±2.17a | 2.19±0.35a | 26.04±0.42a | 13.96±0.97a |
| 15 mg/L | 56.83±3.09d | 0.42±0.09a | 269.06±14.25c | 3.03±0.51a | 48.91±4.06b | 22.93±2.86a |
| 25 mg/L | 25.47±2.92bc | 0.19±0.01a | 169.69±9.20b | 60.72±1.61b | 24.17±3.03a | 135.7±22.48b |
| 35 mg/L | 9.06±0.59a | 0.26±0.02a | 370.94±12.45e | 13.41±8.71a | 53.13±6.13b | 26.78±1.71a |
| Note: different lowercase letters after the data in the same column indicate significant differences (P<0.05). | ||||||
2.2 MSP水提物对斑马鱼免疫相关基因表达的影响 2.2.1 MSP水提物对斑马鱼肠道部分免疫相关基因表达的影响
斑马鱼肠道部分免疫相关基因的相对表达量如图 1所示。从图 1可知,tnf-α的相对表达量在5 mg/L和25 mg/L组中均显著高于空白对照组(P<0.05);nfκb的相对表达量在25 mg/L组显著高于空白对照组(P<0.05),35 mg/L组显著低于空白对照组(P<0.05),其余各组影响不大;defbl1的相对表达量随着MSP水提物浓度的增加整体上先升高后降低,其中5、15、25 mg/L组均与空白对照组有显著性差异(P<0.05);各浓度MSP水提物试验组斑马鱼肠道lyz的相对表达量均高于空白对照组,其中5、25、35 mg/L组均显著高于对照组(P<0.05);il-1β的相对表达量在5 mg/L和35 mg/L组均显著高于空白对照组(P<0.05);c3a的相对表达量除了15 mg/L组其余均显著低于空白对照组(P<0.05),同时整体上呈现出随着MSP水提物浓度的增高而不断降低的趋势。
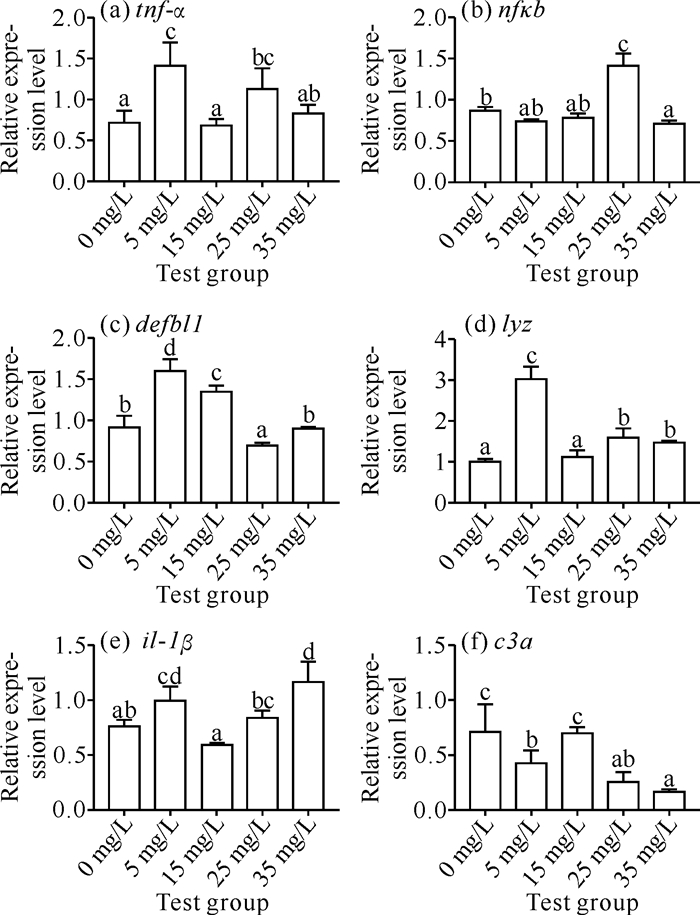
|
| Different letters superscripted on different groups of the same gene indicate significant differences (P < 0.05). 图 1 MSP水提物对斑马鱼肠道部分免疫基因表达的影响 Fig. 1 Effect of MSP aqueous extract on the expression of some immune genes in the zebrafish intestinal tract |
2.2.2 MSP水提物对斑马鱼肝脏部分免疫相关基因表达的影响
斑马鱼肝脏部分的免疫相关基因的相对表达量如图 2所示。从图 2可知,各浓度MSP水提物试验组斑马鱼肝脏tnf-α的相对表达量均高于空白对照组,在5 mg/L组和空白对照组间有显著性差异(P<0.05);nfκb的相对表达量和空白对照组差异不大;defbl1的相对表达量在5 mg/L和35 mg/L组均显著高于空白对照组(P<0.05);lyz的相对表达量在25 mg/L组显著高于空白对照组(P<0.05),其余各组均低于空白对照组;il-1β的相对表达量在25 mg/L和35 mg/L组均显著高于空白对照组(P<0.05);c3a的相对表达量整体上呈现先升高后降低的趋势,在5 mg/L组显著高于空白对照组(P<0.05)。
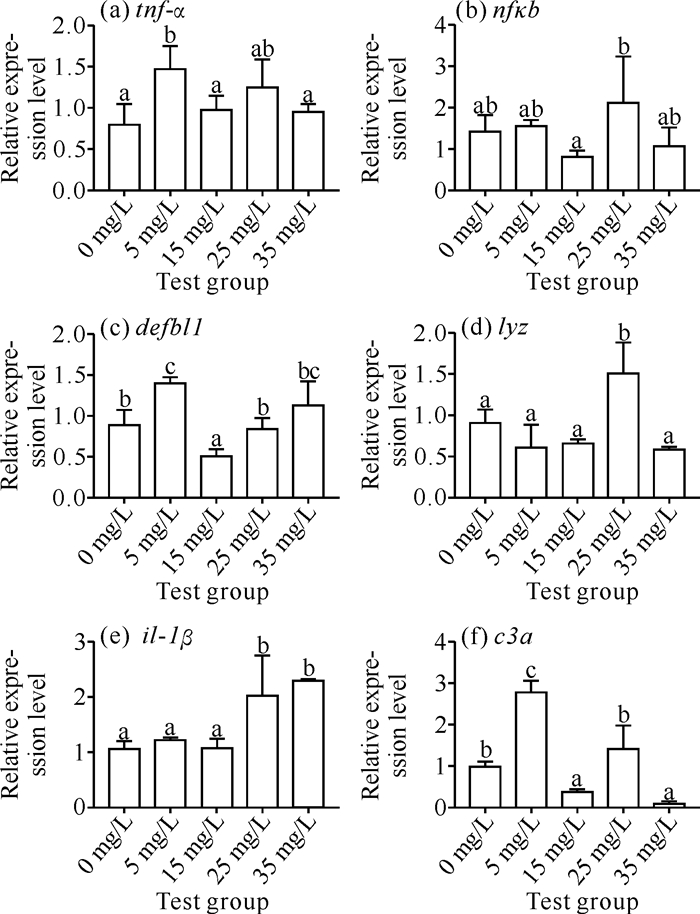
|
| Different letters superscripted on different groups of the same gene indicate significant differences (P < 0.05). 图 2 MSP水提物对斑马鱼肝脏部分免疫基因表达的影响 Fig. 2 Effect of MSP aqueous extract on the expression of some immune genes in the liver of zebrafish |
2.2.3 MSP水提物对斑马鱼大脑部分免疫相关基因表达的影响
斑马鱼大脑部分免疫相关基因的相对表达量如图 3所示。tnf-α的相对表达量随MSP浓度的增加而上调,同时在15 mg/L和35 mg/L组相对表达量均显著上调(P<0.05);nfκb的相对表达量在35 mg/L组显著高于空白对照组(P<0.05);和空白对照组相比,defbl1在25 mg/L组相对表达量最低,35 mg/L组相对表达量最高(P<0.05);ifny的相对表达量均高于空白对照组,在5、25、35 mg/L组均显著高于空白对照组(P<0.05);il-1β的相对表达量在5 mg/L和15 mg/L组均高于空白对照组;c3a的相对表达量呈现平缓上调的趋势,在35 mg/L组显著高于空白对照组(P<0.05)。
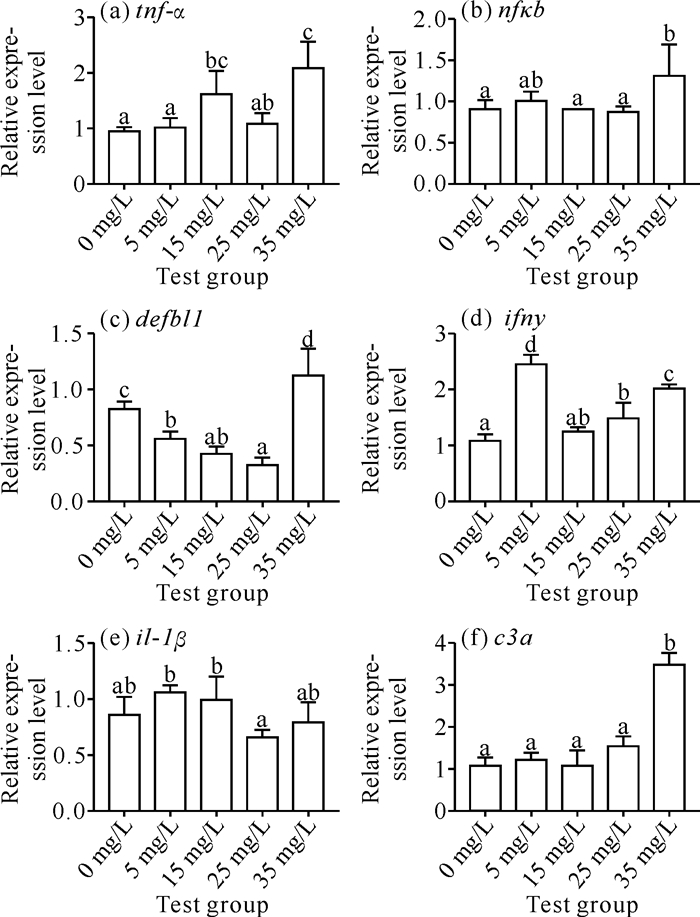
|
| Different letters superscripted on different groups of the same gene indicate significant differences (P < 0.05). 图 3 MSP水提物对斑马鱼大脑部分免疫基因表达的影响 Fig. 3 Effect of MSP aqueous extracts on immune gene expression in zebrafish brain fractions |
2.3 MSP水提物对斑马鱼感染嗜水气单胞菌的保护率
由表 3可知,所有试验组斑马鱼的存活率随MSP水提物浓度的增加而提高,35 mg/L组的存活率(67%)最高。斑马鱼攻毒免疫保护率随MSP水提物浓度的增加而不断提高,35 mg/L组的免疫保护率最高,为28.6%。
| 组别 Groups |
每组攻毒尾数 Number of fish |
存活尾数 Survival tail |
存活率/% Survival rate/% |
免疫保护率/% Immune protection rate/% |
| 0 mg/L | 30 | 16 | 53 | |
| 5 mg/L | 30 | 18 | 60 | 14.3 |
| 15 mg/L | 30 | 18 | 60 | 14.3 |
| 25 mg/L | 30 | 19 | 63 | 21.4 |
| 35 mg/L | 30 | 20 | 67 | 28.6 |
3 讨论 3.1 MSP水提物可以提高斑马鱼组织的抗氧化能力
氧化应激反应是指体内氧化与抗氧化作用失衡,倾向于氧化,机体所做出的反应。T-AOC是指各种抗氧化物质和抗氧化酶等构成的总抗氧化水平。SOD是动物机体一种较为重要的抗氧化酶,可通过清除生物体内的自由基来增强机体免疫力[21]。MDA是氧化应激过程产生的代表性毒性中间产物,其含量过高会损伤细胞[22]。LZM属于非特异性免疫因子,是一种能水解病原微生物细胞壁中黏多糖的碱性酶,对动物肠道有免疫屏障的作用[23]。研究表明,在饲料中添加中草药可以提高牙鲆(Paralichthys olivaceus)[24]、虹鳟(Oncorhynchus mykiss)[25]以及草鱼(Ctenopharyngodon idella)[26]组织的SOD、LZM活性和T-AOC,使鱼机体的抗氧化能力得到提高。研究表明牛大力具有抗氧化能力,主要是通过其所含的多糖、总黄酮、多酚等化学成分清除自由基来实现[27, 28]。本研究中,MSP水提物试验组斑马鱼肠道和肝脏中的SOD活性显著高于空白对照组,同时35 mg/L组斑马鱼肠道中的MDA含量低于空白对照组,LZM活性在高浓度MSP水提物组显著提高,肝脏的T-AOC高于空白对照组,表明MSP水提物能提高斑马鱼的抗氧化能力,增强斑马鱼应对外界应激的能力。
3.2 MSP水提物通过调控斑马鱼的相关免疫基因增强其免疫力tnf-α在炎症反应、细胞免疫、肿瘤免疫、低氧及血脂异常等多种生理和病理过程中发挥着关键作用[29]。il-1β是多功能细胞因子之一,参与机体的炎症反应、细胞生长和组织修复等多项生理过程[30]。nfκb在细胞的炎症反应、免疫应答等过程中起到关键性作用[31, 32]。defbl1是一组在宿主先天性免疫防御中发挥重要作用的小抗菌肽,是许多物种先天免疫系统的一部分;过表达的 defbl1能抑制病毒感染和上调宿主免疫相关基因的表达[33]。补体C3为补体系统中含量最高的成分,在C3转化酶的作用下,其裂解成 c3a和c3b两个片段,在先天性免疫中有重要的作用[34, 35]。ifnγ作为驱动细胞免疫的关键参与者,主要通过增强抗原加工和呈递、增加白细胞运输,诱导抗病毒状态,增强抗微生物功能以及影响细胞增殖和凋亡来发挥其免疫调节作用[36]。药理学研究表明MSP具有调节免疫应答的能力,主要是通过调节肠道微生物群落的多样性,进而增强肠道健康来实现[37, 38]。本研究中,高浓度MSP水提物干预可上调斑马鱼组织中的 tnf-α、il-1β、nfκb、defbl1、ifnγ、lyz、c3a的相对表达量,特别是,在肠道中25 mg/mL组的大部分免疫相关基因显著性高于空白对照组;在肝脏中25 mg/mL MSP水提物试验组也有类似的趋势,表明MSP水提物主要是通过肠-肝轴调节斑马鱼的免疫应答能力。而在脑组织中,35 mg/mL MSP水提物试验组对 tnf-α、nfκb、il-1β、c3a、ifnγ、defbl1的调节较其他浓度MSP水提物组更显著,表明高浓度的MSP水提物可能通过血脑屏障产生免疫调节作用。此外,MSP水提物对斑马鱼感染嗜水气单胞菌的保护试验也表明MSP水提物对斑马鱼具有一定的保护效果,这可能是MSP水提物干预后显著上调相关免疫调节因子,有效提高了斑马鱼的免疫力,从而抵抗外界病菌的侵入。
4 结论本研究中,MSP水提物对斑马鱼的组织生化指标、免疫基因的表达量和抗嗜水气单胞菌感染的能力具有明显的改善作用,能够增强斑马鱼的抗氧化和免疫能力。
| [1] |
李红艳. 我国水产养殖病害防控存在的问题及对策[J]. 乡村科技, 2020, 11(36): 109-110. |
| [2] |
范志聪, 陈婷, 孙加节, 等. 禁抗形势下的替抗产品分析与选择[J]. 广东饲料, 2021, 30(5): 11-14. |
| [3] |
杨嘉, 张兴, 赵映淑, 等. 牛大力对大鼠长期毒性的实验研究[C]//海南省药学会. 海南省药学会2011年学术年会论文集. 海口: [出版者不详], 2011: 202-208.
|
| [4] |
韦翠萍, 刘丹丹, 唐立海, 等. 牛大力对小鼠免疫功能的影响[J]. 广州中医药大学学报, 2009, 26(6): 539-542. |
| [5] |
吕世静, 黄槐莲, 吴宋厦. 牛大力对抗体及IL-2产生的影响[J]. 上海免疫学杂志, 1997(1): 56. |
| [6] |
郑元升, 蒲含林, 麻建军. 牛大力多糖对小鼠T淋巴细胞增殖的双向调节作用[J]. 广东药学院学报, 2008(1): 58-61. |
| [7] |
石焱, 弓小雪, 那婕. 牛大力多糖对免疫抑制小鼠的免疫调节作用[J]. 临床军医杂志, 2008(4): 530-532. |
| [8] |
刘积光. 牛大力对免疫力低下大鼠体液免疫功能的影响[J]. 临床医药文献电子杂志, 2019, 6(28): 41-42. |
| [9] |
田纪祥, 钟俊武. 牛大力提高小鼠免疫功能的实验研究[J]. 现代医学与健康研究电子杂志, 2018, 2(10): 59. |
| [10] |
黄翔, 王晓平, 陈晓白. 中药牛大力抗疲劳抗应激作用的实验研究[J]. 玉林师范学院学报, 2014, 35(2): 55-58. |
| [11] |
罗轩, 林翠梧, 陈洁晶, 等. 牛大力多糖对小鼠抗疲劳作用的研究[J]. 天然产物研究与开发, 2014, 26(3): 324-328. |
| [12] |
郑元升. 牛大力多糖的提取及其药理活性研究[D]. 广州: 暨南大学, 2009.
|
| [13] |
曹志方, 郝赫宣, 杨雨辉, 等. 牛大力多糖在小鼠模型抗肝炎作用的试验观察[J]. 中国兽医杂志, 2015, 51(12): 57-59, 51. |
| [14] |
周添浓, 刘丹丹, 唐立海, 等. 牛大力对四氯化碳及酒精所致小鼠急性肝损伤的保护作用[J]. 时珍国医国药, 2009, 20(10): 2585-2587. |
| [15] |
周楚莹, 赖裕玲, 谢凌鹏, 等. 牛大力水提物对斑马鱼药物性肝纤维化损伤的保护作用[J]. 新中医, 2018, 50(12): 12-16. |
| [16] |
苏芬丽, 丘振文, 孙旭, 等. 牛大力多糖对糖尿病小鼠降血糖作用的研究[J]. 中南药学, 2019, 17(11): 1856-1859. |
| [17] |
朱宝生, 蒋敬全, 龙琳, 等. 食用牛大力汤类产品研究概况[J]. 中国调味品, 2020, 45(2): 133-136. |
| [18] |
赵震宇, 刘平怀, 马莎莎, 等. 药食同源植物牛大力的研究进展(英文)[J]. 食品科学, 2017, 38(9): 293-306. |
| [19] |
范琦琦, 李芝奇, 陈美琳, 等. 基于斑马鱼模型的中药安全性评价研究进展[J]. 中草药, 2022, 53(1): 278-287. |
| [20] |
苏芬丽, 杨泽锐, 黄松, 等. 牛大力多糖提取工艺的优化[J]. 海峡药学, 2019, 31(11): 38-41. |
| [21] |
郭勤单, 王有基, 吕为群. 温度和盐度对褐牙鲆幼鱼渗透生理及抗氧化水平的影响[J]. 水生生物学报, 2014, 38(1): 58-67. |
| [22] |
GHONIMI N A M, ELSHARKAWI K A, KHYAL D S M, et al. Serum malondialdehyde as a lipid peroxidation marker in multiple sclerosis patients and its relation to disease characteristics[J]. Multiple Sclerosis and Related Disorders, 2021, 51: 102941. |
| [23] |
程赛赛, 季金虎, 徐二华, 等. 溶菌酶对动物肠道屏障的影响及其在动物生产中的应用研究进展[J]. 饲料研究, 2021, 44(19): 157-160. |
| [24] |
刁菁, 王友红, 王淑娴, 等. 一种复方中草药免疫增强剂对牙鲆免疫力及抗病力的影响[J]. 广西科学院学报, 2020, 36(2): 137-144. |
| [25] |
刘飞, 王凡, 李聪歌, 等. 红枣提取物对虹鳟血清指标和头肾免疫相关基因表达的影响[J]. 淡水渔业, 2020, 50(1): 15-21. |
| [26] |
李超, 张其中, 朱成科, 等. 增强草鱼免疫功能的复方中草药免疫增强剂筛选[J]. 西南师范大学学报(自然科学版), 2012, 37(4): 121-129. |
| [27] |
莫宏辉, 邓国卫, 李珊. 牛大力叶中总多糖、总黄酮、总皂苷含量及其抗氧化活性的研究[J]. 湖北农业科学, 2021, 60(19): 88-91, 94. |
| [28] |
王立抗, 陈鸿庚, 黄智霖, 等. 牛大力不同部位总黄酮、多酚含量及其抗氧化活性研究[J]. 中华中医药学刊, 2022, 40(3): 139-142. |
| [29] |
冯馨锐, 崔雨舒, 何志涛, 等. 肿瘤坏死因子-α的生物学功能研究进展[J]. 吉林医药学院学报, 2019, 40(1): 66-68. |
| [30] |
AARREBERG L D, ESSER-NOBIS K, DRISCOLL C, et al. Interleukin-1beta Induces mtDNA release to activate innate immune signaling via cGAS-STING[J]. Molecular Cell, 2019, 74(4): 801-815. |
| [31] |
MING J H, YE J Y, ZHANG Y X, et al. Optimal dietary curcumin improved growth performance, and modulated innate immunity, antioxidant capacity and related genes expression of NF-κB and Nrf2 signaling pathways in grass carp (Ctenopharyngodon idella) after infection with Aeromonas hydrophila[J]. Fish Shellfish Immunology, 2020, 97: 540-553. |
| [32] |
OUYANG G, LIAO Q, ZHANG D, et al. Zebrafish NF-κB/p65 is required for antiviral responses[J]. Journal of Immunology, 2020, 204(11): 3019-3029. |
| [33] |
GUO M, WEI J, HUANG X, et al. Antiviral effects of β-defensin derived from orange-spotted grouper (Epinephelus coioides)[J]. Fish Shellfish Immunology, 2012, 32(5): 828-838. |
| [34] |
ZHANG S, CUI P. Complement system in zebrafish[J]. Developmental and Comparative Immunology, 2014, 46(1): 3-10. |
| [35] |
WIBOWO I, MARLINDA N, NASUTION F R, et al. Down-regulation of complement genes in lipopolysaccharide-challenged zebrafish (Danio rerio) larvae exposed to Indonesian propolis[J]. Brazilian Journal of Biology, 2021, 83: e245202. |
| [36] |
KAK G, RAZA M, TIWARI B K. Interferon-gamma (IFN-γ): exploring its implications in infectious diseases[J]. Biomolecular Concepts, 2018, 9(1): 64-79. |
| [37] |
HUANG Z, ZENG Y J, CHEN X, et al. A novel polysaccharide from the roots of Millettia speciosa Champ.: preparation, structural characterization and immunomodulatory activity[J]. International Journal of Biological Macromolecules, 2020, 145: 547-557. |
| [38] |
CHEN X, SUN W, XU B, et al. Polysaccharides from the roots of Millettia speciosa Champ.modulate gut health and ameliorate cyclophosphamide-induced intestinal injury and immunosuppression[J]. Frontiers Immunology, 2021, 12: 766296. |



