2. 安康市中心医院, 陕西安康 725000
2. Ankang Central Hospital, Ankang, Shaanxi, 725000, China
随着肿瘤的急剧生长,其内部血液供应严重不足,导致氧气的输送受到很大程度的抑制,最终使得肿瘤内微环境明显乏氧。因此,乏氧是所有实体瘤的共同特征,它的存在也是引起肿瘤局部复发和远处转移的根源,并最终导致治疗失败[1]。实体瘤乏氧与肿瘤细胞内生物还原酶的活性密切相关,多种生物还原酶通常会过度表达[2, 3]。此外,乏氧通常也会导致肿瘤其他微环境参数发生变化,如pH值降低、间质流体压力升高、糖酵解和还原能力增强等[4]。因此,探索肿瘤演进过程中乏氧的发生发展规律,实现乏氧肿瘤的准确可视化,对恶性肿瘤的早期诊断与筛查具有重要的指导意义。
准确的乏氧成像不仅可以帮助临床医生尽早发现潜在的肿瘤患者,还能帮助临床医生制定合适的治疗策略,从而改善治疗效果。临床上,将氧微电极插入易于接近的肿瘤部位以评估其乏氧水平被认为是一种“金标准”,然而该方法是一种侵入性技术,具有较大创伤性,不利于实时原位成像。作为识别乏氧肿瘤组织的主要手段,磁共振成像和核医学检测技术具有无创性,但这些技术存在乏氧水平误报、对比度差、费用昂贵以及辐射污染等缺点。非侵入性分子成像正成为生命科学,以及临床诊断和指导治疗必不可少的工具,而实现精准成像的关键因素是新型探针化学的创新。乏氧分子探针能够对肿瘤细胞内的乏氧环境进行特异性实时监测,分析相关肿瘤细胞的乏氧情况,具有高选择性、可重复性和快速响应等优点[5, 6],在肿瘤乏氧可视化研究领域得到广泛应用[7, 8]。本文系统总结和评述了可激活肿瘤乏氧分子探针的最新进展,包括基于硝基还原酶(Nitroreductase, NTR)、基于偶氮还原酶和基于氢醌还原酶(Quinone Oxidoreductase, hNQO1)的乏氧分子探针(图 1),并分析了各种成像探针在乏氧肿瘤精确检测中的优缺点。同时,总结了目前肿瘤乏氧分子探针应用过程中存在的问题, 并对其未来发展趋势进行了展望,以期进一步促进乏氧分子探针在肿瘤诊疗方面的应用。
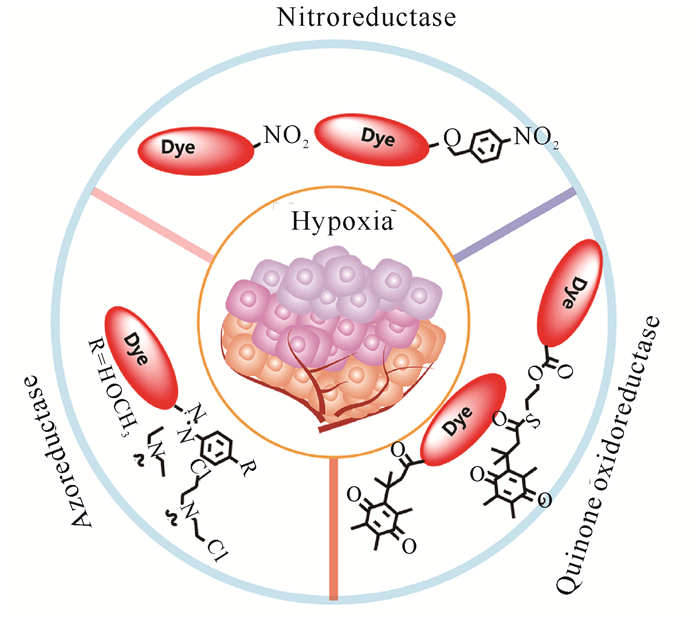
|
| 图 1 肿瘤乏氧相关标志物 Fig. 1 Tumor hypoxia-related markers |
1 基于硝基还原酶的乏氧分子探针
NTR大量存在于肿瘤细胞、组织及实体肿瘤中,因此NTR的浓度可以很好地反映肿瘤的乏氧程度,进而作为判断是否发生癌变的依据之一,这在临床上有着十分重要的意义[9-11]。近年来,研究人员利用芳香硝基基团作为乏氧敏感单元,已经设计开发了多种乏氧分子探针,因此基于NTR的肿瘤乏氧分子探针逐渐成为研究热门。在乏氧微环境下,NTR通过将芳香硝基还原为氨基,继而引发探针波长或发光强度的变化[12-17]。
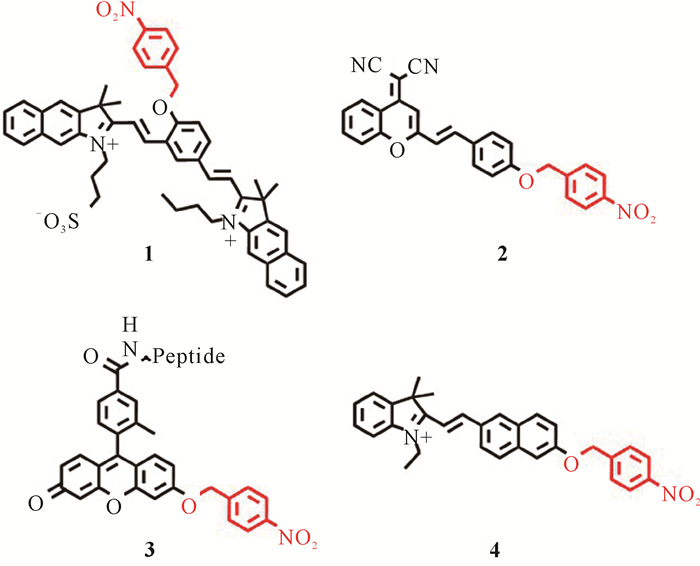
早在2015年,Sha课题组开发了一种具有高灵敏度和高选择性的新型“开启型”乏氧分子探针1[18],该探针由受保护的酚羟基基团和对硝基苄基部分组成(图 2),苯酚部分作为潜在供体与两个苯并吲哚受体偶联。研究人员发现探针1分子中的硝基单元在NTR作用下可快速转化为氨基,随后进行裂解反应并释放出游离苯酚部分,探针1检测过程中表现出独特的颜色变化和荧光强度的增强。该检测方法简单快速,已成功应用于乏氧HeLa肿瘤细胞中NTR的成像,展示出对肿瘤乏氧的潜在诊断能力。
随后,Yang等[19]设计合成了新型乏氧分子探针2 (图 2),用于体外和体内NTR的有效光学检测。在NTR的催化下,探针2分子中的吸电子硝基转变为供电子氨基。此外,探针2具有出色的灵敏度和选择性,其中探针分子中O-C键断裂确保了其选择性的荧光增强。探针2已成功用于秀丽隐杆线虫(Caenorhabditis elegans)、Hi5细胞以及活体肿瘤模型的乏氧检测,证明探针2在肿瘤乏氧可视化中具有较好的应用潜力。该研究有利于揭示肿瘤乏氧与NTR之间的相互关系。
黄微等[20]利用亲水性穿膜肽构建了新型肿瘤乏氧分子探针3 (图 2),环状精氨酸-甘氨酸-天冬氨酸(cRGD肽)的引入能使探针被整合素过表达的肺癌细胞高选择性大量摄取,为其他肿瘤靶向分子探针的设计开发提供了新的思路,为肿瘤早期诊断提供了新的策略。最近,Wang等[21]开发了一种小分子NTR探针4 (图 2)。探针4的合成步骤简单,合成产率较高,可用于A549细胞中NTR的定性和定量检测。此外,探针4还可以解析NTR浓度与乏氧程度之间的关系,Wang等[21]研究表明高压氧辅助化疗可显著降低NTR浓度,是目前第一个用于高压氧辅助化疗期间的荧光分子探针工具。
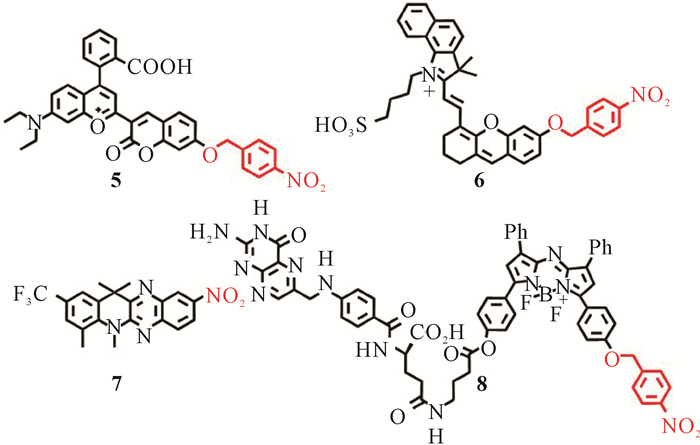
Liu课题组设计合成了一种多功能荧光团,它具有更大的π偶联结构,这使得其吸收和荧光发射波长红移[22]。该荧光团可以通过在母体中引入硝基苄基吸电子基团进一步构筑乏氧分子探针5 (图 3),探针5可以通过电子转移过程淬灭其荧光发射。在与NTR反应后,探针5中的硝基被还原,然后通过重排和消除反应释放荧光团,从而增强探针的荧光信号。因此,探针5可用于细胞和活体水平的乏氧可视化成像研究。
王海艳[23]以硝基为荧光猝灭团,以半花菁染料为母体,设计合成了乏氧分子探针6 (图 3),探针6拥有宽线性响应范围(0.002-1.000 μg/mL)、低检出限(1.0 ng/mL)和高选择性,但探针6以半花菁染料为母体,其合成产率相对偏低,对后续推广应用限制较大。下一步的工作将以提高半花菁染料产率为核心来进一步实现探针6的实际转化应用。
Ji课题组合成了用于NTR检测的四环喹喔啉骨架探针7 (图 3)[24]。探针7对NTR表现出很好的敏感性和选择性。与NTR一起孵育后,探针7可以发生硝基还原反应,然后生成氨基化合物,实现显著的荧光增强和较大的斯托克斯位移。此外,探针7还能对乏氧条件下Hela细胞内的NTR酶活性进行实时监测,是一种非常有潜力的NTR酶活性监测分子工具。
2021年,Hong课题组基于量子化学计算设计了一种癌细胞选择性和乏氧响应探针8 (图 3)[25]。相对于缺乏叶酸或硝基苄基部分的对照物,探针8能对乏氧提供快速荧光“关闭-开启”反应。体外共聚焦成像、流式分析以及CT26实体瘤小鼠的体内近红外光学成像,为探针更容易被叶酸受体阳性CT26癌细胞摄取的论点提供了支持,并且在乏氧条件下能提供优于对照的荧光“关闭-开启”信号。基于这些研究结果,Hong课题组认为探针8可以作为一种肿瘤靶向型乏氧激活探针,在体外和活体内直接监测癌症的发生和发展[25]。
本课题组在经典的含氧半花菁染料分子中,基于能量平衡策略巧妙地调控了辐射跃迁和非辐射跃迁之间的能量分布,构建了近红外荧光/光声双比率型半花菁染料分子骨架[26]。硫原子的引入使得该半花菁类染料展现出近红外荧光/光声双比率性能。基于这种新型含硫半花菁染料分子骨架,本课题组设计合成了第一例近红外荧光/光声双比率型NTR探针9(图 4),这使得肿瘤的乏氧深度精准定量可视化成为可能。
2 基于偶氮还原酶的乏氧分子探针
偶氮还原酶是在一系列原核生物和真核生物中表达的还原型黄素酶,常指黄素单核苷酶[27]。偶氮还原酶可以还原偶氮化合物,这种还原过程高度依赖于乏氧的程度。因此,除了芳香族硝基化合物之外,偶氮衍生物也可以是另一种潜在的乏氧感应单元。偶氮衍生物对光具有明显的敏感性,在药物递送和生物检测中可以作为酶的独特响应候选物[28]。在光激发后,偶氮衍生物中偶氮键超快的构象变化使其本身荧光猝灭[29]。因此大多数偶氮衍生物通常是非荧光的,常用作荧光团的猝灭剂,但可以通过偶氮还原酶还原裂解偶氮键为氨基[30],使其荧光恢复。
2010年,日本科学家Kiyose等[31]报道了近红外乏氧分子探针10 (图 5)。在常氧状态下,探针10的偶氮键不会被还原,其荧光被淬灭;在乏氧环境下,偶氮被还原后吸收减弱,荧光共振能量转移效率下降,引发探针较大的荧光增强。探针10可用于乏氧细胞的荧光成像、活小鼠肝脏和肾脏缺血实时监测。但该淬灭剂不易进行进一步的化学修饰,限制了探针10的生物应用。
Qian课题组报道了一种“开启”型乏氧荧光探针11 (图 5)[32]。由于罗丹明B对偶氮-萘二甲酰亚胺单元具有荧光共振能量转移效应,所以探针11本身的荧光非常微弱。在乏氧条件下,由于淬灭结构的崩解,偶氮键消失,探针11在581 nm处的荧光逐渐增强。循环伏安还原电位和产物质谱验证结果表明,探针11可以快速被还原。共聚焦荧光成像显示,探针11在乏氧细胞和常氧细胞之间的荧光强度差异可达9倍,表明该探针在乏氧肿瘤细胞检测中有很大的应用价值。
2019年,Tan课题组合成了含有偶氮的乏氧激活型荧光探针12 (图 5)[33]。探针12在乏氧状态下的荧光强度较常氧状态下增加了约11倍。进一步的抑制剂实验结果表明,偶氮还原酶并不是唯一可以参与偶氮键还原过程的生物还原酶。探针12在肿瘤细胞的不同乏氧状态中表现出较高的氧敏感性,可作为体内乏氧检测的潜在分子工具。
Wu课题组开发了一种可以特异性响应肿瘤乏氧的荧光和光声双模态探针13 (图 5)[34]。偶氮基团在乏氧条件下被裂解,释放出活性药物,同时探针13在710 nm附近显示出强烈的荧光。活化的荧光团可用于荧光和光声双模态检测、肿瘤乏氧成像,释放的药物可以高效抑制荷瘤小鼠模型中的肿瘤。这项工作不仅可以为肿瘤乏氧提供荧光和光声双模态成像,还可以实现肿瘤的有效抑制。因此,该诊疗一体化探针的构建可以为发展其他肿瘤生物标志物探针和肿瘤治疗提供一定的参考。
Zhou课题组基于偶氮键设计开发了新型肿瘤诊疗探针14 (图 6)[35]。在偶氮还原酶的作用下,探针14在620 nm处呈现红色荧光发射,同时释放抗肿瘤药物,从而达到乏氧成像和肿瘤治疗的综合效果。此外,探针14在裸鼠肿瘤抑制实验中成功地抑制了实体瘤的生长。探针14作为一种新的荧光工具,可以快速确定肿瘤的位置和边缘,在临床癌症治疗中显示出较大的潜力。
Ribagorda课题组报道了基于BODIPY荧光团与偶氮基团结合的乏氧分子探针15 (图 6)[36]。探针15可以在还原条件下(包括细菌和人源偶氮还原酶)逐渐开启其荧光发射特性。使用固定化的细菌偶氮还原酶可以有效评估偶氮乏氧分子探针15的传感性能。荧光显微镜成像实验结果表明,偶氮乏氧分子探针15可用于可视化活细胞内的乏氧微环境。
3 基于氢醌还原酶的乏氧分子探针hNQO1是一种同源二聚体黄素酶,可促进各种醌衍生物还原为对苯二酚形式。目前已知hNQO1对细胞氧化损伤具有一定的抗氧化修复作用,但是hNQO1过表达也会导致代谢紊乱和癌症发生。与正常组织相比,在许多癌症组织中可以观察到更高水平的hNQO1。醌基是乏氧敏感基团,作为有效的乏氧识别单元之一,近几年来逐渐被引入乏氧分子探针的构建和设计当中。
2013年,McCarley课题组基于萘酰亚胺衍生物与醌基底物共价结合合成了一种乏氧分子探针16(图 7)[37]。荧光发光抑制是通过萘酰亚胺报告基团和共价连接的醌基酶底物之间独特的光诱导电子转移来实现的,通过快速去除醌淬灭剂可以恢复染料的荧光。该探针可通过肉眼、流式、光学成像快速区分hNQO1阴性和阳性细胞系,也能够快速识别不同类型的肿瘤细胞,展示了其灵敏度和选择性都较高的突出特点。2015年,该课题组在上述荧光探针16的基础上,又发展了一种用于检测hNQO1的探针17 (图 7)[38]。探针17与hNQO1响应后的荧光亮度提高了136倍。此外,探针17在10 min内即可将hNQO1阳性细胞与阴性细胞区分开,展示了探针17可用于快速和实时分析的潜力。2016年,McCarley课题组基于半萘酚罗丹明荧光团继续开发了一种能够检测hNQO1的探针18 (图 7)[39]。将探针18分别与hNQO1阳性和hNQO1阴性肺癌细胞系(HT29)共孵育,结果仅在hNQO1阳性HT29细胞系中呈现出明亮的红色荧光。可见,该探针及其衍生物在荧光引导手术成像和癌组织切除术等方面具有一定的应用前景。
大多数报道的荧光探针容易受到内源性荧光物质干扰,且穿透深度不足。针对这些问题,Jiang课题组最近设计了双光子hNQO1探针19 (图 7)[40]。在hNQO1作用下,探针19底物部分被催化还原,荧光团释放出来,502 nm处的绿色荧光逐渐增强。探针19在单双光子激发下与hNQO1反应前后荧光增强均超过25倍,斯托克斯位移增加超过100 nm。同时,细胞和组织实验结果表明,探针19可对内源性hNQO1进行成像,且选择性和灵敏度高,具有极好的组织穿透和染色能力。因此,该探针在癌症诊断和成像引导手术中具有很大的应用潜力。
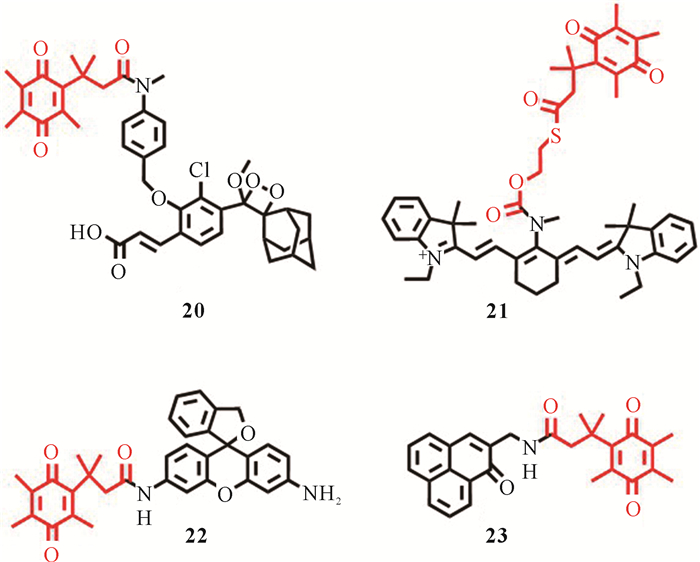
Son等[41]设计了新型乏氧化学发光分子探针20(图 8),该探针可以区分不同癌症亚型。探针20包含二氧杂环丁烷部分和醌基响应部分。将醌基部分还原为相应的对苯二酚形式会产生化学发光信号。从体外细胞培养分析和体内小鼠成像研究的组合推断,该探针是安全的,几乎没有毒性,并且能够在hNQO1阳性A549肺癌模型中产生“开启”化学发光反应,可用于识别以hNQO1水平升高为特征的癌细胞和肿瘤组织。
Kobayashi课题组报道了一种检测腹膜卵巢癌转移(Peritoneal Ovarian Cancer Metastases,POCM)的乏氧分子探针21(图 8)[42]。探针21在hNQO1作用下展示出强烈的近红外荧光信号,且对腹膜卵巢癌转移表现出非常高的灵敏度和特异性。同时,研究表明SHIN3肿瘤组织在喷洒探针21后荧光强度显著增加。由于近红外光具有更深的组织穿透能力和更小的自发荧光背景干扰能力,这种新方法有可能识别组织深处的微小病变,表明该探针在POCM的研究上具有潜在的应用价值。
Best等[43]报道了一种用于检测癌症相关酶hNQO1的探针22 (图 8)。细胞荧光成像实验表明,该探针在hNQO1阳性细胞系和hNQO1阴性细胞系中荧光差异明显,在hNQO1阳性细胞系中荧光强度随着hNQO1活性水平的增加而逐渐增加,而在hNQO1阴性细胞系中荧光很微弱,几乎没有变化。该探针具有极高的荧光开启能力,被用于hNQO1高表达的结直肠癌细胞和卵巢癌细胞的荧光成像,在成像引导手术切除病变组织中具有较好的应用价值。
最近,Beharry课题组通过酰胺键将醌基底物共价连接到荧光母体合成了乏氧荧光探针23(图 8)[44]。通过荧光监测反应证明,在hNQO1作用下探针23在500 nm处的荧光强度增加了5.5倍。在A549细胞和H596细胞的荧光共聚焦实验中,hNQO1高表达的A549细胞中绿色荧光明显更亮。另外探针23的荧光团可以产生单线态氧,可见该探针在癌症诊疗方面具有很大的应用前景。
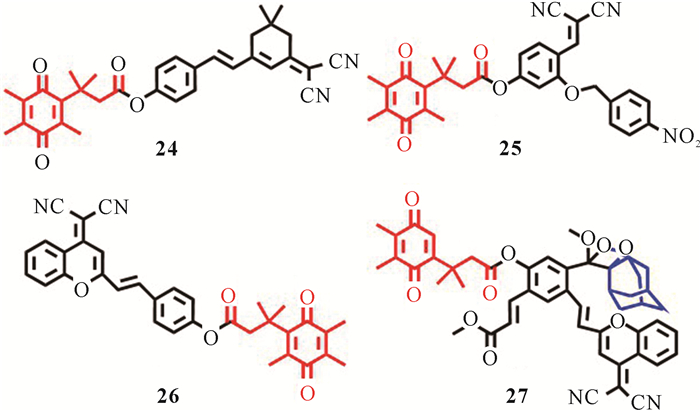
Punganuru等[45]将二氰基异佛尔酮与醌丙酸偶联制备得到hNQO1探针24 (图 9),该探针能够在体外和体内的模型中监测hNQO1活性。在被肿瘤特异性hNQO1激活之前探针保持非荧光状态。探针24在响应后展示出较大的斯托克斯位移、良好的生物相容性和对hNQO1的高选择性,可以有效区分癌细胞和健康细胞。研究人员也成功地利用该探针在体外监测脑肿瘤细胞和裸鼠异种移植肿瘤中的内源性hNQO1活性。
Tang课题组基于共价组装策略,通过在单个分子中引入对硝基苯和三甲基锁醌丙酸基团,构建了双酶响应型探针25 (图 9)[46]。该探针仅在NTR和hNQO1共同存在的情况下才能被激活,原位生成荧光染料,产生较大的荧光响应,从而达到检测活细胞中的内源性NTR和hNQO1活性的目的。共聚焦成像实验表明,探针25能将癌细胞与正常肝HL-7702细胞区分开来,因为癌细胞中存在相对较高水平的内源性生物还原酶。然而探针25相对较短的发射波长限制了其进一步的临床应用。
2022年,Zhao课题组报道了一种用于检测hNQO1的双光子探针26 (图 9)[47]。将探针26与HeLa、LoVo两种细胞进行孵育,均显示出显著的荧光信号增强现象。将探针26注射到HeLa异种移植荷瘤裸鼠的肿瘤组织中,通过体内荧光成像检测hNQO1活性,0.5 h后肿瘤组织内能检测到强的荧光信号,表明探针26可用于肿瘤内源性hNQO1活性测定。
近期,Song课题组报道了一种用于检测异种移植A549肿瘤中异常表达的hNQO1化学发光探针27 (图 9)[48]。探针27不仅能在鸡胸肉组织中(15 mm深度)实现高信噪比成像检测,而且还能灵敏地检测到A549细胞中过表达的hNQO1。研究表明探针27已成功用于可视化皮下异种移植肿瘤中异常表达的hNQO1。这是第一例报道的通过近红外区域化学发光模式检测hNQO1活性的工作。
4 展望本文系统总结了酶反应型肿瘤乏氧分子探针的设计策略、开发及肿瘤诊疗应用。值得欣慰的是,在这个研究领域目前已经取得了许多实质性的进展,使得使用现代光学成像技术对肿瘤乏氧微环境进行无创成像成为可能。例如,为了提高肿瘤识别的准确性,研究人员巧妙地构建了具有多模式信号输出或多靶点级联响应的乏氧分子探针。基于特定的生物还原酶,使用分子探针可以点亮转移性肿瘤的小病变,为准确手术切除提供导航,有效降低复发风险。
虽然近年来用于肿瘤乏氧酶反应型分子探针有了长足的发展,然而大多数尝试仍处于概念验证阶段。在将这些概念从实验室成功转化为临床技术之前,该领域的研究人员仍面临着巨大的挑战,未来仍有许多问题需要解决。(1)近红外荧光团主要集中在近红外一区(650-900 nm)。相比之下,近红外二区(1 000-1 700 nm)的荧光团具有更优异的光学特性,如更深的组织穿透性和更高的信噪比,这将更好地服务于诊断和医疗领域。然而,使用近红外二区荧光团构建肿瘤乏氧分子探针的报道很少,这在很大程度上限制了肿瘤发生、进展和增殖的原位研究。(2)在分子水平上肿瘤发生是由复杂的分子调控和多种酶的过表达引起的。不幸的是,迄今为止开发的大多数肿瘤乏氧分子探针都无法区分肿瘤细胞类型。因此,基于级联反应的多靶点酶激活荧光探针将为体内特定癌细胞和肿瘤的鉴定提供策略。(3)针对特定酶的反应基团和相关传感机制的类型有限。特别的是,分子探针很难选择性地识别同一还原酶家族的不同亚型。研究表明,通过分子对接开发新的识别位点将有利于构建高选择性的肿瘤乏氧分子探针。(4)由于组织穿透深度不足,使用单一成像模式从体内获得的有效信息受到限制。酶响应型多模式探针具有成像模式互补的优势,将成为肿瘤诊断和治疗的强有力的分子工具。(5)肿瘤乏氧反应型分子探针的应用比较简单,大多仅用于细胞和小鼠成像。虽然一些探针已经用于肿瘤切除,但这只是冰山一角。因此,为了使更多的分子探针获得批准并在临床使用,生物学家、化学家和外科医生需要跨学科密切合作,以加速这些探针在医学诊断和癌症治疗中的实际应用。希望本文总结的原理和展望可为肿瘤乏氧分子探针的未来发展提供有益的见解,并为肿瘤的临床诊断和治疗提供新的应用方向。
| [1] |
WALSH J C, LEBEDEV A, ATEN E, et al. The clinical importance of assessing tumor hypoxia: relationship of tumor hypoxia to prognosis and therapeutic opportunities[J]. Antioxidants & Redox Signaling, 2014, 21(10): 1516-1554. |
| [2] |
LIU Z R, TANG Y H, XU A, et al. A new fluorescent probe with a large turn-on signal for imaging nitroreductase in tumor cells and tissues by two-photon microscopy[J]. Biosensors and Bioelectronics, 2017, 89(2): 853-858. |
| [3] |
HORSMAN M R, VAUPEL P. Pathophysiological basis for the formation of the tumor microenvironment[J]. Frontiers in Oncology, 2016, 6: 66. |
| [4] |
AI S F, DONG W H, LI J, et al. Hypoxia-responsive molecular probe lighted up by peptide self-assembly for cancer cell imaging[J]. Journal of Biomedical Nanotechnology, 2022, 18(9): 1019-1027. |
| [5] |
KLOCKOW J L, HETTIE K S, LAGORY E L, et al. An activatable NIR fluorescent rosol for selectively imaging nitroreductase activity[J]. Sensors and Actuators B: Chemical, 2020, 306: 127446. DOI:10.1016/j.snb.2019.127446 |
| [6] |
田昕伟, 李照, 杨兴斌, 等. 肿瘤缺氧荧光探针的研究进展[J]. 中国科学: 化学, 2018, 48(7): 712-730. |
| [7] |
SIDHU J S, KAUR N, SINGH N. Trends in small organic fluorescent scaffolds for detection of oxidoreductase[J]. Biosensors and Bioelectronics, 2021, 191: 113441. DOI:10.1016/j.bios.2021.113441 |
| [8] |
万琼琼, 李照, 马会民. 硝基还原酶荧光探针的研究进展[J]. 分析科学学报, 2014, 30(5): 755-760. DOI:10.13526/j.issn.1006-6144.2014.05.029 |
| [9] |
HAYNES C A, KODER R L, MILLER A F, et al. Structures of nitroreductase in three states[J]. Journal of Biological Chemistry, 2002, 277(13): 11513-11520. DOI:10.1074/jbc.M111334200 |
| [10] |
BRYANT D W, MCCALLA D R, LEEKSMA M, et al. Type Ⅰ nitroreductases of Escherichia coli[J]. Canadian Journal of Microbiology, 2011, 27(1): 81-86. |
| [11] |
CELLIER M, FABREGA O J, FAZACKERLEY E, et al. 2-Arylbenzothiazole, benzoxazole and benzimidazole derivatives as fluorogenic substrates for the detection of nitroreductase and aminopeptidase activity in clinically important bacteria[J]. Bioorganic & Medicinal Chemistry, 2011, 19(9): 2903-2910. |
| [12] |
CUI L, ZHONG Y, ZHU W P, et al. Selective and sensitive detection and quantification of arylamine N-acetyltransferase 2 by a ratiometric fluorescence probe[J]. Chemical Communications, 2010, 46(38): 7121-7123. DOI:10.1039/c0cc01000f |
| [13] |
JIN C, ZHANG Q, LU W. Selective turn-on near-infrared fluorescence probe for hypoxic tumor cell imaging[J]. RSC Advances, 2017, 7(30): 18217-18223. DOI:10.1039/C7RA01466J |
| [14] |
OLIVE P L. Cellular metabolism of fluorescent nitroheterocycles[J]. International Journal of Radiation Oncology Biology Physics, 1984, 10(8): 1357-1360. DOI:10.1016/0360-3016(84)90348-1 |
| [15] |
HODGKISS R J. Use of 2-nitroimidazoles as bioreductive markers for tumour hypoxia[J]. Anti-Cancer Drug Design, 1998, 13(6): 687-702. |
| [16] |
HODGKISS R J, JONES G, LONG A, et al. Flow cytometric evaluation of hypoxic cells in solid experimental tumors using fluorescence immunodetection[J]. British Journal of Cancer, 1991, 63(1): 119-125. DOI:10.1038/bjc.1991.24 |
| [17] |
HODGKISS R J, JONES G W, LONG A, et al. Fluorescent markers for hypoxic cells: a study of nitroaromatic compounds, with fluorescent heterocyclic side chains, that undergo bioreductive binding[J]. Journal of Medicinal Chemistry, 1991, 34(7): 2268-2274. DOI:10.1021/jm00111a049 |
| [18] |
XUE C, LEI Y J, ZHANG S C, et al. A cyanine-derived "turn-on" fluorescent probe for imaging nitroreductase in hypoxic tumor cells[J]. Analytical Methods, 2015, 7(24): 10125-10128. DOI:10.1039/C5AY02312B |
| [19] |
YANG D, TIAN H Y, ZANG T N, et al. Hypoxia imaging in cells and tumor tissues using a highly selective fluorescent nitroreductase probe[J]. Scientific Reports, 2017, 7(1): 9174. DOI:10.1038/s41598-017-09525-2 |
| [20] |
黄微, 吴君臣. 一种硝基还原酶探针的合成与研究[J]. 中国科技论文, 2018, 13(6): 649-654. DOI:10.3969/j.issn.2095-2783.2018.06.008 |
| [21] |
WANG Y, ZHANG L, HUANG Y, et al. Rational design of a nitroreductase-activatable two-photon fluorescent probe for hypoxia imaging in cell and in vivo[J]. Sensors and Actuators B: Chemical, 2020, 310: 127755. DOI:10.1016/j.snb.2020.127755 |
| [22] |
ZHENG A X, SUN H Y, DU Y L, et al. A novel long-wavelength off-on fluorescence probe for nitroreductase analysis and hypoxia imaging[J]. Analytica Chimica Acta, 2021, 1144: 76-84. DOI:10.1016/j.aca.2020.12.002 |
| [23] |
王海艳. 硝基还原酶荧光探针的合成及其成像分析应用[D]. 西安: 陕西师范大学, 2021.
|
| [24] |
JIA C L, ZHANG Y, WANG Y S, et al. A fast-responsive fluorescent turn-on probe for nitroreductase imaging in living cells[J]. RSC Advances, 2021, 11(15): 8516-8520. DOI:10.1039/D0RA09512E |
| [25] |
KARAN S, CHO M Y, LEE H, et al. Near-infrared fluorescent probe activated by nitroreductase for in vitro and in vivo hypoxic tumor detection[J]. Journal of Medicinal Chemistry, 2021, 64(6): 2971-2981. DOI:10.1021/acs.jmedchem.0c02162 |
| [26] |
ZHANG S P, CHEN H, WANG L P, et al. A general approach to design dual ratiometric fluorescent and photoacoustic probes for quantitatively visualizing tumor hypoxia levels in vivo[J]. Angewandte Chemie International Edition, 2022, 61: e202107076. DOI:10.1002/anie.202107076 |
| [27] |
RYAN A. Azoreductases in drug metabolism[J]. British Journal of Pharmacology, 2017, 174(14): 2161-2173. DOI:10.1111/bph.13571 |
| [28] |
WANG Y Q, YU J W, WANG Z, et al. Real-time nearinfrared fluorescence reporting the azoreductase-triggered drug release[J]. Polymer Chemistry, 2020, 11(3): 734-743. DOI:10.1039/C9PY01365B |
| [29] |
SHIN N, HANAOKA K, PIAO W, et al. Development of an azoreductase-based reporter system with synthetic fluorogenic substrates[J]. ACS Chemical Biology, 2017, 12(2): 558-563. DOI:10.1021/acschembio.6b00852 |
| [30] |
WANG S Y, WANG Y Q, SUN Y, et al. A novel BODIPY-based reductant-sensitive near-infrared fluorescent probe for real-time reporting azoreductase-triggered release[J]. Reactive and Functional Polymers, 2021, 165: 104951. DOI:10.1016/j.reactfunctpolym.2021.104951 |
| [31] |
KIYOSE K, HANAOKA K, OUSHIKI D, et al. Hypoxia-sensitive fluorescent probes for in vivo real-time fluorescence imaging of acute ischemia[J]. Journal of the American Chemical Society, 2010, 132(45): 15846-15848. DOI:10.1021/ja105937q |
| [32] |
CAI Q, YU T, ZHU W P, et al. A turn-on fluorescent probe for tumor hypoxia imaging in living cells[J]. Chemical Communications, 2015, 51(79): 14739-14741. DOI:10.1039/C5CC05518K |
| [33] |
WANG C Y, ZHANG S P, HUANG J H, et al. Novel designed azo substituted semi-cyanine fluorescent probe for cytochrome P450 reductase detection and hypoxia imaging in cancer cells[J]. RSC Advances, 2019, 9(37): 21572-21577. DOI:10.1039/C9RA02741F |
| [34] |
HUANG J, WU Y L, ZENG F, et al. An activatable near-infrared chromophore for multispectral optoacoustic imaging of tumor hypoxia and for tumor inhibition[J]. Theranostics, 2019, 9(24): 7313-7324. DOI:10.7150/thno.36755 |
| [35] |
LU Y X, XU J J, JIA Z Y, et al. A near-infrared multifunctional fluorescent probe for hypoxia monitoring and tumor-targeted therapy[J]. Chinese Chemical Letters, 2022, 33(3): 1589-1594. DOI:10.1016/j.cclet.2021.09.013 |
| [36] |
CEINOS S G, RIVERO A R, GELLA F R, et al. Turn-on fluorescent biosensors for imaging hypoxia-like conditions in living cells[J]. Journal of the American Chemical Society, 2022, 144(18): 8185-8193. DOI:10.1021/jacs.2c01197 |
| [37] |
SILVERS W C, PRASAI B, BURK D H, et al. Profluorogenic reductase substrate for rapid, selective, and sensitive visualization and detection of human cancer cells that overexpress NQO1[J]. Journal of the American Chemical Society, 2013, 135(1): 309-314. DOI:10.1021/ja309346f |
| [38] |
PRASAI B, SILVERS W C, MCCARLEY R L. Oxidoreductase-facilitated visualization and detection of human cancer cells[J]. Analytical Chemistry, 2015, 87(12): 6411-6418. DOI:10.1021/acs.analchem.5b01615 |
| [39] |
BEST Q A, JOHNSON A E, PRASAI B, et al. Environmentally robust rhodamine reporters for probe-based cellular detection of the cancer-linked oxidoreductase hNQO1[J]. ACS Chemical Biology, 2016, 11(1): 231-240. DOI:10.1021/acschembio.5b00792 |
| [40] |
PAN D, LUO F Y, LIU X J, et al. A novel two-photon fluorescent probe with a long Stokes shift and a high signal-to-background ratio for human NAD(P)H: quinone oxidoreductase 1 (hNQO1) detection and imaging in living cells and tissues[J]. Analyst, 2017, 142(14): 2624-2630. DOI:10.1039/C7AN00575J |
| [41] |
SON S B, WON M, GREEN O, et al. Chemiluminescent probe for the in vitro and in vivo imaging of cancers over-expressing NQO1[J]. Angewandte Chemie International Edition, 2019, 58(6): 1739-1743. DOI:10.1002/anie.201813032 |
| [42] |
NAKAMURA Y K, SHEN Z H, HARADA T, et al. Characteristics of ovarian cancer detection by a near-infrared fluorescent probe activated by human NAD(P)H: quinone oxidoreductase isozyme 1 (hNQO1)[J]. Oncotarget, 2017, 8(37): 61181-61192. DOI:10.18632/oncotarget.18044 |
| [43] |
BEST Q A, PRASAI B, ROUILLERE A, et al. Efficacious fluorescence turn-on probe for high-contrast imaging of human cells overexpressing quinone reductase activity[J]. Chemical Communications, 2017, 53(4): 783-786. DOI:10.1039/C6CC08306D |
| [44] |
DIGBY E M, SADOVSKI O, BEHARRY A A. An activatable photosensitizer targeting human NAD(P)H: quinone oxidoreductase 1[J]. Chemistry A European Journal, 2020, 26(12): 2713-2718. DOI:10.1002/chem.201904607 |
| [45] |
PUNGANURU S R, MADALA H R, ARUTLA V, et al. Cancer-specific biomarker hNQO1-activatable fluorescent probe for imaging cancer cells in vitro and in vivo[J]. Cancers, 2018, 10(12): 470. DOI:10.3390/cancers10120470 |
| [46] |
KONG F P, LI Y, YANG C, et al. A fluorescent probe for simultaneously sensing NTR and hNQO1 and distinguishing cancer cells[J]. Journal of Materials Chemistry B, 2019, 7(43): 6822-6827. DOI:10.1039/C9TB01581G |
| [47] |
WU W J, LI X, ZHAO L Y, et al. Design and synthesis of a deep tissue penetrating near-infrared two-photon fluorescence probe for the specific detection of NQO1[J]. Chemical Communications, 2022, 58(37): 5634-5637. DOI:10.1039/D2CC01654K |
| [48] |
LIU J Y, CHEN Z X, HUO H Q, et al. An activatable near-infrared molecular chemiluminescence probe for visualization of NQO1 activity in vivo[J]. Chinese Journal of Chemistry, 2022, 40(20): 2400-2406. DOI:10.1002/cjoc.202200300 |