根据全球癌症数据资料统计, 原发性肝癌已经成为全球第三大癌症相关死亡原因,仅位于肺癌和结直肠癌之后, 且其发病率在发展中国家尤甚,年新增病例达到906 000例, 死亡830 000例[1]。作为肝癌的主要治疗手段之一, 放射治疗(RT)在肝癌的治疗中发挥着不可或缺的作用[2]。自噬是一条与溶酶体相关的保守通路, 在细胞质内受损蛋白质、大分子、细胞器的降解过程中发挥着不可或缺的作用[3]。癌症中的自噬已被证明既可以作为肿瘤抑制因子, 也可以作为促进剂, 而抑制自噬通常可以增加放射治疗的敏感性。近年来的研究发现, 罂粟碱(Papaverine, PPV)——一种从罂粟中分离得到的生物碱, 在包括乳腺癌、前列腺癌、结直肠癌等多种肿瘤中都显示了其选择性的抑制作用[4-7]。但目前罂粟碱与自噬在肝癌细胞中的作用以及具体机制尚未完全清晰。故本研究拟探讨罂粟碱和自噬对肝癌细胞增殖、迁移能力及其放射敏感性的影响及内在分子作用机制, 为提高肝癌放射治疗效果提供新方式和新思路。
1 材料与方法 1.1 试剂和仪器人肝癌细胞HepG2和Huh7购自中南大学湘雅医学院。盐酸罂粟碱购自中国食品药品检定研究院。微管相关蛋白轻链3 (LC3B)抗体、选择性自噬接头蛋白1(SQSTM1/p62)抗体购自美国Abcam公司; 磷脂酰肌醇3-激酶(PI3K)抗体、磷酸化磷脂酰肌醇3-激酶(p-PI3K)抗体、AKT抗体、p-AKT抗体、哺乳动物雷帕霉素靶蛋白(mTOR)抗体、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)购自美国Cell Signaling Technology公司; BCA蛋白浓度测定试剂盒、RIPA裂解液、山羊抗兔lgG(H+L)和驴抗兔lgG(H+L)均购自上海碧云天生物技术有限公司; β-actin购自美国Santa Cruz公司; DMEM高糖培养基(10566016)、FBS(A3161001)购自美国GIBCO公司; 青霉素和链霉素混合液、PBS缓冲液购自北京索莱宝科技有限公司; ECL化学发光试剂盒(34577)购自美国Thermo Scientific公司。LC3B、ATG7引物购自生工生物工程(上海)股份有限公司。逆转录酶、TB Green © Premix Ex TaqTMⅡ(Tli RNaseH Plus)购自日本TaKaRa公司。X射线辐射装置购自瑞典Elekta公司。酶标仪购自Bio-Tek公司,CCK8试剂购自日本同仁公司。细胞计数仪购自美国Thermo Scientific公司。微量核酸蛋白浓度测定仪购自美国Thermo Scientific公司。
1.2 细胞培养与分组在肝癌细胞HepG2和Huh7培养瓶中加入含有1%双抗和10%血清的DMEM高糖培养基(完全培养基),在含有5% CO2的37 ℃恒温培养箱中培养。显微镜下每日观察细胞的生长情况,当细胞密度达到培养瓶面积70%左右时,添加0.25%的胰酶-EDTA消化1-3 min后以1∶3的比例进行传代。
将处于对数生长期的HepG2和Huh7细胞随机分为阴性对照(NC)组、罂粟碱(PPV)组、X射线照射(IR)组。阴性对照组为完全培养基,药物浓度为0 μmol/L,照射组照射视野为40 cm×40 cm。处理后的细胞放置于37 ℃的恒温箱中培养24 h,经胰酶消化后用巴氏吸管收集细胞用于后续研究。
1.3 CCK8实验取处于对数生长期的细胞,加入完全培养基重悬细胞后取100 μL/孔(每孔约2 000个细胞)均匀接种于6个96孔板中,置于37 ℃恒温培养箱中继续培养24 h后弃上清液。取一个96孔板加入含不同浓度罂粟碱(0、2、4、6、8、10、12、14、16、20 μmol/L)的完全培养基100 μL,置于37 ℃恒温培养箱中培养,分别在培养24、48、72 h后于每孔加10 μL的CCK8溶液,避免出现气泡,避光置于37 ℃恒温培养箱中孵育2 h后用酶标仪检测细胞的吸光度(OD450)。另取5个96孔板,每个板设对照组和8 μmol/L罂粟碱组,即分别加入100 μL完全培养基和含8 μmol/L罂粟碱的完全培养基,然后将5个96孔板分别按0、2、4、6、8 Gy的剂量用X射线照射,置于37 ℃恒温培养箱培养24 h后,同上述实验加入CCK8溶液后测量吸光度。每组实验重复3次。根据公式计算细胞存活率: 细胞存活率(%)=(实验组OD450/对照组OD450)×100%。
1.4 划痕实验取处于对数生长期的细胞,经胰酶消化后用完全培养基重悬至细胞浓度为3×105 cell/mL,取70 μL菌悬液接种于划痕插件小孔中,置于37 ℃恒温培养箱培养24 h后加入8 μmol/L罂粟碱,置于37 ℃恒温培养箱24 h,更换新鲜低血清培养基(即完全培养基中血清浓度调整为2%)。垂直拔掉罂粟碱组与对照组的划痕插件,在37 ℃恒温培养箱中分别孵育0 h和24 h后使用显微镜观察拍照。使用ImageJ软件测定划痕面积。
1.5 克隆形成实验取对数生长期的HepG2和Huh7细胞,用胰酶进行消化,在37 ℃、1 000 r/min的条件下离心5 min后去除上清液,加入1 mL完全培养基重悬形成单细胞悬浮液,使用细胞计数仪计算细胞数目,并将细胞的浓度调节为1×105个/mL。取10块6孔板,用巴氏吸管向每个孔内加入2 mL完全培养基,然后在5块6孔板的孔内分别加入3.5、4.0、6.0、8.0、10.0 μL浓度为1×105个/mL的HepG2细胞悬液,使孔内细胞个数分别为350、400、600、800、1 000个;在另5块6孔板的孔内分别加入6.0、7.0、8.0、10.0、12.0 μL浓度为1×105个/mL的Huh7细胞悬液,使孔内细胞个数分别为600、700、800、1 000、1 200个;每组3个复孔。将细胞置于37 ℃恒温培养箱中培养,待细胞贴壁后弃置旧培养基,NC组加入2 mL完全培养基,PPV组加入2 mL含有8 μmol/L罂粟碱的完全培养基,以不同的照射剂量(0、2、4、6、8 Gy)照射细胞后置于37 ℃培养箱中继续培养12 d。随后,用PBS缓冲液缓慢清洗细胞2次,每孔加入4%多聚甲醛固定30 min, 弃去固定液,加入500 μL结晶紫染色液染色30 min, 用PBS缓冲液清洗细胞后静置使其自然干燥,拍照记录,并在显微镜下统计克隆数大于50的细胞群落数,计算不同照射剂量下细胞的存活分数。细胞生存分数=处理组的克隆形成率/对照组的克隆形成率;克隆形成率=细胞克隆数/细胞接种数。最后,利用单击多靶模型y=1-[1-exp(-k×x)]N拟合剂量-生存曲线, 其中,N指细胞内所含的放射敏感区域数,即靶数,也是表示放射敏感性相关的参数,是存活曲线直线部分的延长线与纵轴相交处的数值;k为曲线的斜率。
1.6 蛋白免疫印迹(Western blot)取对数生长期的细胞经胰酶消化后,在37 ℃、1 000 r/min的条件下离心5 min后去除上清液,使用RIPA裂解液裂解并提取蛋白,使用BCA蛋白浓度测定试剂盒测定蛋白浓度,使用SDS-PAGE (12%)电泳分离蛋白, 然后进行转膜,接着使用TBST清洗PVDF膜5 min,重复3次,再用快速封闭液封闭15 min, 加入LC3B(1∶2 000)、p62(1∶2 000)、AKT/p-AKT (1∶2 000)、PI3K/p-PI3K (1∶2 000)、mTOR/p-mTOR(1∶2 000)、β-actin(1∶1 000)一抗,4 ℃孵育过夜, TBST清洗3次后加入相应二抗,室温孵育1 h后用化学发光试液显色,最后用ImageJ进行定量分析。
1.7 实时定量PCR (RT-PCR)取对数生长期的HepG2和Huh7细胞,使用胰酶消化后离心去除上清液,加入1 mL的Trizol溶液,吸吹混匀至无明显沉淀,冰上静置5 min以充分裂解。往离心管中加入氯仿200 μL,低速振荡15 s,室温静置8 min,4 ℃、12 000 r/min离心10 min,用吸管将最上层液相吸取转移至新的1.5 mL离心管中,加入异丙醇500 μL,颠倒混匀,室温下静置10 min,4 ℃、12 000 r/min离心15 min,弃上清液,沉淀即为RNA沉淀;加入75% DEPC处理乙醇混合液1 mL,温和振荡以悬浮并漂洗沉淀,4 ℃、7 500 r/min离心10 min,去除上清液后置超净台自然干燥;加入30 μL的DEPC处理水溶解RNA,置于冰上;取2 μL RNA溶液在核酸蛋白浓度纯度测定检测仪上检测,记录OD260/OD280数值和RNA浓度。加入逆转录酶将RNA逆转录为cDNA, 加入相应引物和TB Green、无酶水置于PCR扩增仪进行PCR扩增, 获得RT-PCR的扩增曲线和溶解曲线。采用2-△△Ct法分析数据,目的基因表达量均以对应的内参β-actin表达量作为校正标准。
1.8 统计学方法采用SPSS 17.0和GraphPad Prism 8.0进行统计分析作图。采用单因素方差分析或独立性t检验进行数据组间显著性分析,P < 0.05表示有统计学意义。
2 结果与分析 2.1 罂粟碱对肝癌细胞HepG2、Huh7增殖的影响采用CCK8法检测细胞的增殖情况,结果如图 1所示。罂粟碱可以抑制肝癌细胞HepG2、Huh7的增殖,且其抑制作用呈剂量和时间依赖性。在药物浓度为8 μmol/L且处理24 h后,罂粟碱对HepG2和Huh7细胞的抑制率分别为10.72%和16.45%。考虑到罂粟碱对细胞表现出剂量和时间依赖性的抑制作用,且本实验观察的重点在于药物对自噬的作用,后续还会引入照射的因素,会对细胞产生影响,如果药物浓度过大,细胞死亡太多,不利于后续实验的进行,故接下来采用8 μmol/L的药物浓度。

|
| 图 1 罂粟碱对肝癌细胞HepG2、Huh7增殖的抑制效果 Fig. 1 Inhibitory effect of papaverine on the proliferation of hepatoma cells HepG2 and Huh7 |
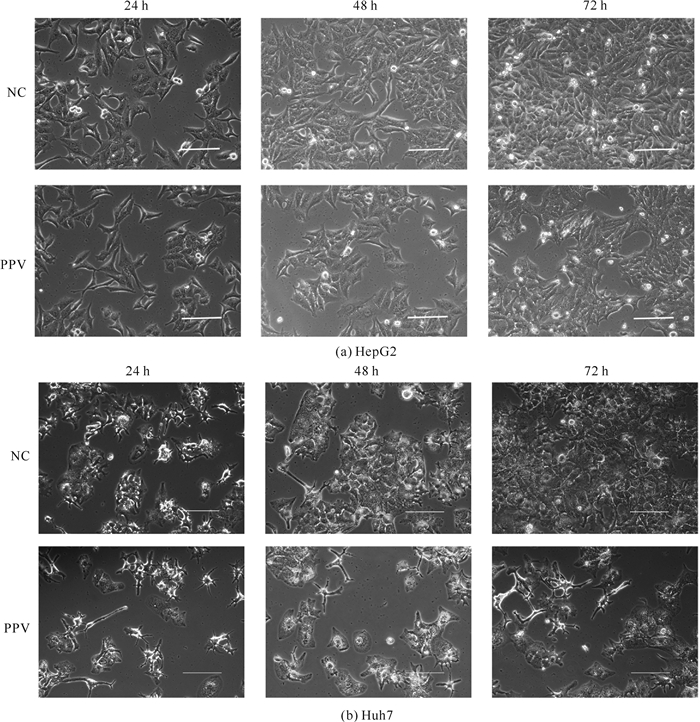
通过光学显微镜观察经罂粟碱处理后的HepG2、Huh7细胞数量、形态。结果显示, 与对照组相比, 罂粟碱组在各个时间点的细胞数量明显减少,但形态未见明显变化(图 2)。这也侧面印证罂粟碱可以抑制HepG2、Huh7细胞的增殖能力。
|
| 图 2 罂粟碱(8 μmol/L)对肝癌细胞HepG2、Huh7数量和形态的影响(标尺=100 μm) Fig. 2 Effect of papaverine (8 μmol/L)on the number and morphology of hepatocellular carcinoma cells HepG2 and Huh7(scale=100 μm) |
2.2 罂粟碱对肝癌细胞HepG2、Huh7迁移能力的影响
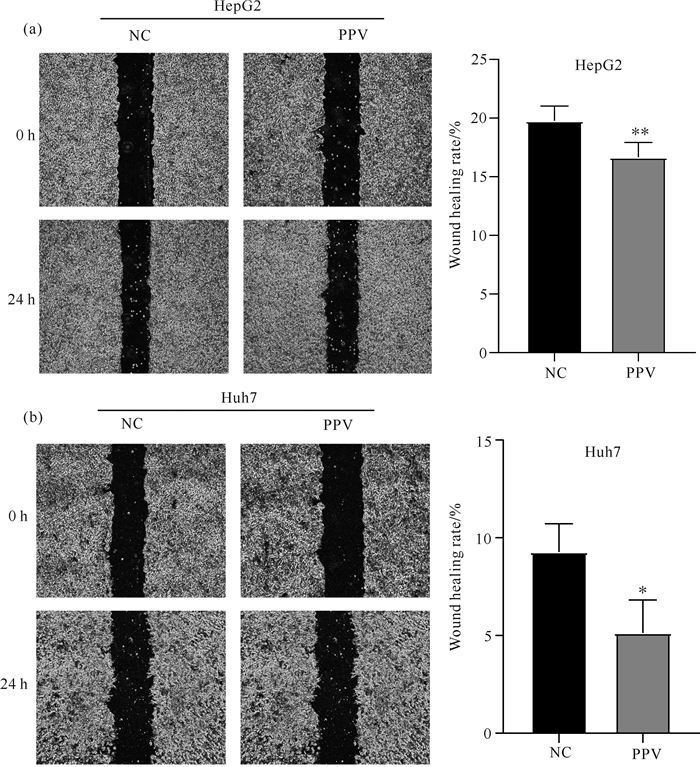
划痕实验结果显示, 对照组的划痕面积明显小于罂粟碱组。尤其是Huh7细胞, 与0 h比较, 24 h对照组的愈合面积达到9.28%, 但8 μmol/L罂粟碱组的愈合面积为仅为5.14%(图 3)。表明罂粟碱可以抑制肝癌细胞HepG2、Huh7的迁移能力。
|
| Compared with control, *P < 0.05, **P < 0.01. 图 3 罂粟碱(8 μmol/L)对肝癌细胞HepG2、Huh7迁移能力的抑制效果 Fig. 3 Inhibitory effect of papaverine (8 μmol/L) on migration of hepatocellular carcinoma cells HepG2 and Huh7 |
2.3 罂粟碱对HepG2、Huh7细胞自噬的影响
为了明确罂粟碱对细胞自噬的影响, 采用RT-PCR检验给药前后HepG2和Huh7细胞内自噬标志物LC3B和ATG7在mRNA表达水平的变化情况。结果显示, 与对照组相比,LC3B和ATG7在mRNA表达水平均显著下降[图 4: (a)(b)]。为了进一步证明以上结果, 采用Western blot实验检测LC3B和p62蛋白表达的变化情况, 结果显示,给药后LC3-Ⅱ/LC3-Ⅰ表达量明显下降, 而p62表达量明显升高[图 4(c)]。上述结果表明罂粟碱处理后HepG2和Huh7细胞自噬水平下调。

|
| Compared with control, **P < 0.01, ***P < 0.001. 图 4 罂粟碱(8 μmol/L)对肝癌细胞HepG2、Huh7自噬的抑制效果 Fig. 4 Inhibitory effect of papaverine (8 μmol/L) on autophagy of hepatocellular carcinoma cells HepG2 and Huh7 |
2.4 罂粟碱对肝癌细胞HepG2、Huh7放射敏感性的影响
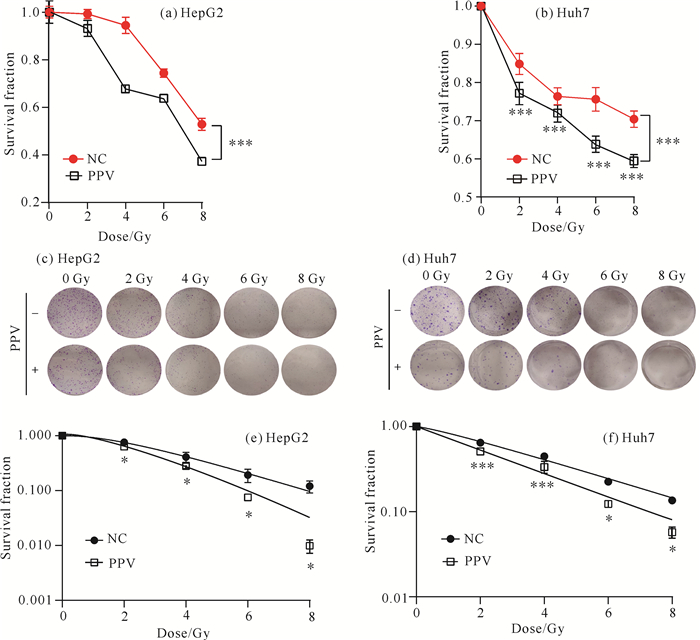
为了研究罂粟碱对肝癌细胞放射敏感性的影响, 进行了CCK8实验。结果表明, 采用不同放射剂量的X射线照射后, 与对照组相比, 罂粟碱组HepG2、Huh7细胞的增殖能力明显受到抑制[图 5: (a)(b)]。进一步采用克隆形成实验验证, 结果表明, 在不同照射剂量下, 罂粟碱组克隆形成的数目均少于对照组[图 5: (c)(d)], 由剂量-存活曲线可以看出, 罂粟碱组细胞的存活分数显著低于对照组[图 5: (e)(f)], 说明罂粟碱可以协同放射治疗发挥抗肿瘤作用。两组的放射生物学参数如表 1所示, 对于HepG2细胞, 罂粟碱组对于对照组的放射增敏比(Sensitization Enhancement Ratio, SER)为D0(NC组)/D0 (PPV组)=1.36;对于Huh7细胞, 两组的SER为1.20。表明与对照组相比,罂粟碱组细胞对放射线更为敏感,罂粟碱具有在体外增加HepG2、Huh7细胞放射敏感性的作用。
|
| Compared with control, * P < 0.05, ***P < 0.001.+ indicates the use of papaverine, that is, the treatment group (PPV), -indicates that papaverine is not used, that is, the control group (NC). 图 5 罂粟碱(8 μmol/L)对肝癌细胞HepG2、Huh7放射敏感性的影响 Fig. 5 Effect of papaverine (8 μmol/L) on radiosensitivity of hepatoma cells HepG2 and Huh7 |
| 组别 Groups |
D0 | Survival fraction (SF2) | |||
| HepG2 | Huh7 | HepG2 | Huh7 | ||
| NC | 2.499±0.307 | 3.769±0.218 | 0.760±0.043 | 0.648±0.013 | |
| PPV | 1.833±0.098 | 3.150±0.045 | 0.63±0.064 | 0.510±0.039 | |
| P | 0.023 0 | 0.008 6 | 0.049 0 | 0.004 3 | |
| Note: D0 refers to the radiation dose required for the linear part of the dose-survival curve to reduce the survival rate from 0.1 to 0.037 or from 0.01 to 0.003 7, D0=1/k.SF2 refers to the survival fraction when the radiation dose is 2 Gy.The data are expressed as mean±standard deviation. | |||||
2.5 罂粟碱对辐射引起的HepG2、Huh7细胞自噬的影响
当使用不同照射剂量时, 细胞存活分数随着放射剂量升高而下降, 照射剂量为8 Gy时HepG2、Huh7细胞存活分数最低, 此时在显微镜下观察发现细胞状态仍然较好[图 5: (a)(b)], 所以接下来采用8 Gy的照射剂量进一步探究罂粟碱对X射线照射后的HepG2、Huh7细胞自噬的影响。结果显示, 在X射线照射之后, 对照组自噬水平有所升高, 说明辐射可以诱导细胞自噬, 而罂粟碱组无论是在mRNA还是蛋白水平, 都提示细胞的自噬水平是下调的(图 6)。以上结果表明, 罂粟碱不仅可以抑制细胞自噬, 还可以下调X射线照射诱导的自噬水平。

|
| Compared with control, *P < 0.05, ***P < 0.001.+ indicates the use of the corresponding measures on the left (irradiation and papaverine) and vice versa, -indicates that it is not used. 图 6 罂粟碱(8 μmol/L)对X射线照射后HepG2、Huh7细胞自噬的抑制作用 Fig. 6 Inhibitory effect of papaverine (8 μmol/L) on autophagy of HepG2 and Huh7 cells after X-ray irradiation |
2.6 罂粟碱对HepG2、Huh7细胞自噬的抑制分析
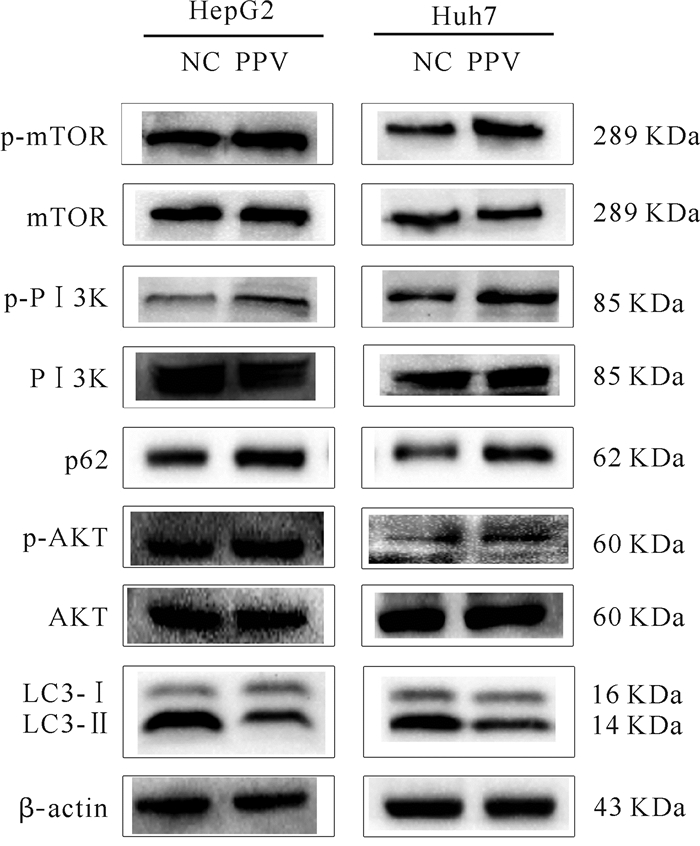
Western-blot结果表明, 与对照组相比, 罂粟碱组LC3-Ⅱ/LC3-Ⅰ明显下降, 而p62明显升高, 说明自噬水平下调;p-PI3K、p-AKT和p-mTOR蛋白表达上调(图 7), 提示罂粟碱通过诱导PI3K/AKT/mTOR信号通路下调自噬。
|
| 图 7 罂粟碱对HepG2、Huh7细胞自噬的作用分析 Fig. 7 Effect of papaverine on autophagy of HepG2 and Huh7 cells |
3 讨论
原发性肝癌在我国常见恶性肿瘤中排第4名,肿瘤相关死亡原因排第2名,对我国人民的生命健康构成巨大危害[8]。放射治疗是晚期肝癌病人的主要治疗方式之一[9],然而放射抵抗对肝癌的治疗效果有巨大的负面影响。因此, 寻找能够增强放疗敏感性的方法和药物对提高放射疗法的效果非常重要。
细胞自噬是指细胞通过降解受损、错误折叠的蛋白质和异常的细胞器来维持其稳态的过程,是一种高度保守的细胞过程[10]。自噬相关基因(Autophagy-related gene, Atg)是高度保守的基因, 是调控自噬的核心分子, 在自噬过程中发挥关键的调节作用[3]。自噬的各种功能是通过许多Atg实现的, 其中, LC3、ATG7和p62在恶性肿瘤的研究中占据重要地位。LC3也称为Atg8, 是哺乳动物的主要Atg, 分为两种亚型: LC3-Ⅰ、LC3-Ⅱ。自噬发生时, ATG7能促进LC3-Ⅰ与磷脂酰乙醇胺的脂质化, 从而生成LC3-磷脂酰乙醇胺偶联物(LC3-Ⅱ)[11], 并在自噬体和溶酶体结合形成自噬溶酶体时, LC3-Ⅰ与内含物一起发生降解[12]。因此LC3-Ⅱ被认为是自噬标志物[13]。SQSTM1/p62是一种自噬适应性蛋白, 能与泛素化蛋白的聚合体结合, 并向自噬体传递以被其降解[14]。另外, 许多蛋白质分子参与自噬, 如PI3K和mTOR在自噬的不同阶段充当调节剂[15]。mTOR可被PI3K/AKT/mTOR通路激活以抑制自噬[16]。
以往研究发现, 罂粟碱可以通过产生活性氧和破坏线粒体膜通透性来抑制细胞的生长, 并通过降低凋亡抑制因子Survivin的表达和抑制细胞周期调节因子cyclin-D1的表达诱导细胞凋亡[6], 是一种潜在的抗癌药物,但其在肝癌中的作用及对自噬的影响还有待挖掘。因此, 本文使用罂粟碱处理肝癌细胞HepG2和Huh7,结果发现罂粟碱可以抑制肝癌细胞HepG2和Huh7的增殖和迁移能力。由于肿瘤细胞增殖迅速, 代谢旺盛, 而肿瘤周围的营养往往供应不足, 因此, 在营养缺乏期间, 肿瘤细胞的自噬被激活, 用以维持重要蛋白质和其他营养物质的供应, 从而增加细胞存活率[17]。本研究发现罂粟碱可以抑制细胞自噬, 说明罂粟碱可能通过抑制自噬来抑制细胞的增殖能力,此外还发现罂粟碱可以增加肝癌细胞的放疗敏感性。由于细胞处于辐射应激时会导致细胞内大分子损伤和线粒体电位降低, 进而产生活性氧和活性氮, 导致氧化应激。反之, 氧化应激可能导致细胞内的各种失衡, 包括DNA损伤、线粒体功能受损、蛋白质错误折叠[18, 19]等, 细胞为了实现自我保护激活自噬[20, 21],诱导的自噬可以回收受损的大分子并通过损伤细胞的修复来促进受照射细胞的存活, 从而保护细胞免受辐射应激的伤害[22]。有研究发现, 罂粟碱作用细胞后不仅可以促进活性氧的产生, 还会损伤线粒体膜的通透性[6]。众所周知, 辐射可以诱导自噬以维持内环境的稳态而产生照射抵抗, 即放射治疗后细胞自噬激活, 在某种程度上, 自噬作为肿瘤细胞对放疗和化疗的一种潜在保护性反应, 提高了肿瘤细胞的放疗和化疗耐受性。而抑制自噬则在一定程度上提高了放射治疗的敏感性[23, 24]。所以本研究进一步探究了罂粟碱对X射线照射后的HepG2和Huh7细胞自噬的影响, 结果发现罂粟碱对照射诱导的细胞自噬也有抑制作用, 提示罂粟碱可能是通过作用于自噬从而降低放射后细胞的存活率。本研究前期实验结果亦表明照射联合自噬抑制剂可以增加肝癌细胞的放射敏感性[25]。本研究中, 罂粟碱处理HepG2和Huh7细胞后, 自噬经典PI3K/AKT/mTOR通路磷酸化水平升高, 表明该通路被激活, 提示罂粟碱可以通过PI3K/AKT/mTOR途径抑制肿瘤细胞的自噬, 从而提高肝癌放射治疗的敏感性。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
TAN W C, DENG Q W, LIN S Y, et al. Comparison of microwave ablation and radiofrequency ablation for hepatocellular carcinoma: a systematic review and meta-analysis[J]. International Journal of Hyperthermia, 2019, 36(1): 263-271. DOI:10.1080/02656736.2018.1562571 |
| [3] |
CUI J Z, SHEN H M, LIM L H K. The role of autophagy in liver cancer: crosstalk in signaling pathways and potential therapeutic targets[J]. Pharmaceuticals, 2020, 13(12): 432. DOI:10.3390/ph13120432 |
| [4] |
INADA M, SATO A, SHINDO M, et al. Anticancer non-narcotic opium alkaloid papaverine suppresses human glioblastoma cell growth[J]. Anticancer Research: International Journal of Cancer Research and Treatment, 2019, 39(12): 6743-6750. |
| [5] |
HUANG H, LI L J, ZHANG H B, et al. Papaverine selectively inhibits human prostate cancer cell (PC-3) growth by inducing mitochondrial mediated apoptosis, cell cycle arrest and downregulation of NF-κB/PI3K/Akt signalling pathway[J]. Journal of BUON, 2017, 22(1): 112-118. |
| [6] |
PARCHA P K, SARVAGALLA S, ASHOK C, et al. Repositioning antispasmodic drug Papaverine for the treatment of chronic myeloid leukemia[J]. Pharmacological Reports, 2021, 73(2): 615-628. DOI:10.1007/s43440-020-00196-x |
| [7] |
AFZALI M, GHAELI P, KHANAVI M, et al. Non-addictive opium alkaloids selectively induce apoptosis in cancer cells compared to normal cells[J]. DARU Journal of Pharmaceutical Sciences, 2015, 23(1): 16. DOI:10.1186/s40199-015-0101-1 |
| [8] |
ZHOU M G, WANG H D, ZENG X Y, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:a systematic analysis for the Global Burden of Disease Study 2017[J]. The Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [9] |
ZHOU J, SUN H C, WANG Z, et al. Guidelines for the diagnosis and treatment of hepatocellular carcinoma (2019 edition)[J]. Liver Cancer, 2020, 9(6): 682-720. DOI:10.1159/000509424 |
| [10] |
LI X H, HE S K, MA B Y. Autophagy and autophagy-related proteins in cancer[J]. Molecular Cancer, 2020, 19(1): 12. DOI:10.1186/s12943-020-1138-4 |
| [11] |
COLLIER J J, GUISSART C, OLÁHOVÁ M, et al. Developmental consequences of defective ATG7-mediated autophagy in humans[J]. New England Journal of Medicine, 2021, 384(25): 2406-2417. DOI:10.1056/NEJMoa1915722 |
| [12] |
HUANG R, LIU W. Identifying an essential role of nuclear LC3 for autophagy[J]. Autophagy, 2015, 11(5): 852-853. DOI:10.1080/15548627.2015.1038016 |
| [13] |
GIAMPIERI F, AFRIN S, FORBES-HERNANDEZ T Y, et al. Autophagy in human health and disease: novel therapeutic opportunities[J]. Antioxidants & Redox Signaling, 2019, 30(4): 577-634. |
| [14] |
KONG L M, DENG J, ZHOU X, et al. Sitagliptin activates the p62-Keap1-Nrf2 signalling pathway to alleviate oxidative stress and excessive autophagy in severe acute pancreatitis-related acute lung injury[J]. Cell Death & Disease, 2021, 12(10): 928. |
| [15] |
LIU L, LIAO J Z, HE X X, et al. The role of autophagy in hepatocellular carcinoma: friend or foe[J]. Oncotarget, 2017, 8(34): 57707-57722. DOI:10.18632/oncotarget.17202 |
| [16] |
HARDIE D G. AMPK: positive and negative regulation, and its role in whole-body energy homeostasis[J]. Current Opinion in Cell Biology, 2015, 33: 1-7. DOI:10.1016/j.ceb.2014.09.004 |
| [17] |
KOPPENOL W H, BOUNDS P L, DANG C V. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nature Reviews Cancer, 2011, 11(5): 325-337. DOI:10.1038/nrc3038 |
| [18] |
BUYTAERT E, DEWAELE M, AGOSTINIS P. Molecular effectors of multiple cell death pathways initiated by photodynamic therapy[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2007, 1776(1): 86-107. DOI:10.1016/j.bbcan.2007.07.001 |
| [19] |
FARRUKH M R, NISSAR U A, AFNAN Q, et al. Oxidative stress mediated Ca2+ release manifests endoplasmic reticulum stress leading to unfolded protein response in UV-B irradiated human skin cells[J]. Journal of Dermatological Science, 2014, 75(1): 24-35. DOI:10.1016/j.jdermsci.2014.03.005 |
| [20] |
GORBUNOV N V, KIANG J G. Up-regulation of autophagy in small intestine Paneth cells in response to total-body γ-irradiation[J]. The Journal of Pathology: A Journal of the Pathological Society of Great Britain and Ireland, 2009, 219(2): 242-252. |
| [21] |
CHEN Y, AZAD M B, GIBSON S B. Superoxide is the major reactive oxygen species regulating autophagy[J]. Cell Death & Differentiation, 2009, 16(7): 1040-1052. |
| [22] |
CHAURASIA M, GUPTA S, DAS A, et al. Radiation induces EIF2AK3/PERK and ERN1/IRE1 mediated pro-survival autophagy[J]. Autophagy, 2019, 15(8): 1391-1406. DOI:10.1080/15548627.2019.1582973 |
| [23] |
宋乐乐, 马琳艳, 陈根德, 等. 自噬抑制剂3-甲基腺嘌呤增强鼻咽癌细胞对放射和化学治疗的敏感性[J]. 中南大学学报(医学版), 2016, 41(1): 9-18. |
| [24] |
GAO L, ZHENG H, CAI Q, et al. Autophagy and Tumour Radiotherapy[J]. Advances in Experimental Medicine and Biology, 2020, 1207: 375-387. |
| [25] |
张华颖, 刘鑫, 林春香, 等. 自噬对肝癌SMMC-7721细胞侵袭迁移能力的影响[J]. 广西科学, 2022, 29(2): 342-348. |



