三阴性乳腺癌(Triple Negative Breast Cancer,TNBC)是一种特殊亚型的乳腺癌,其雌激素受体(Estrogen Receptor,ER)、孕激素受体(Progesterone Receptor,PR)和原癌基因HER2均为阴性,极易发生远处转移和复发。TNBC进展快、预后差且缺少特异性治疗手段,因此免疫治疗是TNBC探索的方向之一。长期以来乳腺癌一直被认为是免疫学上的一种“冷”肿瘤,但是与其他亚型的乳腺癌相比,TNBC免疫原性更强[1-3],提示免疫治疗已成为TNBC治疗新的希望。但实际上TNBC免疫检查点抑制剂单药治疗反应率不高,其中的原因尚未明确。
信号转导和转录激活因子3 (Signal Transducer and Activator of Transcription 3,STAT3)的过度表达[4]、外泌体(Exosomes)携带的细胞程序性死亡-配体1 (Programmed Cell Death Ligand 1,PD-L1)抑制肿瘤微环境[5](Tumor Microenvironment,TME)可能是TNBC免疫检查点抑制剂单药治疗效果差的原因。激活的STAT3不仅与肿瘤增殖、血管生成和转移有关,还能促进免疫抑制因子的表达,同时阻碍Th1细胞[6, 7]分泌细胞因子从而抑制TNBC的肿瘤微环境。肿瘤细胞分泌的外泌体富含免疫抑制蛋白,如PD-L1,其能使免疫细胞失活,并进一步阻止免疫细胞识别和杀伤肿瘤细胞[8, 9]。目前,尚无靶向调控PD-L1转运、STAT3降解并诱导TME重塑的方法。
放射治疗是包括乳腺癌在内多种恶性肿瘤治疗的三大治疗手段之一,对恶性肿瘤细胞有直接杀伤作用,对TME的组成部分也有至关重要的影响。以往的研究认为放射治疗具有免疫抑制作用[10],包括较大的单组分辐射剂量(15-20 Gy)可能会永久地减少血流[11];放射治疗会引起免疫抑制相关分子(如肿瘤坏死因子、白细胞介素1β、白细胞介素6、白细胞介素10和转化生长因子β[12, 13])及细胞(如肿瘤相关巨噬细胞[14]、髓系抑制细胞和调节性T细胞)的聚集增多,同时引起淋巴细胞亚群损伤和功能受到抑制[15]。然而目前更多的研究认为放射治疗可以增强肿瘤细胞和TME的免疫敏感性,刺激肿瘤中更多的免疫细胞浸润和活化[16-18]。另外,照射可以诱导自噬的发生,细胞自噬与肿瘤的发生发展关系密切,并且自噬-溶酶体途径参与了多种物质的转运[19, 20],但是细胞自噬调控PD-L1转运及与调节STAT3的机制尚未明确。本研究利用照射诱导肿瘤细胞发生自噬,探讨自噬对PD-L1和STAT3溶酶体降解的影响,为改善肿瘤微环境的免疫抑制及TBNC治疗提供一个新策略。
1 材料与方法 1.1 材料 1.1.1 细胞与慢病毒载体人乳腺癌细胞TNBC细胞株(MDA-MB-231、BT-549)、非三阴性乳腺癌(non-TNBC)细胞株(MCF-7、BT-474)及Jurkat购自武汉普诺赛生命科技有限公司。根据ATG7基因(Gene ID: 10533)设计的重组慢病毒敲低载体sh-ATG7和空载体vector (阴性对照)购自上海吉凯基因医学科技股份有限公司。
1.1.2 主要材料与试剂自噬激活剂雷帕霉素(Rapamycin,Rapa)购自美国Sigma公司,自噬抑制剂氯喹(Chloroquine, CQ)及蛋白酶体抑制剂MG132、外泌体抑制剂GW4869购自MedChemExpress,抗体LC3B、P62、PD-L1购自美国Abcam公司,E-cadherin、Vimentin购自赛信通(上海)生物试剂有限公司。GAPDH抗体、山羊抗兔lgG(H+L)和驴抗兔lgG(H+L)均购自上海碧云天生物技术有限公司,β-actin购自圣克鲁斯生物技术(上海)有限公司,BCA蛋白定量试剂盒、RIPA裂解液购自上海碧云天生物技术有限公司,杜尔贝科改良伊格尔培养基(Duibecco′s Modified Eagle Medium, DMEM)、1640培养基、胎牛血清(FBS)购自美国GIBCO公司,青霉素、链霉素混合液和PBS缓冲液购自北京索莱宝科技有限公司,增强型化学发光(ECL)试剂盒(货号34577)购自赛默飞世尔科技(中国)有限公司。
1.2 方法 1.2.1 细胞培养乳腺癌细胞培养于含10%胎牛血清、1%青霉素和链霉素混合液的DMEM,置于37 ℃、5% CO2的培养箱中,取对数生长期细胞用于后续研究。雷帕霉素的浓度为20 nmol/L,氯喹的浓度为25 μmol/L,MG132的浓度为5 mmol/L,GW4869的浓度为20 μmol/L。在照射前6 h加入以上浓度的药物,MG132在预定的实验终点前2 h加入。照射组细胞采用直线加速器6MV-X进行照射,照射剂量为8 Gy[21, 22],照射视野为40 cm×40 cm,X射线辐射装置购自瑞典Elekta公司。
1.2.2 慢病毒转染选取处于对数生长期的MDA-MB-231细胞进行慢病毒转染,待细胞铺满孔的50%时,按照说明书将慢病毒敲低载体sh-ATG7及空载慢病毒分别转染MDA-MB-231细胞,经嘌呤霉素筛选后获得稳定转染的细胞株。采用Western blot及RT-qPCR验证转染效率。
1.2.3 RT-qPCR检测mRNA表达使用TRIZOL法提取细胞中总RNA,并使用5×PrimeScript RT Master Mix逆转录成cDNA。根据SYBR Green qPCR Master Mix说明书步骤进行RT-qPCR检测。
1.2.4 Western blot检测蛋白表达用RIPA液裂解各组细胞,离心收集蛋白,测定蛋白浓度,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将蛋白转移到PVDF膜上,TBST缓冲液洗膜3次,室温封闭20 min,分别加入一抗P62、LC3B (均1∶2 000稀释),PD-L1、E-cadherin、Vimentin、β-actin、GAPDH (均1∶1 000稀释),4 ℃孵育过夜,加入二抗(1∶1 000)室温孵育1 h,使用ECL显色。
1.2.5 免疫荧光检测蛋白表达弃去培养基,用PBS缓冲液洗涤细胞3次,加入4%多聚甲醛固定细胞15 min,再用PBS缓冲液洗涤3次,用免疫封闭液封闭1 h。4 ℃孵育相应一抗过夜,用PBS缓冲液洗涤3次,37 ℃孵育荧光二抗1 h,再用DAPI染细胞核5 min。设置未照射(NC)和照射(IR,8 Gy)两个处理。在EVOS FL自动显微镜下观察细胞PD-L1蛋白的绿色荧光焦点数。
1.2.6 外泌体的提取与鉴定将乳腺癌细胞MDA-MB-231置于T175培养瓶中培养,使用无外泌体完全培养基培养,当细胞密度达80%左右时,给予8 Gy X射线照射,继续培养24 h,然后收集细胞上清。通过差速超速离心法提取未照射(NC)与照射(IR)处理的外泌体,用透射电子显微镜观察外泌体的形态,纳米颗粒追踪分析(NTA)外泌体的粒径大小,Western blot检测外泌体标志蛋白CD63、TSG101、ALIX的表达。
1.2.7 生物信息学分析通过在线数据库GEPIA(http://gepia.cancer-pku.cn/)的survival模块验证自噬关键基因ATG7与乳腺癌预后的相关性;利用数据库的Correlation模块对ATG7与STAT1、STAT2、STAT3的关联性进行分析。
1.3 统计学方法采用GraphPad prism 8.0进行统计分析作图。采用单因素方差分析或独立性t检验进行数据组间分析,P < 0.05表示有统计学意义。
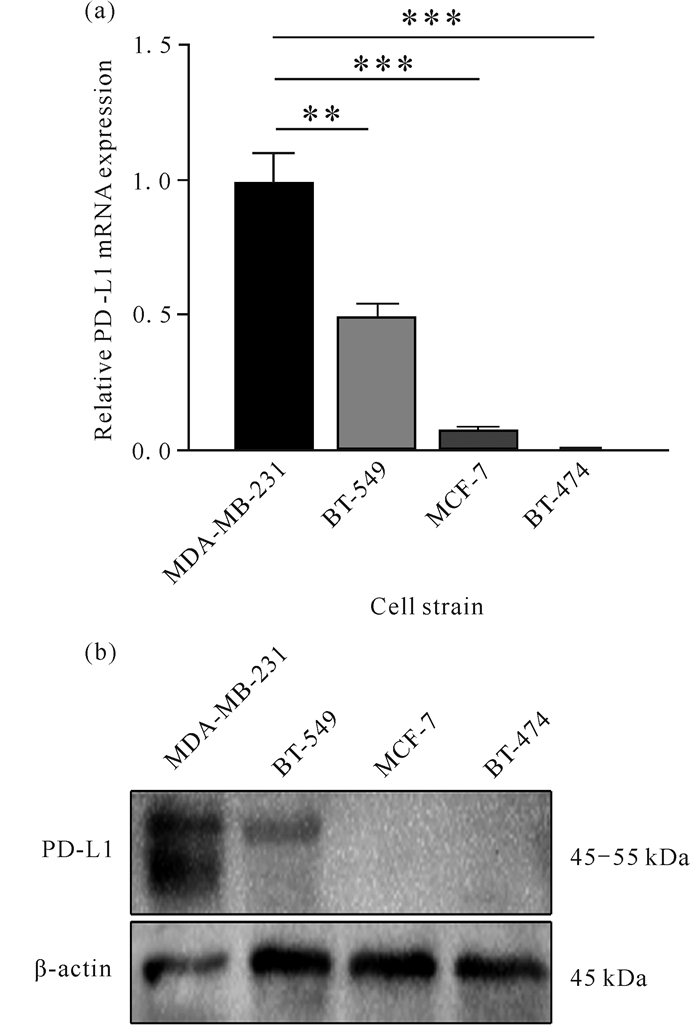
2 结果与分析 2.1 PD-L1在乳腺癌细胞中的差异表达通过RT-qPCR [图 1(a)]和Western blot [图 1(b)]检测TNBC细胞株(MDA-MB-231、BT-549)及non-TNBC细胞株(MCF-7、BT-474)中PD-L1的表达,结果表明,TNBC细胞株中PD-L1的mRNA和蛋白表达均高于non-TNBC。
|
| ** indicates P < 0.01, *** indicates P < 0.001. 图 1 PD-L1在乳腺癌细胞中的差异表达 Fig. 1 Differential expression of PD-L1 in breast cancer cells |
2.2 蛋白酶体和自噬-溶酶体对PD-L1表达的影响
为进一步了解PD-L1降解的主要途径,使用自噬抑制剂CQ、自噬激活剂Rapa及蛋白酶体抑制剂MG132进行联合或不联合照射(IR),二甲基亚砜(DMSO)为阴性对照。Western blot的结果显示,单用MG132几乎不能上调PD-L1的表达;而单用CQ虽然可以上调PD-L1的表达,但是效果不显著[图 2(a)]。当联合照射时,PD-L1的表达明显提高。当使用自噬激活剂Rapa时,PD-L1的表达下调,联合照射不能使PD-L1恢复至DMSO组水平[图 2: (b)(c)],说明自噬-溶酶体途径可能是PD-L1降解的主要途径。

|
| ns indicates no statistical significance, ** indicates P < 0.01, *** indicates P < 0.001. 图 2 蛋白酶体和自噬-溶酶体对PD-L1表达的影响 Fig. 2 Effects of proteasomes and autophagy lysosomes on PD-L1 expression |
2.3 照射对TNBC细胞中PD-L1表达及转运的影响
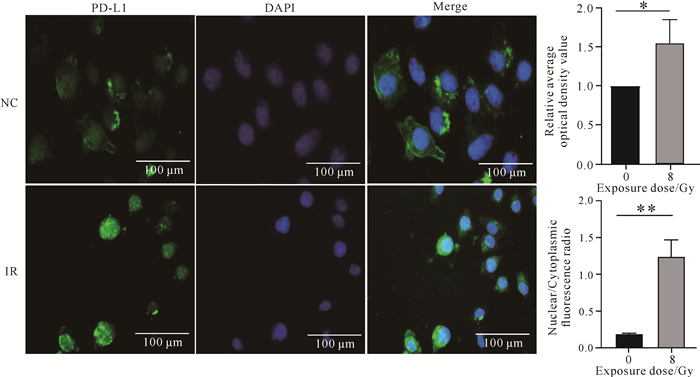
免疫荧光结果显示,照射后MDA-MB-231细胞的PD-L1蛋白在细胞内的荧光焦点数增多(图 3)。免疫荧光结果表明照射促进了PD-L1的内吞并向胞内转移,即照射过程中细胞的内吞-外排途径可以调节PD-L1的表达。
|
| Compared with the NC group, * indicates P < 0.05, ** indicates P < 0.01. 图 3 照射对TNBC细胞中PD-L1表达及转运的影响 Fig. 3 Effects of irradiation on PD-L1 expression and transport in TNBC cell |
2.4 照射对TNBC细胞中sEVs-PD-L1表达的影响
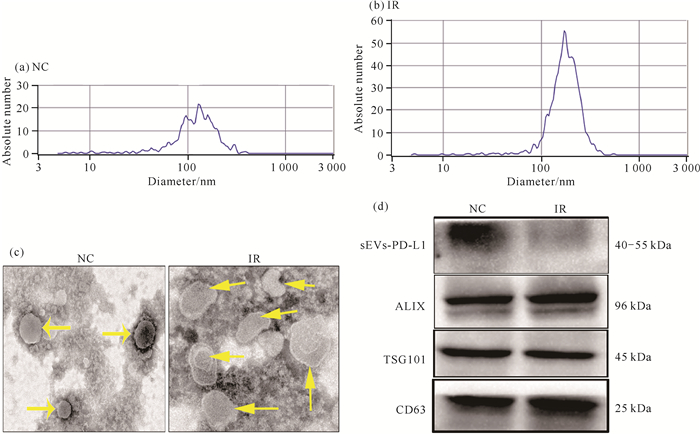
为确定照射对肿瘤微环境中PD-L1的作用,通过差速超速离心法分离细胞培养上清,获得纯化的外泌体。NTA结果发现外泌体粒径大小为160 nm左右[图 4: (a)(b)]。透射电子显微镜下,可见有明显的膜结构,呈近似半球状的囊泡结构[图 4(c)]。Western blot验证了外泌体蛋白标志CD63、TSG101、ALIX的表达呈阳性[图 4(d)]。同时,透射电子显微镜及NTA发现,与未照射组相比,经过8 Gy照射增加了细胞外囊泡的整体释放,然而Western blot检测结果显示,8 Gy照射后相同数量囊泡下的sEVs-PD-L1表达却下降[图 4(d)]。以上结果提示照射可能促进细胞表面PD-L1内吞并转移至溶酶体降解,促使sEVs-PD-L1表达下降从而改善TME。
|
| 图 4 照射对TNBC细胞中sEVs-PD-L1表达的影响 Fig. 4 Effect of irradiation on expression of sEVs-PD-L1 from TNBC cells |
2.5 ATG7与乳腺癌预后及信号通路的相关性分析
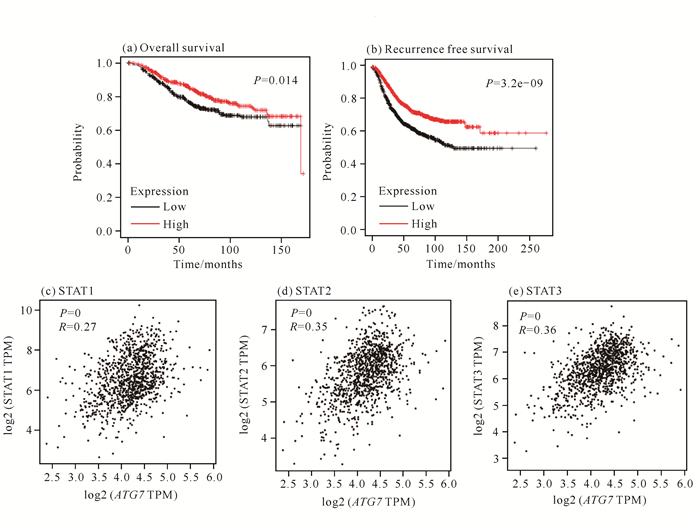
利用在线数据库GEPIA验证自噬关键基因ATG7与乳腺癌预后的相关性,结果表明ATG7的低表达与乳腺癌不良预后有关,同时ATG7与STAT3相关性最强(图 5),说明ATG7可能与STAT3信号通路的调控相关。
|
| 图 5 ATG7与乳腺癌预后及信号通路的相关性分析 Fig. 5 Correlation analysis of ATG7 with prognosis and signal pathway of breast cancer |
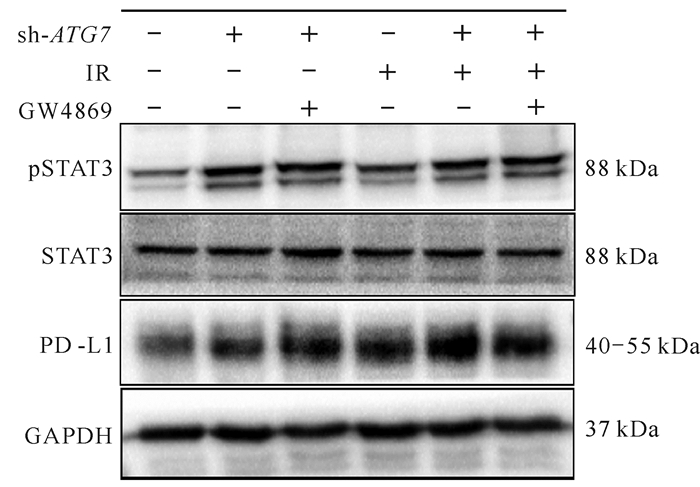
2.6 抑制自噬和(或)抑制外泌体释放对细胞PD-L1表达及STAT3激活的影响
利用慢病毒介导ATG7的沉默,使用外泌体抑制剂GW4869阻碍外泌体的释放,结果表明,与空白对照组相比,单独照射组可激活STAT3,提高PD-L1的表达;与单独沉默ATG7相比,联合使用GW4869可使PD-L1的表达升高,并且照射可在上述分组中进一步提高PD-L1的表达(图 6)。照射、抑制自噬、抑制外泌体释放均可提高PD-L1的表达,其中照射和抑制自噬提高PD-L1的表达与STAT3的激活有关。
|
| + indicates gene knockdown/irradiation using GW4869 inhibitor, -indicates not used. 图 6 抑制自噬和(或)抑制外泌体释放对PD-L1表达及STAT3激活的影响 Fig. 6 Effects of inhibition of autophagy and/or exocrine release on PD-L1 expression and STAT3 activation |
3 讨论
三阴性乳腺癌被认为是最具致命性的乳腺癌亚型,具有高度侵袭性,而且对当前的治疗方法(包括免疫治疗)反应较差。近几年来肿瘤的免疫治疗如雨后春笋崛起,主流医学曾有过很多关于实体瘤中T细胞浸润与术后预后相关的报道,总体上支持T细胞数量越多,特别是CD8+T细胞的数量越多预后效果越好的结论[23]。本课题组致力于放射治疗与细胞自噬相互作用的研究[24, 25],同时了解到细胞自噬对各种刺激产生的胞外小泡的数量和命运起着决定性的作用[26-28],而这些外泌体[9, 29]是TME的重要组成部分。在胶质母细胞瘤[30]以及人类黑色素瘤细胞[5]等多种肿瘤中的研究显示,外泌体中的PD-L1具有抑制T细胞功能的作用,导致TME处于免疫抑制状态。乳腺癌中还存在STAT3的过度激活,而肿瘤细胞中激活的STAT3不仅可以抑制免疫刺激介质的产生,还可以促进免疫抑制因子的释放,从而导致TME中STAT3相关T细胞免疫抑制[31]。然而细胞自噬与外泌体囊泡的转运关系以及照射诱导细胞自噬与STAT3信号通路的关系仍不明确。
目前在TNBC中,尚不清楚照射是否能调节PD-L1的转运及表达进而调控TME。本研究在细胞免疫荧光实验中发现,照射处理上调了MDA-MB-231细胞PD-L1的表达,同时使PD-L1发生了核转位,核转位的PD-L1增多意味着细胞内吞而来的PD-L1减少了,进而可能会导致TME中sEVs-PD-L1的减少,减轻TME的免疫抑制。本研究虽然对sEVs-PD-L1的表达进行了检测,结果也证实了照射可以下调sEVs-PD-L1,但是仍缺乏对TME免疫状态的直接检测。而照射诱导的PD-L1核转位可能由于低氧而引起STAT3的激活[32],照射[33]及低氧环境[34]均会诱导自噬的发生,照射联合诱导自噬是否会促进STAT3的降解以及它们之间的联系尚未明确。
本研究发现,在TNBC中PD-L1的表达受到自噬-溶酶体途径及内吞-外泌体途径的共同调节,而不是蛋白酶体途径,抑制自噬及抑制外泌体释放均使PD-L1表达增加。为进一步证明抑制自噬与PD-L1的关系,通过沉默ATG7联合或不联合照射发现,抑制自噬及照射均激活了STAT3,上调了PD-L1的表达。从以上结果可以看出,不管是照射还是抑制自噬最终都是STAT3的激活使PD-L1表达上调,但是本研究缺乏对过表达ATG7后是否会降解STAT3的研究,后期会继续补充该方面实验。因此,照射联合自噬激活剂或许可以靶向降解STAT3,为减轻或解除免疫抑制提供新思路。乳腺癌存在STAT3的过度激活,STAT3曾被认为是“不可成药”靶点,与化疗耐药、放射抗拒有关;STAT3使得巨噬细胞向M2极化,产生诸如白细胞介素-10、白细胞介素-23和转化生长因子-β等免疫抑制因子,STAT3促进了免疫抑制的TME,参与调节早期肿瘤生长和后期转移阶段[35]。
综上可知,照射可以促进PD-L1的核转位,减少TME中sEVs-PD-L1的分泌,并且照射诱导的细胞自噬可能会降解STAT3,减轻TME的抑制,照射联合自噬诱导可产生协同增效的抗肿瘤作用,为TNBC治疗提供新思考。同时本研究的结果就细胞自噬方面而言,再一次验证了TNBC的治疗不是抑制自噬,而是利用照射诱导的自噬性细胞死亡,后续还需要更多体内外实验去阐述诱导自噬对杀伤TNBC的影响,并且还需进一步通过细胞实验及体内动物实验证明照射改变外泌体释放及其内容物进而调节肿瘤免疫抑制。
4 结论本研究发现了TNBC细胞中照射诱导PD-L1的降解与细胞自噬相关的可能作用机制。照射过程中,抑制自噬可通过激活STAT3上调PD-L1的表达,而激活自噬可通过溶酶体清除PD-L1从而减轻其介导的免疫抑制。此外,照射还可以诱导细胞自噬继而选择性降解照射后转运至胞内的PD-L1,降低外泌体中PD-L1 (sEVs-PD-L1)的表达。总而言之,本研究以PD-L1为靶点,探索照射过程中其降解减少的主要途径,为分析TNBC中抗PD1/PD-L1抑制剂疗效低的原因提供了一种新思路,也为TNBC联合免疫治疗策略提供了新依据。
| [1] |
BARROSO-SOUSA R, JAIN E, COHEN O, et al. Prevalence and mutational determinants of high tumor mutation burden in breast cancer[J]. Annals of Oncology, 2020, 31(3): 387-394. DOI:10.1016/j.annonc.2019.11.010 |
| [2] |
MITTENDORF E A, PHILIPS A V, MERIC-BERNSTAM F, et al. PD-L1 expression in triple-negative breast cancer[J]. Cancer Immunology Research, 2014, 2(4): 361-370. DOI:10.1158/2326-6066.CIR-13-0127 |
| [3] |
DENKERT C, VON MINCKWITZ G, DARB-ESFAHANI S, et al. Tumour-infiltrating lymphocytes and prognosis in different subtypes of breast cancer: a pooled analysis of 3 771 patients treated with neoadjuvant therapy[J]. The Lancet Oncology, 2018, 19(1): 40-50. DOI:10.1016/S1470-2045(17)30904-X |
| [4] |
ZOU S L, TONG Q Y, LIU B W, et al. Targeting STAT3 in cancer immunotherapy[J]. Molecular Cancer, 2020, 19: 145. DOI:10.1186/s12943-020-01258-7 |
| [5] |
CHEN G, HUANG A C, ZHANG W, et al. Exosomal PD-L1 contributes to immunosuppression and is associated with anti-PD-1 response[J]. Nature, 2018, 560(7718): 382-386. DOI:10.1038/s41586-018-0392-8 |
| [6] |
HASHIMOTO S, HASHIMOTO A, MUROMOTO R, et al. Central roles of STAT3-mediated signals in onset and development of cancers: tumorigenesis and immunosurveillance[J]. Cells, 2022, 11: 2618. DOI:10.3390/cells11162618 |
| [7] |
KORTYLEWSKI M, YU H. Role of Stat3 in suppressing anti-tumor immunity[J]. Current Opinion in Immunology, 2008, 20: 228-233. DOI:10.1016/j.coi.2008.03.010 |
| [8] |
YANG Y, LI C W, CHAN L C, et al. Exosomal PD-L1 harbors active defense function to suppress T cell killing of breast cancer cells and promote tumor growth[J]. Cell Research, 2018, 28(8): 862-864. DOI:10.1038/s41422-018-0060-4 |
| [9] |
CHEN J, SONG Y, MIAO F, et al. PDL1-positive exosomes suppress antitumor immunity by inducing tumor-specific CD8+T cell exhaustion during metastasis[J]. Cancer Science, 2021, 112(9): 3437-3454. DOI:10.1111/cas.15033 |
| [10] |
FRIEDMAN E J. Immune modulation by ionizing radiation and its implications for cancer immunotherapy[J]. Current Pharmaceutical Design, 2002, 8(19): 1765-1780. DOI:10.2174/1381612023394089 |
| [11] |
CHIN M S, FRENIERE B B, BONNEY C F, et al. Skin perfusion and oxygenation changes in radiation fibrosis[J]. Plastic and Reconstructive Surgery, 2013, 131(4): 707-716. DOI:10.1097/PRS.0b013e3182818b94 |
| [12] |
HINIKER S M, CHEN D S, REDDY S, et al. A systemic complete response of metastatic melanoma to local radiation and immunotherapy[J]. Translational Oncology, 2012, 5(6): 404-407. DOI:10.1593/tlo.12280 |
| [13] |
HARRIS T J, HIPKISS E L, BORZILLARY S, et al. Radiotherapy augments the immune response to prostate cancer in a time-dependent manner[J]. The Prostate, 2008, 68(12): 1319-1329. DOI:10.1002/pros.20794 |
| [14] |
LAOUI D, VAN OVERMEIRE E, DE BAETSELIER P, et al. Functional relationship between tumor-associated macrophages and macrophage colony-stimulating factor as contributors to cancer progression[J]. Frontiers in Immunology, 2014, 5: 489. |
| [15] |
PARKER J J, JONES J C, STROBER S, et al. Characterization of direct radiation-induced immune function and molecular signaling changes in an antigen presenting cell line[J]. Clinical Immunology, 2013, 148: 44-55. DOI:10.1016/j.clim.2013.03.008 |
| [16] |
DE MARTINO M, DAVIAUD C, VANPOUILLEBOX C. Radiotherapy: an immune response modifier for immuno-oncology[J]. Seminars in Immunology, 2021, 52: 101474. DOI:10.1016/j.smim.2021.101474 |
| [17] |
MCLAUGHLIN M, PATIN E C, PEDERSEN M, et al. Inflammatory microenvironment remodelling by tumour cells after radiotherapy[J]. Nature Reviews Cancer, 2020, 20(4): 203-217. DOI:10.1038/s41568-020-0246-1 |
| [18] |
RUCKERT M, FLOHR A S, HECHT M, et al. Radiotherapy and the immune system: more than just immune suppression[J]. Stem Cells, 2021, 39(9): 1155-1165. DOI:10.1002/stem.3391 |
| [19] |
HAO M G, YEO S K, TURNER K, et al. Autophagy blockade limits HER2+ breast cancer tumorigenesis by perturbing HER2 trafficking and promoting release via small extracellular vesicles[J]. Developmental Cell, 2021, 56(3): 341-355. DOI:10.1016/j.devcel.2020.12.016 |
| [20] |
XU M M, REN L, FAN J H, et al. Berberine inhibits gastric cancer development and progression by regulating the JAK2/STAT3 pathway and downregulating IL-6[J]. Life Sciences, 2022, 290: 120266. DOI:10.1016/j.lfs.2021.120266 |
| [21] |
ZHAO W, HU H B, MO Q Y, et al. Function and mechanism of combined PARP-1 and BRCA genes in regulating the radiosensitivity of breast cancer cells[J]. International Journal of Clinical and Experimental Pathology, 2019, 12(10): 3915-3920. |
| [22] |
赵伟, 殷雪, 朱小东, 等. 聚腺苷二磷酸核糖聚合酶-1抑制剂对乳腺癌易感基因突变乳腺癌细胞放射敏感性的影响及调控机制[J]. 中华放射医学与防护杂志, 2016, 36(3): 168-172. DOI:10.3760/cma.j.issn.0254-5098.2016.03.002 |
| [23] |
MAIBACH F, SADOZAI H, SEYED J S M, et al. Tumor-infiltrating lymphocytes and their prognostic value in cutaneous melanoma[J]. Frontiers in Immunology, 2020, 11: 2105. DOI:10.3389/fimmu.2020.02105 |
| [24] |
卢小迪, 朱小东, 赵伟, 等. 自噬相关基因ATG5沉默增加鼻咽癌裸鼠移植瘤的放射敏感性[J]. 上海医学, 2015, 38(2): 151-154, 90. |
| [25] |
CHEN Z T, ZHAO W, QU S, et al. PARP-1 promotes autophagy via the AMPK/mTOR pathway in CNE-2 human nasopharyngeal carcinoma cells following ionizing radiation, while inhibition of autophagy contributes to the radiation sensitization of CNE-2 cells[J]. Molecular Medicine Reports, 2015, 12(2): 1868-1876. DOI:10.3892/mmr.2015.3604 |
| [26] |
FADER C M, SÁNCHEZ D, FURLÁN M, et al. Induction of autophagy promotes fusion of multivesicular bodies with autophagic vacuoles in K562 cells[J]. Traffic, 2008, 9(2): 230-250. |
| [27] |
MURROW L, MALHOTRA R, DEBNATH J. ATG 12-ATG3 interacts with Alix to promote basal autophagic flux and late endosome function[J]. Nature Cell Biology, 2015, 17(3): 300-310. DOI:10.1038/ncb3112 |
| [28] |
MINAKAKI G, MENGES S, KITTEL A, et al. Autophagy inhibition promotes SNCA/alpha-synuclein release and transfer via extracellular vesicles with a hybrid autophagosome-exosome-like phenotype[J]. Autophagy, 2018, 14(1): 98-119. DOI:10.1080/15548627.2017.1395992 |
| [29] |
MASHOURI L, YOUSEFI H, AREF A R, et al. Exosomes: composition, biogenesis, and mechanisms in cancer metastasis and drug resistance[J]. Molecular Cancer, 2019, 18: 75. |
| [30] |
RICKLEFS F L, ALAYO Q, KRENZLIN H, et al. Immune evasion mediated by PD-L1 on glioblastoma-derived extracellular vesicles[J]. Science Advances, 2018, 4(3): eaar2766. DOI:10.1126/sciadv.aar2766 |
| [31] |
JIN J, LI Y, ZHAO Q J, et al. Coordinated regulation of immune contexture: crosstalk between STAT3 and immune cells during breast cancer progression[J]. Cell Communication and Signaling, 2021, 19(1): 50. DOI:10.1186/s12964-021-00705-2 |
| [32] |
HOU J W, ZHAO R C, XIA W Y, et al. PD-L1-mediated gasdermin C expression switches apoptosis to pyroptosis in cancer cells and facilitates tumour necrosis[J]. Nature Cell Biology, 2020, 22(10): 1264-1275. DOI:10.1038/s41556-020-0575-z |
| [33] |
CLASSEN F, KRANZ P, RIFFKIN H, et al. Autophagy induced by ionizing radiation promotes cell death over survival in human colorectal cancer cells[J]. Experimental Cell Research, 2019, 374(1): 29-37. DOI:10.1016/j.yexcr.2018.11.004 |
| [34] |
BAI X W, ZHOU Y M, YOKOTA Y, et al. Adaptive antitumor immune response stimulated by bio-nanoparticle based vaccine and checkpoint blockade[J]. Journal of Experimental and Clinical Cancer Research, 2022, 41(1): 132. DOI:10.1186/s13046-022-02307-3 |
| [35] |
JONES L M, BROZ M L, RANGER J J, et al. STAT3 establishes an immunosuppressive microenvironment during the early stages of breast carcinogenesis to promote tumor growth and metastasis[J]. Cancer Research, 2016, 76(6): 1416-1428. DOI:10.1158/0008-5472.CAN-15-2770 |



