高浓度的结晶盐类(NaCl)会限制微生物生长,通常认为极端的高盐环境如盐田、盐湖或高浓度盐溶液食物中只存在原核生物。直到2000年左右,Buchalo等[1]和Gunde-Cimerman等[2]从高盐环境中分离得到真菌之后,高盐生态系统及其真菌物种多样性才引起人们的注意。具有代表性的高盐生态系统有美国大盐湖,以色列、巴勒斯坦、约旦交界处的死海,以及中国新疆、青海、内蒙古等地的盐湖等[1, 3]。生存在深海沉积物、盐湖、盐田、盐土和海水等高盐环境中的微生物统称嗜盐微生物。陈星宇等[4]根据不同盐度下的生长情况,把微生物划分为不同类型:非嗜盐菌(< 1.17% NaCl)、轻度嗜盐菌(1.17%-2.93% NaCl)、中等嗜盐菌(2.93%-14.63% NaCl)、极端嗜盐菌(14.63%-30.40% NaCl)、耐盐菌(1.17%-14.63% NaCl)。我国已报道的常见嗜盐真菌有青霉属(Penicillium)[5, 6]、曲霉属(Aspergillus)[5, 6]、镰刀菌属(Fusarium)[7, 8]、枝孢属(Cladosporium)[7, 8]等类群。我国有绵延的海岸线,大多地势平坦,滩涂广阔,很适合建滩晒盐。因此,北起辽东半岛,南至海南岛,我国分布有大大小小超过1 000个盐湖/盐场。但是,我国高盐环境下的微生物多样性研究关注度还不足,相关研究仍然较少。
嗜盐耐盐真菌次生代谢产物丰富,包括酚类[9]、甾醇类[9]、核酸类[10]、醌类[10]、生物碱[11]等单体化合物,这些化合物结构新颖,且部分具有良好的抗菌、抗肿瘤活性等。在研究耐盐真菌P.chrysogenum HK14-01的次生代谢产物中,曲鹏等[12]发现化合物(2S, 3R)-oxaline、(Z)-N-(4-hydroxystyryl) formamide和(E)-N-(4-hydroxystyryl) formamide对大肠杆菌(Escherichia coli)表现出抑菌活性,化合物(2S, 3R)-oxaline和emodin对金黄色葡萄球菌(Staphyloccocus aureus)表现出抑菌活性,化合物emodin还能微弱地抑制小鼠白血病悬浮细胞(P388)的增殖。对于耐盐真菌Wallemia sebi PXP-89,Peng等[11]发现其次生代谢产物对产气肠杆菌(Enterobacter aerogenes)具有抗菌活性,最小抑菌浓度为76.7 μmol/L。刘培培等[13]从内蒙古盐湖的沉积物中筛选出一株耐盐真菌Aspergillus variecolor B-17,其具有明显的细胞毒活性(小鼠乳腺癌细胞株tsFT210)和海虾(Artemia salina Leach)致死活性;从该菌发酵产物的石油醚层提取物中分离出的3个单体化合物[2-(E-1-庚烯基)-3, 6-二羟基-5-(3-甲基-2-丁烯基)苯甲醛、2-庚基-3, 6-二羟基-5-(3-甲基-2-丁烯基)苯甲醛、2-(E, E-3, 5-庚二烯基)-3, 6-二羟基-5-(3-甲基-2-丁烯基)苯甲醛],对P388、A549、HL-60和BEL-7402肿瘤细胞表现出弱的细胞增殖抑制活性,半抑制浓度IC50值分别为88、68、66、65 μmol/L,9、99、110、84 μmol/L以及77、147、93、203 μmol/L。
北海竹林盐场是广西最大的海晶盐生产基地,制盐历史悠久。陈显强等[14]于2019年5月从北海竹林盐场的海盐田中分离得到26株嗜盐真菌,鉴定为3科4属11种,其中青霉菌属菌株为优势菌群;菌株Epicoccum sorghinum GXIMD02001具有靶向FGFR2抗肿瘤作用,Aspergillus versicolor GXIMD02004和Penicillium citrinum GXIMD02009等具有抑制乳腺癌细胞增殖的作用。为研究冬季北海海盐田嗜盐真菌的物种多样性,本课题组于2020年11月底从广西北海竹林盐场的饱和盐水区域采集样品,采用两种高盐培养基——高盐虎红培养基和高盐马铃薯葡萄糖培养基进行菌株筛选分离;同时,使用4种致病菌[耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)、表皮葡萄球菌(Staphylococcus epidermidis,SE)、无乳链球菌(Streptococcus agalactiae,SA)和海豚链球菌(Strepstococcus iniae,SI)]作为指示菌,对嗜盐真菌发酵提取物的抗菌活性进行评价,从而得到具有潜在抗菌活性的菌株,为北部湾嗜盐真菌资源的开发利用奠定基础。
1 材料与方法 1.1 材料 1.1.1 培养基培养基均经121 ℃高温高压灭菌30 min后使用,配方如下。
(1) 分离培养基
高盐虎红培养基(RBM):蛋白胨5.0 g,葡萄糖10.0 g,KH2PO4 1.0 g,MgSO4 0.5 g,孟加拉红0.033 g,琼脂粉15.0 g,氯霉素0.1 g,含10%海盐的人工海水1 000 mL。
高盐查氏琼脂培养基(CDA):NaNO3 3.0 g,K2HPO4 1.0 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4 0.01 g,蔗糖30.0 g,琼脂粉15.0 g,氯霉素0.1 g,含10%海盐的人工海水1 000 mL。
(2) 纯化培养基
高盐马铃薯葡萄糖琼脂培养基(PDA):马铃薯提取粉6.0 g,葡萄糖20.0 g,琼脂粉15.0 g,含10%海盐的人工海水1 000 mL。
(3) 发酵培养基
高盐马铃薯葡萄糖培养基(PD):马铃薯提取粉6.0 g,葡萄糖20.0 g,含10%海盐的人工海水1 000 mL。
1.1.2 采样信息2020年11月27日在广西北海竹林盐场选取6个饱和盐度的采样点进行采样(表 1),采集的样品放入无菌袋中,无菌袋放入装有冰袋的隔温箱里带回实验室,当天进行菌株分离。
| 序号 Serial number |
北纬 Northern latitude |
东经 East longitude |
样品来源 Sample source |
| 1 | 21°26′35″ | 109°16′22″ | Salt field drainage pool water |
| 2 | 21°26′35″ | 109°16′22″ | Sediments of salt drainage ponds |
| 3 | 21°26′35″ | 109°16′23″ | Salt field water |
| 4 | 21°26′35″ | 109°16′23″ | Sediments of salt field |
| 5 | 21°26′35″ | 109°16′23″ | Sediments of salt field ditch |
| 6 | 21°26′35″ | 109°16′23″ | Salt field ditch water |
1.1.3 指示菌
指示菌包括两种人类致病菌——耐甲氧西林金黄色葡萄球菌和表皮葡萄球菌,两种水产养殖致病菌——无乳链球菌和海豚链球菌,均由华南农业大学海洋学院张晓勇副教授惠赠。
1.2 方法 1.2.1 真菌分离沉积物样品取约2 g,加入2 mL无菌水,研磨混匀,即为样品原液;水池水/盐田水直接作为样品原液。用无菌海水将样品原液稀释成1∶10、1∶100的样品悬液。各取100 μL两种浓度样品悬液涂布于分离培养基中,置于25 ℃恒温培养箱培养12 d。用灭菌竹签挑取形态不同的单菌落接种于PDA培养基上,纯化菌株。
1.2.2 真菌鉴定在超净工作台中从培养平板上刮取一定量的菌丝体和孢子,放入无菌的1.5 mL离心管中。离心管中加入0.2% NaOH溶液,沸水浴5 min,-80 ℃条件下冷冻10 min。取破壁后的菌液进行PCR扩增,扩增体系为25 μL,其中模板DNA 0.5 μL,Buffer(含Mg2+) 2.5 μL,dNTP 1 μL,Easy taq酶0.2 μL,引物ITS1和ITS4各0.5 μL,ddH2O补足至25 μL。PCR扩增程序:预变性94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;修复延伸72 ℃ 10 min;终止反应4 ℃ 10 min。取5 μL扩增产物使用1%琼脂凝胶电泳检验,并用Bio-RDS凝胶成像仪观察电泳结果。将有荧光反应的PCR扩增产物进行ITS-rDNA测序。所有ITS测序结果使用Seqman软件分析剪切,之后将剪切后的ITS序列上传至NCBI核酸序列数据库与已知序列进行比对,选择相似性高的序列进行分析。使用MEGA-7软件,采用邻接法(Neighbor-Joining,N-J)构建系统发育树。将形态学观察结果与序列对比结果相结合进行分类、排重,将具有代表性的真菌ITS序列上传到GenBank,获取登录号。
1.2.3 菌株发酵提取物的制备将纯培养所得菌株接种于PD培养基中,28 ℃、180 r/min振荡培养7 d。将等体积乙酸乙酯加入真菌PD培养基中,40 kHz超声提取20 min,真空抽滤,静置分层并弃去水层,将乙酸乙酯层减压浓缩后得到提取物。使用二甲基亚砜(Dimethyl Sulfoxide,DMSO)作为助溶剂,将提取物溶解成1.28 mg/mL的药液,备用。
1.2.4 抑菌活性的测定采用96孔板法测定菌株发酵提取物对MASA、SE、SA和SI 4种指示菌的抑菌活性[15]。活化后的指示菌接种于LB培养基,30 ℃、180 r/min振荡培养至对数生长期,调整指示菌悬液浓度为1×106 CFU/mL。96孔板中加入195 μL指示菌悬液,再加入5 μL药液,混匀,使用二倍稀释法将药液稀释。每个孔混匀密封后,于37 ℃培养箱中培养24 h,使用酶标仪于600 nm处测定OD值。青霉素G和氯霉素为两种阳性对照,初浓度都为1 mg/mL,同时设置阴性对照(DMSO)和空白对照(LB培养基)。每个样品设置3个平行样,样品抑菌活性结果用最小抑菌浓度表示,最小抑菌浓度为抑制90%受试菌所需要的最低药物浓度(90% Minimal Inhibitory Concentration,MIC90)。抑制率(%)=(阴性对照吸光值-样品吸光值)/阴性对照吸光值×100%。
2 结果与分析 2.1 可培养真菌的分离结果对采集的饱和盐度样品进行分离纯化,得到16株可培养极端嗜盐真菌,1至6号采样地点菌株数量分别为2、6、0、4、3、1株。其中,在盐田排水池沉积物中分离得到的真菌数量最多。
2.2 可培养真菌的多样性从竹林盐场中分离得到16株真菌,根据菌落形态特征差异进行分类后,对其中12株具有代表性的真菌进行DNA提取和PCR扩增,将菌株的ITS序列经BALST比对,找到与其相似度达97%以上的匹配序列。比对检索结果得到12种极端嗜盐真菌,分属于6科6属,其中丛梗孢科(Moniliaceae)枝孢菌属(Cladosporium)3种,黑粉菌科(Ustilaginaceae)黑孢霉属(Nigrospora)3种,瘤座孢科(Tuberculariaceae)镰刀菌属(Fusarium)3种,格孢腔菌科(Pleosporaceae)链格孢属(Alternaria)1种,暗色孢科(Dematiaceae)弯孢属(Curvularia)1种,隔孢假壳科(Didymosphaeriaceae)Paraphaeosphaeria属1种(表 2,图 1)。
| 序号 Serial number |
菌株编号 Strain number |
最相近菌株(BLAST) Closest strain (BLAST) |
相似度/% Similarity/% |
GenBank登录号 GenBank accessing number |
| 1 | GXIMD00527 | Fusarium incarnatum | 99.44 | ON287016 |
| 2 | GXIMD00528 | Fusarium sp.LD-12 | 100.00 | ON287017 |
| 3 | GXIMD00529 | Paraphaeosphaeria sp.QTYC50 | 100.00 | ON287018 |
| 4 | GXIMD00531 | Nigrospora oryzae | 99.80 | ON287019 |
| 5 | GXIMD00532 | Alternaria alternata | 99.81 | ON287020 |
| 6 | GXIMD00533 | Cladosporium cladosporioides | 100.00 | ON287021 |
| 7 | GXIMD00534 | Cladosporium dominicanum | 100.00 | ON287022 |
| 8 | GXIMD00535 | Cladosporium oxysporum | 99.80 | ON287023 |
| 9 | GXIMD00536 | N.sphaerica | 99.22 | ON287024 |
| 10 | GXIMD00538 | Curvularia hawaiiensis | 99.22 | ON287025 |
| 11 | GXIMD00540 | Nigrospora sp.JS3 | 99.61 | ON287026 |
| 12 | GXIMD00541 | F.chlamydosporum | 99.44 | ON287027 |
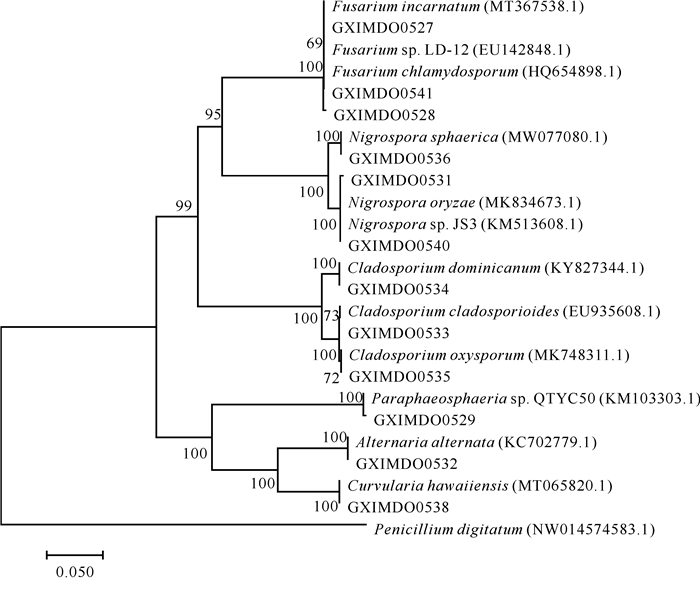
|
| 图 1 基于N-J法构建的系统发育树 Fig. 1 Phylogenetic tree based on the N-J method |
2.3 抑菌活性结果
真菌发酵提取物抗MASA、SE、SA和SI活性结果如表 3所示,其中F.incarnatum GXIMD00527的发酵提取物对4种指示菌都具有极强的抑菌活性(MIC90 < 3.125 μg/mL),其活性作用与阳性对照氯霉素相当;真菌F.chlamydosporum GXIMD00541发酵提取物对4种指示菌的抑菌活性较好(MIC90 < 6.25 μg/mL);真菌Alternaria alternata GXIMD00532、Cladosporium cladosporioides GXIMD00533、Curvularia hawaiiensis GXIMD00538发酵产物对MRSA有一定的抑菌活性(MIC90≤25 μg/mL),对其他3种指示菌表皮葡萄球菌、海豚链球菌和无乳链球菌抑菌活性较弱(MIC90>25 μg/mL)。
| Unit: μg/mL | |||||||||||||||||||||||||||||
| 菌株编号 Number of strain |
MIC90 | ||||||||||||||||||||||||||||
| 耐甲氧西林金黄色葡萄球菌 MRSA |
表皮葡萄球菌 SE |
无乳链球菌 SA |
海豚链球菌 SI |
||||||||||||||||||||||||||
| GXIMD00527 | < 3.125 | < 3.125 | < 3.125 | < 3.125 | |||||||||||||||||||||||||
| GXIMD00532 | 25 | >25 | >25 | >25 | |||||||||||||||||||||||||
| GXIMD00533 | 25 | >25 | >25 | >25 | |||||||||||||||||||||||||
| GXIMD00538 | 12.5 | >25 | >25 | >25 | |||||||||||||||||||||||||
| GXIMD00541 | < 6.25 | < 6.25 | < 6.25 | < 6.25 | |||||||||||||||||||||||||
| Chloramphenicol | < 3.125 | 3.125 | 3.125 | 3.125 | |||||||||||||||||||||||||
| Penicillin | < 0.781 25 | < 0.781 25 | 1.562 5 | >25 | |||||||||||||||||||||||||
| Note: chloramphenicol and penicillin are positive controls. | |||||||||||||||||||||||||||||
3 讨论
为了研究北海竹林盐场极端嗜盐真菌的物种多样性,本课题组于2020年11月在广西北海竹林盐场饱和盐度采样地采集样品,分离得到可培养极端嗜盐真菌16株,鉴定为6科6属12种。陈显强等[14]从2019年5月采集的北海竹林盐场海盐田样品中分离得到26株嗜盐真菌,鉴定为3科4属11种,其中青霉菌属和曲霉属为优势种属,占比分别达到55%和27%。本研究所得嗜盐真菌物种与陈显强等[14]的报道相比,两者均分离得到链格孢属(Alternaria)菌株。但不同的是,本研究分离得到的极端嗜盐真菌物种更丰富,并且优势种属不同,为枝孢菌属(3种)、黑孢霉属(3种)、镰刀菌属(3种)。上述结果表明,不同季节的北海竹林盐场极端嗜盐真菌物种多样性不同。在培养基不变的条件下,增加采样季节,可以更系统地研究北海海盐田极端嗜盐真菌的物种多样性。
本研究发现两株抗菌活性显著的镰刀菌属真菌F.incarnatum GXIMD00527和F.chlamydosporum GXIMD00541。镰刀菌属真菌广泛分布于土壤和有机体内,研究者从不同地域、样品中分离、鉴定出大量的镰刀菌属真菌[16]。该属真菌常常产生有毒物质,如镰刀属真菌毒素会污染食物或牲畜饲料,引发人类或动物的疾病[17]。镰刀菌属真菌除了产生有毒物质外,还拥有较为丰富的次生代谢产物,如生物碱、肽类、酰胺类、萜类、醌类、吡喃酮等,这些代谢产物具有抗肿瘤、抗菌等活性,因此该属真菌具有探索天然活性代谢产物的价值[18]。
嗜盐真菌为了适应极端环境,进化出了特殊的代谢途径。长期生存在高盐环境下,嗜盐真菌有着与普通环境中真菌不一样的生理特性:高盐环境中的Na+对嗜盐真菌细胞膜的结构稳定、细胞壁的结构完整和功能起着重要的作用。此外,嗜盐真菌细胞存在质膜、色素、H+泵、酶,使得嗜盐真菌具有在高盐极端环境下生存的能力[1]。特殊的生理机制造就了嗜盐真菌次生代谢产物丰富、结构新颖、活性优良的特点。本研究中镰刀菌属嗜盐真菌F.incarnatum GXIMD00527、F.chlamydosporum GXIMD00541的乙酸乙酯粗提物具有极好的抑菌活性,目前的研究仅仅局限于粗提物的活性测定,今后将以抑菌活性为导向,探讨两株镰刀菌属嗜盐真菌的具体活性成分。
4 结论本研究分离得到可培养极端嗜盐真菌16株,鉴定为6科6属12种。枝孢菌属、黑孢霉属、镰刀菌属、弯孢属、Paraphaeosphaeria属为首次从北海竹林盐场中分离得到,丰富了北海竹林盐场嗜盐真菌的物种多样性。本研究考察了北海竹林盐场嗜盐真菌的抑菌活性,其中镰刀菌属真菌F.incarnatum GXIMD00527、F.chlamydosporum GXIMD00541的发酵产物对4株测试细菌均表现出显著的抑菌活性,后续可进一步扩大发酵研究,探究其活性成分。本研究丰富了嗜盐真菌的物种多样性,为北部湾嗜盐真菌资源的进一步开发利用提供了菌种支持。
| [1] |
BUCHALO A S, NEVO E, WASSER S P, et al. Fungal life in the extremely hypersaline water of the Dead Sea: first records[J]. Proceedings: Biological Sciences, 1998, 265(1404): 1461-1465. DOI:10.1098/rspb.1998.0458 |
| [2] |
GUNDE-CIMERMAN N, ZALAR P, DE HOOG S, et al. Hypersaline waters in salterns-natural ecological niches for halophilic black yeasts[J]. Fems Microbiology Ecology, 2000, 32(3): 235-240. |
| [3] |
MA Y, GALINSKI E A, GRANT W D, et al. Halophiles 2010: life in saline environments[J]. Applied and Environmental Microbiology, 2010, 76(21): 6971-6981. DOI:10.1128/AEM.01868-10 |
| [4] |
陈星宇, 马信, 孙长龙, 等. 嗜盐微生物的研究进展[J]. 盐科学与化工, 2019, 48(2): 1-4. |
| [5] |
曲佳, 刘开辉, 丁小维, 等. 南海局部海洋沉积物中真菌多样性及产酶活性[J]. 微生物学报, 2014, 54(5): 552-562. |
| [6] |
李治滢, 李绍兰, 杨丽源, 等. 云南三个盐矿盐卤沉淀池耐盐真菌的活性研究[J]. 天然产物研究与开发, 2013, 25(11): 1485-1488, 1532. |
| [7] |
王芳. 嗜盐耐盐真菌的分类及系统分类学研究[D]. 泰安: 山东农业大学, 2013.
|
| [8] |
代东梅. 嗜盐耐盐真菌的分类及分子系统学研究[D]. 泰安: 山东农业大学, 2013.
|
| [9] |
林婷婷, 李铭刚, 丁章贵, 等. 昆明盐矿真菌次生代谢产物的分离与鉴定[J]. 云南大学学报(自然科学版), 2017, 39(6): 1065-1072. |
| [10] |
ZHANG S Y, LI Z L, BAI J, et al. A new perylenequinone from a halotolerant fungus, Alternaria sp. M6[J]. Chinese Journal of Natural Medicines, 2012, 10(1): 68-71. DOI:10.1016/S1875-5364(12)60015-6 |
| [11] |
PENG X P, WANG Y, LIU P P, et al. Aromatic compounds from the halotolerant fungal strain of Wallemia sebi PXP-89 in a hypersaline medium[J]. Archives of Pharmacal Research, 2011, 34(6): 907-912. |
| [12] |
曲鹏, 刘培培, 付鹏, 等. 黄河三角洲耐盐真菌Penicillium chrysogenum HK14-01的次生代谢产物[J]. 微生物学报, 2012, 52(9): 1103-1112. |
| [13] |
刘培培, 王文良, 顾谦群, 等. 耐盐真菌Aspergillus variecolor B-17产生的烃基苯甲醛衍生物及其细胞毒活性[J]. 中国海洋大学学报, 2008, 38(4): 585-589. |
| [14] |
陈显强, 邢楠楠, 黄亮华, 等. 嗜盐真菌多样性及其抗肿瘤活性研究[J]. 广西科学, 2020, 27(5): 526-531. |
| [15] |
陆春菊, 陆玫霖, 刘昕明, 等. 广西涠洲岛柳珊瑚共附生真菌多样性及其抑菌活性[J]. 热带海洋学报, 2021, 40(5): 45-52. |
| [16] |
王世伟, 王卿惠, 李小鹏, 等. 镰刀菌分子鉴定与重要应用的研究进展[J]. 微生物学通报, 2018, 45(4): 907-919. |
| [17] |
张向民. 镰刀菌属分类学研究历史与现状[J]. 菌物研究, 2005, 3(2): 59-62. |
| [18] |
LI M Z, YU R L, BAI X L, et al. Fusarium: a treasure trove of bioactive secondary metabolites[J]. Natural Product Reports, 2020, 37(12): 1568-1588. |



