2. 白山市科学技术研究所,吉林白山 134300
2. Baishan Institute of Science and Technology, Baishan, Jilin, 134300, China
人参(Panax ginseng C.A.Meyer)是五加科(Araliaceae)人参属(Panax L.)多年生宿根草本植物,是一种名贵的中药材,在中国主要分布于长白山地区,具有治疗神经系统、心脑血管系统疾病,抗肿瘤等方面的作用[1]。由于野生人参资源较为稀少,早在西晋时期便开始人参栽培,清朝乾隆至同治年间,人参栽培发展迅速,规模逐渐扩大[2]。如今随着市场需求的增加,人参的栽培已较为常见,其中林下参的品质较高。
人参极易发生土传病害和连作障碍,有关文献表明,酚酸类自毒物质的积累,是导致人参连作障碍的主要原因[3, 4]。但李崇玮等[5]研究发现西洋参连作过程中出现了酚酸类代谢产物含量降低的现象。杨莉等[6]证实人参根际分泌物中有机酸类物质(苯甲酸、邻苯二甲酸、己二酸、丁二酸)即公认的化感物质,对人参生防菌的促进作用大于病原菌,对部分病原菌生长具有直接的抑制活性。
连作是土传病害的主要成因,林间连续种植人参,使得人参土传病害的致病菌连年繁殖,在土壤中大量积累进而形成病土,并且可以通过土壤和病残体进行传播,从根部或茎部侵害作物导致其发生病害,并且土传病害具有分布广、传播快、危害大等特点[7]。人参作为以根部入药的植物,土传病害严重影响了人参的产量及质量[8]。本研究采样地为吉林省临江市人参实验基地,2年参苗移栽4年后出现了健康和严重土传病害(人参根腐病和人参锈腐病)两种现象,为开展连作和土传病害对土壤微生物群落影响的研究提供了可靠样本。
有关人参连作障碍和土传病害的研究大多集中于土壤病原真菌、土壤微生物群落的变化,以及化感物质的成分组成及含量,而关于土壤微生物群落对酚酸类化感物质变化响应的相关研究较少。因此本研究以空白林地土为对照,以连作健康林地参、连作土传病害严重林地参根际土壤为研究对象,从土壤可培养细菌群落入手,研究酚酸类化感物质对连作人参根际土壤中微生物区系及可培养细菌群落多样性的影响,并探讨连作后健康和土传病害严重两种样品可培养细菌优势菌属差异,为人参连作障碍的研究提供参考。
1 材料与方法 1.1 材料 1.1.1 土壤样品供试土壤样品由吉林省白山市科学技术研究所进行采集,实验基地位置:吉林省临江市蚂蚁河乡三棚湖村(北纬41°51′02.80″,东经127°6′21.81″),海拔833 m。采用五点采样法,所选区域去表层10 cm土后,采集人参根际土并混匀。所采样品置于冰箱-20 ℃保存,用于土壤微生物区系及可培养细菌的变化分析,其余样品自然风干后用于酚酸类物质的提取。对所采样品进行编号,1#样品为未种植人参的林地土壤, 2#样品为2年参苗移栽连作4年、健康林地参根际土壤, 3#样品为2年参苗移栽连作4年、产生严重土传病害林地参根际土壤。每个土壤样品设置3组重复。
1.1.2 试剂细菌DNA提取药品Chelex-100 sodium(美国SIGMA公司),琼脂粉(德国Biofroxx公司),色谱级乙腈(诺尔施科技有限公司)。
1.1.3 仪器与设备ZHJH-C1106B型超净工作台(上海智城分析仪器制造有限公司),ZXSD-B1160型生化培养箱(上海智城分析仪器制造有限公司),ZWY-2212B型全温度恒温摇床(上海智城分析仪器制造有限公司),G154DP型全自动立式高压灭菌锅[致微(厦门)仪器有限公司],BCD-521WDPW型冷藏冷冻冰箱(青岛海尔股份有限公司),AR224CN型电子天平[奥豪斯仪器(常州)有限公司],T100型梯度PCR仪(美国BIO RAD公司),LEGEND MICRO17型微量台式离心机(美国Thermo Fisher公司),DYY-6C型电泳仪(北京六一生物科技有限公司),JY02型紫外透射仪(北京君意东方电泳设备有限公司),LC-100型高效液相色谱仪(上海伍丰科学仪器有限公司),OAA C18色谱柱[月旭科技(上海)股份有限公司],OAA型保护柱[月旭科技(上海)股份有限公司]。
1.2 方法 1.2.1 土壤酚酸类成分的提取与鉴定土壤酚酸提取参照李崇玮等[5]的方法。酚酸混标:分别精密称取香豆酸5.1 mg、香草酸4.6 mg、水杨酸5.0 mg、苯甲酸5.4 mg、肉桂酸4.4 mg、没食子酸4.8 mg、丁香酸4.6 mg、阿魏酸5.0 mg,分别置于1 mL容量瓶中制成母液。梯度稀释后经高效液相色谱(High Performance Liquid Chromatography, HPLC)分析,以酚酸浓度为横坐标、峰面积为纵坐标进行标准曲线绘制。在280 nm紫外波长下进行HPLC检测分析。甲酸水溶液(0.1%,V/V)和乙腈做流动相,进样体积20 μL,流速1.0 mL/min,洗脱梯度为5%-10%乙腈(0-10 min),10%-10%乙腈(10-20 min),10%-35%乙腈(20-60 min),35%-60%乙腈(60-75 min),60%-60%乙腈(75-85 min),60%-5%乙腈(85-86 min),5%-5%乙腈(86-90 min)并保持5 min。每次进样间隔用流动相使柱平衡10 min。
1.2.2 土壤可培养微生物数量的测定土壤细菌、真菌、放线菌数量的测定采用稀释平板计数法[9]。细菌使用牛肉膏蛋白胨琼脂培养基,真菌使用虎红(孟加拉红)琼脂培养基,放线菌使用高氏一号琼脂培养基。
牛肉膏蛋白胨琼脂培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂20 g、水1 000 mL、pH值7.4-7.6。
高氏一号琼脂培养基:硝酸钾1 g、磷酸氢二钾0.5 g、七水硫酸镁0.5 g、氯化钠0.5 g、硫酸亚铁0.01 g、可溶性淀粉20 g、琼脂20 g、水1 000 mL、pH值7.4-7.6。
虎红(孟加拉红)琼脂培养基:蛋白胨5 g、葡萄糖10 g、磷酸二氢钾1 g、七水硫酸镁0.5 g、琼脂20 g、孟加拉红0.033 3 g、氯霉素0.1 g、水1 000 mL。
1.2.3 土壤中可培养细菌的分离纯化采用LB、NB、TSA、Zobell 2216E、R2A 5种培养基,通过稀释涂布和平板划线的方法进行可培养细菌的分离纯化[10]。取-20 ℃保存的土壤样品各2.5 g,加入盛有22.5 mL无菌水和适量无菌玻璃珠的无菌三角瓶内。于摇床上200 r/min、25 ℃振荡10 min,静置后取上清液梯度稀释后涂布。涂布后置于30 ℃恒温培养箱倒置培养3 d。随后采用平板划线的方法对其进行分离纯化。纯化为单一菌株后用甘油管置于-20 ℃冰箱保存。
LB培养基:胰蛋白胨10.0 g/L、酵母浸粉5.0 g/L、氯化钠10 g/L、琼脂15.0 g/L、pH值7.0±0.2(25 ℃)。
NB培养基:蛋白胨10.0 g/L、牛肉浸粉3.0 g/L、氯化钠5.0 g/L、琼脂15.0 g/L、pH值7.2±0.2(25 ℃)。
TSA培养基:胰蛋白胨15.0 g/L、大豆胨5.0 g/L、氯化钠5.0 g/L、琼脂15.0 g/L、pH值7.3±0.2(25 ℃)。
Zobell 2216E培养基:蛋白胨5.0 g/L、酵母粉1.0 g/L、柠檬酸铁0.1 g/L、氯化钠19.45 g/L、氯化镁5.98 g/L、硫酸钠3.24 g/L、氯化钙1.8 g/L、氯化钾0.55 g/L、碳酸钠0.16 g/L、溴化钾0.08 g/L、氯化铯0.034 g/L、硼酸0.022 g/L、硅酸钠0.004 g/L、氟化钠0.002 4 g/L、硝酸铵0.001 6 g/L、磷酸氢二钠0.008 g/L、琼脂15.0 g/L、pH值7.6±0.2(25 ℃)。
R2A培养基:胰蛋白胨0.25 g/L、酸水解酪蛋白0.5 g/L、酵母浸粉0.5 g/L、可溶性淀粉0.5 g/L、磷酸氢二钾0.3 g/L、硫酸镁0.1 g/L、丙酮酸钠0.3 g/L、琼脂12.0 g/L、蛋白胨0.25 g/L、葡萄糖0.5 g/L、pH值7.2±0.2 (25 ℃)。
1.2.4 细菌16S rDNA分子鉴定纯化为单一菌株后进行16S rDNA提取及PCR扩增。采用10%的Chelex-100溶液提取细菌DNA,细菌16S rDNA的鉴定选择通用引物27F(5′-AGAGTTTGATCCTGGCTAG-3′)和1541R(5′-AAGGAGGTGATCCAGCCGCA-3′)作为引物,利用50 μL体系(PCR Mix 25 μL、ddH2O 22 μL、引物27F 1 μL、引物1541R 1 μL、DNA模板1 μL)进行PCR扩增,1%琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司进行测序。测序结果输入EzBioCloud数据库以及NCBI网站进行比对,获得所培养菌株的最相似模式菌株,获取模式菌株16S rDNA基因序列。通过MEGA 6.0软件,采用邻接法(Neighbor-joining)和Kimura双参数模型进行聚类分析并构建系统发育树,设定自展值(Bootstrap value)1 000评估系统发育树的拓扑结构稳定性。
1.2.5 可培养细菌多样性指数采用辛普森(Simpson)多样性指数(D)、香农-威纳(Shannon-Wiener)指数(H)、香农-威纳(Shannon-Wiener)均匀度指数(E)计算3种样品可培养细菌多样性[11]。计算公式如下:
| $ D=1-\sum\limits_{i=1}^S\left(P_i\right)^2=1-\sum\limits_{i=1}^S\left(\frac{N_i}{N}\right)^2, $ |
| $ H=-\sum\limits_{i=1}^S P_i \ln P_i, $ |
| $ E=\frac{H}{\ln S} $ |
式中,S为菌种数。Pi为第i种的多度比例, 即群落中物种i的个体占总个体的比例。Ni是第i种的菌株数,N是所有菌株数总和。
1.2.6 实验数据处理采用Excel软件对实验数据进行统计及初步分析;采用SPSS Statistics 21软件进行数据的显著性分析;采用单因素方差分析(One-way ANOVA)比较显著差异性,显著性水平设置为0.05;采用最小显著性差异(Least Significant Difference, LSD)法进行多重比较分析;采用Origin 2019进行图表的制作。
2 结果与分析 2.1 3种土壤中酚酸类成分及含量的测定图 1为8种酚酸混标及3种土壤样品中酚酸类物质的高效液相色谱分离图,8种酚酸均可良好分离,峰形良好。经高效液相色谱分析,3种土壤样品中均含有实验所选取的8种酚酸标品。表 1为3种土壤样品中酚酸的含量,其中与1#样品相比,2#样品中没食子酸、阿魏酸、肉桂酸的含量出现了积累,含量分别增加26.74%、11.05%、33.50%;3#样品中香豆酸和肉桂酸含量分别增加344.97%、58.62%。而香草酸、丁香酸、水杨酸、苯甲酸含量与预期相反, 出现了不同水平的下降,且差异显著(P<0.05)。
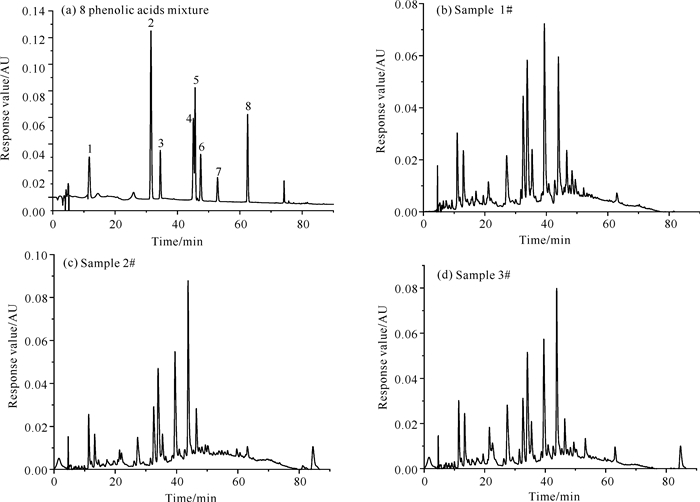
|
| 1.gallic acid, 2.vanillic acid, 3.syringic acid, 4.ferulic acid, 5.salicylic acid, 6.benzoic acid, 7.coumaric acid, 8.cinnamic acid. 图 1 8种酚酸混标及3种土壤样品中酚酸类物质的HPLC分离图 Fig. 1 HPLC separation diagram of 8 phenolic acids mixture and phenolic acid components of three soil samples |
| Unit: mg/kg | |||||||||||||||||||||||||||||
| 样品编号 Sample number |
没食子酸 Gallic acid |
香草酸 Vanillic acid |
丁香酸 Syringic acid |
阿魏酸 Ferulic acid |
水杨酸 Salicylic acid |
苯甲酸 Benzoic acid |
香豆酸 Coumaric acid |
肉桂酸 Cinnamic acid |
|||||||||||||||||||||
| 1# | 2.506±0.000 b | 6.805±0.000 a | 3.127±0.000 a | 1.792±0.000 b | 8.114±0.000 a | 3.728±0.000 a | 0.169±0.000 b | 0.203±0.000 c | |||||||||||||||||||||
| 2# | 3.176±0.000 a | 4.555±0.00 c | 2.251±0.000 c | 1.990±0.000 a | 2.840±0.000 c | 1.648±0.000 c | 0.148±0.000 c | 0.271±0.000 b | |||||||||||||||||||||
| 3# | 2.344±0.000 c | 4.728±0.000 b | 3.073±0.000 b | 1.758±0.000 c | 4.709±0.000 b | 2.977±0.000 b | 0.752±0.000 a | 0.322±0.000 a | |||||||||||||||||||||
| Note: different lowercase letters behind numeric values in the same column indicate significant difference (P<0.05).Note: different lowercase letters behind numeric values in the same column indicate significant difference (P<0.05). | |||||||||||||||||||||||||||||
2.2 3种土壤中可培养微生物区系的探究
表 2为1#样品、2#样品和3#样品可培养微生物数量测试结果。由表 2可知,2#样品和3#样品可培养微生物总量与1#样品相比明显下降,差异显著(P<0.05),细菌和放线菌数量也均低于1#样品,差异显著(P<0.05)。2#样品的真菌数量高于1#样品,但3#样品的真菌数量明显低于1#样品,且两者均差异显著(P<0.05)。真菌群落在土壤总微生物群落中的占比随着人参的长期种植出现明显的上升,由0.067 6%上升为0.245 0%和0.099 3%。土壤可培养微生物区系发生了细菌型向真菌型的转化。
| 样品编号 Sample number |
细菌数量/ (×107 CFU/g) Bacteria number/ (×107 CFU/g) |
真菌数量/ (×104 CFU/g) Fungi number/ (×104 CFU/g) |
放线菌数量/ (×105 CFU/g) Actinomycetes number/ (×105 CFU/g) |
微生物总数量/ (×107 CFU/g) Total microorganisms number/ (×107 CFU/g) |
| 1# | 8.8±0.12 a | 6.0±0.36 b | 7.4±0.48 a | 8.88±0.34 a |
| 2# | 3.4±0.12 b | 8.4±0.36 a | 2.0±0.48 b | 3.43±0.35 b |
| 3# | 2.8±0.12 b | 2.8±0.12 c | 1.8±0.36 b | 2.82±0.35 c |
| Note: different lowercase letters behind numeric values in the same column indicate significant difference (P<0.05). | ||||
2.3 3种土壤中可培养细菌分离鉴定结果
通过多种培养基培养,从3种人参栽培土壤样品中共分离得到193株细菌(含放线菌)。对193株菌进行16S rDNA序列测序,测序结果经EzBioCloud数据库及NCBI网站进行比对,显示193株菌株分属于4门6纲13目19科39属96种。表 3为1#样品、2#样品和3#样品的可培养细菌的纲水平相对分离频率。2#样品芽孢杆菌纲Bacilli和放线菌纲Actinobacteria的相对分离频率明显上升,β-变形菌纲Betaproteobacteria的相对分离频率下降,3#样品中芽孢杆菌纲的相对分离频率下降,放线菌纲的相对分离频率上升。表明土传病害导致土壤中芽孢杆菌纲和变形菌纲细菌含量显著下降,放线菌纲细菌含量明显上升。
| 样品编号 Sample number |
纲 Class |
细菌株数 Number of bacteria |
相对分离频率/% Relative isolation frequency/% |
| 1# | Bacilli | 31 | 51.67 |
| Actinobacteria | 15 | 25.00 | |
| Betaproteobacteria | 8 | 13.33 | |
| Gammaproteobacteria | 3 | 5.00 | |
| Alphaproteobacteria | 3 | 5.00 | |
| 2# | Bacilli | 48 | 64.00 |
| Actinobacteria | 21 | 28.00 | |
| Gammaproteobacteria | 6 | 8.00 | |
| 3# | Bacilli | 28 | 48.28 |
| Actinobacteria | 24 | 41.38 | |
| Alphaproteobacteria | 2 | 3.45 | |
| Gammaproteobacteria | 2 | 3.45 | |
| Betaproteobacteria | 1 | 1.72 | |
| Sphingobacteriia | 1 | 1.72 |
图 2为1#样品、2#样品和3#样品属水平相对分离频率。1#样品和2#样品芽孢杆菌属Bacillus相对分离频率最高,分别为15.00%和21.33%,3#样品链霉菌属Streptomyces相对分离频率最高,为24.14%。类芽孢杆菌属Paenibacillus相对分离频率出现明显降低,在3种土壤样品中分别为11.67%(1#样品)、10.67%(2#样品)、6.90%(3#样品)。
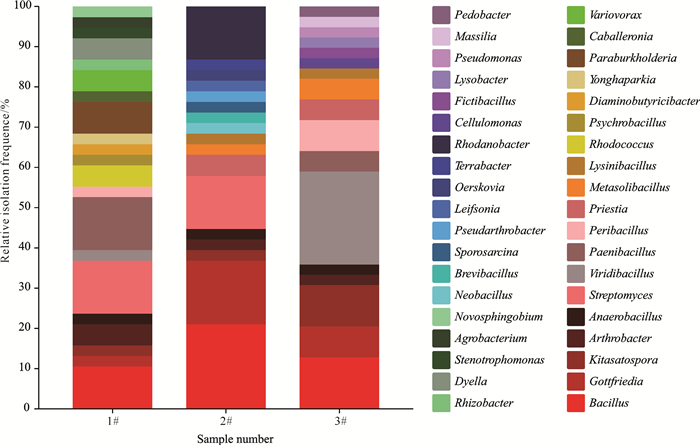
|
| 图 2 3种土壤样品可培养细菌属水平相对分离频率 Fig. 2 Relative isolation frequency of culturable bacteria in the three soil samples at genus level |
表 4为3种土壤样品可培养细菌多样性指数。3#样品中土壤可培养细菌的辛普森多样性指数、香农-威纳指数、香农-威纳均匀度指数均最高,2#样品最低,3种样品的多样性差异并不明显。
| 样品编号 Sample number |
多样性指数Diversity index | ||
| 辛普森多样性指数 Simpson (D) |
香农-威纳指数 Shannon-Wiener (H) |
香农-威纳均匀度指数 Shannon-Wiener evenness index (E) |
|
| 1# | 0.951 7 | 3.339 9 | 0.932 0 |
| 2# | 0.950 4 | 3.319 2 | 0.919 2 |
| 3# | 0.957 2 | 3.374 2 | 0.949 0 |
2.4 3种土壤中可培养细菌及酚酸含量的相关性分析
相关热图分别显示了可培养细菌纲水平[图 3(a)]和属水平[图 3(b)]相对丰度与酚酸成分含量之间的关系。香草酸的含量与α-变形菌纲和γ-变形菌纲的相对丰度呈显著正相关,与芽孢杆菌纲的相对丰度呈显著负相关;水杨酸的含量与γ-变形菌纲的相对丰度呈显著正相关,与芽孢杆菌纲的相对丰度呈显著负相关;香豆酸的含量与放线菌纲和鞘脂杆菌纲的相对丰度呈显著正相关;肉桂酸的含量和β-变形菌纲的相对丰度呈显著负相关。
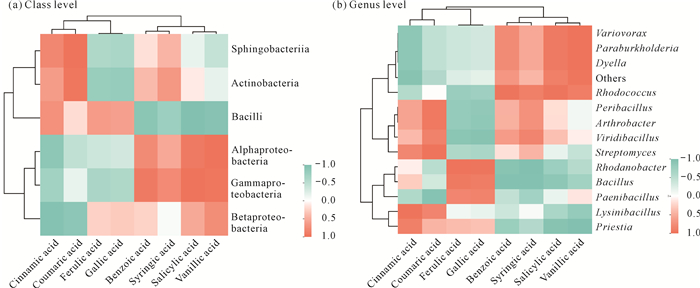
|
| 图 3 可培养细菌相对丰度与酚酸成分含量的相关性热图 Fig. 3 Heatmap of correlation between relative abundance of culturable bacteria and the content of phenolic acids |
香草酸的含量与副伯克霍尔德氏菌属Paraburkholderia、贪噬菌属Variovorax、戴氏菌属Dyella的相对丰度呈显著正相关,与普里斯特氏菌属Priestia的相对丰度呈显著负相关;没食子酸和阿魏酸的含量与罗河杆菌属Rhodanobacter的相对丰度呈显著正相关;丁香酸的含量与芽孢杆菌属和罗河杆菌属的相对丰度呈显著负相关;水杨酸、苯甲酸的含量与红球菌属Rhodococcus的相对丰度呈显著正相关;苯甲酸的含量与芽孢杆菌属的相对丰度呈显著负相关;香豆酸的含量与链霉菌属呈显著正相关,与芽孢杆菌属和类芽孢杆菌属呈负相关;肉桂酸的含量与赖氨酸芽孢杆菌属Lysinibacillus的相对丰度呈显著正相关。
3 讨论 3.1 连作和土传病害对人参根际土壤中微生物区系及可培养细菌群落多样性的影响土壤微生物区系的数量及分布特征是评价土壤质量的生物学指标。通过对3种土壤样品的研究发现,连作导致土壤样品中的微生物数量总量呈现降低的趋势,这与杨珍等[12]的报道一致。人参的连作使根际土壤中真菌数量呈现上升趋势,土壤微生物区系发生了细菌型向真菌型的转变。推测是由于土壤酸化,而酸性的土壤环境更适合真菌生长[13, 14],进而导致真菌数量上升。扈进冬等[15]认为真菌数量的上升进一步导致土传真菌病的发生,严重影响了人参的生长。上述的土壤微生物数量的变化特征,与Wu等[16]、刘晔等[17]的报道一致。
通过对不同土壤样品中可培养细菌群落的研究发现,连作和严重的土传病害未导致人参根际可培养细菌多样性下降,但土传病害导致根际土壤中芽孢杆菌纲和变形菌纲细菌含量显著下降,放线菌纲细菌含量明显上升,土壤中优势菌属也由芽孢杆菌属转变为链霉菌属,类芽孢杆菌属的相对分离频率明显下降。其中链霉菌属相对分离频率的上升与Tan等[18]的研究不符,值得关注。
芽孢杆菌属细菌在大多数研究中被证实具有广谱的生物防治性能[19, 20],是人参常见土传病害生物防治的主要菌属。张宁等[21]发现贝莱斯芽孢杆菌Bacillus velezensis具有广谱抑菌作用,对人参黑斑病具有显著的防治效果。Kim等[22]分离获得1株解淀粉芽孢杆菌B.amyloliquefaciens AK-0,对人参锈腐病、人参根腐病、人参灰霉病的病原菌具有良好的体外抑制效果。类芽孢杆菌属细菌同样对人参灰霉病、人参根腐病、人参菌核病等土传病害表现出良好的抑菌潜力[23]。因此推断2#样品连作却未出现土传病害是由于样品中含有较高丰度的芽孢杆菌属和类芽孢杆菌属。
链霉菌属作为人参病害生防放线菌的主要菌属,可以产生次级代谢产物抑制病原菌的生长,诱导人参产生防御酶增强对病原菌的抗性。链霉菌属细菌有种类丰富的代谢产物,其中最主要的是抗生素类物质[24],如大环内酯类抗生素、氨基糖苷类抗生素、四环素等。而抗生素可以通过抑制细胞壁的合成、干扰蛋白质的合成、抑制核酸的复制和转录来抑制微生物的生长[25]。虽然链霉菌属中大多数菌常被用来做广谱抗菌剂,用来控制通过土壤和种子传播的植物疾病[26], 但高玉婷等[27]发现分离自土壤的黄灰链霉菌Streptomyces flavogriseus对枯草芽孢杆菌B.subtilis具有抑制作用。陶宗[28]发现链霉菌属潜在新种潭州链霉菌S.tanzhouensis sp.nov.对芽孢杆菌属细菌具有广谱的抑菌性。故推断3#样品中链霉菌属相对分离频率的上升并未缓解人参的连作障碍,是由于高丰度的链霉菌属抑制了芽孢杆菌属和类芽孢杆菌属等细菌的增殖。
3.2 连作和土传病害对人参根际土壤中酚酸类成分含量的影响本研究采用的8种酚酸标准品在3种样品中均有检测到,其中含有没食子酸、水杨酸、苯甲酸、肉桂酸,与李自博等[29]对连作人参根系土壤中的酚酸类物质的研究结果一致。但本研究中酚酸含量与预期不符,香草酸、丁香酸、水杨酸和苯甲酸没有积累,相反出现了显著下降的现象。李崇玮等[5]也在研究中发现在收获西洋参后恢复一年的老参地中的苯甲酸含量显著低于未种植过西洋参的对照组。没食子酸和阿魏酸在2#样品中显著积累,在3#样品中出现下降。肉桂酸在人参连作后出现显著积累,香豆酸在发生土传病害的土样中显著积累。吴立洁等[30]研究发现,香豆酸会影响与人参同属药材三七的苗高、发芽率及根长等。
3.3 酚酸类化感物质对连作人参根际土壤中微生物区系及可培养细菌群落多样性的影响相关性分析表明,香草酸和水杨酸含量的下降以及肉桂酸含量的积累共同导致了变形菌门相对丰度的下降。变形菌门具有物质转化和分解植物残体的功能,能促进土壤养分循环、维持土壤的生态平衡,是土壤中物质循环的重要组成[31]。香草酸、水杨酸、丁香酸和苯甲酸含量的下降以及肉桂酸含量的上升变化对芽孢杆菌纲生防菌的富集有促进作用。芽孢杆菌纲细菌中的芽孢杆菌属[32]和类芽孢杆菌属[33]具有广谱的生物防治性能,对人参常见土传病害具有生物防治的功能。香豆酸含量的积累抑制了类芽孢杆菌属菌株的富集,同时促进了链霉菌属菌株的富集。查阅文献发现,酚酸类成分对部分病原真菌具有低促高抑的现象,如李自博等[34]曾报道酚酸类化合物在高浓度下可以抑制西洋参疫霉病病原菌的生长。故推测本研究中香草酸、水杨酸、丁香酸、苯甲酸和肉桂酸含量的变化有利于人参的健康生长,而香豆酸是人参连作障碍的主导化感物质。
4 结论本研究通过对连作4年的健康和土传病害人参根际土壤的研究,发现连作导致根际土壤中微生物总量下降,微生物区系由细菌型转变为真菌型。土传病害导致芽孢杆菌属、类芽孢杆菌属细菌丰度下降,链霉菌属丰度上升。以上3种土壤微生物的变化以及香豆酸含量的积累可能是导致人参土传病害进而发生连作障碍的主要原因。香草酸、水杨酸、丁香酸和苯甲酸含量的下降和肉桂酸含量的积累促进生防菌和有益菌群的富集。关于酚酸类物质是否导致人参的连作障碍仍有待研究。
| [1] |
黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-166. DOI:10.3321/j.issn:0253-2670.2009.01.049 |
| [2] |
彭浩, 吕龙石. 中国人参药用和栽培史及关键栽培技术研究[J]. 安徽农业科学, 2012, 40(20): 10400-10402, 10434. |
| [3] |
李敏, 闫兴富, 马丽, 等. 酚酸类化感自毒物质对枸杞种子萌发的抑制作用[J]. 生态学报, 2020, 40(6): 2072-2079. |
| [4] |
王倩, 李晓林. 苯甲酸和肉桂酸对西瓜幼苗生长及枯萎病发生的作用[J]. 中国农业大学学报, 2003, 8(1): 83-86. DOI:10.3321/j.issn:1007-4333.2003.01.019 |
| [5] |
李崇玮, 柏新富, 陈国忠, 等. 不同恢复年限老参地土壤养分以及酚酸类代谢物含量差异[J]. 植物生态学报, 2021, 45(11): 1263-1274. |
| [6] |
杨莉, 于俐, 孙卓, 等. 人参根系分泌物中有机酸及皂苷对人参病原菌与生防菌的化感差异研究[J]. 中国农业科技导报, 2022, 24(6): 145-155. |
| [7] |
王瑞, 董林林, 徐江, 等. 基于病虫害综合防治的人参连作障碍消减策略[J]. 中国中药杂志, 2016, 41(21): 3890-3896. |
| [8] |
邵财. 人参连作障碍化感作用研究[D]. 北京: 中国农业科学院, 2009.
|
| [9] |
程琳. 不同荒漠草原和主要植物根际土壤细菌多样性研究[D]. 兰州: 兰州理工大学, 2017.
|
| [10] |
詹伟. 金钗石斛根际土壤细菌和放线菌分离及抑菌活性研究[D]. 贵阳: 贵州师范大学, 2016.
|
| [11] |
戚珊珊, 周礼红, 胡久平, 等. 西藏多地区土壤可培养细菌的分离鉴定及多样性分析[J]. 西南农业学报, 2017, 30(7): 1629-1635. |
| [12] |
杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22. |
| [13] |
王孝国, 胡文革, 陈登稳, 等. 新疆艾比湖精河入湖口湖滨湿地土壤微生物区系研究[J]. 西南农业学报, 2012, 25(3): 972-976. DOI:10.3969/j.issn.1001-4829.2012.03.047 |
| [14] |
谢龙莲, 陈秋波, 王真辉, 等. 环境变化对土壤微生物的影响[J]. 热带农业科学, 2004(3): 39-47. |
| [15] |
扈进冬, 杨在东, 吴远征, 等. 哈茨木霉拌种对冬小麦生长、土传病害及根际真菌群落的影响[J]. 植物保护, 2021, 47(5): 35-40. |
| [16] |
WU L K, WANG J Y, HUANG W M, et al. Plant-microbe rhizosphere interactions mediated by Rehmannia glutinosa root exudates under consecutive monoculture[J]. Scientific Reports, 2015, 5(1): 15871. |
| [17] |
刘晔, 姜瑛, 王国文, 等. 不同连作年限对植烟土壤理化性状及微生物区系的影响[J]. 中国农学通报, 2016, 32(13): 136-140. |
| [18] |
TAN Y, CUI Y S, LI H Y, et al. Diversity and composition of rhizospheric soil and root endogenous bacteria in Panax notoginseng during continuous cropping practices[J]. Journal of Basic Microbiology, 2017, 57(4): 337-344. |
| [19] |
SWAIN M R, RAY R C. Biocontrol and other beneficial activities of Bacillus subtilis isolated from cowdung microflora[J]. Microbiological Research, 2009, 164(2): 121-130. |
| [20] |
王捷. 苹果腐烂病生防芽孢杆菌的筛选鉴定及其防治效果初探[D]. 咸阳: 西北农林科技大学, 2022.
|
| [21] |
张宁, 张晶晶, 李雅淑, 等. 人参黑斑病生防菌的分离鉴定及防效[J]. 中国生物防治学报, 2022, 38(5): 1308-1315. |
| [22] |
KIM Y S, BALARAJU K, JEON Y H. Biological characteristics of Bacillus amyloliquefaciens AK-0 and suppression of ginseng root rot caused by Cylindrocarpon destructans[J]. Journal of Applied Microbiology, 2017, 122(1): 166-179. |
| [23] |
章亚博, 王丽伟, 赵敏, 等. 人参土传病害生防微生物及其抑菌促生机制研究进展[J]. 中国植保导刊, 2022, 42(5): 20-26, 33. |
| [24] |
CLARDY J, FISCHBACH M A, WALSH C T. New antibiotics from bacterial natural products[J]. Nature Biotechnology, 2006, 24(12): 1541-1550. |
| [25] |
GOODFELLOW M, WILLIAMS S T. Ecology of Actinomycetes[J]. Annual Review of Microbiology, 1983, 37(1): 189-216. |
| [26] |
黄媛林, 潘信利, 陆璐, 等. 一株红树林链霉菌所产抑菌活性化合物的分离及其生物合成基因簇的研究[J]. 中国抗生素杂志, 2021, 46(12): 1090-1101. |
| [27] |
高玉婷, 邓巍, 张发, 等. 4株链霉菌的鉴定及抑菌活性研究[J]. 大理大学学报, 2022, 7(6): 91-96. |
| [28] |
陶宗. 青钱柳叶黑枯病菌拮抗微生物筛选、鉴定及抗生机理初步研究[D]. 湘潭: 湖南科技大学, 2019.
|
| [29] |
李自博, 周如军, 傅俊范. 哈茨木霉菌Tri41对连作人参根际土壤中酚酸类物质的消减作用[J]. 沈阳农业大学学报, 2016, 47(6): 661-666. |
| [30] |
吴立洁, 刘杰, 王文祎, 等. 三七根际土壤中酚酸类物质的鉴定及含量测定[J]. 世界科学技术-中医药现代化, 2014, 16(4): 825-829. |
| [31] |
TANG L L, FAN C, YUAN H M, et al. The effect of rotational cropping of industrial hemp (Cannabis sativa L.) on rhizosphere soil microbial communities[J]. Agronomy, 2022, 12(10): 2293. |
| [32] |
ASATUROVA A M, ZHEVNOVA N A, TOMASHE-VICH N S, et al. Evaluation of Bacillus velezensis biocontrol potential against fusarium fungi on winter wheat[J]. Agronomy, 2022, 12(8): 1956. |
| [33] |
史洪丽, 李腊, 郭翠梅, 等. 番茄灰霉病生防菌株TL1的分离、鉴定及其生防能力分析[J]. 园艺学报, 2023, 50(1): 79-90. |
| [34] |
李自博, 周如军, 解宇娇, 等. 人参连作根际土壤中酚酸物质对人参锈腐病菌的化感效应[J]. 应用生态学报, 2016, 27(11): 3616-3622. |



