2. 河池学院化学与生物工程学院,广西河池 546300;
3. 河池学院广西现代蚕桑丝绸协同创新中心,广西河池 546300
2. College of Chemical and Biological Engineering, Hechi University, Hechi, Guangxi, 546300, China;
3. Guangxi Collaborative Innovation Center of Modern Sericulture and Silk, Hechi University, Hechi, Guangxi, 546300, China
“根际”一词最早由德国微生物学家Lorenz Hiltner提出,是指与植物根系紧密接触的、距根面1-2 mm的土壤环境[1]。根际土壤受植物根系的直接影响,在能量代谢和物质循环方面最为活跃,是植物和微生物相互作用的重要场所[2, 3],因此,近年来根际土壤细菌群落组成特征及其对根系的响应备受关注[4]。
根际土壤细菌群落与植物根系在长期作用过程中形成了协同进化和互惠共生的关系[5]。植物代谢的碳有10%-40%以根分泌物、黏液、溶解物和脱落细胞等形式转移到土壤中[6],这些有机物能为根际土壤提供较为丰富的碳源,能够刺激或抑制微生物活性和种群的发展,从而引起根际土壤环境微生物群落组成的演替变化[7, 8]。土壤中细菌群落的代谢活动能促进碳、氮、磷、钾等元素化合物的分解[9-13],增加植物营养元素的有效性[14, 15];土壤细菌群落还可以通过产生植物生长激素等促进植物生长[16],同时,一些细菌群落还能分泌抑菌类次生代谢产物,通过抑制病原微生物的生长而保护植物免受侵害, 为抵御土壤传播病原体的根系感染提供了第一道防线[14, 17-20],在保护植物免受病原体的侵害和促进植物生长等方面发挥重要作用。因此,在农业上,作物根际和非根际土壤细菌群落组成特征可以反映土壤肥力和健康状况[21];在自然生态环境的研究中,对植物根际土壤与非根际土壤细菌群落组成的研究,在理解生态系统功能方面具有重要意义[22]。而植物和土壤细菌群落之间的相互作用关系复杂而多样,不同植物对细菌群落组成与功能的影响不同[7],所以有必要进一步开展不同植物根际和非根际土壤环境细菌群落组成特征、功能特征及其对环境响应方面的调查研究。
河岸带是河流与陆地的交错地带,具有拦截污染、保持水土、维护景观和生物多样性等生态服务功能[23-27],受到洪水冲刷和水位涨落的影响,河岸带稳定性较低,极易发生水土流失[27],因此,良好的植被条件是河岸带发挥正常生态服务功能的基础。撑篙竹(Bambusa pervariabilis McClure)是华南地区河岸带广泛分布的植物种类,在河岸护坡固岸和防止水土流失方面发挥重要作用,其发达的须根系能有效截留和吸收河岸带土壤中的污染物,从而保护河流免受污染,但是关于撑篙竹的研究多局限于其药用价值的研究[28],而其生态服务功能的研究鲜有报道。龙江河为珠江水系上游重要支流,地处典型喀斯特地貌环境,土地资源匮乏,土壤侵蚀严重,对其河岸带的保护十分必要。因此,本研究选取龙江河河岸带为研究区域,研究撑篙竹根际和非根际土壤中细菌群落组成特征、功能差异及其环境影响因子,以期为河岸带生态环境保护提供基础数据支撑。
1 材料与方法 1.1 样品采集本实验样品采集于广西龙江河沿岸,采样区域分布于龙江河宜州段的上游怀远古镇至下游三岔镇,依次设置8个采样点,采样点经纬度如表 1所示。各采样点均选取有撑篙竹生长的地方,分别采集0-20 cm的根际土壤(Rhizosphere soil,简称:R,分别标记为R1、R2、R3、……、R8)和非根际土壤(Bulk soil,简称:B,分别标记为B1、B2、B3、……、B8),其中,根际土壤为附着在竹根表面1-2 mm的土壤[1, 29],非根际土壤为竹根附近与竹根距离较远的土壤。根际土壤和非根际土壤均分别采集2组,其中一组采集约1 kg (根际土壤约0.3 kg),装入聚乙烯塑料袋,带回实验室风干,用于理化指标测定;另一组分别取适量根际和非根际土壤装入配有DNA保存液的50 mL离心管中,置于冰上,带回实验室-80 ℃保存,用于土壤中细菌DNA提取。共采集到16个土壤样品。
| 采样点 Sampling site |
经度(E) Longitude (E) |
纬度(N) Latitude (N) |
| A | 108.488 0° | 24.563 6° |
| B | 108.537 5° | 24.543 5° |
| C | 108.506 1° | 24.567 2° |
| D | 108.634 0° | 24.500 2° |
| E | 108.677 1° | 24.494 1° |
| F | 108.792 6° | 24.518 3° |
| G | 108.841 7° | 24.533 3° |
| H | 108.960 3° | 24.471 4° |
1.2 土壤理化因子检测
风干土壤过10目尼龙筛后,将去离子水和土壤按2.5∶1(体积∶质量)比例混匀1 min,静置30 min,用pH计测定pH值;采用1 mol/L KCl溶液浸提,连续流动分析仪测定氨氮(NH4+-N)、硝氮(NO3--N)和亚硝氮(NO2--N)含量;采用0.5 mol/L NaHCO3溶液浸提,钼锑抗显色,紫外可见分光光度计测定速效磷(Available Phosphorus,AP)含量;采用重铬酸钾稀释热法测定土壤有机碳(Soil Organic Carbon,SOC)含量,土壤有机质(Soil Organic Matter,SOM)含量等于SOC含量乘以1.724;采用烘干法测定土壤水分含量(Moisture Content,MC)。
1.3 DNA提取、PCR扩增及高通量测序土壤细菌DNA提取按照FastDNA®Spin Kit for Soil说明书进行,DNA提取后采用1%琼脂糖凝胶电泳,以DNA Marker为对照检测;DNA浓度通过紫外可见分光光度计检测,确保满足测序要求后,将经过纯化后的DNA溶于50 μL的TE缓冲液中,置于冰上,送到上海美吉生物医药科技有限公司(以下简称美吉生物公司)进行16S rRNA基因测序。PCR扩增选择细菌16S rRNA基因通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAY-3′),16S rRNA基因扩增区域为V3-V4高变区[30],高通量测序在美吉生物公司Illumina MiSeq PE300平台进行。
1.4 数据分析细菌群落原始测序数据已上传至NCBI网站(编号为PRJNA882635)。结果分析及图形绘制采用美吉生物-生信云工具(https://cloud.majorbio.com/)完成,数据分析前,采用云平台自带的分析模块按最小样本序列数进行数据抽平处理[31]。α多样性指数组间差异分析采用Student′s t检验方法;PCoA分析基于Bray-Curtis距离算法进行,组间差异检验采用相似性分析(ANOSIM)方法;细菌群落组成组间差异分析采用Student′s t检验方法、错误发现率(False Discovery Rate,FDR)多重检验校正;门水平上物种相对丰度与环境因子的相关性分析采用Spearman相关系数类型Average层级聚类方式。单因素网络分析方法选取相对丰度前50的属构建|Spearman相关系数|≥0.5且P<0.05的网络,网络图中的每个节点代表一个属,每条边代表节点之间存在显著相关性,使用Gephi 0.9.2软件计算每个网络图的拓扑参数,包括平均度、边数、平均聚类系数、平均路径长度、网络密度[32]。土壤环境理化因子数据采用Excel 2010软件进行处理;环境理化因子之间的相关性采用IBM SPSS Statistics 24软件进行分析,多重比较选择ANOVA检验。
2 结果与分析 2.1 撑篙竹根际和非根际土壤营养与环境理化因子分析撑篙竹根际和非根际土壤环境理化因子及其Pearson相关性分析见表 2。根际土壤pH值、NH4+-N、NO3--N和AP均低于非根际土壤,其中pH值和NH4+-N在根际和非根际土壤之间差异显著(P<0.05);根际和非根际土壤中NO2--N、MC和SOM含量差异不显著(P>0.05)。
| 理化指标 Physical and chemical factors |
测定值(平均值±标准差) Measured value (Mean±standard deviation) |
Pearson相关性系数 Pearson correlation coefficient |
||||||||
| R | B | pH值 pH value |
NH4+-N | NO2--N | NO3--N | AP | MC | SOM | ||
| pH value | 7.37±0.16b | 7.67±0.17a | 1.000 | 0.628** | 0.211 | 0.352 | 0.093 | -0.462 | -0.584* | |
| NH4+-N | 16.93±0.52b | 17.86±1.09a | 1.000 | -0.110 | -0.216 | -0.062 | -0.232 | -0.387 | ||
| NO2--N | 0.06±0.02a | 0.06±0.02a | 1.000 | 0.507* | 0.226 | -0.117 | -0.345 | |||
| NO3--N | 1.07±0.61a | 1.22±0.63a | 1.000 | 0.501* | -0.441 | -0.489 | ||||
| AP | 2.59±1.24a | 2.83±0.81a | 1.000 | -0.330 | -0.313 | |||||
| MC | 22.59±0.94a | 22.02±0.67a | 1.000 | 0.654** | ||||||
| SOM | 21.56±0.65a | 21.09±0.57a | 1.000 | |||||||
| Note: * indicates significant correlation (P<0.05);** indicates extremely significant correlation (P<0.01);different lowercase letter indicates significant difference at the P<0.05 level between two types of soil; the unit of the measured value is mg/kg, except pH value. | ||||||||||
根际和非根际土壤共16个样本各项环境理化因子之间相关性分析的结果(表 2)显示,pH值与NH4+-N、NO2--N与NO3--N、NO3--N与AP,以及MC与SOM这4组环境理化因子之间存在显著正相关关系,其中,pH值与NH4+-N、MC与SOM这2组之间相关性达到极显著水平(P<0.01),其他2组之间则达到显著水平(P<0.05)。pH值与SOM之间存在显著负相关关系,其他理化因子之间部分存在一定的相关性,但是相关性均不显著。
2.2 细菌群落组成与结构特征 2.2.1 细菌群落组成多样性分析通过对细菌群落16S rRNA基因Illumina MiSeq高通量测序,龙江河岸撑篙竹根际和非根际土壤中共获得有效序列534 206条,以97%相似性阈值进行微生物操作分类单元(Operational Taxonomic Unit, OTU)聚类,在根际和非根际土壤中分别获得5 117和5 274个OTUs。Venn图显示,根际和非根际土壤共有的OTUs为4 460个,非根际土壤特有的OTUs较根际土壤的高[图 1(a)]。
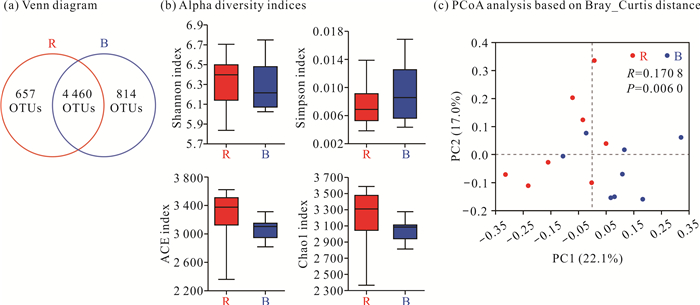
|
| 图 1 撑篙竹根际与非根际土壤细菌群落组成多样性分析 Fig. 1 Richness and diversity of bacterial communities in rhizosphere and bulk soil of B.pervariabilis McClure |
通过对16S rRNA基因高通量测序结果比对,进行撑篙竹根际和非根际土壤细菌群落丰富度和多样性指数统计[图 1: (b)(c)]。α多样性分析结果[图 1(b)]显示,根际土壤中Shannon指数高于非根际土壤,而Simpson指数低于非根际土壤,已有研究表明Shannon指数对物种丰富度更敏感,而Simpson指数对物种的均匀度更敏感[33],结合根际土壤中ACE和Chao1指数均高于非根际土壤,可判定根际土壤细菌群落丰富度较非根际土壤高,而多样性较非根际土壤低。基于Bray_Curtis距离,在OTU水平上对根际和非根际土壤进行PCoA分析[图 1(c)],结果显示PC1和PC2分别解释了22.1%、17.0%的变异,累计解释度达到39.1%,基于ANOSIM组间差异检验,根际和非根际土壤的细菌群落组成存在显著差异(R=0.170 8,P=0.006 0)。
2.2.2 细菌群落组成分析在门和纲水平上,撑篙竹根际和非根际土壤中细菌群落组成种类相似,但是不同采样点之间,根际土壤细菌群落的相对丰度变化较大,而非根际土壤细菌群落的相对丰度分布较均匀(图 2)。Dai等[34]按照不同的物种相对丰度提出了物种的划分方法,即在所有样本中相对丰度均大于1%的物种为丰富物种,在0.1%-1%的为中等物种,小于0.1%的为稀有物种。根据该分类方法,龙江河岸撑篙竹根际与非根际土壤的细菌群落相对丰度前15的门和纲均属于中等物种及以上水平。
在门水平上,属于丰富物种的细菌群落有放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadota)、髌骨菌门(Patescibacteria)、黏球菌门(Myxococcota)等7个门,它们在根际土壤中平均相对丰度分别为26.93%、17.63%、12.17%、12.14%、7.94%、4.28%和3.25%,在非根际土壤中平均相对丰度分别为19.78%、16.46%、16.66%、13.32%、11.93%、2.64%和3.00%。其中,根际土壤中放线菌门、变形菌门、髌骨菌门和黏球菌门4个门的相对丰度高于非根际土壤,在根际土壤中表现出一定程度的富集现象,而其他3个门的相对丰度则在非根际土壤中更高。此外,根际土壤中属于丰富物种的门还有蓝藻门(Cyanobacteriota,2.65%),非根际土壤中还有Latescibacterota (1.53%)和浮霉菌门(Planctomycetota,2.02%)。

|
| Ra is the average relative abundance in the rhizosphere soil; Ba is the average relative abundance in the bulk soil. 图 2 撑篙竹根际与非根际土壤相对丰度前15的细菌群落组成 Fig. 2 Composition of bacterial communities in the top 15 relative abundance in rhizosphere and bulk soil of B.pervariabilis McClure |
在纲水平上,根际和非根际土壤中属于丰富物种的细菌群落有放线菌纲(Actinobacteria)、γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、Vicinamibacteria、芽单胞菌纲(Gemmatimonadetes)、嗜热油菌纲(Thermoleophilia)、厌氧绳菌纲(Anaerolineae)、酸微菌纲(Acidimicrobiia)、KD4-96和Polyangia等10个,它们在根际土壤中相对丰度分别为13.89%、9.56%、8.06%、7.89%、7.52%、7.74%、3.97%、3.64%、2.97%和2.64%,在非根际土壤中相对丰度分别为7.89%、10.64%、5.82%、10.07%、11.52%、7.88%、5.44%、2.62%、2.29%和1.92%。其中,根际土壤中放线菌纲、α-变形菌纲、酸微菌纲、KD4-96和Polyangia 5个纲的相对丰度较非根际土壤的高,在根际土壤中存在一定程度的富集现象,而其他5个纲的相对丰度则在非根际土壤中更高。此外,属于丰富物种的纲中,根际土壤中还有Saccharimonadia (2.65%)和蓝藻纲(Cyanobacteria,2.58%),非根际土壤中还有Blastocatellia (2.57%)。
为研究根际和非根际土壤中细菌群落组成的差异情况,在门和纲水平上,基于Kruskal-Wallis秩和检验进行根际和非根际土壤中细菌群落差异分析(图 3)。结果显示,在门水平上,存在显著差异的细菌群落共有6个,其中,Patescibacteria属于丰富物种,其相对丰度在根际土壤中显著高于非根际土壤,Methylomirabilota、厚壁菌门(Firmicutes)、RCP2-54、Calditrichota和Dependentiae这5个门的细菌群落相对丰度在根际土壤中显著低于非根际土壤。在纲水平上,存在显著差异的细菌群落共有12个,其中,放线菌纲、α-变形菌纲和Saccharimonadia这3个纲的细菌群落在根际和非根际土壤中均属于丰富物种,相对丰度在根际土壤中均显著高于非根际土壤;其余存在显著差异的9个纲的物种中,前4个纲为中等物种,后4个为稀有物种,这9个纲的细菌群落相对丰度在根际土壤中均显著低于非根际土壤。
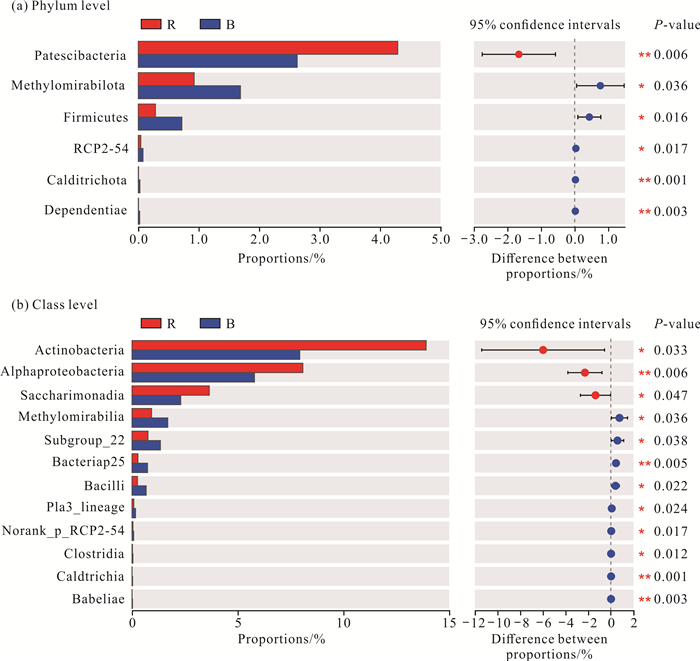
|
| * indicates significant difference (P < 0.05);** indicates extremely significant difference (P < 0.01). 图 3 撑篙竹根际与非根际土壤存在显著差异的细菌群落 Fig. 3 Bacterial communities of significant differences between rhizosphere and bulk soil of B.pervariabilis McClure |
2.2.3 关键物种的相互作用与功能分析
为研究根际和非根际土壤中细菌之间的相互关系情况,在属水平上选取丰度前50的细菌群落进行单因素网络分析(图 4)。撑篙竹根际土壤网络由45个节点、249条边组成,其中正相关125条(占比50.20%);非根际土壤网络由49个节点,143条边连接而成,其中正相关72条(占比50.35%)。根际和非根际土壤中细菌群落的平均度指数分别为11.067和5.837,平均聚类系数指数值分别为0.650和0.498,平均图密度指数值分别为0.252和0.122。网络拓扑特性参数表明根际土壤细菌网络更复杂,连接更紧密。此外,Microscillaceae (度=25)、Gaiella (度=21)、土壤红杆菌属(Solirubrobacter,度=18)、类诺卡氏属(Nocardioides,度=16)、Acidibacter (度=13)、硝化螺菌属(Nitrospira,度=12)和Polycyclovorans (度=12)等是根际土壤网络中的关键物种;而在非根际土壤网络中关键物种较少,只有硝化螺菌属(Nitrospira,度=9)和Gaiella (度=8)等具有较多的连接。
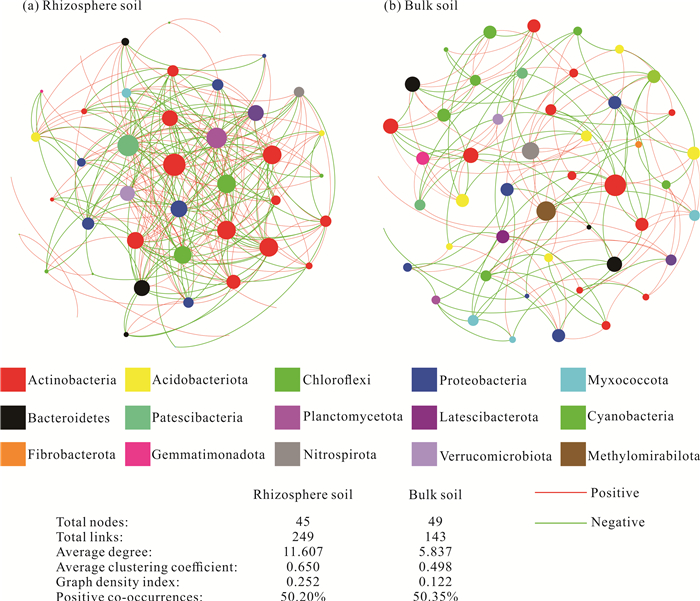
|
| 图 4 属水平相对丰度前50的细菌群落单因素网络分析 Fig. 4 Single factor network analysis of bacterial community in the top 50 relative abundance at genus level |
基于Tax4Fun细菌群落功能预测工具对16S rRNA基因序列进行京都基因与基因百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)功能注释,根际和非根际土壤中细菌群落相对丰度≥1%或者存在显著差异(P<0.05)的一级、二级功能通路相对丰度见表 3。在一级功能层面获得6类功能通路,其中,新陈代谢(Metabolism)和环境信息处理(Environmental information processing)为主要功能通路,且前者在根际和非根际土壤中相对丰度分别达到61.722%和61.176%,后者相对丰度分别达到19.623%和20.227%。两大一级功能通路在根际和非根际土壤中的相对丰度均存在显著差异。
| 一级功能通路 Primary functional pathway |
相对丰度/% Relative abundance/% |
二级功能通路 Secondary functional pathway |
相对丰度/% Relative abundance/% |
||
| R | B | R | B | ||
| Metabolism | 61.722a | 61.176b | Carbohydrate metabolism | 12.838 | 12.786 |
| Lipid metabolism | 3.683 | 3.689 | |||
| Metabolism of cofactors and vitamins | 7.071a | 6.960b | |||
| Energy metabolism | 7.266 | 7.305 | |||
| Nucleotide metabolism | 5.056 | 5.048 | |||
| Biosynthesis of other secondary metabolites | 0.867a | 0.824b | |||
| Amino acid metabolism | 12.481a | 12.144b | |||
| Metabolism of terpenoids and polyketides | 2.594 b | 2.654 a | |||
| Xenobiotics biodegradation and metabolism | 4.830 | 4.770 | |||
| Metabolism of other amino acids | 2.854a | 2.787b | |||
| Glycan biosynthesis and metabolism | 2.180 | 2.209 | |||
| Environmental information processing | 19.623b | 20.227a | Membrane transport | 11.899 | 12.204 |
| Signal transduction | 7.723b | 8.022a | |||
| Genetic information processing | 10.601 | 10.532 | Translation | 4.300 | 4.259 |
| Folding, sorting and degradation | 2.178 | 2.172 | |||
| Replication and repair | 3.940 | 3.919 | |||
| Organismal systems | 0.846 | 0.834 | Endocrine system | 0.313b | 0.322a |
| Circulatory system | 0.016A | 0.014B | |||
| Digestive system | 0.133a | 0.119b | |||
| Cellular processes | 5.207 | 5.212 | Cell motility | 2.398 | 2.410 |
| Cell growth and death | 2.061 | 2.039 | |||
| Human diseases | 1.876 | 1.903 | Infectious disease: bacterial | 1.128 | 1.185 |
| Infectious disease: parasitic | 0.154A | 0.129B | |||
| Cancer: specific types | 0.049b | 0.050a | |||
| Cardiovascular disease | 0.012A | 0.010B | |||
| Note: different lowercase letters indicate significant difference (P < 0.05);different capital letters indicate extremely significant difference (P < 0.01). | |||||
二级功能分析表明,新陈代谢通路中,根际和非根际土壤中有辅因子和维生素的代谢(Metabolism of cofactors and vitamins)、其他次生代谢物的生物合成(Biosynthesis of other secondary metabolites)、氨基酸代谢(Amino acid metabolism)、萜类和聚酮类的代谢(Metabolism of terpenoids and polyketides)和其他氨基酸的代谢(Metabolism of other amino acids)等5个代谢通路的相对丰度存在显著差异。其中,除了萜类和聚酮类的代谢通路的相对丰度在根际土壤中显著低于非根际土壤外,其他4个代谢通路的相对丰度在根际土壤中均显著高于非根际土壤。环境信息处理通路中,信号传导(Signal transduction)通路的相对丰度在根际土壤中显著低于非根际土壤;有机系统通路中,内分泌系统(Endocrine system)通路的相对丰度在根际土壤中显著低于非根际土壤,循环系统(Circulatory system)和消化系统(Digestive system)通路的相对丰度在根际土壤中显著高于非根际土壤;人类疾病通路中,传染病:寄生(Infectious disease: parasitic)和心血管疾病(Cardiovascular disease)通路的相对丰度在根际土壤中显著高于非根际土壤,癌症:特定类型(Cancer: specific types)通路的相对丰度在根际土壤中显著低于非根际土壤。
2.3 细菌群落组成与土壤环境理化因子之间的相关性分析为研究环境理化因子与土壤细菌群落之间的相关性,选取撑篙竹根际与非根际土壤中门水平相对丰度前30的细菌群落与土壤环境理化因子作Spearman相关性分析,结果如图 5所示。在门水平上,相对丰度前30的细菌群落主要与MC存在显著相关性,达到显著水平的有8个,其中1个达到极显著水平;其次是pH值,相关性达到显著水平的有3个。此外,与SOM、NH4+-N、NO2--N存在显著相关性的各有2个。属于中等物种及以上的细菌群落中,与环境理化因子之间存在显著相关性的有酸杆菌门与pH值、NH4+-N,绿弯菌门与NO3--N、AP,疣微菌门(Verrucomicrobiota)与MC、NH4+-N,拟杆菌门(Bacteroidota)与MC,浮霉菌门与MC,变形菌门与MC、SOM,黏球菌门与MC。
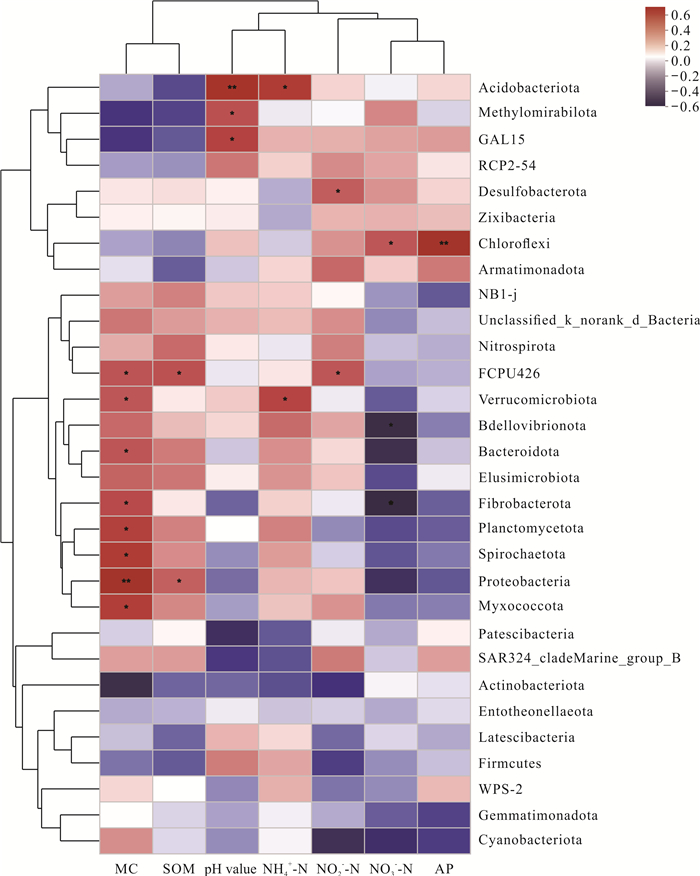
|
| *indicates significant difference (P < 0.05), ** indicates extremely significant difference (P < 0.01). 图 5 门水平相对丰度前30的细菌群落与土壤环境理化因子的相关性分析热图 Fig. 5 Correlation analysis heat map of the top 30 bacterial communities and the physical and chemical factors of the soil environment at the phylum level |
从聚类分析看,环境理化因子可以聚类为2类,其中MC和SOM为第1类,pH值、NH4+-N和NO2--N、NO3--N、AP为第2类。细菌群落主要聚类为3类,其中酸杆菌门、Methylomirabilota、GAL15、RCP2-54、脱硫菌门(Desulfobactcrota)、Zixibacteria、绿弯菌门和Armatimonadota为一类,主要与MC、SOM含量存在一定的负相关性,而与pH值、NH4+-N、NO2--N、NO3--N、AP存在较明显的正相关性;NB1-j、Unclassified_k_norank_d_Bacteria、硝化菌门(Nitrospirota)、FCPU426、疣微菌门、Bdellovibrionota、拟杆菌门、Elusimicrobiota、纤维杆菌门(Fibrobacterota)、浮霉菌门、Spirochaetota、变形菌门和黏球菌门为一类,主要与MC、SOM、pH值、NH4+-N、NO2--N存在较明显的正相关性,部分存在弱负相关性,而与NO3--N、AP主要存在负相关性;Patescibacteria、SAR324、放线菌门、Entotheonellaeota、Latescibacteria、厚壁菌门、WPS-2、Gemmatimonadota和蓝藻门(Cyanobacteriota)为一类,更倾向于与各环境理化因子存在负相关性。
3 讨论 3.1 细菌群落多样性与组成特征α多样性分析可以反映细菌群落的丰富度和多样性。根据α多样性分析结果,撑篙竹根际土壤细菌群落丰富度较非根际土壤高,而多样性较非根际土壤低。这一结果与Steinauer等[8]的研究结果相似,这主要与植物根际效应、根际和非根际土壤环境理化条件差异等有关[35-39]。说明撑篙竹的根系活动导致其根际土壤细菌群落出现一定的富集现象,但是根际从非根际土壤中招募细菌群落具有选择性,因此,根际土壤细菌群落多样性较非根际土壤细菌群落多样性低[4, 40]。
土壤细菌群落在生物地球化学循环中发挥重要作用,也是衡量土壤环境生态系统稳定性的关键因素[14, 15, 22]。通过高通量测序分析发现,撑篙竹根际土壤中放线菌门和变形菌门为主要优势细菌群落,属于这两个细菌门的放线菌纲和α-变形菌纲也为撑篙竹根际土壤的主要优势细菌类群,其他相对丰度较高的还有Patescibacteria、黏球菌门和蓝藻门等3个门,以及酸微菌纲、KD4-96、Polyangia、Saccharimonadia和蓝藻纲等5个纲。这与沈聪等[22]对干旱荒漠区柠条林地根际土壤细菌群落组成的研究结果相近。放线菌门细菌群落参与土壤养分元素的物质循环[4, 41],共生放线菌可以直接或间接地增加植物对养分和水分的吸收利用,放线菌门中部分细菌群落能够增加植物生长激素的分泌,促进植物的生长发育[5],还有一些细菌群落能够合成抗生素和次生代谢产物来增强植物的抗逆性[42, 43]。变形菌门细菌群落也与土壤碳、氮、磷、硫等营养元素循环有关[12, 13],如α-变形菌纲中存在许多植物共生固氮菌,包括Rhizobium、Rickettsia等[44]。说明撑篙竹与根际细菌群落在长期的相互作用中形成了互惠共生的关系,其中益生菌具有潜在的开发应用价值。
3.2 关键物种的相互作用与功能特征在生态系统中,微生物存在复杂的网络结构和相互作用[45],单因素网络分析能比较直观地反映土壤细菌群落内部潜在的相互作用关系。本研究中,根际土壤细菌种间相互作用较非根际土壤更复杂,相互联系更紧密,关键物种更多,表明根际土壤细菌群落之间相互作用关系更紧密,在物质循环、能量流动和信息传递等方面具有更高的效率。此外,网络中正相关关系表示物种的生态位相同或具有共生性,负相关关系表示种间存在竞争或者捕食关系[46],根际土壤中种间正相关比率略低于非根际土壤,可能根际土壤中细菌种间存在更激烈的竞争或者捕食关系。
微生物的群落功能特征是微生物群落生态学研究的重点[47],因此,本研究基于Tax4Fun细菌群落功能预测工具,对16S rRNA基因序列进行了KEGG功能注释。一级功能通路中,主要为新陈代谢和环境信息处理,其中,根际土壤中新陈代谢功能通路相对丰度更高,非根际土壤中环境信息处理功能通路相对丰度更高,这可能与根际和非根际土壤营养成分含量和环境理化条件差异有关。二级功能通路中,在新陈代谢和环境信息处理方面,有较多二级功能通路相对丰度在根际和非根际土壤中存在显著差异,在有机系统和人类疾病方面也有较多二级功能通路相对丰度存在显著差异。表明根际土壤和非根际土壤中细菌群落在功能上存在差异。
3.3 土壤环境理化因子及其对细菌群落组成的影响从土壤环境理化条件看,根际土壤中NH4+-N、NO3--N、NO2--N和AP的含量均低于非根际土壤,其中,NH4+-N在根际和非根际土壤中的差异达到显著水平(P<0.05),说明撑篙竹与细菌群落等共同作用下,土壤中的营养成分被大量吸收,从而降低了其在土壤中的含量,有利于保护河流免受营养元素的污染,这与已有研究[48]报道的结果相一致;同时,撑篙竹根际土壤pH值显著低于非根际土壤,MC较非根际土壤高,有利于撑篙竹吸收水分和获得活性金属营养元素。此外,根际土壤中SOM含量较非根际土壤高,枯萎枝叶掉落形成的枯枝落叶层也可能是造成有机质对河流影响的原因。
根际细菌群落的多样性和组成是植物种类和土壤环境理化条件共同作用的结果[37, 49],而且植物根际碳源等对微生物具有选择富集作用[38]。相关性分析表明,撑篙竹根际和非根际土壤中细菌群落相对丰度主要与土壤MC含量、pH值存在显著相关性,说明土壤MC含量和pH值对土壤微生物群落的组成影响较大,另外,还有SOM、NH4+-N和NO2--N也会造成一定的影响。但是从综合相关性分析结果来看,细菌群落相对丰度与所测土壤环境理化指标之间的相关性程度不高,可能控制细菌群落组成特征的还有其他一些环境理化指标,比如植物和微生物等的代谢产物。下一步可以结合代谢组学进一步研究撑篙竹根际和非根际土壤细菌群落组成的控制因素。
4 结论本研究结果表明,龙江河河岸带撑篙竹根际土壤pH值、NH4+-N、NO3--N和AP的含量均低于非根际土壤,MC和SOM含量则高于非根际土壤,部分理化指标之间存在显著相关性;与非根际土壤相比,撑篙竹根际土壤细菌群落丰富度高,而多样性低;门和纲水平上,根际和非根际土壤中相对丰度前15的细菌群落组成上相似,均属于中等物种及以上水平,但是相对丰度存在差异;根际土壤细菌群落网络更复杂、连接更紧密,且具有较多的关键物种;根际和非根际土壤中细菌群落功能通路主要为新陈代谢和环境信息处理;土壤中细菌群落主要与土壤pH值和水分含量存在显著相关性。本研究结果为探究撑篙竹与根际土壤细菌群落共同作用下,生态系统服务功能发挥的机制及其环境影响因子等方面奠定了基础,也为植物益生菌的开发提供了基础支持。
| [1] |
HARTMANN A, ROTHBALLER M, SCHMID M. Lorenz Hiltner, a pioneer in rhizosphere microbial ecology and soil bacteriology research[J]. Plant and Soil, 2008, 312: 7-14. DOI:10.1007/s11104-007-9514-z |
| [2] |
李金花, 高克祥, 万利, 等. 微生物菌剂对楸树幼苗生长及根际土细菌群落结构的影响[J]. 生态学报, 2020, 40(21): 7588-7601. |
| [3] |
LU H F, LASHARI M S, LIU X Y, et al. Changes in soil microbial community structure and enzyme activity with amendment of biochar-manure compost and pyroligneous solution in a saline soil from Central China[J]. European Journal of Soil Biology, 2015, 70: 67-76. DOI:10.1016/j.ejsobi.2015.07.005 |
| [4] |
LING N, WANG T T, KUZYAKOV Y. Rhizosphere bacteriome structure and functions[J]. Nature Communications, 2022, 13(1): 836. DOI:10.1038/s41467-022-28448-9 |
| [5] |
宁楚涵, 李文彬, 刘润进. 植物共生放线菌研究进展[J]. 生态学杂志, 2019, 38(1): 256-266. DOI:10.13292/j.1000-4890.201901.001 |
| [6] |
ANDREWS J H, HARRIS R F. The ecology and biogeography of microorganisms on plant surfaces[J]. Annual Review of Phytopathology, 2000, 38: 145-180. DOI:10.1146/annurev.phyto.38.1.145 |
| [7] |
黄龙, 包维楷, 李芳兰, 等. 土壤结构和植被对土壤微生物群落的影响[J]. 应用与环境生物学报, 2021, 27(6): 1725-1731. |
| [8] |
STEINAUER K, JENSEN B, STRECKER T, et al. Convergence of soil microbial properties after plant colonization of an experimental plant diversity gradient[J]. BMC Ecology, 2016, 16: 19. DOI:10.1186/s12898-016-0073-0 |
| [9] |
王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.002 |
| [10] |
鲜文东, 张潇橦, 李文均. 绿弯菌的研究现状及展望[J]. 微生物学报, 2020, 60(9): 1801-1820. |
| [11] |
刘兰, 明语真, 吕爱萍, 等. 厌氧氨氧化细菌的研究进展[J]. 微生物学报, 2021, 61(4): 969-986. DOI:10.13343/j.cnki.wsxb.20200755 |
| [12] |
ANANTHARAMAN K, BROWN C T, HUG L A, et al. Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system[J]. Nature Communications, 2016, 7(1): 13219. DOI:10.1038/ncomms13219 |
| [13] |
GUO X P, LU D P, NIU Z S, et al. Bacterial community structure in response to environmental impacts in the intertidal sediments along the Yangtze Estuary, China[J]. Marine Pollution Bulletin, 2018, 126: 141-149. DOI:10.1016/j.marpolbul.2017.11.003 |
| [14] |
YIN C T, VARGAS J M C, SCHLATTER D C, et al. Rhizosphere community selection reveals bacteria associated with reduced root disease[J]. Microbiome, 2021, 9(1): 86. DOI:10.1186/s40168-020-00997-5 |
| [15] |
ZHENG X H, OBA B T, WANG H, et al. Organo-mineral complexes alter bacterial composition and induce carbon and nitrogen cycling in the rhizosphere[J]. Science of the Total Environment, 2022, 836: 155671. DOI:10.1016/j.scitotenv.2022.155671 |
| [16] |
LIN H, LIU C J, LI B, et al. Trifolium repens L.regulated phytoremediation of heavy metal contaminated soil by promoting soil enzyme activities and beneficial rhizosphere associated microorganisms[J]. Journal of Hazardous Materials, 2021, 402: 123829. DOI:10.1016/j.jhazmat.2020.123829 |
| [17] |
BERENDSEN R L, VISMANS G, YU K, et al. Disease-induced assemblage of a plant-beneficial bacterial consortium[J]. The ISME Journal, 2018, 12(6): 1496-1507. DOI:10.1038/s41396-018-0093-1 |
| [18] |
YUAN J, ZHAO J, WEN T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Microbiome, 2018, 6(1): 156. DOI:10.1186/s40168-018-0537-x |
| [19] |
李菲, 黄庶识, 王伟, 等. 海绵Pseudoceratina sp.共栖细菌多样性及其抑制甘蔗鞭黑粉菌活性研究[J]. 广西科学, 2018, 25(1): 87-93, 99. |
| [20] |
MENDES L W, RAAIJMAKERS J M, DE HOLLANDER M, et al. Influence of resistance breeding in common bean on rhizosphere microbiome composition and function[J]. The ISME Journal, 2018, 12(1): 212-224. DOI:10.1038/ismej.2017.158 |
| [21] |
DE LA PAZ J M, DE LA HORRA A, PEUZZO L, et al. Soil quality: a new index based on microbiological and biochemical parameters[J]. Biology and Fertility of Soils, 2002, 35(4): 302-306. DOI:10.1007/s00374-002-0450-z |
| [22] |
沈聪, 刘爽, 苏建宇, 等. 半干旱荒漠区柠条根际细菌群落结构与功能[J]. 基因组学与应用生物学, 2021, 40(Z4): 3508-3517. |
| [23] |
NORRIS V. The use of buffer zones to protect water quality: a review[J]. Water Resour Manage, 1993, 7: 257-272. DOI:10.1007/BF00872284 |
| [24] |
刘瑞霞, 王立阳, 孙菲, 等. 以农业面源污染阻控为目标的河流生态缓冲带研究进展[J]. 环境工程学报, 2022, 16(1): 25-39. |
| [25] |
王孟文, 齐伟, 王鹏涛, 等. 鲁东山区流域景观格局与面源污染关联关系[J]. 自然资源学报, 2020, 35(12): 3007-3017. |
| [26] |
赵鹏, 胡艳芳, 林峻宇. 不同河岸带修复策略对氮磷非点源污染的净化作用[J]. 中国环境科学, 2015, 35(7): 2160-2170. DOI:10.3969/j.issn.1000-6923.2015.07.041 |
| [27] |
JOHANSSON J, EDESKÄR T. Effects of external water-level fluctuations on slope stability[J]. Electronic Journal of Geotechnical Engineering, 2014, 19: 2437-2463. |
| [28] |
孙嘏. 撑篙竹(Bambusa pervariabilis McClure)竹叶化学成分及其生物活性的研究[D]. 北京: 中国林业科学研究院, 2010.
|
| [29] |
EDWARDS J, JOHNSON C, SANTOS-MEDELLÍN C, et al. Structure, variation, and assembly of the root-associated microbiomes of rice[J]. Proceedings of the National Academy of Sciences, 2015, 112(8): 911-920. |
| [30] |
XU N, TAN G C, WANG H Y, et al. Effect of biochar additions to soil on nitrogen leaching, microbial biomass and bacterial community structure[J]. European Journal of Soil Biology, 2016, 74: 1-8. |
| [31] |
黄家庆, 赖永翔, 翁伯琦, 等. 花生壳生物炭对镉污染菜园土壤细菌群落结构的影响[J]. 应用与环境生物学报, 2020, 26(5): 1115-1128. |
| [32] |
BASTIAN M, HEYMANN S, JACOMY M. Gephi: an open source software for exploring and manipulating networks[C]//Proceedings of the Third International ICWSM Conference, San Jose, California: AAAI, 2009: 361-362.
|
| [33] |
许晴, 张放, 许中旗, 等. Simpson指数和Shannon-Wiener指数若干特征的分析及"稀释效应"[J]. 草业科学, 2011, 28(4): 527-531. |
| [34] |
DAI T J, ZHANG Y, TANG Y S, et al. Identifying the key taxonomic categories that characterize microbial community diversity using full-scale classification: a case study of microbial communities in the sediments of Hangzhou Bay[J]. FEMS Microbiology Ecology, 2016, 92(10). |
| [35] |
YAN Y, KURAMAE E E, DE HOLLANDER M, et al. Functional traits dominate the diversity-related selection of bacterial communities in the rhizosphere[J]. The ISME Journal, 2017, 11(1): 56-66. |
| [36] |
樊博, 林丽, 曹广民, 等. 不同演替状态下高寒草甸土壤物理性质与植物根系的相互关系[J]. 生态学报, 2020, 40(7): 2300-2309. |
| [37] |
JIANG Y J, LI S Z, LI R P, et al. Plant cultivars imprint the rhizosphere bacterial community composition and association networks[J]. Soil Biology and Biochemistry, 2017, 109: 145-155. |
| [38] |
KUZYAKOV Y, RAZAVI B S. Rhizosphere size and shape: temporal dynamics and spatial stationarity[J]. Soil Biology and Biochemistry, 2019, 135: 343-360. |
| [39] |
LI H, SU J Q, YANG X R, et al. Distinct rhizosphere effect on active and total bacterial communities in paddy soils[J]. Science of the Total Environment, 2019, 649: 422-430. |
| [40] |
VIEIRA S, SIKORSKI J, DIETZ S, et al. Drivers of the composition of active rhizosphere bacterial communities in temperate grasslands[J]. The ISME Journal, 2019, 14(2): 463-475. |
| [41] |
魏玉倩, 陈健鑫, 郑艳玲, 等. 攀枝花苏铁珊瑚根共生放线菌鉴定及共生体养分吸收[J]. 中南林业科技大学学报, 2022, 42(11): 44-52. |
| [42] |
ZHANG Z Y, ZHANG Q, CUI H Z, et al. Composition identification and functional verification of bacterial community in disease-suppressive soils by machine learning[J]. Environmental Microbiology, 2022, 24(8): 3405-3419. |
| [43] |
ALBLOOSHI A A, PURAYIL G P, SAEED E E, et al. Biocontrol potential of endophytic actinobacteria against Fusarium solani, the causal agent of sudden decline syndrome on date palm in the UAE[J]. Journal of Fungi, 2021, 8(1): 8. |
| [44] |
葛应兰, 孙廷. 马铃薯根际与非根际土壤微生物群落结构及多样性特征[J]. 生态环境学报, 2020, 29(1): 141-148. |
| [45] |
COYTE K Z, SCHLUTER J, FOSTER K R. The ecology of the microbiome: networks, competition, and stability[J]. Science, 2015, 350(6261): 663-666. |
| [46] |
LAYEGHIFARD M, HWANG D M, GUTTMAN D S. Disentangling interactions in the microbiome: a network perspective[J]. Trends in Microbiology, 2017, 25(3): 217-228. |
| [47] |
GIBBONS S M. Microbial community ecology: function over phylogeny[J]. Nature Ecology & Evolution, 2017, 1(1): 32. |
| [48] |
朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学: 生命科学, 2021, 51(1): 1-11. |
| [49] |
GARBEVA P, VAN ELSAS J D, VAN VEEN J A. Rhizosphere microbial community and its response to plant species and soil history[J]. Plant and Soil, 2008, 302: 19-32. |



