2. 潍坊医学院口腔医学院, 山东潍坊 261053;
3. 潍坊医学院基础医学院, 山东潍坊 261053;
4. 潍坊医学院科研处, 医学研究实验中心, 山东潍坊 261053
2. School of Stomatology, Weifang Medical University, Weifang, Shandong, 261053, China;
3. School of Basic Medical Sciences, Weifang Medical University, Weifang, Shandong, 261053, China;
4. Experimental Center for Medical Research, Division of Scientific Research, Weifang Medical University, Weifang, Shandong, 261053, China
衰老是一个十分复杂的生物学现象,是一种不可抗拒的自然规律。随着年龄的增长,机体各细胞、组织、器官会发生功能上的退行性变化,导致阿尔兹海默症和动脉粥样硬化等多种疾病发生[1],给家庭和社会带来沉重的经济负担。英国学者Harman[2]提出的“自由基学说”认为衰老是由于机体内的自由基和活性氧引发脂质过氧化、蛋白变性以及核酸交联而产生的。岩藻黄素(Fucoxanthin,FUCO)作为一种天然的藻类色素,已有研究证明其具有抗癌[3]、抗氧化[4]、降血糖[5]等多种生物活性,还能延缓果蝇(Drosophila melanogaster)和线虫(Caenorhabditis elegans)的衰老[6, 7],抑制H2O2引起的细胞早衰[8],缓解皮肤光老化[9]。目前,斑马鱼(Barchydanio rerio)已用于多种体内实验模型的建立[10-12]和衰老相关疾病的研究[13-15],如阿尔兹海默症[16]。基于以上理论和实验研究结果,本研究以斑马鱼为实验对象,利用H2O2诱导建立体内衰老模型,研究探讨FUCO的抗衰老作用。
1 材料与方法 1.1 材料组织研磨机(JXFSTPRP-24,上海净信实业发展有限公司),酶标仪(Multiskan GO,Thermo公司),倒置荧光显微镜(IX73,Olympus公司),光照培养箱(GZP-150S,广州市康恒仪器有限公司)。
AB品系野生型斑马鱼胚胎(上海费曦生物科技有限公司潍坊养殖基地),斑马鱼胚胎培养液(上海费曦生物科技有限公司),FUCO (Sigma,纯度≥95%),H2O2(北京索莱宝科技有限公司),BCA蛋白浓度测定试剂盒、丙二醛(Malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(Superoxide Dismutase,SOD)活性检测试剂盒(WST-8法)、活性氧(Reactive Oxygen Species,ROS)检测试剂盒及SA-β-半乳糖苷酶染色试剂盒(上海碧云天生物技术有限公司)。
岩藻黄素母液的配制:将50 mg FUCO用10 mL二甲基亚砜(Dimethyl Sulfoxide,DMSO)溶解,涡旋振荡促进充分溶解,FUCO终浓度为7 588 μmol/L,分装(用锡箔纸包被避光)后置于冰箱-80 ℃保存备用。
1.2 方法 1.2.1 H2O2诱导建立斑马鱼衰老模型 1.2.1.1 H2O2对斑马鱼胚胎存活率的影响设空白对照组(0 mmol/L H2O2,C组)和3个不同浓度H2O2组(1、2、4 mmol/L),重复3次。
选择受精后24 h (24 hours post-fertilization,24 hpf)发育正常的斑马鱼胚胎随机放入6孔细胞培养板中,每孔15个胚胎,每组2个平行孔。C组每孔加入5 mL新鲜斑马鱼胚胎培养液,其余各组每孔分别加入5 mL含不同浓度H2O2的胚胎培养液。将6孔板置于28.5 ℃、14/10光暗周期的光照培养箱中培养。在胚胎发育过程中每6-8 h观察一次胚胎发育情况,根据心跳情况判断斑马鱼胚胎存活与否,及时用滴管将死亡胚胎及胎膜吸出,记录不同时间点存活斑马鱼胚胎的数量变化,并在H2O2处理96 h后根据存活数量计算各组斑马鱼胚胎的存活率。
1.2.1.2 H2O2对斑马鱼胚胎SA-β-半乳糖苷酶活性的影响实验分组与药物处理方法同1.2.1.1节,重复3次。
从1.2.1.1节中测完存活率的各组斑马鱼胚胎中每组随机挑选10个用SA-β-半乳糖苷酶染色试剂盒进行染色以检测斑马鱼胚胎体内的SA-β-半乳糖苷酶活性。具体方法:取药物处理后的鱼放入96孔板中,每孔1条。用胚胎培养液清洗斑马鱼胚胎3次,每孔加入4%多聚甲醛100 μL后置于4 ℃固定过夜。次日,用磷酸盐缓冲液(Phosphate Buffered Saline,PBS)清洗鱼体3次,每孔加入SA-β-半乳糖苷酶染色工作液100 μL后置于37 ℃培养箱中染色14 h。染色结束后,用PBS充分清洗3次,在倒置显微镜下观察各组斑马鱼胚胎的蓝染情况。每次实验分别从每组中随机选取6个斑马鱼胚胎,用Image J软件对其染色情况进行定量分析。
1.2.1.3 H2O2对斑马鱼胚胎丙二醛含量的影响实验分组与药物处理方法同1.2.1.1节,重复3次。
将斑马鱼胚胎放入6孔板中培养,每孔20个胚胎,每组3个平行孔(每组胚胎数量为60个)。将H2O2处理后的斑马鱼用胚胎培养液清洗3次后转入1.5 mL离心管中,加入预冷的PBS,用组织研磨机进行低温组织匀浆,匀浆液在4 ℃、12 000 g条件下离心10 min,取上清液,按照MDA和BCA检测试剂盒说明书检测各组斑马鱼胚胎的MDA含量和蛋白含量。MDA含量计算:根据蛋白标准曲线计算样品的蛋白含量,MDA含量用每毫克蛋白中含有的MDA量表示(μmol/mg蛋白)。
1.2.2 FUCO对H2O2诱导斑马鱼胚胎衰老的抑制作用 1.2.2.1 FUCO对斑马鱼的适宜作用浓度筛选设空白对照组(0.0 μmol/L FUCO)和5个不同浓度FUCO组(2.5、5.0、10.0、15.0、20.0 μmol/L),即C组和F2.5、F5、F10、F15、F20组,重复3次。
将24 hpf发育正常的斑马鱼胚胎随机放入6孔板中,每孔15个胚胎,每组2个平行孔。C组每孔加入5 mL新鲜胚胎培养液,FUCO组每孔分别加入5 mL含不同浓度FUCO的胚胎培养液,各组在28.5 ℃、14/10光暗周期的光照培养箱中培养100 h后,计算各组斑马鱼胚胎的存活率。培养期间定时观察胚胎的发育情况,及时吸出死胎和胎膜,并做好记录。
1.2.2.2 FUCO对H2O2诱导衰老的斑马鱼胚胎存活率的影响设空白对照组(0.0 μmol/L FUCO)、H2O2模型组(2 mmol/L H2O2)和5个FUCO组(FUCO+2 mmol/L H2O2,FUCO浓度分别为2.5、5.0、10.0、15.0、20.0 μmol/L),即C组、M组和F2.5、F5.0、F10.0、F15.0、F20.0组,重复3次。
将24 hpf发育正常的斑马鱼胚胎随机放入6孔板中,每孔15个胚胎,每组2个平行孔。空白对照组和H2O2模型组每孔加入5 mL新鲜胚胎培养液,FUCO组每孔分别加入5 mL含不同浓度FUCO的胚胎培养液进行预培养。4 h后,除空白对照组外,其余各组均加入H2O2溶液使其终浓度为2 mmol/L。各组在28.5 ℃、14/10光暗周期的光照培养箱中继续培养96 h(继续培养至48 h时更换一次培养液)。根据存活数量计算各组斑马鱼胚胎的存活率。
1.2.2.3 FUCO对H2O2诱导衰老的斑马鱼胚胎SA-β-半乳糖苷酶活性的影响设空白对照组(0.0 μmol/L FUCO)、H2O2模型组(2 mmol/L H2O2)和4个FUCO组(FUCO+2 mmol/L H2O2,FUCO浓度分别为2.5、5.0、10.0、15.0 μmol/L),即C组、M组和F2.5、F5.0、F10.0、F15.0组,重复3次。
胚胎药物处理方法同1.2.2.2节。
1.2.2.2节存活率检测实验结束后,从除F20.0组之外的每个组中各随机挑选10个活的斑马鱼胚胎,按1.2.1.2节中的方法对斑马鱼胚胎进行SA-β-半乳糖苷酶染色,显微镜下观察鱼体蓝染情况并拍照,每次实验分别从每组中随机选取6个斑马鱼胚胎,用Image J软件对其染色情况进行定量分析。
1.2.2.4 FUCO对H2O2诱导衰老斑马鱼MDA含量的影响实验分组同1.2.2.3节,分为C组、M组和F2.5、F5.0、F10.0、F15.0共6组,重复3次。
每组胚胎数量为100个,放入6孔板中培养,设置5个平行孔,即每孔胚胎数为20个。各组胚胎药物处理方法同1.2.2.2节。药物处理结束后的斑马鱼胚胎按1.2.1.3节中的方法进行MDA含量检测。
1.2.2.5 FUCO对H2O2诱导衰老的斑马鱼胚胎SOD活性的影响实验分组及胚胎药物处理方法同1.2.2.4节,重复3次。
取1.2.2.4节中获得的鱼体组织上清液,分别按照SOD和BCA检测试剂盒说明书检测各组斑马鱼胚胎的SOD活性和蛋白含量,SOD活力单位用U/mg蛋白表示。
1.2.2.6 FUCO对H2O2诱导衰老的斑马鱼胚胎ROS含量的影响实验分组同1.2.2.4节。胚胎放入6孔板中培养,每组15个,且同组放在同一孔中培养。药物处理方法同1.2.2.2节。重复3次。
将药物处理后的斑马鱼胚胎转入96孔板中,每孔各放置1个斑马鱼胚胎,用胚胎培养液清洗3次后每孔加入100 μL含10 μmol/L 2', 7'-二氯二氢荧光素二乙酸酯(2', 7'-Dichlorodihydrofluorescein Diacetate,DCFH-DA)的胚胎培养液,于28.5 ℃、避光环境中孵育1 h。孵育结束后,用胚胎培养液清洗3次,在倒置荧光显微镜下观察记录各组斑马鱼胚胎体内的ROS荧光强度,每次实验分别从每组中随机选取6个斑马鱼胚胎,用Image J软件对其荧光强度进行定量分析。
1.3 数据分析测量数据以(x±s)表示,使用SPSS 22.0软件检测计量资料,经方差齐性检验为方差齐性,采用单因素方差分析法(One-way ANOVA)检验,以P < 0.05为显著差异,以P < 0.01为极显著差异。采用GraphPad Prism 8作图。
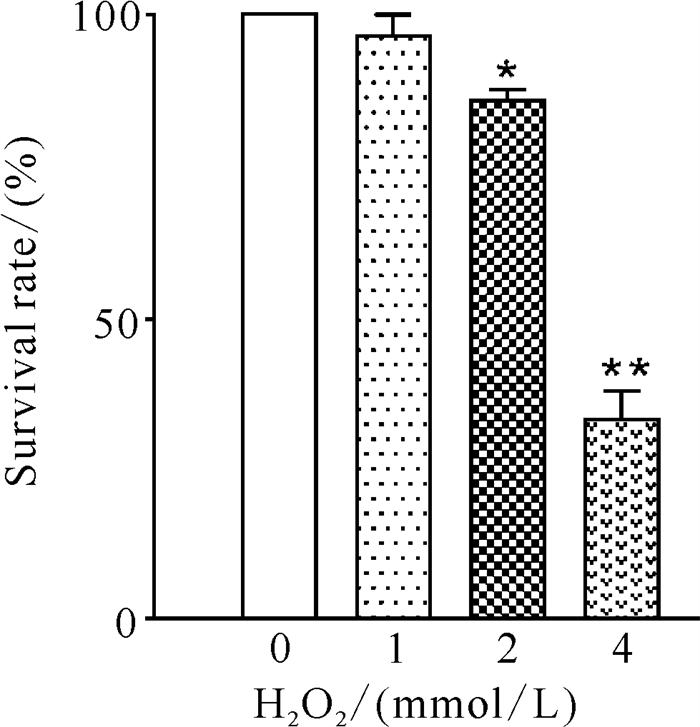
2 结果与分析 2.1 斑马鱼胚胎衰老模型的建立 2.1.1 H2O2对斑马鱼胚胎存活率的影响实验中没有发现存活的斑马鱼出现身体明显畸形的情况。从图 1可以看出,斑马鱼胚胎存活率随H2O2浓度升高而降低。空白对照组(C组)胚胎无死亡现象发生,其存活率为100%,1、2、4 mmol/L H2O2组斑马鱼胚胎的存活率分别为(96.52±3.18)%、(85.86±1.56)%和(33.63±4.28)%,其中,2 mmol/L H2O2组的存活率比C组明显降低(P < 0.05),4 mmol/L H2O2组的存活率与C组相比存在极显著差异(P < 0.01)。
|
| Data are expressed as mean ±standard deviation, n=3, *P < 0.05, **P < 0.01. 图 1 H2O2对斑马鱼胚胎存活率的影响 Fig. 1 Effect of H2O2 on the survival rate of B.rerio embryos |
2.1.2 H2O2对斑马鱼胚胎SA-β-半乳糖苷酶活性的影响
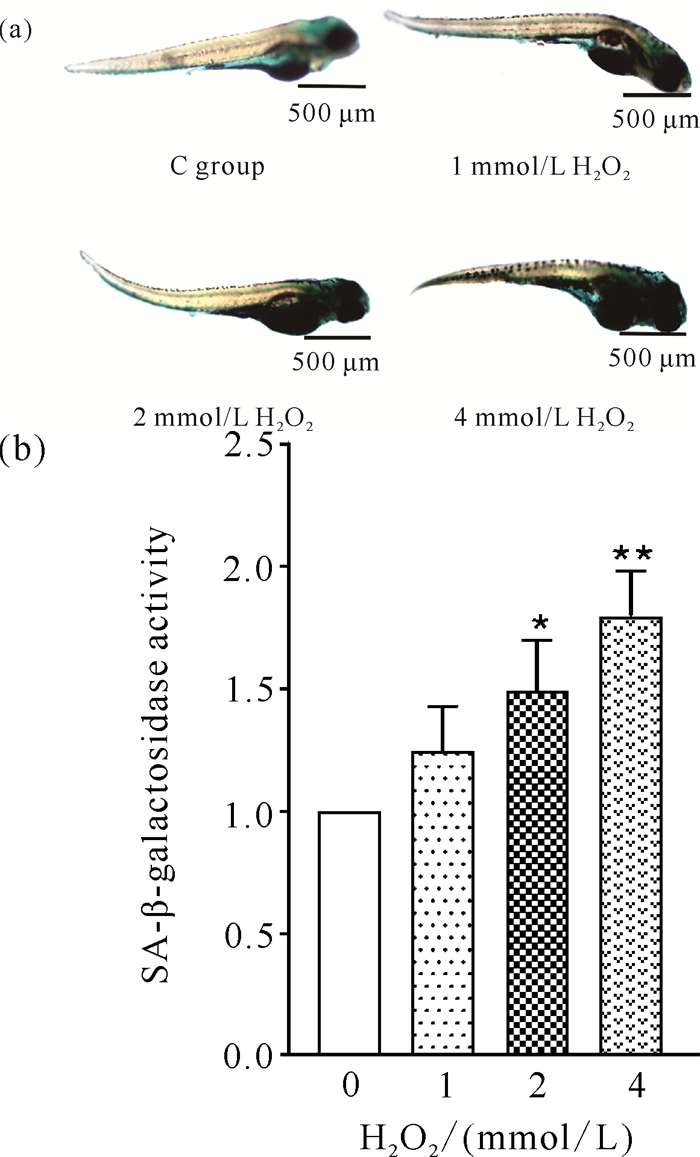
斑马鱼胚胎SA-β-半乳糖苷酶染色结果见图 2。从图 2(a)可以看出,与空白对照组相比,不同浓度H2O2(1、2、4 mmol/L)处理的斑马鱼胚胎蓝染程度均加深(蓝色代表酶活性为阳性),蓝染程度与H2O2浓度呈剂量依赖关系,H2O2浓度增高,蓝染程度加深。其量化关系如图 2(b)所示,随着H2O2浓度增高,SA-β-半乳糖苷酶活性增加,说明H2O2处理能够导致斑马鱼衰老。
|
| Data are expressed as mean ± standard deviation, n=3, *P < 0.05, **P < 0.01. 图 2 H2O2对斑马鱼胚胎SA-β-半乳糖苷酶活性的影响 Fig. 2 Effect of H2O2 on the activity of SA-β-galactosidase of B.rerio embryos |
2.1.3 H2O2对斑马鱼胚胎MDA含量的影响
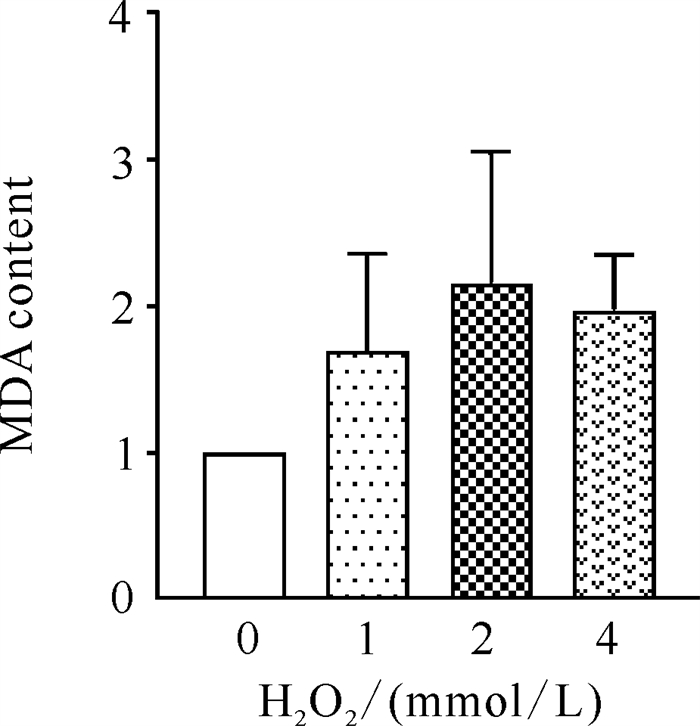
实验结果如图 3所示,不同浓度H2O2组(1、2、4 mmol/L)斑马鱼胚胎的MDA含量均高于空白对照组(C组),但各组与C组之间差异无统计学意义(P>0.05)。
|
| Data are expressed as mean ±standard deviation,n=3. 图 3 H2O2对斑马鱼胚胎MDA含量的影响 Fig. 3 Effect of H2O2 on the MDA content of B.rerio embryos |
2.2 FUCO对H2O2诱导斑马鱼胚胎衰老的抑制作用 2.2.1 FUCO对斑马鱼的浓度筛选
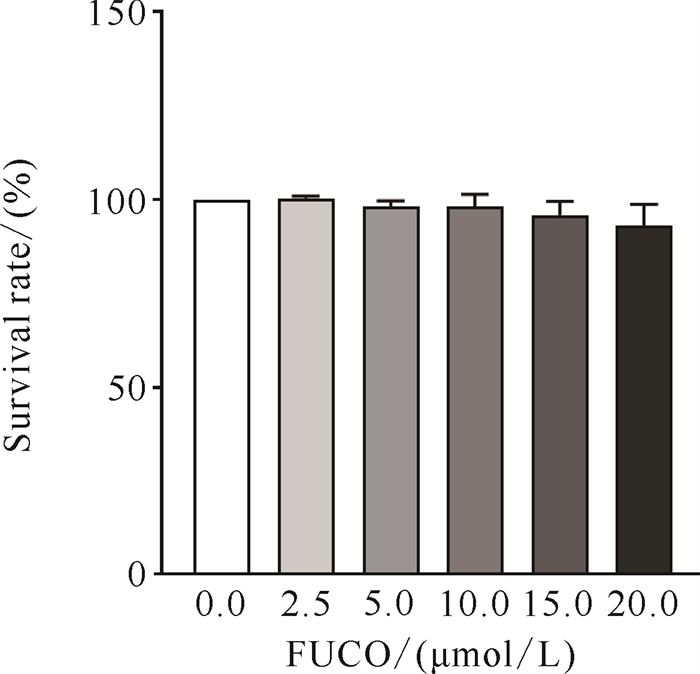
实验结果如图 4所示,FUCO浓度为2.5-20.0 μmol/L时对斑马鱼胚胎的发育成活几乎无毒副作用(VS 0.0,P>0.05)。
|
| Data are expressed as mean ±standard deviation, n=3. 图 4 FUCO对斑马鱼胚胎存活率的影响 Fig. 4 Effect of FUCO on the survival rate of B.rerio embryos |
2.2.2 FUCO对H2O2诱导衰老的斑马鱼胚胎存活率的影响
实验结果如图 5所示。空白对照组(C组)斑马鱼胚胎存活率为(98.45±1.34)%,模型组(M组)斑马鱼胚胎存活率为(89.46±1.94)%,明显低于C组(P < 0.01)。F2.5、F5.0、F10.0、F15.0组的斑马鱼胚胎存活率分别为(98.82±1.07)%、(97.21±0.76)%、(94.27±5.0)%和(95.72±4.91)%,均高于M组(F2.5、F5.0组与M组差异显著,P < 0.01),但与C组相比没有明显差异。F20.0组存活率为(68.81±5.09)%,明显低于C、M组(P < 0.01)。
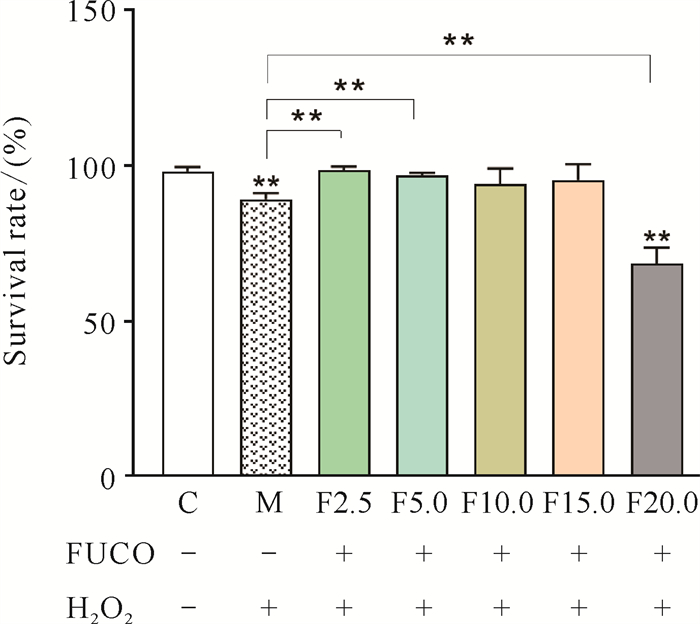
|
| Data are expressed as mean±standard deviation, n=3, **P < 0.01, + indicates added, -indicates not added. 图 5 FUCO对H2O2诱导衰老的斑马鱼胚胎存活率的影响 Fig. 5 Effect of FUCO on the survival rate of H2O2-induced senescent B.rerio embryos |
2.2.3 FUCO对H2O2诱导衰老的斑马鱼胚胎SA-β-半乳糖苷酶活性的影响
从图 6(a)可以看出,显微镜下M组鱼体蓝色较深,头部和腹部均出现蓝染。FUCO组蓝染主要集中在腹部,且蓝染较轻,为浅蓝色。设C组斑马鱼胚胎SA-β-半乳糖苷酶活性为1,定量分析结果[(图 6(b)]表明,与C组相比,M组SA-β-半乳糖苷酶活性明显上升(P < 0.01),为2.29±0.38。F2.5、F5.0、F10.0、F15.0组的酶活性均比C组高,但均低于M组,其中F2.5、F5.0、F10.0组活性明显低于M组,分别为1.57±0.28、1.69±0.27(P < 0.01)和1.80±0.13(P < 0.05)。实验结果表明FUCO能抑制H2O2诱导的斑马鱼胚胎SA-β-半乳糖苷酶活性的增高。
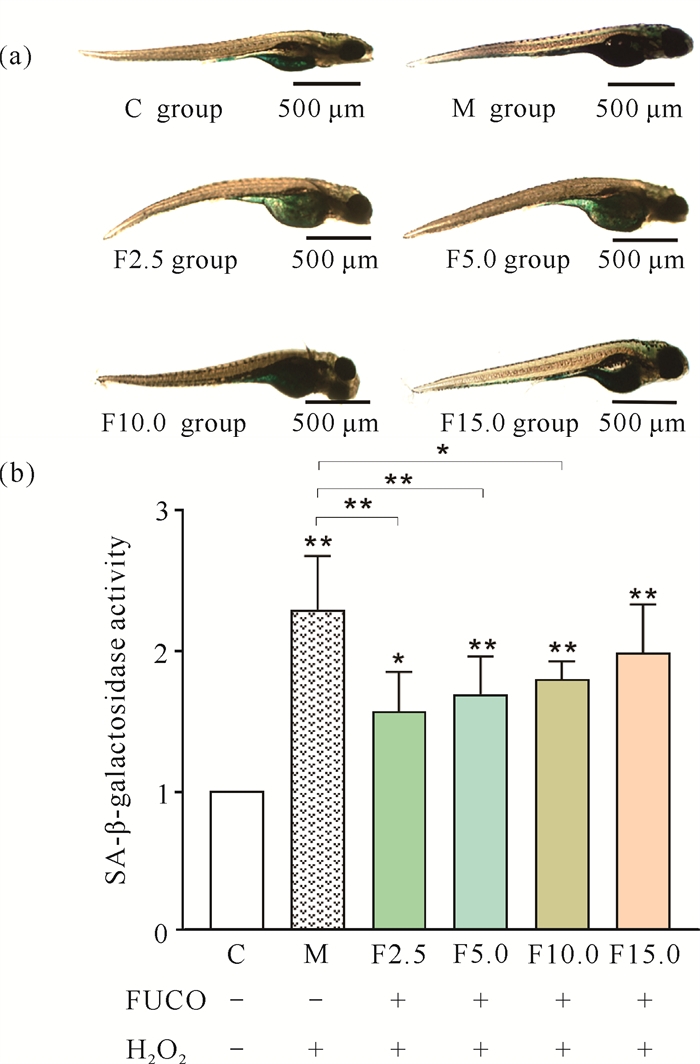
|
| Data are expressed as mean ±standard deviation, n=3, *P < 0.05, **P < 0.01;+ indicates added, -indicates not added. 图 6 FUCO对H2O2诱导衰老的斑马鱼胚胎SA-β-半乳糖苷酶活性的影响 Fig. 6 Effect of FUCO on the SA-β-galactosidase activity of H2O2-induced senescent B.rerio embryos |
2.2.4 FUCO对H2O2诱导衰老的斑马鱼胚胎MDA含量的影响
由图 7可知,模型组(M组)斑马鱼胚胎的MDA含量与空白对照组(C组)相比显著增高(P < 0.01),为C组的(2.23±0.25)倍,而F2.5、F5.0、F10.0组的MDA含量与M组相比均明显下降(P < 0.01),分别为C组的(1.07±0.05)、(1.28±0.08)和(1.61±0.17)倍。F15.0组的MDA含量较M组低,为(1.91±0.22) μmol/mg蛋白,但二者之间没有明显差异(P>0.05)。上述结果表明FUCO能抑制H2O2诱导的斑马鱼体胚胎内MDA含量的增高。
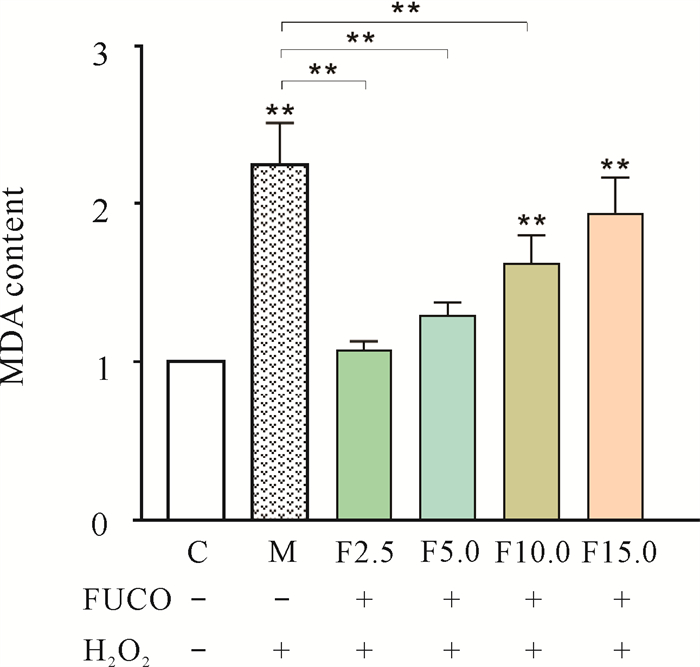
|
| Data are expressed as mean ±standard deviation, n=3, **P < 0.01;+ indicates added, -indicates not added. 图 7 FUCO对H2O2诱导衰老的斑马鱼胚胎MDA含量的影响 Fig. 7 Effect of FUCO on the MDA content of H2O2-induced senescence in B.rerio embryos |
2.2.5 FUCO对H2O2诱导衰老的斑马鱼胚胎SOD活性的影响
设空白对照组的SOD活性为1。从图 8可以看出,模型组(M组)的SOD活性低于空白对照组(C组),二者之间差异明显(P < 0.01)。F2.5、F5.0、F10.0组的SOD活性均明显高于M组,分别为1.39±0.09 (P < 0.01)、1.20±0.06 (P < 0.05)和1.01±0.08 (P < 0.05)。F15.0组的SOD活性虽较M组增高,但与M组相比无明显差异。实验结果表明FUCO能提高H2O2诱导衰老的斑马鱼胚胎体内的SOD活性。

|
| Data are expressed as mean±standard deviation, n=3, *P < 0.05, **P < 0.01;+ indicates added, -indicates not added. 图 8 FUCO对H2O2诱导衰老的斑马鱼胚胎SOD活性的影响 Fig. 8 Effect of FUCO on the SOD activity of H2O2-induced senescence in B.rerio embryos |
2.2.6 FUCO对H2O2诱导衰老的斑马鱼胚胎ROS含量的影响
从图 9(a)可以看出,模型组(M组)的荧光强度最强,几乎整个鱼体都出现绿色荧光。设空白组(C组)荧光强度为1,从图 9(b)可以看出,M组为2.53±0.52(VS C组,P < 0.01),F2.5、F5.0、F10.0、F15.0组与M组相比荧光强度均下降,分别为1.63±0.35、1.84±0.42、2.12±0.39、2.31±0.42,其中F2.5、F5.0组与M组相比差异显著(F2.5组VS M组P < 0.01,F5.0组VS M组P < 0.05)。上述结果表明FUCO能降低H2O2诱导的衰老斑马鱼胚胎体内的ROS含量。
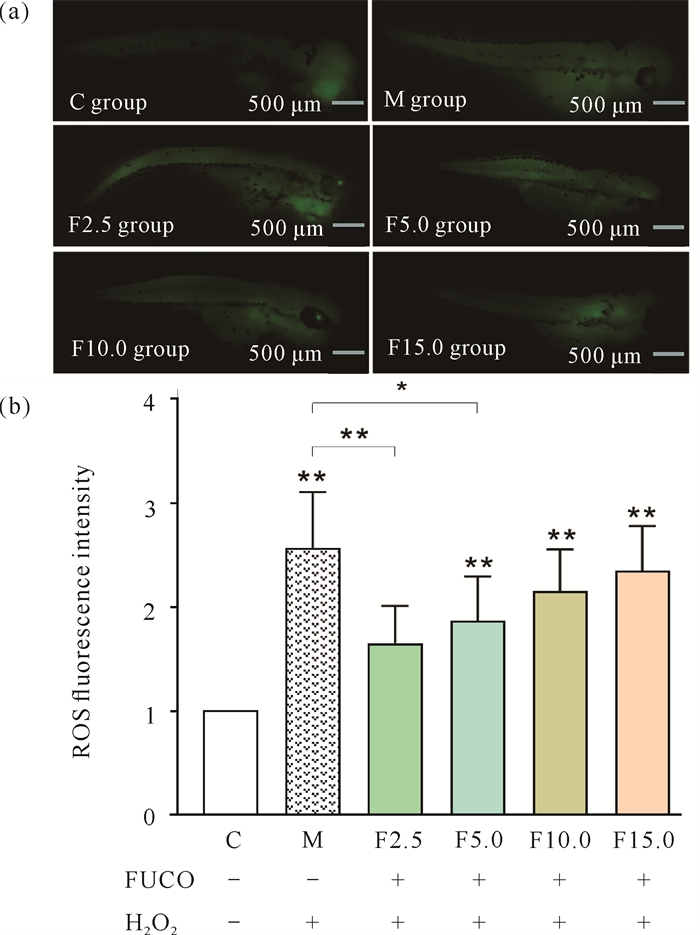
|
| Data are expressed as mean ±standard deviation, n=3, *P < 0.05, **P < 0.01, + indicates added, -indicates not added. 图 9 FUCO对H2O2诱导衰老的斑马鱼胚胎ROS荧光强度的影响 Fig. 9 Effect of FUCO on the ROS fluorescence intensity of H2O2-induced senescence in B.rerio embryos |
3 讨论
斑马鱼在胚胎期对外源化学物质非常敏感[17],所以建模通常在斑马鱼胚胎或者斑马鱼幼鱼期进行[18]。目前,已有多篇文献用斑马鱼胚胎建立早衰模型进行了衰老及疾病有关研究[19, 20]。小分子氧化剂H2O2是一种可靠的衰老诱导剂[21],张梦斯[22]用0.5 mmol/L H2O2处理4 hpf斑马鱼胚胎48 h,成功建立了斑马鱼早衰模型,黄理杰[23]用200 μmol/L H2O2作用3月龄斑马鱼4周,成功建立了斑马鱼衰老模型。因此,本研究用H2O2诱导斑马鱼胚胎建立早衰模型进行抗衰老研究是合理可行的。综合考虑本实验中斑马鱼胚胎的存活率、SA-β-半乳糖苷酶活性及MDA含量检测结果,最终确定以2 mmol/L H2O2建立斑马鱼早衰模型进行FUCO抗衰老活性研究。
FUCO具有多种生物活性。2015年Lashmanova等[6]首次报道FUCO可以延缓动物(线虫和果蝇)的衰老,2018年Moskalev等[7]报道FUCO抗果蝇衰老的分子机制。斑马鱼作为一种广泛应用的脊椎动物模型,与人类的相似性多于果蝇和线虫,斑马鱼比果蝇和线虫更适合作为研究人类衰老及疾病等的实验对象。因此,采用H2O2诱导斑马鱼胚胎建立早衰模型探索岩藻黄素的抗衰老作用是本文的创新之处。
FUCO是否具有毒副作用是其能否获得实际应用的前提,也是科研工作者关注的重点。已有不少研究发现FUCO对实验动物不会产生毒性作用,无致畸作用[24-26]。但因本实验中FUCO的溶剂是DMSO,Hoyberghs等[27]报道DMSO在培养液中占比高于1%时对斑马鱼具有毒性作用,因此本研究探讨了FUCO单独作用于斑马鱼胚胎时斑马鱼的存活率,结果显示浓度为2.5-20.0 μmol/L时FUCO各组的存活率都在90%以上,20.0 μmol/L组存活率最低,为93%,20.0 μmol/L FUCO组也是DMSO浓度(约0.26%,13.17 μL岩藻黄素母液加入4 986.83 μL胚胎培养液中配成5 000 μL混合胚胎培养液)最高的实验组,这个结果可以说明FUCO和DMSO在本研究设定的浓度范围内对斑马鱼基本上没有毒性作用。
为进一步筛选和确定FUCO的适宜作用浓度,本研究又探讨FUCO对H2O2诱导后斑马鱼胚胎存活率的影响。实验结果表明,随着作用时间的延长,20.0 μmol/L FUCO组出现较多鱼死亡的现象,其存活率仅为68.81%,远低于20 μmol/L FUCO单独处理斑马鱼胚胎时的存活率,可能是由于H2O2和高浓度的FUCO、DMSO共同作用导致斑马鱼胚胎产生较大的毒副作用。因此,最终选择2.5、5.0、10.0、15.0 μmol/L 4个FUCO浓度进行后续实验。
SA-β-半乳糖苷酶可在经历多次传代后的细胞及诱导衰老的细胞中检测到,其阳性率能较好地反映细胞衰老程度[28]。MDA是常用的衰老检测指标[29]。SOD是机体内抗氧化过程中的关键酶,该酶可通过减轻自由基对细胞的损伤从而延缓衰老的进程[30]。体内过多的ROS能引起细胞DNA和RNA的损伤、破坏蛋白质等生物大分子的结构、引发脂质过氧化、导致MDA含量增高,是引起细胞和机体衰老的重要因素之一。已有研究发现FUCO能抑制氧化应激诱导的损伤视网膜色素细胞(Retinal Pigment Epithelium,RPE)中的MDA含量的增高[31],提高小鼠和细胞的SOD活性[32, 33],减少细胞内ROS的产生[34-37]。因此,本研究选择SA-β-半乳糖苷酶和SOD活性、MDA含量和ROS含量作为实验指标探究FUCO的抗衰老作用是合理的。但本研究结果显示,随着FUCO浓度的增高,SA-β-半乳糖苷酶活性增加,SOD活性降低,MDA含量和ROS含量增加。这一结果似乎表明高浓度的FUCO对斑马鱼的抗衰老能力较弱,这与FUCO具有强抗氧化能力相矛盾。研究发现FUCO的抗氧化活性和抗衰老能力并不会随着浓度的增高而增加[38-40],这可能是由于细胞和生物对FUCO的吸收率较低引起的,高浓度的FUCO并没有全部被吸收而发挥抗氧化和抗衰老作用。而且,多项研究发现FUCO是通过诱导产生ROS从而引起癌细胞的凋亡或死亡[41, 42],说明FUCO在某种条件下可诱导产生ROS,从而引发衰老。因此,关于高浓度FUCO抗斑马鱼衰老活性较低的原因是下一步研究的主要问题之一,拟先从斑马鱼胚胎对FUCO的吸收率进行探讨。
4 结论在浓度为2.5-15.0 μmol/L,尤其是低于10.0 μmol/L时,岩藻黄素能抑制H2O2诱导斑马鱼胚胎的衰老,表明岩藻黄素具有良好的抗衰老作用。本研究可为岩藻黄素的药用活性研究、抗衰老药物研发及藻类物质的高值化利用提供理论基础。
| [1] |
TURNHEIM K. When drug therapy gets old: pharmacokinetics and pharmacodynamics in the elderly[J]. Experimental Gerontology, 2003, 38(8): 843-853. DOI:10.1016/S0531-5565(03)00133-5 |
| [2] |
HARMAN D. Aging: a theory based on free radical and radiation chemistry[J]. Journal of Gerontology, 1956, 11(3): 298-300. DOI:10.1093/geronj/11.3.298 |
| [3] |
FOO S C, YUSOFF F M, IMAM M U, et al. Increased fucoxanthin in Chaetoceros calcitrans extract exacerbates apoptosis in liver cancer cells via multiple targeted cellular pathways[J]. Biotechnology Reports, 2018, 21: e00296. |
| [4] |
FUNG A, HAMID N, LU J. Fucoxanthin content and antioxidant properties of Undaria pinnatifida[J]. Food Chemistry, 2013, 136(2): 1055-1062. DOI:10.1016/j.foodchem.2012.09.024 |
| [5] |
OLIYAEI N, MOOSAVI-NASAB M, TAMADDON A M, et al. Antidiabetic effect of fucoxanthin extracted from Sargassum angustifolium on streptozotocin-nicotinamide-induced type 2 diabetic mice[J]. Food Science & Nutrition, 2021, 9(7): 3521-3529. |
| [6] |
LASHMANOVA E, PROSHKINA E, ZHIKRIVET-SKAYA S, et al. Fucoxanthin increases lifespan of Drosophila melanogaster and Caenorhabditis elegans[J]. Pharmacological Research, 2015, 100: 228-241. DOI:10.1016/j.phrs.2015.08.009 |
| [7] |
MOSKALEV A, SHAPOSHNIKOV M, ZEMSKAYA N, et al. Transcriptome analysis reveals mechanisms of geroprotective effects of fucoxanthin in Drosophila[J]. Bmc Genomics, 2018, 19(Suppl 3): 77. |
| [8] |
崔艳君, 唐娜, 牛建峰, 等. 岩藻黄素抗H2O2诱导WI-38细胞早衰的作用研究[J]. 中国海洋药物, 2018, 37(3): 48-52. |
| [9] |
HEO S J, JEON Y J. Protective effect of fucoxanthin isolated from Sargassum siliquastrum on UV-B induced cell damage[J]. Journal of Photochemistry and Photobiology B: Biology, 2009, 95: 101-107. DOI:10.1016/j.jphotobiol.2008.11.011 |
| [10] |
YALCIN H C, AMINDARI A, BUTCHER J T, et al. Heart function and hemodynamic analysis for zebrafish embryos[J]. Developmental Dynamics, 2017, 246(11): 868-880. DOI:10.1002/dvdy.24497 |
| [11] |
FONTANA B D, MEZZOMO N J, KALUEFF A V, et al. The developing utility of Barchydanio rerio models of neurological and neuropsychiatric disorders: a critical review[J]. Experimental Neurology, 2018, 299(Pt A): 157-171. |
| [12] |
HORZMANN K A, FREEMAN J L. Making waves: new developments in toxicology with the zebrafish[J]. Toxicological Sciences, 2018, 163(1): 5-12. DOI:10.1093/toxsci/kfy044 |
| [13] |
ZAMBUSI A, BURHAN Ö P, GIAIMO R D, et al. Granulins regulate aging kinetics in the adult zebrafish telencephalon[J]. Cells, 2020, 9(2): 350. DOI:10.3390/cells9020350 |
| [14] |
YAN J H, LI H S, BU H S, et al. Aging-associated sinus arrest and sick sinus syndrome in adult zebrafish[J]. PLoS One, 2020, 15(5): e0232457. DOI:10.1371/journal.pone.0232457 |
| [15] |
CARNOVALI M, BANFI G, MARIOTTI M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates[J]. Geroscience, 2021, 43(2): 927-940. DOI:10.1007/s11357-020-00267-0 |
| [16] |
NIE Y Y, YANG J M, ZHOU L J, et al. Marine fungal metabolite butyrolactone Ⅰ prevents cognitive deficits by relieving inflammation and intestinal microbiota imbalance on aluminum trichloride-injured zebrafish[J]. Journal of Neuroinflammation, 2022, 19(1): 39. DOI:10.1186/s12974-022-02403-3 |
| [17] |
LEE K J, NALLATHAMBY P D, BROWNING L M, et al. In vivo imaging of transport and biocompatibility of single silver nanoparticles in early development of zebrafish embryos[J]. ACS Nano, 2007, 1(2): 133-143. DOI:10.1021/nn700048y |
| [18] |
MACRAE C A, PETERSON R T. Zebrafish as tools for drug discovery[J]. Nature Reviews Drug Discovery, 2015, 14(10): 721-731. DOI:10.1038/nrd4627 |
| [19] |
SOUNDARARAJAN A, YOGANANTHARAJAH P, RAGHAVAN S, et al. Bisphenol A exposure under metabolic stress induces accelerated cellular senescence in vivo in a p53 independent manner[J]. Science of the Total Environment, 2019, 689: 1201-1211. DOI:10.1016/j.scitotenv.2019.06.391 |
| [20] |
DONNINI S, GIACHETTI A, ZICHE M. Assessing vascular senescence in zebrafish[J]. Methods in Molecular Biology, 2013, 965: 517-531. |
| [21] |
潘长伟, 赵峰, 郎宏鑫, 等. 过氧化氢诱导人皮肤成纤维细胞衰老模型的建立[J]. 解剖科学进展, 2019, 25(2): 193-195, 199. |
| [22] |
张梦斯. 琼玉膏通过sirt1/p53信号通路延缓H2O2诱导斑马鱼衰老的研究[D]. 广州: 广州中医药大学, 2018.
|
| [23] |
黄理杰. 琼玉膏通过Klotho/FGF-23信号通路延缓斑马鱼衰老的研究[D]. 广州: 广州中医药大学, 2019.
|
| [24] |
KADEKARU T, TOYAMA H, YASUMOTO T. Safety evaluation of fucoxanthin purified from Undaria pinnatifida[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2008, 55(6): 304-308. DOI:10.3136/nskkk.55.304 |
| [25] |
BEPPU F, NIWANO Y, TSUKUI T, et al. Single and repeated oral dose toxicity study of fucoxanthin (FX), a marine carotenoid, in mice[J]. The Journal of Toxicological Sciences, 2009, 34(5): 501-510. DOI:10.2131/jts.34.501 |
| [26] |
BEPPU F, NIWANO Y, SATO E, et al. In vitro and in vivo evaluation of mutagenicity of fucoxanthin (FX) and its metabolite fucoxanthinol (FXOH)[J]. The Journal of Toxicological Sciences, 2009, 34(6): 693-698. DOI:10.2131/jts.34.693 |
| [27] |
HOYBERGHS J, BARS C, AYUSO M, et al. DMSO concentrations up to 1% are safe to be used in the zebrafish Embryo Developmental Toxicity Assay[J]. Frontiers in Toxicology, 2021, 3: 804033. DOI:10.3389/ftox.2021.804033 |
| [28] |
DIMRI G P, LEE X, BASILE G, et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J]. Proceedings of the National Academy of Sciences of the United States of America, 1995, 92(20): 9363-9367. DOI:10.1073/pnas.92.20.9363 |
| [29] |
TSIKAS D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: analytical and biological challenges[J]. Analytical Biochemistry, 2017, 524: 13-30. DOI:10.1016/j.ab.2016.10.021 |
| [30] |
CHEN W, SU H M, XU Y, et al. In vitro gastrointestinal digestion promotes the protective effect of blackberry extract against acrylamide-induced oxidative stress[J]. Scientific Reports, 2017, 7: 40514. DOI:10.1038/srep40514 |
| [31] |
CHEN S J, LIN T B, PENG H Y, et al. Cytoprotective potential of fucoxanthin in oxidative stress-induced age-related macular degeneration and retinal pigment epithelial cell senescence in vivo and in vitro[J]. Marine Drugs, 2021, 19(2): 114. DOI:10.3390/md19020114 |
| [32] |
YANG H Y, XING R, LIU S, et al. Role of fucoxanthin towards cadmium-induced renal impairment with the antioxidant and anti-lipid peroxide activities[J]. Bioengineered, 2021, 12(1): 7235-7247. DOI:10.1080/21655979.2021.1973875 |
| [33] |
OU H C, CHOU W C, CHU P M, et al. Fucoxanthin protects against oxLDL-induced endothelial damage via activating the AMPK-Akt-CREB-PGC1α pathway[J]. Molecular Nutrition & Food Research, 2019, 63(10): e1801353. |
| [34] |
齐佳, 崔艳君, 王广策, 等. 岩藻黄素对H2O2诱导BNL CL.2细胞氧化损伤保护作用研究[J]. 中国海洋大学学报(自然科学版), 2019, 49(1): 63-68. |
| [35] |
WANG X, CUI Y J, QI J, et al. Fucoxanthin exerts cytoprotective effects against hydrogen peroxide-induced oxidative damage in L02 cells[J]. BioMed Research International, 2018, 2018: 1085073. |
| [36] |
WU W, HAN H, LIU J W W, et al. Fucoxanthin prevents 6-OHDA-induced neurotoxicity by targeting keap1[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 6688708. |
| [37] |
JERKOVIĆ I, CIKOŠ AM, BABIĆ S, et al. Bioprospecting of less-polar constituents from endemic brown macroalga Fucus virsoides J.Agardh from the Adriatic sea and targeted antioxidant effects in vitro and in vivo (zebrafish model)[J]. Marine Drugs, 2021, 19(5): 235. DOI:10.3390/md19050235 |
| [38] |
SHI Y X, REN J Y, ZHAO B M, et al. Photoprotective mechanism of fucoxanthin in ultraviolet B irradiation-induced retinal müller cells based on lipidomics analysis[J]. Journal of Agricultural and Food Chemistry, 2022, 70(10): 3181-3193. DOI:10.1021/acs.jafc.1c07980 |
| [39] |
LIU C L, LIANG A L, HU M L. Protective effects of fucoxanthin against ferric nitrilotriacetate-induced oxidative stress in murine hepatic BNL CL.2 cells[J]. Toxicology in Vitro, 2011, 25: 1314-1319. DOI:10.1016/j.tiv.2011.04.023 |
| [40] |
GUVATOVA Z, DALINA A, MARUSICH E, et al. Protective effects of carotenoid fucoxanthin in fibroblasts cellular senescence[J]. Mechanisms of Ageing and Development, 2020, 189: 111260. DOI:10.1016/j.mad.2020.111260 |
| [41] |
IYAPPAN P, BALA M D, SURESHKUMAR M, et al. Fucoxanthin induced apoptotic cell death in oral squamous carcinoma (KB) cells[J]. Bioinformation, 2021, 17(1): 181-191. DOI:10.6026/97320630017181 |
| [42] |
KIM K N, HEO S J, KANG S M, et al. Fucoxanthin induces apoptosis in human leukemia HL-60 cells through a ROS-mediated Bcl-xL pathway[J]. Toxicology in Vitro, 2010, 24: 1648-1654. DOI:10.1016/j.tiv.2010.05.023 |



