结直肠癌(Colorectal Cancer,CRC)是发病率位列全球第三的恶性肿瘤,也是导致癌症相关死亡的第二大原因,且CRC的预后与早期诊断密切相关,多数早期CRC可以治愈,5年生存率可达90%,而晚期CRC生存率则不足10%[1]。因此,研究CRC癌前病变的发生、发展及其早期诊治,对CRC防治具有重要意义。其中,具有高度恶性潜能的结直肠侧向发育型肿瘤(Laterally Spreading Tumor,LST)逐渐成为研究热点。LST是一类直径大于或等于10 mm,并侧向扩展生长的表浅型病变。根据内镜形态可划分为颗粒型(Granular Type,LST-G)和非颗粒型(Non-Granular Type,LST-NG),其中颗粒型包括颗粒均一型(Homogeneous Type,LST-GH)和结节混合型(Nodular-Mixed,LST-GM),非颗粒型包括扁平隆起型(Flat Elevated Type,LST-F)和假凹陷型(Pseudo Depressed Type,LST-D)[2, 3]。
目前关于LST侧向生长和癌变倾向的分子机制尚未明了。有研究提示Wnt信号通路的激活可能与LST的发生、发展相关[4],但具体机制尚未阐明,仍需进一步探讨Wnt信号通路对LST的影响。LST作为一种恶变潜能较高的癌前病变,通过研究其发生、发展及恶变的机制,可为结直肠癌的防治提供思路。Wnt信号通路相关分子富含亮氨酸重复序列G蛋白偶联受体5(Leucine-rich repeat-containing G protein-coupled Receptor 5,LGR5)、细胞周期蛋白依赖性激酶5(Cyclin-Dependent Kinase 5,CDK5)和β-连环蛋白(β-catenin)均与肿瘤生物学行为关系紧密,并与多种肿瘤的不良预后有关[5-7]。已有研究表明,β-catenin在LST的发生、发展中具有重要意义,但尚无LGR5和CDK5在LST中的相关研究。本研究通过分析Wnt信号通路相关分子LGR5、CDK5和β-catenin在正常组织、隆起型腺瘤(Protruded-type colorectal Adenoma,PA)、LST和CRC中的表达水平,为探讨LST的发生、发展及临床诊治提供一定的参考依据。
1 材料与方法 1.1 材料 1.1.1 组织标本收集2017年1月至2021年11月在广西医科大学第二附属医院行内镜治疗患者的LST组织标本56例,其中男性32例,女性24例;年龄为27-80岁;LST直径:>20 mm 14例,≤20 mm 42例;LST部位:近端结肠27例,远端结肠17例,直肠12例;LST病理分型:LST-GH 14例,LST-GM 26例,LST-F 15例,LST-D 1例,因为LST-D只有1例,故将LST-F和LST-D合并统计。收集经内镜切除的PA 58例,其中男性41例,女性17例;年龄为25-63岁;直径:>20 mm 5例,≤20 mm 53例;病变部位:近端结肠14例,远端结肠30例,直肠14例。收集外科手术治疗CRC及相应正常组织44例,其中男性31例,女性13例;年龄为34-81岁;肿瘤部位:近端结肠15例,远端结肠18例,直肠11例。所有标本均经病理证实。
1.1.2 主要试剂SP-9000免疫组化试剂盒、DAB显色试剂盒、柠檬酸修复液均购自北京中衫金桥生物技术有限公司,免疫组化一抗来源:β-catenin (8480T-100 μL)购自CST公司、LGR5(ab273092-100 μL)和CDK5(ab40773-100 μL)均购自Abcam公司。
1.2 免疫组织化学染色法用甲醛固定和石蜡包埋组织标本,切片,厚度约2 μm;将组织切片置于60 ℃恒温烤箱中烘烤30 min;二甲苯脱蜡后,使用不同浓度的酒精(浓度从高到低)进行水化,最后用蒸馏水清洗切片,依次经组织抗原修复、灭活内源性过氧化物酶、正常山羊血清封闭、一抗孵育。湿盒内4 ℃冰箱过夜。过夜后复温、二抗孵育、滴加辣根过氧化物酶标记的链霉素卵白素,DAB显色、苏木素复染、盐酸酒精分化、自来水冲洗,返蓝后用中性树脂封片。
1.3 染色结果判定采用10倍放大倍数扫描染色组织,获得细胞分布的整体印象。评估阳性细胞,以更高的放大率进行半定量分析,并确定最终分数。根据细胞染色强度、阳性细胞比例得出最终评分。免疫染色强度评分如下:0(无免疫染色)、1(弱免疫染色)、2(中等免疫染色)和3(强免疫染色)。细胞的阳性比例评分如下:0(阳性细胞<5%)、1(阳性细胞5%-25%)、2(阳性细胞26%-50%)和3(阳性细胞>50%)。最终染色分数为染色强度分数乘以阳性细胞染色比例分数。0-2分被定义为阴性(-)表达,3分及以上被定义为阳性(+)表达。
1.4 统计学方法数据分析采用R语言软件进行统计(版本:4.0.3)。两组计量资料的比较采用t检验或Wilcoxon秩和检验,多组计量资料的比较采用方差分析或Kruskal-Wallis H检验,计数资料采用卡方检验或Fisher确切概率法分析。所有结果检验取双侧P值,P<0.05为差异有统计学意义。
2 结果与分析 2.1 临床病理资料分析LST各亚型之间在性别、年龄、病变部位及病理类型上差异无统计学意义(P>0.05),在病变大小上差异具有统计学意义(P<0.05)(表 1)。通过对LST和PA的临床病理资料进行比较,发现两者性别差异没有统计学意义(P>0.05),而年龄、病变部位、病理类型和病变大小差异具有统计学意义(P<0.05)。本研究中LST主要位于近端结肠(48.21%),而PA主要位于远端结肠(51.72%),LST的病变大小比PA更大(P<0.05),并且LST相对PA具有更高的癌变率(表 2)。
| 项目 Item |
分类 Classification |
LST-NG | LST-GM | LST-GH | P |
| Number | 16 | 26 | 14 | ||
| Gender/[number (%)] | 0.859 | ||||
| Male | 10 (62.50) | 14 (53.85) | 8 (57.14) | ||
| Female | 6 (37.50) | 12 (46.15) | 6 (42.86) | ||
| Age | 62.00 [50.00, 68.25] | 64.00 [55.25, 68.50] | 60.00 [55.00, 62.00] | 0.753 | |
| Lesion location/[number (%)]※ | 0.596 | ||||
| Proximal colon | 7 (43.75) | 11 (42.31) | 9 (64.29) | ||
| Distal colon | 5 (31.25) | 8 (30.77) | 4 (28.57) | ||
| Rectum | 4 (25.00) | 7 (26.92) | 1 (7.14) | ||
| Pathological type/[number (%)] | 0.453 | ||||
| Tubular adenoma | 8 (50.00) | 13 (50.00) | 7 (50.00) | ||
| Villous adenoma | 0 (0.0) | 2 (7.69) | 1 (7.14) | ||
| Tubular villous adenoma | 3 (18.75) | 6 (23.08) | 2 (14.29) | ||
| Serrated lesion | 3 (18.75) | 0 (0.00) | 3 (21.43) | ||
| Canceration※ | 2 (12.50) | 5 (19.23) | 1 (7.14) | ||
| Tumor size/[number (%)] | 0.004 | ||||
| ≤20 mm | 16 (100.00) | 15 (57.69) | 11 (78.57) | ||
| >20 mm | 0 (0.00) | 11 (42.31) | 3 (21.43) | ||
| Note: ※ proximal colon includes cecum, ascending colon and transverse colon.Distal colon includes descending colon and sigmoid colon.Canceration refers to intramucosal carcinoma+submucosal carcinoma+high-grade intramucosal neoplasia. | |||||
| 项目 Item |
分类 Classification |
LST | PA | P |
| Number | 56 | 58 | ||
| Gender/(%) | 0.190 | |||
| Male | 32 (57.14) | 41 (70.69) | ||
| Female | 24 (42.86) | 17 (29.31) | ||
| Age | 59.93 [47.79, 72.07] | 54.76 [43.04, 66.48] | 0.023 | |
| Lesion location/[number (%)]※ | 0.020 | |||
| Proximal colon | 27 (48.21) | 14 (24.14) | ||
| Distal colon | 17 (30.36) | 30 (51.72) | ||
| Rectum | 12 (21.43) | 14 (24.14) | ||
| Pathological type/[number (%)] | 0.002 | |||
| Tubular adenoma | 28 (50.00) | 30 (51.73) | ||
| Villous adenoma | 3 (5.36) | 5 (8.62) | ||
| Tubular villous adenoma | 11 (19.64) | 22 (37.93) | ||
| Serrated lesion | 6 (10.71) | 0 (0.00) | ||
| Canceration※ | 8 (14.29) | 1 (1.72) | ||
| Tumor size/[number (%)] | 0.036 | |||
| ≤20 mm | 42 (75.00) | 53 (91.38) | ||
| >20 mm | 14 (5.00) | 5 (8.62) | ||
| Note: ※ proximal colon includes cecum, ascending colon and transverse colon.Distal colon includes descending colon and sigmoid colon.Canceration refers to intramucosal carcinoma+submucosal carcinoma+high-grade intramucosal neoplasia. | ||||
2.2 各组织中LGR5、CDK5和β-catenin的表达情况
免疫组织化学染色显示,LGR5、CDK5和β-catenin在正常组织中的表达较弱,在PA、LST和CRC组织中升高,LGR5和CDK5主要表达于质膜中,呈淡黄色、棕黄色甚至褐色颗粒;β-catenin表达于细胞质膜及细胞核中,呈淡黄色、棕黄色甚至褐色颗粒(图 1-图 3)。

|
| 图 1 LGR5在不同组织中的表达(400×) Fig. 1 Expression of LGR5 in different tissues (400×) |

|
| 图 2 CDK5在不同组织中的表达(400×) Fig. 2 Expression of CDK5 in different tissues (400×) |
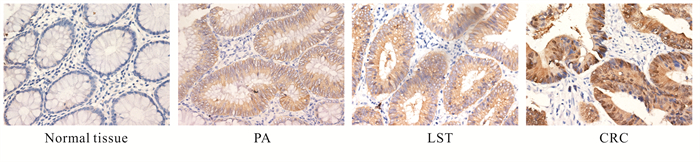
|
| 图 3 β-catenin在不同组织中的的表达(400×) Fig. 3 Expression of β-catenin in different tissues (400×) |
2.3 LGR5、CDK5和β-catenin在正常组织、PA、LST和CRC中的表达情况
LGR5在正常组织、PA、LST和CRC中的阳性率分别是61.36%、51.72%、80.36%和97.73%,CDK5在正常组织、PA、LST和CRC中的阳性率分别是27.27%、55.17%、78.57%、90.91%,β-catenin在正常组织、PA、LST和CRC中的阳性率分别是31.82%、48.28%、89.29%、88.64%。LGR5、CDK5及β-catenin在LST中的表达均高于正常组织和PA,差异具有统计学意义(P<0.05, 表 3)。LGR5、CDK5和β-catenin在不同LST亚型之间的表达差异均无统计学意义(P>0.05, 表 4)。
| 组织 Tissue |
例数 Number |
LGR5 | CDK5 | β-catenin | ||||||||
| 阴性 Negative |
阳性 Positive |
P | 阴性 Negative |
阳性 Positive |
P | 阴性 Negative |
阳性 Positive |
P | ||||
| Normal tissues | 44 | 17 | 27 | 0.000 | 32 | 12 | 0.000 | 30 | 14 | 0.000 | ||
| PA | 58 | 28 | 30 | 26 | 32 | 30 | 28 | |||||
| LST | 56 | 11 | 45 | 12 | 44 | 6 | 50 | |||||
| CRC | 44 | 1 | 43 | 4 | 40 | 5 | 39 | |||||
| Normol tissues vs LST | 0.035 | 0.000 | 0.000 | |||||||||
| PA vs LST | 0.001 | 0.008 | 0.000 | |||||||||
| CRC vs LST | 0.007 | 0.094 | 1.000 | |||||||||
| LST亚型LST subtype | 例数Number | LGR5 | CDK5 | β-catenin | ||||||||
| 阴性 Negative |
阳性 Positive |
P | 阴性 Negative |
阳性 Positive |
P | 阴性 Negative |
阳性 Positive |
P | ||||
| LST-GH | 16 | 4 | 12 | 0.690 | 3 | 13 | 0.769 | 2 | 14 | 0.748 | ||
| LST-GM | 26 | 4 | 22 | 5 | 21 | 2 | 24 | |||||
| LST-NG | 14 | 3 | 11 | 4 | 10 | 2 | 12 | |||||
3 讨论
LST作为一类特殊类型的癌前疾病,癌变率明显高于PA[8]。本研究中LST癌变率为14.29%,明显高于PA,因此LST作为一种具有较高恶变潜能的结直肠病变受到越来越多的关注,但其特殊生长方式的分子机制及恶变机制尚不清楚。研究表明Wnt/β-catenin信号通路参与多种肿瘤的进程[9],并且研究发现Wnt/β-catenin信号通路参与LST发生、发展,甚至与恶变过程密切相关[10],然而该信号通路调控LST的具体机制尚未完全阐明。
Wnt/β-catenin信号通路是一条保守的信号轴,参与各种生理过程,如增殖、分化、凋亡、迁移、侵袭和组织稳态[11]。β-catenin作为Wnt经典信号通路中最关键的传递分子,其通过促进癌基因的转录导致肿瘤的发生[12, 13]。有研究发现β-catenin在LST组织中的表达水平明显高于PA[14],并且Wnt/β-catenin信号通路的激活与LST发生、发展,甚至恶变过程密切相关[15]。本研究证实β-catenin在正常组织、PA、LST和CRC中的阳性表达率逐渐增高,且β-catenin在LST与CRC中的表达无明显差异,也表明Wnt/β-catenin信号通路的激活可能参与LST发生、发展与恶变[10]。
CDK5、LGR5均是Wnt信号通路的重要蛋白[5, 6]。研究表明,CDK5参与多种癌症的肿瘤增殖、迁移和侵袭过程[16]。在本研究中,LST组织中CDK5的表达高于正常组织及PA组织,提示CDK5可能与LST的特殊生长方式相关。研究报道CDK5可影响E-钙黏蛋白和N-钙黏蛋白等表达,导致细胞黏附能力的改变,从而促进上皮间质转化(Epithelial-Mesenchymal Transition,EMT)[17],并且已经证明CDK5可以通过激活Wnt信号通路介导EMT过程促进CRC的进展[18]。本研究中,CDK5在LST中与CRC组织表达无明显差异,提示LST和CRC可能有相似的Wnt信号通路活动水平,CDK5与恶变潜能密切相关。
LGR5是Wnt信号传导的一部分,可以调节Wnt信号通路的表达水平,并且对肿瘤的发生、发展和转移起至关重要的作用[19]。本研究发现LGR5在LST组织表达水平低于CRC组织而高于PA组织。有研究发现LGR5在正常组织、炎性息肉、腺瘤、腺癌中的阳性表达呈现逐渐增高趋势,考虑其表达与异型增生程度相关[20]。提示LGR5可能参与LST的特殊生长方式或恶变潜能,是促进结直肠黏膜组织异性增生并进一步导致LST癌变进展的重要分子。
已有研究表明LST的生长特征可能与细胞极性密切相关[21],正常结直肠上皮组织良好的结构与顶端和基底外侧极性相关,细胞极化是指细胞内有组织地建立不对称性[22],EMT是指上皮细胞顶端-基底极性的丧失和间质细胞前-后极性的重新启动[23]。在某些特殊情况下,细胞极性会受到干扰,极性改变会致使上皮细胞黏附减弱,迁移能力增加,获得更强的运动性,直接参与伤口愈合或促进肿瘤细胞迁移[24]。既往研究证实β-catenin表达升高可以激活Wnt信号通路下游靶基因进而促进EMT[25],因此,LGR5、CDK5可能通过Wnt/β-catenin信号通路调控EMT参与LST的特殊生长方式和癌变。LGR5和CDK5可能是潜在的LST及结直肠癌的治疗靶点,然而,具体机制还需进一步深入研究。本研究为进一步阐明LST和结直肠癌发病机制及防治提供了思路。
| [1] |
SIEGE R L, MILLER K D, FUCHS BS H E, et al. Cancer statistics[J]. CA: A Cancer Journal for Clinicians, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
LAMBERT R, TANAKA S. Laterally spreading tumors in the colon and rectum[J]. European Journal of Gastroenterology & Hepatology, 2012, 24(10): 1123-1134. |
| [3] |
ANTONIO F, MATTEO A, MARIANNA D M, et al. Non-polypoid colorectal neoplasms: classification, therapy and follow-up[J]. World Journal of Gastroenterology, 2015, 21(17): 5149-5157. DOI:10.3748/wjg.v21.i17.5149 |
| [4] |
张泉, 朱蓉, 赵逵. Wnt/β-catenin信号通路及相关因子与大肠侧向发育型肿瘤发病机制的研究进展[J]. 重庆医学, 2019, 48(5): 841-844. |
| [5] |
XU L, LIN W, WEN L, et al. Lgr5 in cancer biology: functional identification of Lgr5 in cancer progression and potential opportunities for novel therapy[J]. Stem Cell Research & Therapy, 2019, 10(1): 219. |
| [6] |
DORAND R D, NTHALE J, MYERS J T, et al. Cdk5 disruption attenuates tumor PD-L1 expression and promotes antitumor immunity[J]. Science, 2016, 353(6297): 399-403. DOI:10.1126/science.aae0477 |
| [7] |
PENG Y, XU Y, ZHANG X, et al. A novel protein AXIN1-295aa encoded by circAXIN1 activates the Wnt/β-catenin signaling pathway to promote gastric cancer progression[J]. Molecular Cancer, 2021, 20(1): 158. DOI:10.1186/s12943-021-01457-w |
| [8] |
段天英, 周峻锋, 谭玉勇, 等. β-catenin、VEGF、CD105在大肠侧向发育型肿瘤中的表达及临床意义[J]. 中华胃肠内镜电子杂志, 2016, 3(1): 20-26. |
| [9] |
PARSONS M J, TAMMELA T, DOW L E. WNT as a driver and dependency in cancer[J]. Cancer Discovery, 2021, 11(10): 2413-2429. DOI:10.1158/2159-8290.CD-21-0190 |
| [10] |
SHI L, WU Y X, YU J H, et al. Research of the relationship between β-catenin and c-myc-mediated Wnt pathway and laterally spreading tumors occurrence[J]. European Review for Medical and Pharmacological Sciences, 2017, 21(2): 252-257. |
| [11] |
ZHANG Y, WANG X. Targeting the Wnt/β-catenin signaling pathway in cancer[J]. Journal of Hematolo- gy & Oncology, 2020, 13(1): 165. |
| [12] |
XU X, ZHANG M, XU F, et al. Wnt signaling in breast cancer: biological mechanisms, challenges and opportunities[J]. Molecular Cancer, 2020, 19(1): 165. DOI:10.1186/s12943-020-01276-5 |
| [13] |
BISSO A, FILIPUZZI M, GAMARRA FIGUEROA G P, et al. Cooperation between MYC and β-Catenin in liver tumorigenesis requires Yap/Taz[J]. Hepatology, 2020, 72(4): 1430-1443. DOI:10.1002/hep.31120 |
| [14] |
王新颖, 王菁, 龚伟, 等. β-catenin、磷酸化GSK-3β、c-myc与大肠侧向发育型肿瘤关系的研究[J]. 广东医学, 2010, 31(15): 1973-1975. |
| [15] |
NAKAE K, MITOMI H, SAITO T, et al. MUC5AC/β-catenin expression and KRAS gene alteration in laterally spreading colorectal tumors[J]. World Journal of Gastroenterology, 2012, 18(39): 5551-5559. DOI:10.3748/wjg.v18.i39.5551 |
| [16] |
DO P A, LEE C H. The role of CDK5 in tumours and tumour microenvironments[J]. Cancers, 2020, 13(1): 101. DOI:10.3390/cancers13010101 |
| [17] |
JIA Y, DUAN Y, LIU T, et al. LncRNA TTN-AS1 promotes migration, invasion, and epithelial mesenchymal transition of lung adenocarcinoma via sponging miR-142-5p to regulate CDK5[J]. Cell Death & Disease, 2019, 10(8): 573. |
| [18] |
LI X, HUANG J, YU T, et al. Fusobacterium nucleatum promotes the progression of colorectal cancer through Cdk5-Activated Wnt/β-Catenin signaling[J]. Frontiers in Microbiology, 2020, 11: 545251. |
| [19] |
LAU W D, PENG W C, GROS P, et al. The R-spon- din/Lgr5/Rnf43 module: regulator of Wnt signal strength[J]. Genes & Development, 2014, 28(4): 305-316. |
| [20] |
薛伟彩, 王建立, 许建成, 等. 结直肠息肉和结直肠癌中CD24和Lgr5的表达[J]. 中国老年学杂志, 2018, 38(13): 3116-3119. |
| [21] |
ICHIKAWA Y, NAGASHIMA Y, MORIOKA K, et al. Colorectal laterally spreading tumors show characteristic expression of cell polarity factors, including atypical protein kinase C λ/ι, E-cadherin, β-catenin and basement membrane component[J]. Oncology Letters, 2014, 8(3): 977-984. |
| [22] |
BUTLER M T, WALLINGFORD J B. Planar cell polarity in development and disease[J]. Nature Reviews Molecular Cell Biology, 2017, 18(6): 375-388. |
| [23] |
ZHANG N, NG A S, CAI S, et al. Novel therapeutic st- rategies: targeting epithelial-mesenchymal transition in colorectal cancer[J]. The Lancet Oncology, 2021, 22(8): e358-e368. |
| [24] |
THIERY J P. Epithelial-mesenchymal transitions in tumour progression[J]. Nature Reviews Cancer, 2002, 2(6): 442-454. |
| [25] |
YUAN K, XIE K, LAN T, et al. TXNDC12 promotes EMT and metastasis of hepatocellular carcinoma cells via activation of β-catenin[J]. Cell Death and Differentiation, 2020, 27(4): 1355-1368. |



