2. 北部湾海洋产业研究院, 广西防城港 538000
2. Beibu Gulf Marine Industry Research Institute, Fangchenggang, Guangxi, 538000, China
浮游植物为海洋生态系统提供了95%的初级生产力,在海洋能量流动、物质循环和信息传递中起关键作用,是海洋生态系统的基础节点[1]。由于浮游植物群落结构易受环境因素波动的影响,因此被认为是海洋环境变化的生物指标和资源评估的重要依据[2]。浮游植物种类与形态众多,一般可将其分为硅藻(Diatoms)、甲藻(Dinoflagellates)和金藻(Chrysophytes)等十余个大类;依据细胞粒径的范围,可将其分为小型浮游植物(Microphytoplankton,20-200 μm)、微型浮游植物(Nanophytoplankton,2-20 μm)、微微型浮游植物(Picophytoplankton,0.2-2 μm)[3]。显微镜镜检法是分析浮游植物群落结构的传统方法,但该法费时费力,难以鉴定微微型、部分微型、易破碎或变形的浮游植物。目前,以多种光合色素与叶绿素a的比值矩阵为依据,利用Mackey等[4]开发的CHEMTAX软件将高效液相色谱(HPLC)技术测定的光合色素换算为各门类浮游植物对叶绿素a贡献值的HPLC-CHEMTAX技术得到广泛应用[5, 6]。该技术不仅可揭示全粒级浮游植物类群结构,而且操作简单、快速,适用于大批量样品的分析,能克服镜检法的局限[6]。
钦州湾属于典型的亚热带半封闭式海湾,其北部为茅尾海,属于钦州湾内湾;中段为湾颈;外为钦州港,也称外湾[7]。近年来,随着钦州湾周边经济的快速发展,钦州湾增养殖业规模不断扩大,牡蛎养殖已经从内湾扩张至外湾的近岸海域,这对海湾的生态环境、浮游植物群落的组成和丰度都有较大影响[8, 9]。目前关于钦州湾海域浮游植物结构的研究已有大量报道,但几乎都是基于显微镜镜检法,因此对浮游植物结构的描述缺乏完整性[7, 8, 10]。蓝文陆等[9, 11, 12]通过HPLC-CHEMTAX技术分别对枯水期、平水期和丰水期的钦州湾浮游植物群落进行分析,发现在显微镜下无法观察到的小粒径藻类[如青绿藻(Prasinophytes)和蓝藻(Cyanobacteria)]普遍存在于钦州湾海域,并在浮游植物群落中占据相当大的比例。微型和微微型浮游植物也是重要的初级生产力贡献者[13],许多微型真核藻类被列为我国近海常见的赤潮原因种,其中球形棕囊藻(Phaeocystis globosa)是形成钦州湾棕囊藻赤潮的原因种[14]。赵越等[15]分析了微型、微微型浮游植物与北部湾海域球形棕囊藻赤潮生消过程的关系,发现赤潮发生过程中聚球藻(Synechococcus spp.)和原绿球藻(Prochlorococcus spp.)丰度快速下降,该现象有望用于球形棕囊藻赤潮的预警。由此可见,长期监测钦州湾微型和微微型浮游植物的变化对完善该海域的生态环境评估是非常必要的。本研究选择赤潮频发的钦州湾外湾为调查区域,利用HPLC-CHEMTAX技术研究冬季钦州湾外湾海域浮游植物的群落结构,为全面揭示钦州湾浮游植物群落结构,以及环境因素、贝类养殖对浮游植物群落结构的影响提供科学参考。
1 材料与方法 1.1 调查时间与研究区域于2021年1月13日在广西钦州湾外湾海域进行现场调查,共设置13个站位(图 1),检测的主要参数包括温度、盐度、无机营养盐以及浮游植物光合色素。
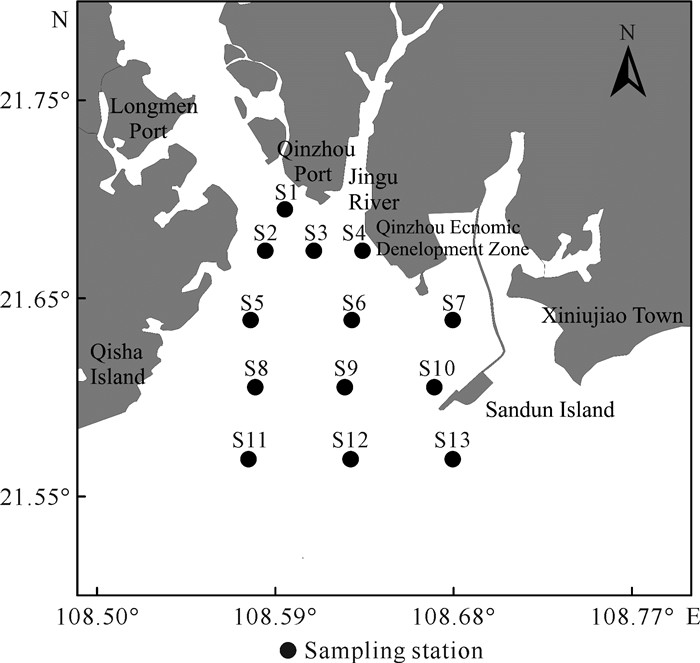
|
| 图 1 采样站位 Fig. 1 Location of sampling stations |
1.2 样品的采集与处理
现场样品的采集、保存和分析均按照《海洋调查规范:第4部分海水化学要素调查》(GB/T 12763.4-2007)[16]执行。使用5 L Niskin采水器收集表层水样(-0.5 m),取一定体积水样经20 μm筛绢过滤,用于收集微微型和微型浮游植物(粒径小于20 μm);另取一定体积水样经200 μm筛绢过滤,用于收集全粒径浮游植物。将上述经不同孔径筛绢过滤的水样分别在弱真空(<0.03 MPa)下用47 mm Whatman GF/F玻璃纤维膜过滤,滤膜用铝箔纸包裹并置于液氮中保存直至进行色素测定;过滤水样装于聚乙烯瓶中,加入氯仿并置于-20℃条件下冷冻保存,用于磷酸盐(PO4-P)、溶解性无机氮(DIN)、硅酸盐(SiO3-Si)的测定。浮游植物样品固定:取1 L水样加入鲁哥试剂,使其最终浓度为15%,并保存于阴暗处直至进行样品分析。温度、盐度等水文指标采用AAQ171型直读式多参数水质分析仪现场测定。
1.3 浮游植物的光学显微镜检测参照Utermöhl[17]的方法对样品进行浮游植物鉴定和计数:将样品静置沉降48 h,用虹吸法吸走上清液, 将样品浓缩为5-15 mL,取0.1 mL浓缩样品于浮游植物计数框中,在Nikon ECLIPSE Ti-S倒置荧光显微镜下对浮游植物进行分类鉴定和计数。
1.4 HPLC色素分析色素提取:在弱光条件下,将滤膜剪碎,置于10 mL聚乙烯塑料离心管中,用3-5 mL 95%甲醇提取色素,冰浴超声处理5 min,用尼龙滤膜针筒滤器(孔径为0.22 μm)将提取液过滤至1.5 mL进样小瓶中并保存于-80℃冰箱中。测定前将200 μL色素提取液与67 μL超纯水混合,按照Zapata等[18]的方法进行HPLC色素分析。
实验使用Agilent 1200型高效液相色谱仪。系统配置包括G1322A在线脱气装置、G1311A四元梯度泵、G1329B自动进样器、G1316A柱温箱以及G1314B可变波长检测器。选择Waters Symmetry C8柱为色谱柱,规格为150 mm×4.6 mm,3.5 μm,100 -孔径。流动相A为甲醇-乙腈-吡啶水溶液,三者体积比为50∶25∶25;流动相B为甲醇-乙腈-丙酮,三者体积比为20∶60∶20。采用二元梯度洗脱程序:在22 min内流动相B的浓度由初始0%上升至40%;到28 min时升至95%,并保持10 min;最后在2 min内降至0%。进样量为100 μL,柱温为25 ℃,流速为1.0 mL/min,可变波长检测器的波长为440 nm。
22种色素标准品均购自DHI (Institute for Water and Environment, Denmark),包括叶绿素a (Chlorophyll a,Chl a)、二乙烯基叶绿素a (Divinyl Chlorophyll a,Dv Chl a)、脱镁叶绿素a (Pheophythin a,Pheo a)、叶绿素b (Chlorophyll b,Chl b)、叶绿素c2 (Chlorophyll c2,Chl c2)、叶绿素c3 (Chlorophyll c3,Chl c3)、Mg-2, 4-二乙烯基脱镁卟啉a5单甲基酯(Mg-2, 4-divinylpheoporphyrin a5 monomethylester,Mg DVP)、多甲藻素(Peridinin,Peri)、岩藻黄素(Fucoxanthin,Fuco)、19′-丁酰氧基岩藻黄素(19′-Butanoyloxyfucoxanthin,But)、19′-己酰氧基岩藻黄素(19′-Hexanoyloxyfucoxanthin,Hex)、4-酮基-19′-己酰氧基岩藻黄素(19′-Hexanoyloxy-4-ketofucoxanthin,4k-hex-fuco)、新黄素(Neoxanthin,Neo)、青绿素(Prasinoxanthin,Pras)、紫黄素(Violaxanthin,Viol)、硅甲藻黄素(Diadinoxanthin,Diad)、硅藻黄素(Diatoxanthin,Diat)、别藻黄素(Alloxanthin,Allo)、玉米黄素(Zeaxanthin,Zea)、叶黄素(Lutein,Lut)等等。
1.5 色素数据的CHEMTAX分析利用CHEMTAX软件[4],依据色素浓度数据计算不同浮游植物类群对Chl a的贡献量(即浮游植物类群的生物量)和贡献率(即浮游植物类群对总生物量的贡献率)。本文分析了8个浮游植物类群:青绿藻、甲藻、隐藻(Cryptophytes)、定鞭藻(Haptophytes)、绿藻(Chlorophytes)、硅藻、蓝藻、金藻。初始矩阵是根据Mackey等[4]和Wang等[19]的结果得出,如表 1所示。
| Peri | But | Fuco | Hex | Neo | Pras | Viol | Allo | Lut | Zea | Chl b | Chl a | |
| Prasinophytes | 0.15 | 0.32 | 0.06 | 0.01 | 0.95 | 1.00 | ||||||
| Dinoflagellates | 1.06 | 1.00 | ||||||||||
| Cryptophytes | 0.23 | 1.00 | ||||||||||
| Haptophytes | 0.02 | 0.05 | 1.2 | 1.00 | ||||||||
| Chlorophytes | 0.06 | 0.06 | 0.2 | 0.01 | 0.26 | 1.00 | ||||||
| Diatoms | 0.75 | 1.00 | ||||||||||
| Cyanobacteria | 1.2 | 1.00 | ||||||||||
| Chrysophytes | 1.3 | 0.2 | 0.01 | 1.00 |
1.6 数据分析
水质参数、光合色素以及浮游植物生物量平面分布图使用Surfer 14.0软件绘制。浮游植物细胞丰度与利用CHEMTAX计算得出的浮游植物生物量之间的相关性使用Origin 2017软件分析(采用Pearson相关性系数)。采用CANOCO 5软件进行冗余分析(RDA),以探索海水水质和利用CHEMTAX计算得出的浮游植物生物量之间的关系(即浮游植物组成对水质参数的响应),使用蒙特卡罗检验(Monte Carlo Test)验证排序结果,若P < 0.05,说明排序分析结果可以采用。
2 结果与分析 2.1 海水水质的分布特征钦州湾外湾海域冬季表层海水的温度、盐度、无机氮、磷酸盐和硅酸盐等水质参数的分布特征见图 2和表 2。表层海水温度变化范围较小(11.16-14.55 ℃),除了位于防城港核电站排水口附近的S8站位(14.55 ℃),其余站位之间的温差最高仅为1 ℃,而S8站位与其他站位的温差为2.38-3.39 ℃,平均温差达到2.81 ℃,温度从近岸到远岸海域(由北向南)呈逐渐升高的趋势。海水盐度变化范围也不大(28.66-32.11),由于受到湾中部金鼓江淡水输入的影响,低值区出现在位于河口的S3和S4站位,盐度在空间分布上呈近岸低、远岸高趋势。而S8站位虽然比较靠外海,但是因受核电站温排水影响,其盐度值(30.51)低于同一纬度上的S9站位(31.62)。由于受陆源金鼓江淡水输入的影响,3类无机营养盐的高值区均出现在S3和S4站位,且空间分布特征相似,均沿着盐度增加的梯度由北向南、从近岸向远岸逐渐降低。调查区域的N/P均小于Redfield比值(16∶1),根据Justić等[20]定义的营养盐限制标准,本次采样区内所有站点都处于结构性氮限制状态,其中S9、S11、S12、S13站位的DIN浓度均低于浮游植物生长的阈值(1 μmol/L)。
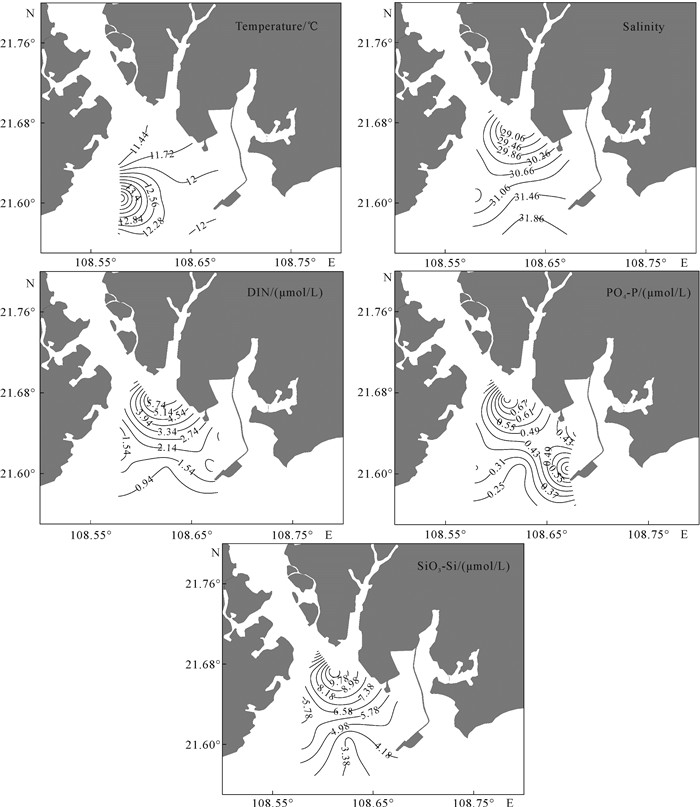
|
| 图 2 钦州湾外湾海域冬季表层海水水质参数的分布特征 Fig. 2 Distribution of water quality parametersinthe surface waters of outer Qinzhou Bayin winter |
| 项目Items | T/℃ | 盐度Salinity | DIN/ (μmol/L) | PO4-P/ (μmol/L) | SiO3-Si/ (μmol/L) | NO3-N/ (μmol/L) | NO2-N/ (μmol/L) | NH4-N/ (μmol/L) | N/P | Si/N | Si/P |
| Ranges | 11.16-14.55 | 28.66-32.11 | 0.34-6.32 | 0.19-0.83 | 2.58-11.42 | 0.11-5.34 | 0.16-0.38 | 0.00-0.69 | 1.42-9.12 | 1.53-11.10 | 6.50-18.52 |
| Mean values | 11.96 | 30.82 | 2.17 | 0.40 | 5.57 | 1.76 | 0.26 | 0.16 | 4.93 | 4.14 | 14.94 |
2.2 主要光合色素的组成与分布
本次调查在钦州湾外湾海域中检出的Chl a和5种主要特征色素的含量高低依次为Chl a>Fuco>Chl b>Allo>Peri>Pras,其空间分布如图 3所示。Chl a的平均浓度为1.34 μg/L,从北向南浓度逐渐升高,高值区位于南部远岸的S12站位(2.02 μg/L)和S13站位(2.00 μg/L),低值区有2个,分别位于西部的S8站位(0.98 μg/L)和北部的S3站位(0.74 μg/L)。Fuco是含量最高的特征色素,浓度为0.30-1.28 μg/L,平均值为0.74 μg/L。Fuco和Peri空间分布特征与Chl a相似,最高值都出现在S12站位。Chl b、Pras的分布特征与Chl a的分布特征相反,即浓度从北向南呈逐渐降低趋势,最高值都出现在最北侧的S1站位,最低值都出现在西南侧的S8站位。Allo有两个浓度高值区,分别为最北侧的S1站位和最东侧的S7站位,最低值出现在S8站位,整体分布呈北高南低的趋势。

|
| 图 3 钦州湾外湾海域主要光合色素浓度的分布特征 Fig. 3 Distribution characteristics of main photosynthetic pigment concentrations in the outer bay waters of Qinzhou Bay |
2.3 浮游植物类群的生物量及其空间分布
利用CHEMTAX软件,以初始矩阵为依据对光合色素进行换算,结果显示钦州湾外湾海域冬季主要浮游植物类群为硅藻、隐藻、青绿藻和甲藻,蓝藻、绿藻、定鞭藻和金藻的检出量相对较低。图 4为主要浮游植物类群生物量的空间分布变化情况。硅藻是浮游植物群落中的绝对优势类群,其生物量为0.31-1.58 μg/L。由于But和Hex两种色素(分别为金藻和定鞭藻的特征色素[4])在本航次中的检出量较低,因此Fuco几乎都是由硅藻产生。经CHEMTAX软件换算,硅藻的空间分布与Fuco一致,即由近岸向远岸浓度逐渐升高,S12站位生物量最高。隐藻是第二优势类群,生物量为0.05-0.49 μg/L,其空间分布情况与其特征色素Allo[4]相似,高值区为S1和S7站位。青绿藻的生物量为0.03-0.24 μg/L,整体上呈现从北到南逐渐降低的趋势,最高值出现在西北端的S1站位。甲藻生物量较少(0.02-0.09 μg/L),分布特征与硅藻相似。蓝藻、绿藻、定鞭藻和金藻的生物量总和为0.03-0.10 μg/L,其中蓝藻和绿藻对此小类群生物量的贡献最大,东部和南部为高值区,越往北生物量越小。

|
| 图 4 钦州湾外湾海域主要浮游植物类群的生物量分布 Fig. 4 Biomass distribution of main phytoplankton groups in the outer bay waters of Qinzhou Bay |
2.4 浮游植物群落的组成结构与分布
硅藻是钦州湾外湾海域冬季浮游植物群落中最大的优势类群,硅藻对总生物量的贡献率为40.38%-86.67%,平均为62.29%,除S1、S3和S4站位外,硅藻在其他站位的贡献率都超过50%[图 5(a)]。隐藻在所有站位中是仅次于硅藻的第二大浮游植物类群,占总生物量的4.95%-33.81%,平均为20.25%,其在群落中的占比整体上由北向南逐渐降低[图 5(a)]。青绿藻占总生物量的3.41%-18.32%,平均为9.77%,其在群落中的占比趋势与隐藻相似。甲藻和绿藻在调查区域的占比相对稳定(1.09%-6.03%),平均占比分别为3.43%和2.40%。蓝藻、定鞭藻和金藻3个类群对总生物量的贡献最小,在各站位所占比例平均值均不超过1%。

|
| 图 5 钦州湾外湾海域不同类群(a)和不同粒径(b)浮游植物对总生物量的贡献 Fig. 5 Contribution of various phytoplankton groups (a) and particle sizes (b) to total biomass in the outer bay waters of Qinzhou Bay |
由图 5(b)可知,在本次调查区域内小型浮游植物(20-200 μm)对总生物量的贡献率整体上随着离岸的距离增加而增加,而粒径小于20 μm的浮游植物的贡献率则在近岸处较高。小型浮游植物对总生物量的贡献率为39.25%,粒径小于20 μm的浮游植物的贡献率为60.75%。图 6显示,硅藻的细胞粒径范围较广,而隐藻、甲藻和蓝藻的细胞粒径大多在20 μm以下,可见小型浮游植物的生物量主要由硅藻提供。小型硅藻的生物量分布整体上表现为由近岸向湾口逐渐增大的趋势,小粒径硅藻(< 20 μm)的生物量在各个调查站位的波动不大。
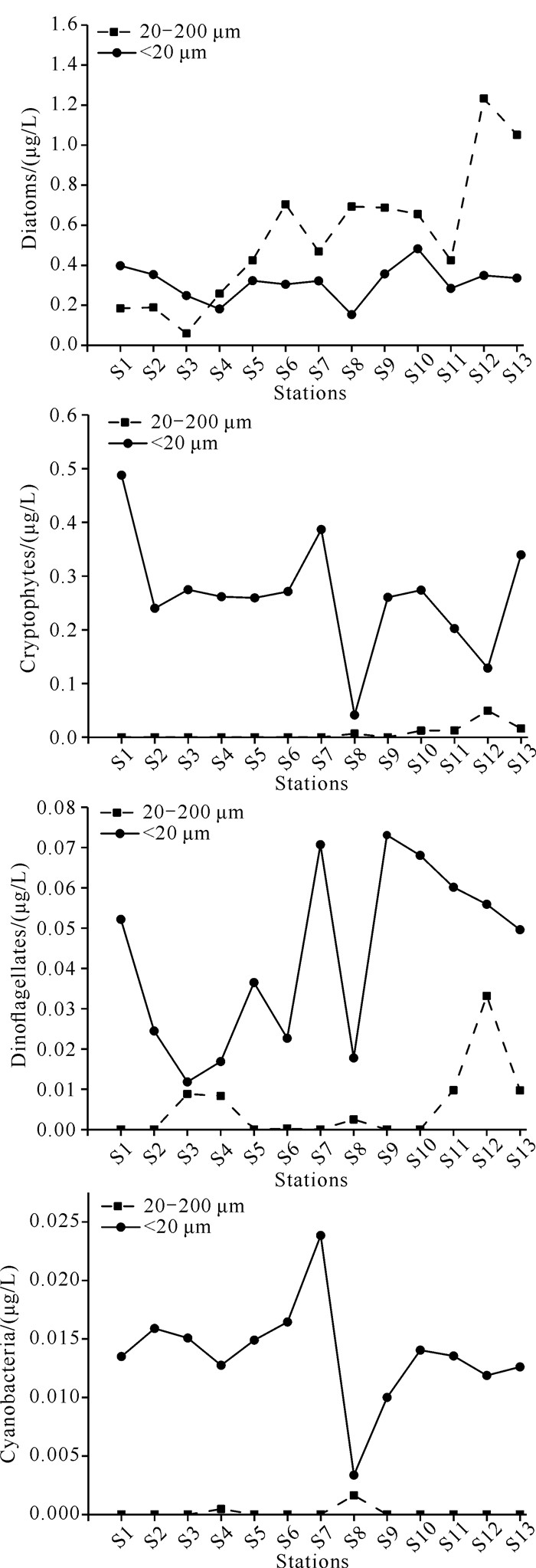
|
| 图 6 钦州湾外湾海域主要浮游植物类群的粒径分布 Fig. 6 Particle size distribution of major phytoplankton groups in the outer bay waters of Qinzhou Bay |
2.5 CHEMTAX计算结果与显微镜镜检结果的相关性分析
硅藻和甲藻是镜检法检出的主要浮游植物类群。将CHEMTAX计算结果与显微镜镜检结果进行线性回归分析发现(图 7),硅藻细胞丰度与CHEMTAX计算结果(硅藻生物量)呈正相关关系,相关性系数为0.29,但无显著性(P>0.05),表明两者的相关性不显著;甲藻细胞丰度与CHEMTAX计算结果(甲藻生物量)呈显著正相关关系(P < 0.05),相关性系数为0.45,表明两者的相关性较好。

|
| 图 7 硅藻(a)和甲藻(b)细胞丰度与生物量的线性关系 Fig. 7 Linear relationship between abundance and biomass of Diatoms (a) and Dinoflagellates (b) |
2.6 环境因子对浮游植物类群的影响
利用CHEMTAX计算结果进行RDA,研究浮游植物组成对水质参数的响应。蒙特卡罗检验结果显示,环境因子对浮游植物数据的变化具有显著的解释作用(P < 0.05)。经CANOCO 5软件自动校正后,选取的5个环境因子(温度、盐度、无机氮、磷酸盐和硅酸盐)可解释浮游植物群落总变量的53.20%,第一轴和第二轴的物种-环境相关系数分别为0.856和0.870,并分别解释了45.18%和7.93%的物种变量(图 8)。
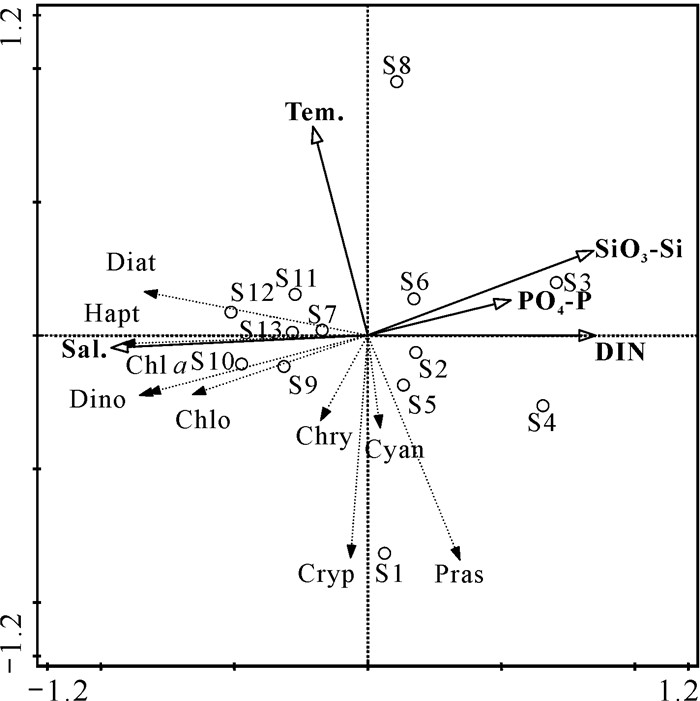
|
| Sal.: Salinity; Tem.: Temperature; Diat: Diatoms; Dino: Dinoflagellates; Hapt: Haptophytes; Cryp: Cryptophytes; Pras: Prasinophytes; Chry: Chrysophytes; Chlo: Chlorophytes; Cyan: Cyanobacteria. 图 8 钦州湾外湾海域的RDA排序图 Fig. 8 Ordination diagram of RDA in outer Qinzhou Bay |
不同浮游植物类群受环境因子影响的模式不同(图 8),Chl a、硅藻、甲藻、定鞭藻和绿藻与盐度呈较强正相关,与磷酸盐、无机氮和硅酸盐则呈较强负相关。金藻与盐度呈正相关,与磷酸盐和硅酸盐呈负相关。青绿藻、蓝藻和隐藻与温度呈较强的负相关,而与其他环境因子相关性较小。Chl a、硅藻、甲藻、定鞭藻和绿藻的生物量集中在采样区的东南部(S9、S10、S12和S13),该区域具有高盐度和低营养盐浓度的特征。采样区最北侧的S1站位以青绿藻和隐藻为主。S2-S4和S6站位受金鼓江影响较大,成为营养盐的高浓度区,S2-S4站位是整个采样区浮游植物生物量最低的区域。S8站位温度最高,且浮游植物群落结构上除硅藻外其他藻类占比均较低。
3 讨论钦州湾海域浮游植物丰度四季均有从湾内向湾外递增的趋势[7, 8, 10],这与本次调查的浮游植物总生物量(Chl a)分布趋势一致(图 3)。多项研究结果表明硅藻在钦州湾海域浮游植物群落中常年占据绝对优势地位,只有在发生球形棕囊藻赤潮时,其优势地位才会被取代[7, 8, 10, 21]。但这些研究大多是通过传统的显微镜镜检法来对浮游植物进行分类鉴定和计数,由于镜检法的局限性,小粒径和易破碎的细胞无法被观察到。镜检法检出的非硅藻类群大多为甲藻,其他类群如蓝藻,主要是较大个体的颤藻(Oscillatoria sp.)和念珠藻(Nostoc sp.)[7, 8, 11],其丰度比例都很低,因而体型较大的硅藻和甲藻一直被认为是该海域的主要类群。但是蓝文陆等[9, 11, 12]在2010-2011年的调查研究中已经证明微微型的蓝藻和青绿藻普遍存在于钦州湾海域,因此只通过镜检法表征浮游植物群落结构是不全面的。本研究中Fuco是含量最高的特征色素(图 3),经过CHEMTAX软件换算得知硅藻在钦州湾依旧占据主导地位(图 5);而从未被列入优势类群的隐藻,在本次调查中成为了仅次于硅藻的第二优势类群,其在S1站位的生物量占比高达33.81%;作为第三优势类群的微微型浮游植物青绿藻在所有站位中都有检出。分级结果显示,钦州湾外湾海域的浮游植物总生物量主要由粒径小于20 μm的藻类提供(图 5)。这表明微型和微微型藻类在该海域长期并稳定地存在着。
将CHEMTAX分析法和镜检法检出的浮游植物群落结构进行对比,Brito等[5]和Havskum等[22]发现两种方法的结果相关性较好,Pan等[6]和Rodriguez等[23]则发现两种方法的结果存在一定的差异。在本研究中,硅藻和甲藻的细胞丰度与CHEMTAX计算结果都表现出正相关性,但是相关性达到显著水平的只有甲藻(图 7)。造成细胞丰度与CHEMTAX计算结果之间存在差异的原因是多方面的:(1)本研究中不同区域的浮游植物粒级结构差异较大,如果没有经过特定公式换算,浮游植物的丰度并不一定能很好地表征浮游植物的生物量;(2)镜检法不能检出小粒径或易破碎的细胞;(3)CHEMTAX分析法不能检出没有色素的异养甲藻和已死亡的细胞。可见两种方法各有优劣。CHEMTAX分析法能将浮游植物分类到纲或门,因此在纲或门的级别上,CHEMTAX分析法能更全面地表征浮游植物群落结构特征。如果需要获取浮游植物的种属信息,则需通过镜检法来实现。
浮游植物的分布和演替是对周围环境适应的结果,温度、盐度以及氮、磷、硅等营养物质的浓度和存在的形态等被认为是影响浮游植物的生长和分布的主要影响因素[24, 25]。根据研究区域的水质参数分布特征可知钦州湾外湾海域在枯水期也受到陆域径流(金鼓江)的影响(图 2),从近岸到远岸显示出温度和盐度逐渐增高而营养盐浓度逐渐降低的典型河口特征。但非常值得注意的是,位于防城港核电站排水口附近的S8站位与其他站位的温差较大(图 2)。通常在温排水的影响下,局部水温可上升4-7 ℃,而热污染和温排水中余氯的长期累积效应会对海洋初级生产力产生巨大影响[26]。这种负面影响在本次调查中体现得较为明显,S8站位的浮游植物总生物量相较附近站位来说偏低(图 3),硅藻在群落结构中处于绝对优势地位,其他小粒径非硅藻类群的生物量较低,而且在分粒级结构上小型藻类(主要为硅藻)占优势(图 5、图 6),说明温排水可能会导致浮游植物生物量降低,尤其是对微型及微微型的非硅藻类群影响较大。因此,温排水是导致温度与隐藻、青绿藻和蓝藻呈较强负相关关系的重要因素(图 8)。本研究中盐度与硅藻、甲藻和定鞭藻等呈显著正相关(图 8),浮游植物总生物量(Chl a)也沿着盐度增加的梯度从近岸向湾口递增(图 3)。湾颈和河口附近的浮游植物需要承受高能量波浪、强潮流和激烈的盐度变动[27],一些耐低盐的藻类(如隐藻)能够生长但难以大量繁殖,而远岸海域相对稳定的水团环境有利于藻类生长繁殖[12]。盐度和潮流的变化可能是近岸浮游植物生物量低于湾口的原因之一。
虽然受陆域径流的影响,但是处于枯水期的钦州湾营养盐浓度并不是很高,而且调查海区内所有站点都处于结构性氮限制状态(表 2)。同时,RDA分析也显示营养盐与浮游植物总生物量呈较强的负相关,说明此时的钦州湾外湾营养盐的消耗速率大于补充速率,这可能是高生物量的浮游植物对营养物质的吸收增加所导致的[5]。赖俊翔等[28]和莫钰等[29]分析了2014年钦州湾分粒级Chl a的分布特征,发现在1月和3月,粒径小于20 μm的浮游植物分别占Chl a总量的85.1%和85.6%,小型浮游植物所占的比例分别为14.9%和14.3%。上述结果与本次调查结果并不一致,在本研究中小型浮游植物和粒径小于20 μm的浮游植物对总生物量的贡献率分别为39.25%和60.75%,说明钦州湾浮游植物群落的粒级结构在不断地演替变化。研究表明,微型浮游植物和微微型浮游植物比小型浮游植物更偏好NH4-N[30],相比于2014年1月(NH4-N平均值为3.76 μmol/L)[28],NH4-N在本次调查海域中浓度非常低,平均值仅为0.16 μmol/L(表 2),说明微型浮游植物和微微型浮游植物占比的降低可能与较低的NH4-N浓度有关。
Cloern[31]发现在生长着大量滤食性贝类(Musculus senhousia, Tapes japonica, Gemma gemma)的浅水海湾,即使出现富营养化,浮游植物的生物量依旧很低,而浮游动物的摄食压力仅占很少一部分,表明贝类滤食的下行控制作用远强于富营养的上行效应。在本研究中也发现类似现象,钦州湾的贝类养殖日益扩大,从内湾(茅尾海)至外湾北部近岸海域分布着大面积的牡蛎吊养养殖区。在贝类的摄食压力下,即使是在营养相对较高的近岸海域,浮游植物(尤其是硅藻)也难以大量繁殖,这可能是除了盐度和潮流因素外,近岸浮游植物生物量低于湾口的第3个因素,也是最主要的因素。除了影响浮游植物生物量外,贝类的滤食对浮游植物群落结构和粒级组成的影响也非常大。在营养盐丰富的海域,粒径较大的浮游植物更具有竞争优势[32],本研究的结果却显示小粒径浮游植物在高营养盐含量的近岸海域占有优势,而大粒径浮游植物的生物量由近岸向低营养的远岸海域逐渐增大(图 5、6)。再者,硅藻通常在营养丰富和人为营养盐加富的水体中形成优势类群[33],青绿藻等微微型浮游植物因其相对表面积较大,对营养盐的利用率较高,易在贫营养的海域中占据竞争优势[34],但在本研究中硅藻和青绿藻的高值区分别出现在湾口低营养区和近岸高营养区。这些现象的产生显然与钦州湾牡蛎养殖对浮游植物的选择性摄食压力有关。一般来说,双壳贝类主要滤食粒径较大的浮游植物(>3 μm)[35],小粒径浮游植物特别是微微型浮游植物难以被贝类的摄食器官捕获,因此高密度的贝类养殖会造成微微型浮游植物的大量繁殖[36]。牡蛎对外湾近岸海域内粒径较大的硅藻和甲藻的选择性摄食,可能是导致小粒径的隐藻和青绿藻在这些高营养盐区域成为次于硅藻的第二、第三优势类群的主要原因。近岸海域微微型浮游植物的大量增殖可能会影响海洋生态系统的平衡,长期监测钦州湾浮游植物多样性及粒径发展趋势非常重要。
4 结论(1) 硅藻是冬季钦州湾外湾海域浮游植物群落中的优势类群,隐藻成为仅次于硅藻的第二优势类群,微微型浮游植物青绿藻为第三优势类群,它们分别平均占据了浮游植物总生物量的62.29%、20.25%和9.77%。在粒级结构上,小型浮游植物(主要为硅藻)对总生物量的贡献率为39.25%,粒径小于20 μm的浮游植物的贡献率为60.75%。硅藻的细胞粒径范围较广,而隐藻、甲藻和蓝藻的细胞粒径大多在20 μm以下。结合先前的报道可发现,微型和微微型藻类在该海域长期并稳定地存在着。
(2) 浮游植物总生物量和硅藻的分布特征均是从近岸到远岸海域(从北向南)呈逐渐升高的趋势,隐藻和青绿藻的分布特征则相反;在盐度低、无机营养盐含量相对较高的近岸海域微型和微微型浮游植物占优势,而在高盐度、低营养的远岸海域小型浮游植物的生物量较高。
(3) 冬季浮游植物群落结构的组成和分布特征主要由盐度、潮流、无机营养盐浓度以及贝类养殖所决定,其中贝类摄食的下行控制效应对浮游植物群落的影响最大。另外,位于核电站排水口的S8站位的浮游植物类群则主要受温排水的影响。建议对该海域进行长期监测,以进一步探究钦州湾浮游植物群落的变化趋势以及相关的影响因素。
| [1] |
REYNOLDS C S. Phytoplankton periodicity: the interactions of form, function and environmental variability[J]. Freshwater Biology, 1984, 14(2): 111-142. DOI:10.1111/j.1365-2427.1984.tb00027.x |
| [2] |
RACAULT M-F, LE QUÉRÉ C, BUITENHUIS E, et al. Phytoplankton phenology in the global ocean[J]. Ecological Indicators, 2012, 14(1): 152-163. DOI:10.1016/j.ecolind.2011.07.010 |
| [3] |
LE QUÉRÉ C, HARRISON S P, PRENTICE I C, et al. Ecosystem dynamics based on plankton functional types for global ocean biogeochemistry models[J]. Global Change Biology, 2005, 11(11): 2016-2040. |
| [4] |
MACKEY M D, MACKEY D J, HIGGINS H W, et al. CHEMTAX-a program for estimating class abundances from chemical markers: application to HPLC measurements of phytoplankton[J]. Marine Ecology Progress Series, 1996, 144(1/3): 265-283. |
| [5] |
BRITO A C, S- C, MENDES C R, et al. Structure of late summer phytoplankton community in the Firth of Lorn (Scotland) using microscopy and HPLC-CHEMTAX[J]. Estuarine, Coastal and Shelf Science, 2015, 167(Part A): 86-101. |
| [6] |
PAN H, LI A, CUI Z, et al. A comparative study of phytoplankton community structure and biomass determined by HPLC-CHEMTAX and microscopic methods during summer and autumn in the central Bohai Sea, China[J]. Marine Pollution Bulletin, 2020, 155: 111172. DOI:10.1016/j.marpolbul.2020.111172 |
| [7] |
姜发军, 陈波, 何碧娟, 等. 广西钦州湾浮游植物群落结构特征[J]. 广西科学, 2012, 19(3): 268-275. |
| [8] |
王迪, 陈丕茂, 逯晶晶, 等. 钦州湾浮游植物周年生态特征[J]. 应用生态学报, 2013, 24(6): 1686-1692. |
| [9] |
蓝文陆, 李天深, 郑新庆, 等. 枯水期钦州湾浮游植物群落结构组成与分布特征[J]. 海洋学报, 2014, 36(8): 122-129. |
| [10] |
陈成英. 钦州湾浮游植物的初步调查[J]. 南海研究与开发, 1989(4): 32-37. |
| [11] |
蓝文陆, 黎明民, 李天深. 基于光合色素的钦州湾平水期浮游植物群落结构研究[J]. 生态学报, 2013, 33(20): 6595-6603. |
| [12] |
蓝文陆, 王晓辉, 黎明民. 应用光合色素研究广西钦州湾丰水期浮游植物群落结构[J]. 生态学报, 2011, 31(13): 3601-3608. |
| [13] |
WANG H L, HUANG B Q, HONG H S. Size-fractionated productivity and nutrient dynamics of phytoplankton in subtropical coastal environments[J]. Hydrobiologia, 1997, 352: 97-106. DOI:10.1023/A:1003017726533 |
| [14] |
覃仙玲, 赖俊翔, 陈波, 等. 棕囊藻北部湾株的18S rDNA分子鉴定[J]. 热带亚热带植物学报, 2016, 24(2): 176-181. |
| [15] |
赵越, 于仁成, 张清春, 等. 北部湾海域微型、微微型浮游植物类群季节变化及其与棕囊藻赤潮的关系初探[J]. 海洋与湖沼, 2019, 50(3): 590-600. |
| [16] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋调查规范: 第4部分海水化学要素调查: GB/T 12763.4-2007[S]. 北京: 中国标准出版社, 2007.
|
| [17] |
UTERMÖHL H. Zur Vervollkommnung der quantitativen phytoplankton-methodik[J]. Internationale Vereinigung Für Theoretische und Angewandte Limnologie: Mitteilungen, 1958, 9(1): 1-38. |
| [18] |
ZAPATA M, RODR-GUEZ F, GARRIDO J L. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases[J]. Marine Ecology Progress Series, 2000, 195: 29-45. DOI:10.3354/meps195029 |
| [19] |
WANG L, HUANG B Q, LIU X, et al. The modification and optimizing of the CHEMTAX running in the South China Sea[J]. Acta Oceanologica Sinica, 2015, 34(2): 124-131. DOI:10.1007/s13131-015-0621-z |
| [20] |
JUSTIĆ D, RABALAIS N N, TURNER R E, et al. Changes in nutrient structure of river-dominated coastal waters: stoichiometric nutrient balance and its consequences[J]. Estuarine, Coastal and Shelf Science, 1995, 40(3): 339-356. DOI:10.1016/S0272-7714(05)80014-9 |
| [21] |
刘璐, 李艳, 孙萍, 等. 钦州湾外湾海域浮游植物群落结构季节变化及其影响因素分析[J]. 海洋环境科学, 2020, 39(5): 776-784. |
| [22] |
HAVSKUM H, SCHLVTER L, SCHAREK R, et al. Routine quantifi cation of phytoplankton groups-microscopy or pigment analyses?[J]. Marine Ecology Progress Series, 2004, 273: 31-42. DOI:10.3354/meps273031 |
| [23] |
RODRIGUEZ F, VARELA M, ZAPATA M. Phyto-plankton assemblages in the Gerlache and Bransfield Straits (Antarctic Peninsula) determined by light microscopy and CHEMTAX analysis of HPLC pigment data[J]. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 2002, 49(4/5): 723-747. |
| [24] |
ÁLVAREZ-GÓNGORA C, HERRERA-SILVEIRA J A. Variations of phytoplankton community structure related to water quality trends in a tropical karstic coastal zone[J]. Marine Pollution Bulletin, 2006, 52(1): 48-60. DOI:10.1016/j.marpolbul.2005.08.006 |
| [25] |
HUNT C D, BORKMAN D G, LIBBY P S, et al. Phytoplankton patterns in Massachusetts Bay-1992-2007[J]. Estuaries and Coasts, 2010, 33(2): 448-470. DOI:10.1007/s12237-008-9125-9 |
| [26] |
唐森铭, 严岩, 陈彬. 春夏季大亚湾核电厂温排水对海洋浮游植物群落结构的影响[J]. 应用海洋学学报, 2013, 32(3): 373-382. |
| [27] |
何青, 孙军, 栾青杉, 等. 冬季长江口及其邻近水域的浮游植物[J]. 海洋环境科学, 2009, 28(4): 360-365. |
| [28] |
赖俊翔, 覃仙玲, 姜发军, 等. 钦州湾表层水分粒级Chl a分布特征及其影响因素[J]. 海洋环境科学, 2016, 35(5): 685-691. |
| [29] |
莫钰, 龙寒, 蓝文陆, 等. 钦州湾枯水期和丰水期分粒级Chl a的分布及影响因素[J]. 海洋环境科学, 2017, 36(3): 434-440. |
| [30] |
焦念志. 海洋浮游生物氮吸收动力学及其粒级特征[J]. 海洋与湖沼, 1995, 26(2): 191-198. |
| [31] |
CLOERN J E. Does the benthos control phytoplankton biomass in South San Francisco Bay?[J]. Marine Ecology Progress Series, 1982, 9(2): 191-202. |
| [32] |
IRWIN A J, FINKEL Z V, SCHOFIELD O M E, et al. Scaling-up from nutrient physiology to the size-structure of phytoplankton communities[J]. Journal of Plankton Research, 2006, 28(5): 459-471. DOI:10.1093/plankt/fbi148 |
| [33] |
HERN-NDEZ-BECERRIL D U, AQUINO-CRUZ A, SALAS-DE-LE-N D A, et al. Studies on picophytoplankton in the southern Gulf of Mexico: pigment analysis and potential importance of the picoeukaryote Prasinophyte Micromonas pusilla[J]. Marine Biology Research, 2012, 8(4): 331-340. DOI:10.1080/17451000.2011.638639 |
| [34] |
SABETTA L, BASSET A, SPEZIE G. Marine phytoplankton size-frequency distributions: spatial patterns and decoding mechanisms[J]. Estuarine, Coastal and Shelf Science, 2008, 80(1): 181-192. DOI:10.1016/j.ecss.2008.07.021 |
| [35] |
WARD J E, SHUMWAY S E. Separating the grain from the chaff: particle selection in suspension- and deposit-feeding bivalves[J]. Journal of Experimental Marine Biology and Ecology, 2004, 300(1/2): 83-130. |
| [36] |
JIANG T, WANG L, ZHANG F, et al. Selective feeding of bay scallop Argopecten irradians on phytoplankton community revealed by HPLC analysis of phytopigments in Bohai Sea, China[J]. Journal of Oceanology and Limnology, 2019, 37(5): 1746-1755. DOI:10.1007/s00343-019-8280-0 |



