2. 广西森林生态与保育重点实验室,广西南宁 530004
2. Guangxi Key Laboratory of Forest Ecology and Conservation, Nanning, Guangxi, 530004, China
降香黄檀(Dalbergia odorifera)为豆科(Fabaceae)蝶形花亚科(Papilionoideae)黄檀属(Dalbergia)常绿半落叶乔木,原产于我国海南省,广东、广西和福建南部等地从20世纪60年代后期陆续引种栽培[1]。降香黄檀的木材结构致密,花纹美观,是制作高档家具的上等用材;其树干和根部的干燥心材可药用,有降血压、止痛止血等功效[2, 3]。由于降香黄檀经济价值和药用价值凸显,其野生资源遭到毁灭性破坏,已被列为国家二级保护植物,为濒危树种[4]。因此,保护现有的降香黄檀野生资源,大力发展降香黄檀人工栽培具有重要的生态意义和经济意义。市场对降香黄檀的需求量非常大[5, 6]。近年来,随着珍贵树种在南方地区的大力推广,降香黄檀种植面积逐年增加,而人工造林大部分采用种子播种育苗,基本上都未进行良种筛选,种植现状存在种苗质量参差不齐、苗木生长分化严重等问题,急需选择优良种子以提高降香黄檀的栽培效益[7]。同时,降香黄檀根系发达,有根瘤,具有极强的抗逆境能力,能很好地适应喀斯特石漠化地区生境,选择成熟且优良的降香黄檀种子种植至广西等地的喀斯特石漠化地区,一方面可以改善当地环境,另一方面也可以带动当地的经济发展[8]。然而,降香黄檀的种子不易保存,自然繁殖能力弱,生长缓慢,过早采摘会造成种子成熟度不够、活力低、质量差,过晚采摘则使种子严重掉落或发霉[9-11]。目前,虽已有部分学者在扦插、组织培养等繁育技术方面进行了研究,但关于降香黄檀种子的研究仅限于形态测量[12]、萌发特性[13, 14]及贮藏方法[15],对其适宜采收期的研究甚少。因此,本研究通过动态观测不同发育时期降香黄檀荚果和种子的形态大小、种子发芽率及生理指标的变化,分析降香黄檀荚果和种子生长发育规律,从而确定降香黄檀种子的最适宜采收期,为降香黄檀在广西的科学采种提供理论依据。
1 材料与方法 1.1 试验地自然概况本研究于广西南宁市广西大学林学院教学实践基地(22°48′ N,108°22′ E)进行。该地年均气温21.6 ℃左右,夏季高温时期为7月、8月,全年雨量充沛,年均降水量达1 304.2 mm,降水日数为116-181 d,平均相对湿度约为79%,年日照时数为1 169-2 219 h[16]。
1.2 材料试验材料采自广西大学林学院教学实践基地2012年种植的降香黄檀,采集时间为2019年5-12月。选择具有代表性的5株降香黄檀,按树冠东、南、西、北4个方向,每个方向上、中、下部位混合采集荚果。每隔5 d采集一次,每次采集大约50个荚果并贴好时间标签,待其表面自然干燥后放入保鲜袋封口。一部分于冰箱4 ℃保存,用于种子形态、生理指标、含水量的测定,以及发芽试验(9-12月即盛花期后80-200 d采收的种子);另一部分在烘箱中105 ℃下杀青10 min后,于80 ℃烘干至恒重,并存于干燥器中备用。由于降香黄檀荚果含种子1-2粒,而本研究对含有单粒、两粒种子的降香黄檀荚果均有取材,故将降香黄檀荚果按其形态与颜色变化特征分为Ⅰ、Ⅱ类荚果。
1.3 方法 1.3.1 荚果和种子的形态与生理指标测定荚果和种子形态测定:从每次采集的荚果中随机取出30个,先用游标卡尺测量种子至果柄长度(柄种距)、荚果宽度、荚果长度、种廓长、种廓宽和种廓厚度后,将其种子取出,测量种子纵径、横径、厚度并记录,计算平均值。根据各时期测得荚果和种子形态指标计算出荚果和种子的体积及球度[17]。
种子生理指标测定:从每次采集的样品中随机抽取新鲜降香黄檀荚果6个,将其种子取出,清洗干净表面污物,再用蒸馏水冲洗3次以上,然后用滤纸吸干种子表面的水分,每组分别剪碎混匀,称取3份,每份0.2 g,即重复3次。分别按蒽酮比色法、考马斯亮蓝G-250法[18]测定种子可溶性糖和可溶性蛋白含量。
1.3.2 种子含水量和千粒重测定种子含水量采用105 ℃恒重法[19]。从每次所取样品中随机称取5 g左右的种子,然后称其鲜重m1,重复3次,将其放入预先烘干的称量瓶中,烘至恒重,取出在干燥器中冷却,称其质量,重复此过程直至恒重m2,最后计算种子含水量。种子含水量(%)=(m1-m2)/m1×100%。
种子千粒重根据《林木种子检验规程》(GB 2772-1999)[20]中的种子品质指标测定要求测定,随机取自然风干种子100粒进行称量,重复8次,计算其平均值。
1.3.3 种子发芽试验发芽试验参照米永伟[21]的方法,于2020年1-2月采用培养皿滤纸床进行。从每次采集的种子中随机抽取饱满、无机械损伤的降香黄檀种子共300粒,随机分为3组,每组取100粒,即3次重复,分别对应编号,用灭菌蒸馏水浸润在直径为15 cm、深2.5 cm的培养皿中,置于25 ℃光照培养箱中,每天光照16 h、黑暗8 h。期间,给培养皿覆膜,并在培养皿中适当加入灭菌蒸馏水,以保持种子发芽期间的水分。以2 mm长的胚根的出现作为发芽的标准,连续监测发芽,直到没有新的发芽种子出现并每天定时记录种子开始发芽天数、发芽结束天数和每日发芽种子数直至实验结束,计算其发芽率、发芽势、发芽指数及平均发芽时间。
1.4 数据处理采用SPSS 20.0进行单因素检验方差分析,使用Origin Pro 8.5作图。
2 结果与分析 2.1 降香黄檀荚果和种子的形态与颜色变化规律依据降香黄檀Ⅰ、Ⅱ类荚果和种子的外观形态变化,将其生长发育过程分为4个阶段(表 1、图 1),荚果和种子的颜色从盛花期后160 d开始由黄褐色逐渐转变成深褐色,且种皮皱缩失水。
| 发育阶段 Developmental stage |
盛花期后天数/(d) Days after full blooming stage/(d) |
生长发育过程 Growth and development process |
| 1 | 5-50 | Pod is thin, the color of seeds and pods is light green, the seed outline appears and the seeds begin to grow |
| 2 | 50-135 | Pod is thickened, dark green in color, the seed outline is clear and obviously thickened, and the seed color transits from bright green to light yellow |
| 3 | 135-160 | Pod and seed are yellowish in color, and seed profile is dark green.The class Ⅱ pod is obviously elongated, the seed profile is adhered and elongated, and the two seeds begin to separate |
| 4 | 160-200 | Pods and seeds are mature, dark brown in color, the fold of seed profile is deepened, the seed coat is wrinkled and dehydrated, and the seed profile of class Ⅱ pods is completely separated |

|
| 图 1 不同采收期降香黄檀荚果和种子的外观形态变化 Fig. 1 Changes in appearance and morphology of D.odorifera pods and seeds in different harvesting periods |
2.2 降香黄檀荚果和种子的生长发育规律 2.2.1 荚果的生长发育规律
降香黄檀荚果的宽度在盛花期后20 d内生长快速,20 d之后开始缓慢生长,185 d后趋于稳定。Ⅰ、Ⅱ类荚果长度和体积在盛花期后155 d内生长趋势一致,从快速增加变为缓慢增加;而在155 d后,Ⅰ、Ⅱ类荚果长度和体积的生长速度不同,Ⅰ类荚果长度和体积仍然维持缓慢增加,Ⅱ类荚果长度和体积再次开始快速增加,体积最终在190 d后达到4.29 cm3并保持稳定。Ⅰ、Ⅱ类荚果在整个生长时期球度指数均小于0.28。Ⅰ、Ⅱ类荚果柄种距的生长总体呈下降趋势。在盛花期后175 d后,柄种距平缓变短,达到1.9 cm后趋于稳定(图 2)。
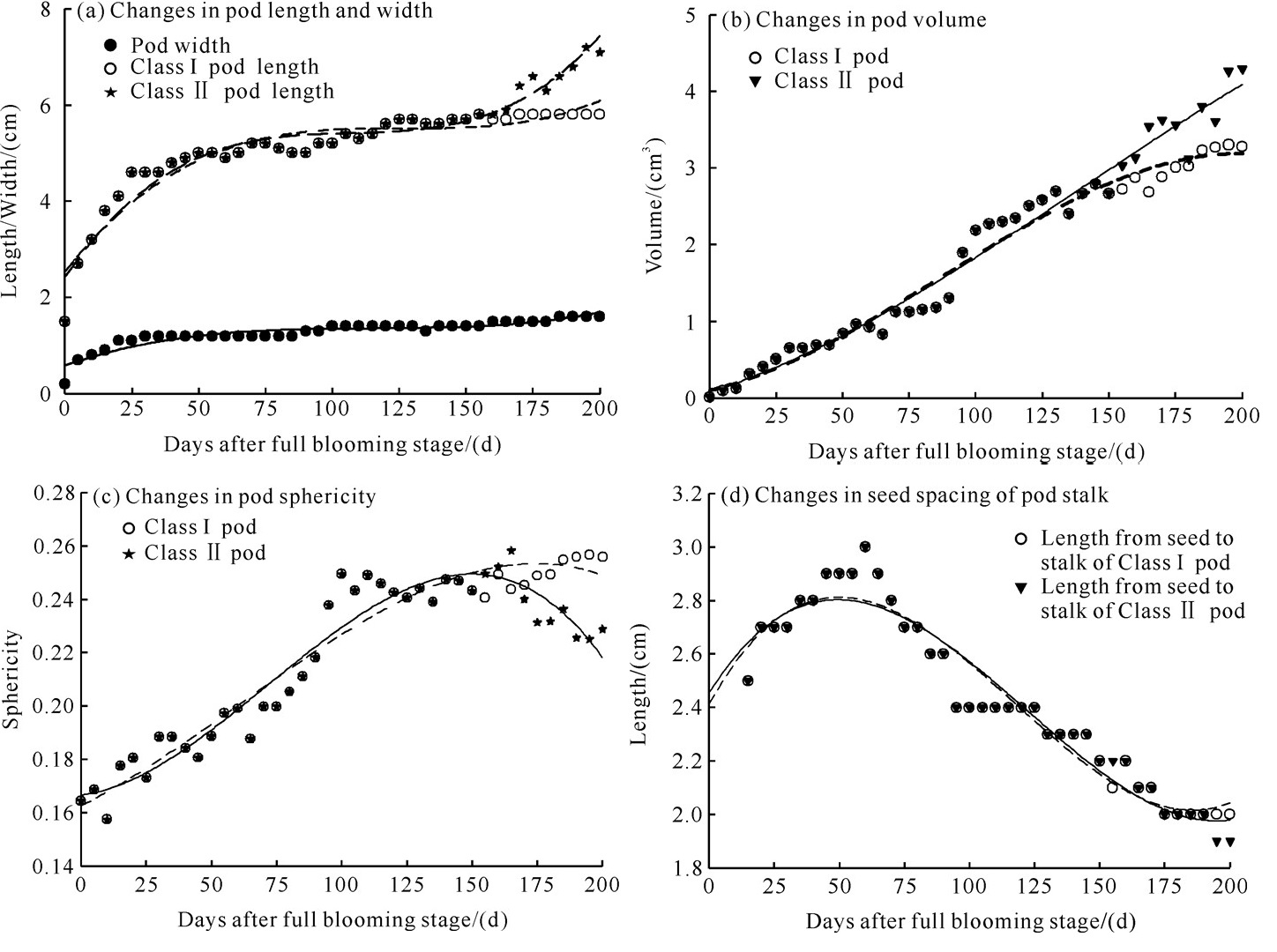
|
| 图 2 不同采收期降香黄檀荚果大小变化 Fig. 2 Variation of D.odorifera pod size in different harvesting periods |
2.2.2 荚果种廓的生长发育规律
Ⅰ、Ⅱ类荚果种廓宽生长曲线相同。盛花期后15 d后,种廓宽一直保持增长趋势,在185 d后达到1.2 cm,保持稳定不变。盛花期后15-155 d,种廓长开始快速增加,最终达到2.3 cm。盛花期后155 d开始,Ⅰ类荚果种廓长与Ⅱ类荚果变化趋势不同。Ⅰ类荚果种廓长缓慢增长,盛花期后185 d逐渐趋于稳定;Ⅱ类荚果种廓长一直保持增加趋势,盛花期后155 d后,Ⅱ类荚果种廓厚度出现较大波动,最大达到0.4 cm (图 3)。
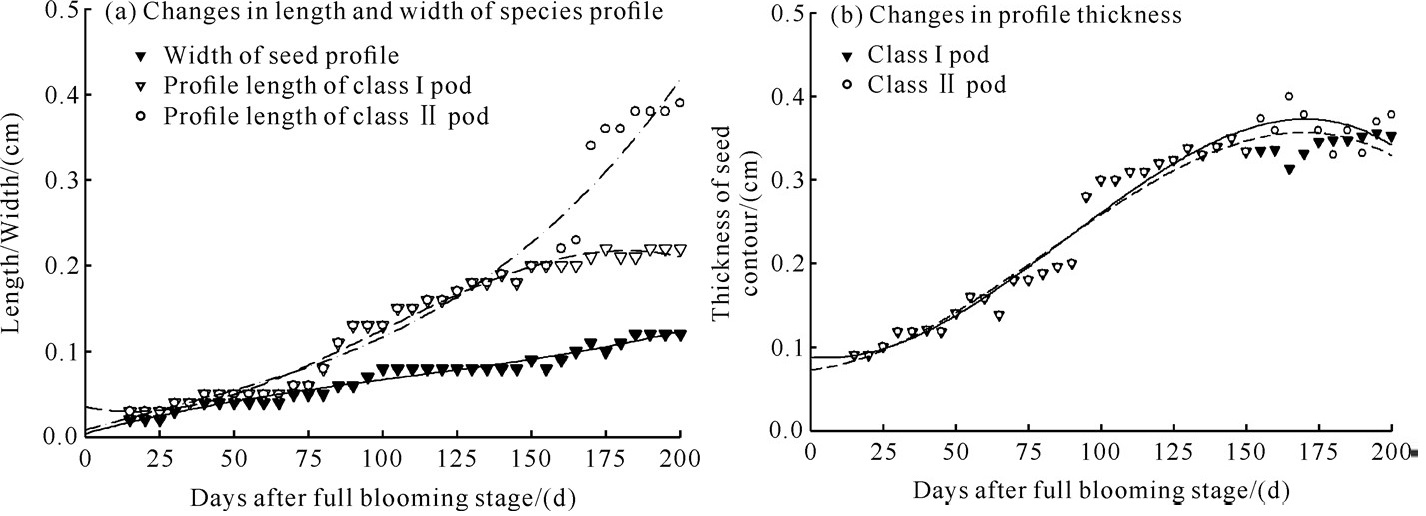
|
| 图 3 不同采收期降香黄檀荚果种廓大小变化 Fig. 3 Variation of D.odorifera pod profile size in different harvesting periods |
2.2.3 种子的生长发育规律
整个采收期中,种子厚度一直维持稳定的增长。在盛花期后185 d达最大值并在之后趋于稳定。种子纵、横径生长变化的趋势从先降低后增加到逐渐稳定,且在盛花期后145 d达最大值并在之后趋于平稳。种子球度在盛花期后75 d开始减小,至盛花期后150 d达到最低点0.352,然后又开始缓慢增大,在盛花期后185 d达到0.39并在之后趋于平衡。种子体积在种子整个生长发育过程中一直保持增长趋势,在盛花期后185 d开始趋于平衡(图 4)。
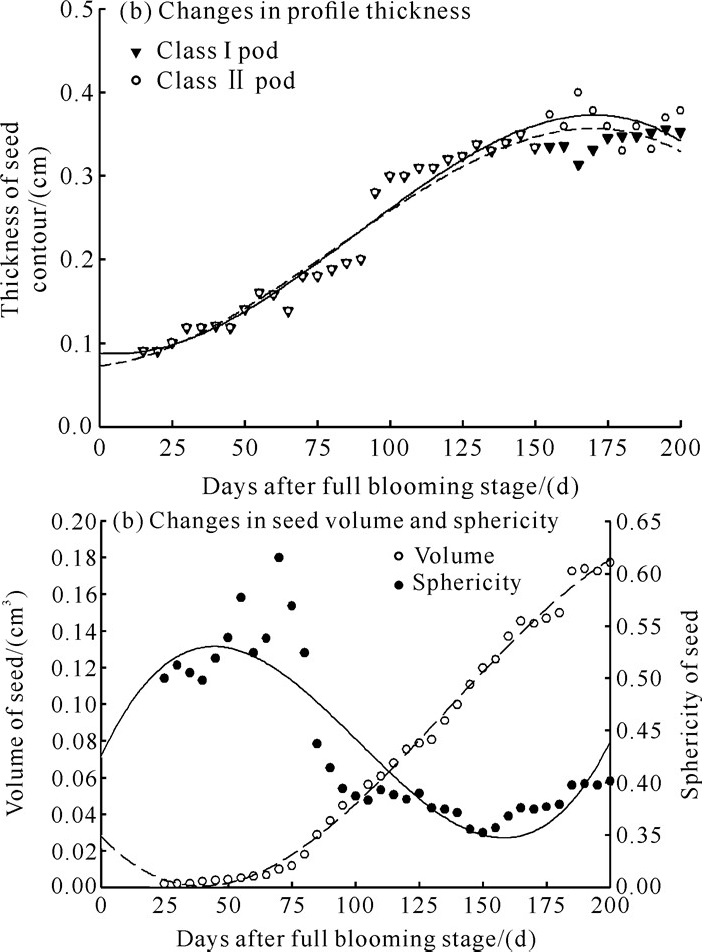
|
| 图 4 不同采收期降香黄檀种子大小的变化 Fig. 4 Variation of D.odorifera seed size in different harvest periods |
2.3 降香黄檀种子生理指标的变化规律
盛花期后20-155 d,种子干重由缓慢增长变为快速增长,到盛花期后185 d左右趋于稳定。种子鲜重在盛花期后20-140 d呈稳定增长趋势。盛花期后145 d种子鲜重开始缓慢降低,至盛花期后175 d开始趋于稳定,种子含水量在盛花期后65 d开始急剧下降,盛花期后185 d种子含水量开始稳定下降,最终降至35%左右并趋于稳定(图 5)。
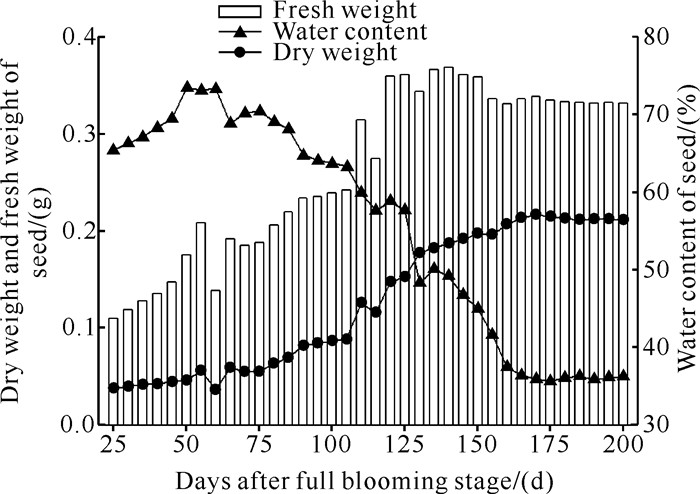
|
| 图 5 种子干重、鲜重和含水量的变化 Fig. 5 Change of seed dry weight, fresh weight and water content |
种子可溶性糖含量一直保持增加趋势,在盛花期后165 d含量最高,为45 g·kg-1左右,之后开始缓慢降低,直至盛花期后195 d降至42 g·kg-1左右(图 6)。
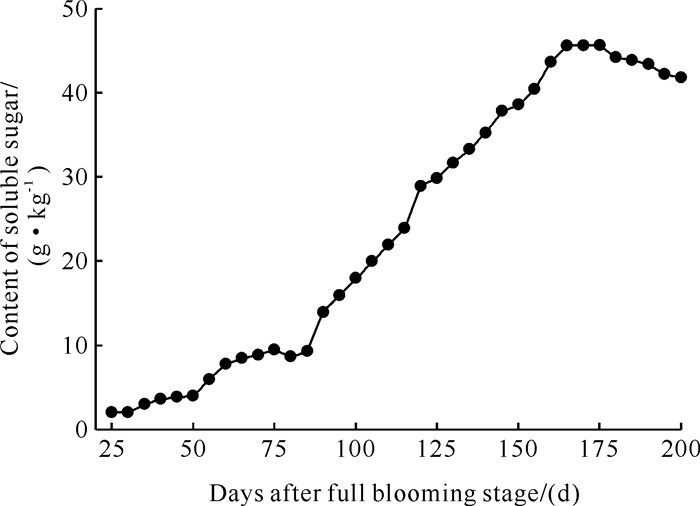
|
| 图 6 种子可溶性糖的变化 Fig. 6 Change of seed soluble sugar |
盛花期后80-180 d,种子可溶性蛋白含量的变化趋势为上升-下降-上升,表现为波动性升高。在盛花期后135 d达到第1个峰值26.47 mg·g-1(鲜重),盛花期后180 d达到第2个峰值37.77 mg·g-1(鲜重)。之后种子可溶性蛋白含量再呈现缓慢下降的趋势,于190 d后趋于稳定(图 7)。
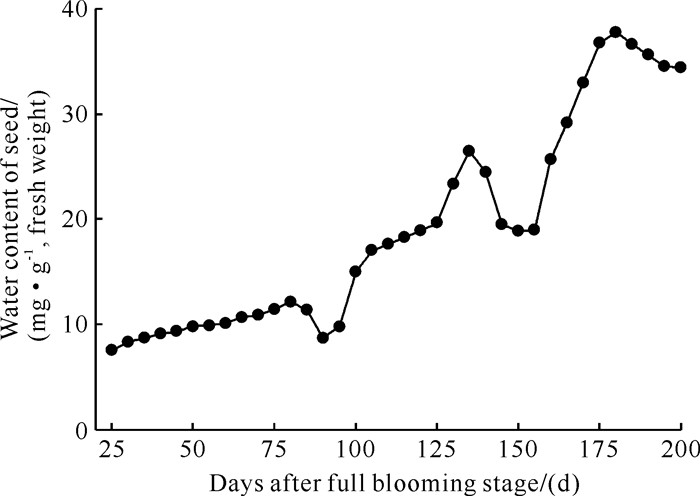
|
| 图 7 种子可溶性蛋白的变化 Fig. 7 Change of seed soluble protein |
2.4 降香黄檀种子的萌发特性
发芽试验以盛花期后80 d(即9月份开始)采收的种子为材料。不同采收期种子的萌发特性如表 2所示。种子千粒重在盛花期后140-170 d达最大值。通过逐日统计观察,盛花期后110 d后采收的种子开始发芽时间没有差异,均在播种置床后第3天开始发芽。在盛花期后140-170 d种子发芽势、发芽率最高,在盛花期后170 d后发芽势、发芽率开始降低。但与盛花期后140-170 d相比,盛花期后170-200 d的种子发芽势和发芽率均没有显著差异。
| 盛花期后天数/(d) Days after full blooming stage/(d) |
指标Index | |||||
| 千粒重/(g) 1 000 grain weight/(g) |
发芽率/(%) Germination rate/(%) |
发芽势/(%) Germination potentia/(%) |
发芽指数 Germination index |
平均发芽时间/(d) Mean germinating time/(d) |
||
| 80-110 | 53.2±2.8c | 48.4±1.8b | 40.3±1.3c | 2.0±0.3b | 3.6±0.3b | |
| 110-140 | 82.1±1.6b | 74.7±1.2a | 49.3±1.2b | 5.93±0.8a | 7.1±0.4a | |
| 140-170 | 88.4±2.5a | 80.7±6.1a | 62.7±5.7a | 5.8±0.7a | 6.8±0.7a | |
| 170-200 | 79.6±3.4b | 78.0±2.0a | 59.3±5.0a | 5.9±0.2a | 7.9±0.4a | |
| Note: different lowercase letters in the same column indicate significant differences (P < 0.05). | ||||||
3 讨论 3.1 降香黄檀荚果和种子发育过程中形态变化分析
确定种子适宜采收期的判定方法有多种[22-24]。本研究主要依据荚果和种子的形态学指标、生理指标和标准发芽试验来确定降香黄檀种子的适宜采收期。荚果或种子的形态学指标被认为是判定种子适宜收获时间的准确、简捷、快速的指标[17]。许多研究表明,大多数植物的种子颜色会随着成熟度的变化而发生规律性改变[25, 26]。种子内部干物质随着发育进程逐渐积累,种皮颜色也随着种子的成熟而逐渐变化。尚帅斌等[27]研究发现,青皮果皮颜色由青色向褐色过渡、少量被毛时即可采种。Wang等[28]发现,广布野豌豆(Vicia cracca)在荚果与种子分别变为浅棕色和黑色时即可收获。本研究中,随着发育时间的延长,降香黄檀荚果和种子均逐渐褪绿、变硬,依次变黄褐色、深褐色,且果荚成熟后不开裂。说明降香黄檀种子在生长发育过程中不断累积物质,种皮颜色会随种子成熟度发生动态变化。种子的发育一般有体积膨大、干物质充实和种子成熟3个阶段[29]。通过对降香黄檀荚果和种子发育过程形态的观测,整个采收期中荚果和种子的形态大小一直保持不断增长,其中荚果宽度、种廓宽、种廓长以及种子的体积、球度大小均在盛花期后185 d后稳定不变。因此,降香黄檀形态稳定期为盛花期后185-200 d。从荚果球度来看,本研究发现,在降香黄檀荚果生长过程中,其果实的球度在0.15-0.28,其中Ⅱ类荚果降香黄檀果长由于出现两次较快增长趋势,球度指数在后期有所回落,相较于Ⅰ类荚果球度小,在果实发育期间,降香黄檀荚果始终呈现扁长状。从种子形状来看,盛花期后135 d已基本具备成熟种子所呈现的肾形,此后一直保持不变,说明种子形态在整个种子发育过程中非常稳定。
3.2 降香黄檀种子发育过程中生理指标和萌发特性变化分析根据种子的生理指标来确定适宜的收获时间。种子的含水量是反映种子营养物质积累和转化、判断种子成熟的重要指标[30]。Fraser等[31]研究认为种子含水量可作为大豆(Glycine max)生理收获期的准确指标。也有研究表明所有的种子在生理成熟时含水量是非常相似的,且不受环境因子的影响[32]。在本研究中,降香黄檀种子含水量呈先上升后下降的趋势。种子含水量在盛花期后185 d后,降至最低并逐渐趋于稳定。这与Hebblethwaite等[10]的研究结果相一致。降香黄檀种子可溶性糖含量在整个发育过程中一直保持相对较高水平,在盛花期后80-165 d快速增长并达到最大值,之后开始缓慢下降。种子可溶性蛋白含量分别于盛花期后135 d和180 d达到高峰,然后呈缓慢下降趋势,说明盛花期后180 d后降香黄檀种子积累和转化营养物质的速度开始缓慢降低,降香黄檀种子可溶性糖的积累速度及积累量远远大于可溶性蛋白。这一研究结果与齐永平[33]的研究结果相似,但与马春晖等[34]的不同。
种子发芽率、发芽势和发芽指数是衡量种子质量的重要指标,在不同的采收期采收种子会影响种子的发芽能力。李帅[35]通过综合测量黄芩(Scutellaria baicalensis)盛花期后18-33 d种子的发芽率、千粒重、种子活力,最终确定盛花期后24-30 d为黄芩种子最适宜采收期。刘日林等[36]研究发现夏枯草(Prunella vulgaris)果穗全黄时立即采收,此时种子千粒重、发芽率均达到最大值。本研究发现不同发育时期对降香黄檀种子萌发能力影响较大。其中种子千粒重、发芽势、发芽率在盛花期后140-170 d均达最大值,且发芽势、发芽率与盛花期后170-200 d相比均无显著差异。说明盛花期后140-200 d有活力的种子较多,种子充实且饱满。
4 结论综上所述,通过较全面地研究降香黄檀Ⅰ、Ⅱ类荚果和种子发育过程中形态、含水量、发芽率及生理指标的变化,发现盛花期后160 d后种子的颜色完全由黄褐色转变成深褐色。荚果宽度在盛花期后185 d后趋于稳定,Ⅱ类荚果体积在190 d后保持不变,Ⅰ类荚果的种廊长和Ⅰ、Ⅱ类荚果的种廓宽均在盛花期后185 d后稳定不变。种子的球度先增大再减小,然后缓慢增大,种子的体积大小则一直保持增长,最终在盛花期后185 d开始趋于平衡。种子含水量在盛花期后185 d后趋于稳定;可溶性糖含量在盛花期后165 d达到最大值,在盛花期后195 d保持稳定;可溶性蛋白含量在盛花期后180 d达到第2个最高峰值,之后呈现缓慢下降的趋势,于盛花期后190 d后趋于稳定。盛花期后140-170 d种子千粒重最大,发芽势、发芽率高。因此,确定盛花期后185-200 d为降香黄檀种子的最适宜采收期。由此可知,降香黄檀种子在广西的采摘日期最好在11月下旬(盛花期后185-200 d)。本研究结果为广西等地更好地指导降香黄檀种子生产提供了理论基础,但是因为各种环境因子都会影响降香黄檀种子的采收时间,所以在实际生产中还应根据实际环境条件采摘降香黄檀种子。
| [1] |
李萌, 谭许脉, 肖纳, 等. 引种降香黄檀和顶果木对石漠化山区土壤磷素转化及其有效性的影响[J]. 生态学报, 2022, 42(4): 1594-1605. |
| [2] |
邱治军, 周光益, 陈升华. 海南特有珍贵红木树种: 降香黄檀[J]. 林业实用技术, 2004(6): 41-42. |
| [3] |
韦金朵. 珍贵树种降香黄檀栽培技术及发展略述[J]. 农业与技术, 2019, 39(8): 75-76. |
| [4] |
麦有专, 杨玉坤, 陈彧, 等. 热带珍贵树种降香黄檀研究进展[J]. 热带林业, 2018, 46(4): 25-28. |
| [5] |
小梅. 不同基质配比和菌肥用量对降香黄檀幼苗生长及生理指标的影响[D]. 南宁: 广西大学, 2018.
|
| [6] |
吕金阳. 降香黄檀木材美学价值研究[D]. 南宁: 广西大学, 2013.
|
| [7] |
邓才双. 浅谈降香黄檀的发展前景和种植技术[J]. 科技展望, 2014(11): 19. |
| [8] |
刘震. 降香黄檀幼苗对不同石砾含量土壤的适应性研究[D]. 南宁: 广西大学, 2015.
|
| [9] |
程亮, 余玉珠, 胡礼伟, 等. 降香黄檀育苗及高效栽培技术[J]. 林业实用技术, 2012(8): 21-23. |
| [10] |
HEBBLETHWAITE P D, EL H AHMED M. Optimum time of combine harvesting for amenity grasses grown for seed[J]. Grass and Forage Science, 1978, 33(1): 35-40. DOI:10.1111/j.1365-2494.1978.tb00794.x |
| [11] |
LIU X J, XU D P, YANG Z J, et al. Geographic variations in seed germination of Dalbergia odorifera T.Chen in response to temperature[J]. Industrial Crops and Products, 2017, 102: 45-50. DOI:10.1016/j.indcrop.2017.03.027 |
| [12] |
ANDERSEN S, ANDERSEN K. Relationship between seed maturation and seed yield in grasses[J]. Proceedings-Easter School in Agricultural Science, University of Nottingham, 1978, 151-172. |
| [13] |
葛玉珍, 梁惠凌, 蒋国秀, 等. 不同产地降香黄檀种子和幼苗性状的变异研究[J]. 广西植物, 2020, 40(4): 567-575. |
| [14] |
李效文, 刘星, 潘凤跃, 等. 不同配比基质对降香黄檀种子萌发的影响[J]. 林业科技通讯, 2018(6): 65-68. |
| [15] |
刘盛波, 张伟, 杜尚嘉, 等. NaCl胁迫对降香黄檀(Dalbergia oderifera)种子萌发及幼苗生长的影响[J]. 种子, 2016, 35(6): 22-26. |
| [16] |
韦耀妮, 杨振德, 文黎, 等. 两种生长基质下降香黄檀叶片形态解剖表型可塑性比较[J]. 广西科学, 2021, 28(2): 189-195. |
| [17] |
王颖. 广布野豌豆荚果和种子发育动态及种子适宜收获时间的确定[D]. 长春: 东北师范大学, 2008.
|
| [18] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006: 144-148.
|
| [19] |
晋凡生, 张彦琴, 梁改梅, 等. 贮藏温度和含水量对党参种子活力的影响[J]. 种子, 2020, 39(7): 6-11. |
| [20] |
国家质量技术监督局, 全国林木种子标准化技术委员会. 林木种子检验规程: GB 2772-1999 [S]. 北京: 中国标准出版社, 1999.
|
| [21] |
米永伟. 麻花秦艽有性繁育系统及种子适宜采收期研究[D]. 兰州: 甘肃农业大学, 2013.
|
| [22] |
CHANDLER J, CORBESIER L, SPIELMANN P, et al. Moulating flowering time and prevention of pod shatter in oilseed rape[J]. Molecular Breeding, 2005, 15(1): 87-94. DOI:10.1007/s11032-004-2735-4 |
| [23] |
LEMKE B M, GIBSON L R, KNAPP A D, et al. Maximizing seed production in eastern Gamagrass[J]. Agronomy Journal, 2003, 95(4): 863-869. DOI:10.2134/agronj2003.8630 |
| [24] |
赵殿洲. 主要林木种子采收期和调制方法[J]. 新农业, 2018(1): 17-18. |
| [25] |
蔺吉祥, 李卓琳, 林立东, 等. 判断种子适宜收获时间的方法[J]. 草业科学, 2013, 30(5): 772-776. |
| [26] |
唐晓敏, 程轩轩, 张春荣, 等. 广金钱草种子适宜采收期研究[J]. 种子, 2018, 37(3): 98-101. |
| [27] |
尚帅斌, 郭俊杰, 汪奕衡, 等. 果实成熟度对青皮种子萌发及幼苗生长的影响[J]. 种子, 2014, 33(7): 27-29. |
| [28] |
WANG Y, MU C S, HOU Y, et al. Optimum harvest time of Vicia cracca in relation to high seed quality during pod development[J]. Crop Science, 2008, 48(2): 709-715. DOI:10.2135/cropsci2007.04.0211sc |
| [29] |
SUNG J M. Lipid peroxidation and peroxide-scavenging in soybean seeds during aging[J]. Physiologia Plantarum, 1996, 97(1): 85-89. DOI:10.1111/j.1399-3054.1996.tb00482.x |
| [30] |
李婷, 彭祚登. 不同采种期对国槐种子萌发及生理代谢的影响[J]. 东北林业大学学报, 2016, 44(3): 33-36. |
| [31] |
FRASER J, EGLI D B, LEGGETT J E. Pod and seed development in soybean cultivars with differences in seed size 1[J]. Agronomy Journal, 1982, 74(1): 81-85. DOI:10.2134/agronj1982.00021962007400010022x |
| [32] |
王华磊, 赵致, 唐平, 等. 喜树种子适宜采收期研究[J]. 中国现代中药, 2011, 13(8): 20-21, 33. |
| [33] |
齐永平. 华中五味子种子发育生理生化动态研究[D]. 西安: 陕西师范大学, 2009.
|
| [34] |
马春晖, 韩建国, 孙洁峰, 等. 结缕草种子发育过程中生理生化变化的研究[J]. 草业学报, 2009, 18(6): 174-179. |
| [35] |
李帅. 黄芩种子及药材最佳采收期研究[D]. 长春: 吉林农业大学, 2011.
|
| [36] |
刘日林, 张丽芬, 江建铭, 等. 夏枯草采收时期对果穗与种子质量的影响[J]. 浙江林业科技, 2009, 29(5): 38-40. |



