2. 广西医科大学,广西高等学校生物分子医学研究重点实验室,广西南宁 530021;
3. 广西医科大学基础医学院,生物化学与分子生物学教研室,广西南宁 530021
2. Guangxi Colleges and Universities Key Laboratory of Biological Molecular Medicine Research, Guangxi Medical University, Nanning, Guangxi, 530021, China;
3. Department of Biochemistry and Molecular Biology, School of Basic Medical Sciences, Guangxi Medical University, Nanning, Guangxi, 530021, China
肾细胞癌是世界上最常见的恶性肿瘤之一,最常见的组织学亚型是肾透明细胞癌(Kidney Renal Clear Cell Carcinoma, KIRC),约占肾细胞癌患者的80%-90%[1]。肾透明细胞癌易转移,在进行部分或根治性肾切除术后仍有约30%的患者会复发,预后差[2]。因此,迫切需要新的生物标志物来对肾透明细胞癌进行早期诊断,并对患者进行个性化治疗。
N-乙酰半乳糖胺转移酶家族(GALNTs)有20个成员,包括GALNT1-14和GALNTL1-L6[3, 4]。GALNTs作为黏液蛋白糖基化的诱导剂,其表达可以改变肿瘤细胞的增殖、迁移能力和耐药性[3, 4],对人类泌尿生殖系统癌症的发生、发展及预后有影响[5]。例如,GALNT1突变引起的糖基化异常与膀胱癌的发生有关,GALNT3在恶性程度较高的肾细胞癌和前列腺癌患者中高表达[3];GALNT4高表达的肾透明细胞癌患者的无病生存率(Disease Free Survival,DFS)明显升高,GALNT10的高表达与肾透明细胞癌的Tumor Node Metastasis (TNM)分期进展相关[6, 7]。因此,可推测GALNTs参与了泌尿生殖系统中大多数癌症的发生、发展和转移。GALNT14不仅能抑制细胞迁移、改变细胞形态,而且会导致胚胎发育过程中增殖不足或过度,从而导致生长缺陷[6]。GALNT14在人类生长发育过程中能引起破坏性的孟德尔突变,从而导致胚胎死亡[8]。另外,GALNT14还可以改变凋亡信号的组织侵袭性,调节癌细胞的迁移,从而对乳腺、肺、胃肠道和卵巢恶性肿瘤的预后产生影响[4, 9]。但迄今为止,对GALNT14的研究大多为其在呼吸系统和消化系统肿瘤中所起的作用[1, 10, 11],尚无全面的生物信息学分析GALNT14在肾透明细胞癌中的表达及其临床意义。因此,本研究利用The Cancer Genome Atlas (TCGA)数据库探讨GALNT14对肾透明细胞癌患者预后的影响,旨在发掘与肾透明细胞癌治疗相关的潜在生物标志物。
1 材料与方法 1.1 生物信息学数据收集所有与肾透明细胞癌相关的数据(包括临床信息和相应的mRNA表达数据)均从TCGA数据库(https://portal.gdc.cancer.gov/)下载。使用Perl软件和R软件对数据进行排序和提取,并将表达式数据与临床数据合并。无临床信息、mRNA表达数据的病例,以及非原发性肾透明细胞癌的病例被排除在外。最终,共611例具有详细GALNT14表达数据的肾透明细胞癌原发肿瘤组织样本和537组从TCGA下载的肾透明细胞癌患者的临床数据(包括患者的年龄、性别、组织学分级、临床分期、TNM分期及其生存状况)用于后续分析。
1.2 GALNT14的表达使用带“limma”软件包的R软件去除重复基因,即取重复基因的平均值,提取单基因表达量。将R软件的“beeswarm”软件包与Perl软件相结合,进行差异表达分析及配对差异表达分析,比较TCGA数据库中GALNT14在癌旁样本和肾透明细胞癌样本中的表达水平。基于TCGA和Genotype-Tissue Expression (GTEx)数据库中9 736个肿瘤样本和8 587个正常组织样本,在Gene Expression Profiling Interactive Analysis (GEPIA)数据库——由北京大学研制开发的在线应用数据库(http://gepia.cancer-pku.cn/)中分析GALNT14在癌症和正常癌旁组织中RNA的表达差异,验证GALNT14在肾透明细胞癌患者中的表达水平。另外,采用Starbase v3.0 (http://starbase.sysu.edu.cn/)、UALCAN (http://ualcan.path.uab.edu/)等在线分析工具和CCLE数据库(https://portals.broadinstitute.org/ccle/about)进一步验证GALNT14在肾透明细胞癌的表达水平。
1.3 临床相关性分析用Perl软件检测GALNT14表达与肾透明细胞癌患者临床特征的相关性,使用Logistic回归分析GALNT14表达在肾透明细胞癌中的临床意义。以从TCGA下载的539个肾透明细胞癌样本的中位数为分界点,将样本分为高表达组和低表达组两部分。利用R软件Logistic回归分析GALNT14在高/低表达组中的表达水平是否存在差异及差异程度。采用GEPIA数据库和UALCAN在线分析工具检测GALNT14的表达特征。
1.4 生存分析及COX回归分析使用Perl软件从Extensible Markup Language(XML)中提取临床样本数据的信息矩阵,将生存分析与Kaplan-Meier生存分析相结合,并使用R软件及阈值为P<0.05的“生存”软件包进行log-rank检验,计算P值, 分析GALNT14表达组间的总生存率(Overall Survival, OS)差异。同时,采用GEPIA数据库、Starbase v3.0、UALCAN及Kaplan-Meier Plotter (http://kmplot.com/analysis/)在线分析工具检测GALNT14在肾透明细胞癌中的表达及预后(总生存率或无病生存率)。使用R软件的Survival和SurvMiner软件包进行COX回归分析,对影响患者OS的预后因素进行单因素和多因素分析,以确定GALNT14的预后价值。采用单因素COX回归分析估计肾透明细胞癌患者总生存期与GALNT14表达水平的相关性,采用多因素COX回归分析验证GALNT14表达与生存期、其他临床特征的相关性,其中P<0.05表示具有统计学意义。
1.5 甲基化分析本研究使用UALCAN在线分析工具来评估肾透明细胞癌中GALNT14启动子的甲基化修饰水平及其与临床特征的关系。分析步骤为①选择功能键:TCGA;②输入基因类型:GALNT14;③选择样本类型:Kidney renal clear cell carcinoma;④链接分析:Methylation;⑤选择不同肿瘤亚类中启动子甲基化状态:样本类型、年龄、性别、分级和转移状态等。另外,使用β值表示DNA甲基化程度,范围从0(未甲基化)到1(完全甲基化)。β值为0.50-0.70时表示超甲基化,β值为0.25-0.30时表示低甲基化[12]。
1.6 共表达基因分析为探究GALNT14的共表达基因及其表达水平,本研究使用LinkedOmics数据库(一个公开门户网站,包含来自TCGA的32种癌症的多组数据,http://www.linkedomics.org/)和GeneMANIA数据库(http://genemania.org)分析其基因共表达情况。从STRING数据库(https://www.string-db.org/)中获得与GALNT14相互作用的蛋白质,并在LinkedOmics网站中的LinkFinder模块中分析GALNT14共表达基因在肾透明细胞癌中的表达水平。分析步骤为①选择肿瘤类型:肾透明细胞癌(KIRC);②选择数据类型:RNAseq、HiSeq RNA;③选择样本类型:不输入;④选择数据属性:GALNT14;⑤选择靶数据类型:Clinical;⑥选择统计方法: 非参数检验。本研究中输入“ GALNT14”,物种类型选择“人类”,置信度选择“Medium 0.400”,相互作用最大数选择“20”。
1.7 基因集富集分析(GSEA)利用京都基因与基因组百科全书(KEGG,http://www.genome.jp/kegg/)对肾透明细胞癌中与GALNT14相关的潜在生物信号通路进行研究。根据GALNT14 mRNA的中位数,将所有基因按顺序排列后分为GALNT14高表达组(n=269)和GALNT14低表达组(n=270)。GSEA每次分析均执行1 000个基因组序列。此外,为使多途径富集结果更明了,使用R软件的“ggplot2”软件包、“plyr”软件包、“grid”软件包和“gridExtra”软件包对GALNT14进行多基因集富集分析。用归一化富集评分(NES)对每个表型富集的途径进行分类,标准化P值(NOM P值)<0.05的基因集被认为显著富集。
2 结果与分析 2.1 研究人群的特征根据联合国世界卫生组织的年龄划分标准,将各年龄人群按照以下标准划分:18-65岁为年轻人、66-79岁为中年人和80-99岁为老年人,这3个年龄组在本研究中的比例分别为65.5%、29.8%和4.7%,平均年龄为61岁。本研究中,肾透明细胞癌的组织学分级包括G1、G2、G3、G4和GX,G1占2.6%,G2占42.8%,G3占38.5%,G4占14.5%,GX占0.9%;病理学分期中Ⅰ期269例(50.1%),Ⅱ期57例(10.6%),Ⅲ期125例(23.3%),Ⅳ期83例(15.5%),具体情况如表 1所示。
| 临床特征 Clinical characteristics |
数量(例) Numbers (ind.) |
占比(%) Proportion (%) |
|
| Age | 18-65 Yrs | 352 | 65.5 |
| 66-79 Yrs | 160 | 29.8 | |
| 80-99 Yrs | 25 | 4.7 | |
| Average age | 61 Yrs | ||
| Gender | Female | 191 | 35.6 |
| Male | 346 | 64.4 | |
| Histological grade | G1 | 14 | 2.6 |
| G2 | 230 | 42.8 | |
| G3 | 207 | 38.5 | |
| G4 | 78 | 14.5 | |
| GX | 5 | 0.9 | |
| Not available | 3 | 0.6 | |
| Pathologic stage | Stage Ⅰ | 269 | 50.1 |
| Stage Ⅱ | 57 | 10.6 | |
| Stage Ⅲ | 125 | 23.3 | |
| Stage Ⅳ | 83 | 15.5 | |
| Not available | 3 | 0.6 | |
| T stage | T1 | 275 | 51.2 |
| T2 | 69 | 12.8 | |
| T3 | 182 | 33.9 | |
| T4 | 11 | 2.0 | |
| M stage | M0 | 426 | 79.3 |
| M1 | 79 | 14.7 | |
| MX | 30 | 5.6 | |
| Not available | 2 | 0.4 | |
| N stage | N0 | 240 | 44.7 |
| N1 | 17 | 3.2 | |
| NX | 280 | 52.1 | |
| Survival time | <1 Yrs | 118 | 22.0 |
| 1-5 Yrs | 303 | 56.4 | |
| 5-10 Yrs | 117 | 21.8 | |
| Survival status | Death | 170 | 31.7 |
| Survival | 367 | 68.3 | |
2.2 GALNT14在癌及正常癌旁组织中的表达
差异表达分析结果显示,与正常癌旁组织相比,GALNT14在肾透明细胞癌组织中显著高表达[P=1.433e-25,图 1(a)]。配对差异分析结果表明,肿瘤组织中GALNT14的表达水平明显高于健康对照组[P=1.752e-18,图 1(b)]。GEPIA数据库分析结果显示,与正常癌旁组织(n=100)相比,GALNT14的表达水平在肾透明细胞癌(n=523)中明显上调[P<0.05,图 1(c)]。StarBase v3.0数据库分析结果显示,与相邻正常组织(n=72)相比,肾透明细胞癌组织(n=535)中GALNT14的表达水平明显上调[(P<0.05,图 1(d)]。UALCAN在线工具分析结果显示,和正常癌旁组织(n=72)相比,GALNT14在肾透明细胞癌(n=533)中显著高表达[P=1.62e-12,图 1(e)]。此外,为验证上述生物信息学分析结果,通过CCLE数据库分析证实,GALNT14在人肾透明细胞癌ACHN细胞和肾癌A498细胞中高表达。综上,所有结果均显示GALNT14在癌组织中的表达水平明显高于正常癌旁组织,表明GALNT14可能是影响肾透明细胞癌预后的潜在关键基因。
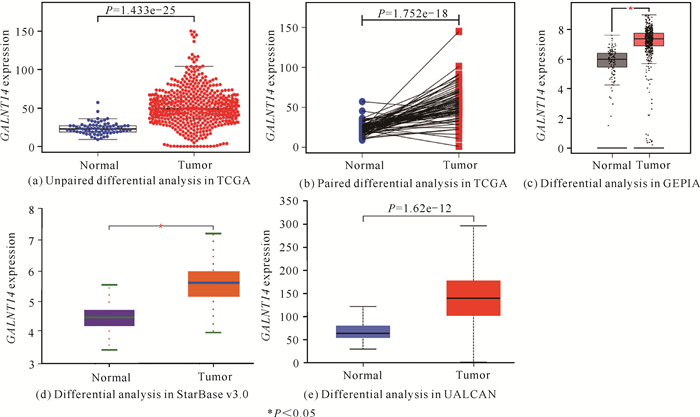
|
| 图 1 GALNT14在肾透明细胞癌及正常癌旁组织中的表达情况 Fig. 1 Expression of GALNT14 in KIRC and normal adjacent tissues |
2.3 肾透明细胞癌中GALNT14表达与患者临床特征的相关性
GALNT14在临床分期[P=0.009,图 2(a)]、T期[P=4.104e-05,图 2(e)]、M期[P=0.005,图 2(f)]和生存状态[P=3.988e-05,图 2(h)]这些不同亚组间的表达有显著差异,在组织分级[P=0.059,图 2(b)]、年龄[P=0.468,图 2(c)]、性别[P=0.084,图 2(d)]和N期[P=0.168,图 2(g)]这些亚组间的表达无统计学意义。亚组分析显示,肾透明细胞癌中GALNT14的高表达与分期、分级和年龄等临床特征显著相关(P<0.05,表 2)。同样,UALCAN在线分析工具检测结果显示GALNT14在分期[图 3(a)]、分级[图 3(b)]、年龄[图 3(c)]、性别[图 3(d)]和N期[图 3(e)]表达上调,且分级和分期的等级越高,GALNT14的表达越少[图 3:(a)(b)]。此外,单因素Logistic回归分析显示,GALNT14与临床病理特征相关,且预后良好,此外,GALNT14在肾透明细胞癌中的表达具有显著的性别差异(P=2.21e-02, 表 2)。
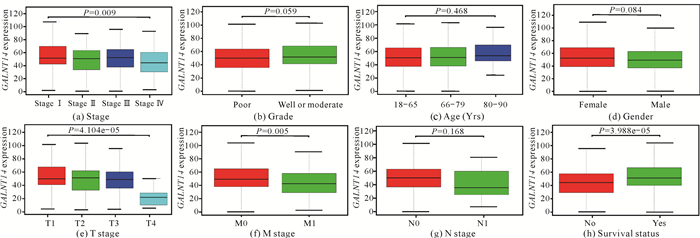
|
| 图 2 GALNT14的表达与肾透明细胞癌患者临床特征的相关性 Fig. 2 Correlation between GALNT14 expression and clinical characteristics in patients with KIRC |
| 临床特征 Clinical characteristics |
对比 Comparison |
P值 P value |
临床特征 Clinical characteristics |
对比 Comparison |
P值 P value |
|
| Stage | Normal vs.Stage Ⅰ | 1.62e-12 | Age | Normal vs.Age (21-40 Yrs) | 1.05e-04 | |
| Normal vs.Stage Ⅱ | 9.89e-08 | Normal vs.Age (41-60 Yrs) | 1.62e-12 | |||
| Normal vs.Stage Ⅲ | 1.62e-12 | Normal vs.Age (61-80 Yrs) | <1e-12 | |||
| Normal vs.Stage Ⅳ | 1.20e-10 | Normal vs.Age (81-100 Yrs) | 5.90e-07 | |||
| Stage Ⅰ vs.Stage Ⅳ | 5.98e-04 | Gender | Normal vs.Male | <1e-12 | ||
| Stage Ⅲ vs.Stage Ⅳ | 4.43e-02 | Normal vs.Female | 1.62e-12 | |||
| Grade | Normal vs.Grade 1 | 3.85e-06 | Male vs.Female | 2.21e-02 | ||
| Normal vs.Grade 2 | 1.62e-12 | T stage | T4 vs.T1 | 0.02 | ||
| Normal vs.Grade 3 | 1.62e-12 | T4 vs.T2 | 0.03 | |||
| Normal vs.Grade 4 | 5.41e-08 | T4 vs.T3 | 0.04 | |||
| Grade 1 vs.Grade 4 | 1.91e-02 | Metastasis status |
Normal vs.N0 | <1e-12 | ||
| Grade 2 vs.Grade 4 | 1.17e-04 | Normal vs.N1 | 4.13e-02 | |||
| Grade 3 vs.Grade 4 | 1.98e-03 | Survival status | Survival status (Yes vs.No) | 0.01 |
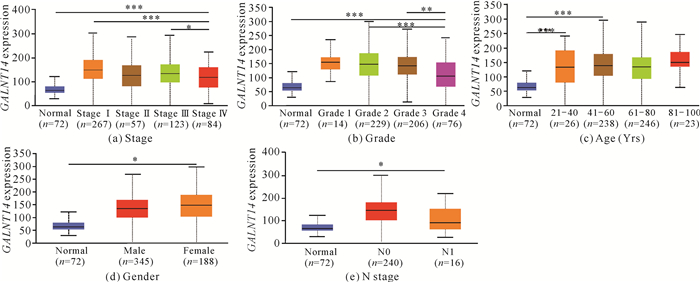
|
| *P<0.05, **P<0.01, ***P<0.001 图 3 GALNT14的甲基化修饰水平 Fig. 3 Methylation modification level of GALNT14 |
2.4 GALNT14对肾透明细胞癌患者生存率的预后价值
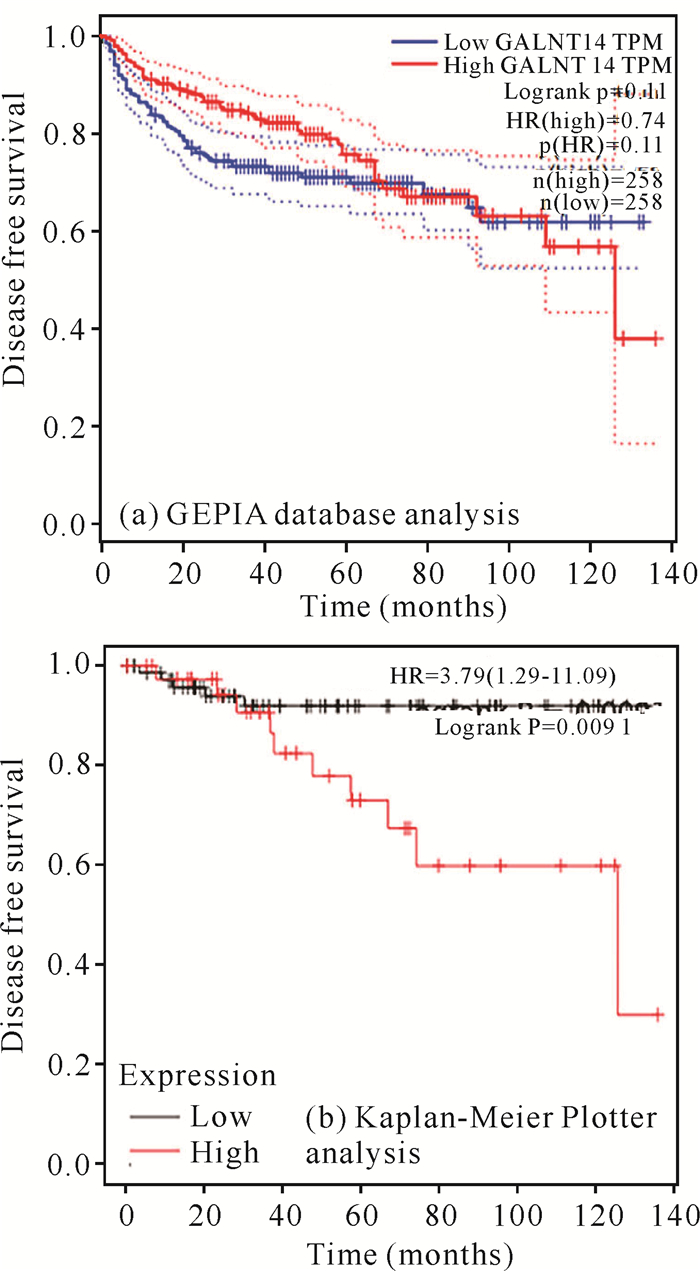
GALNT14在GEPIA、Starbase v3.0、UALCAN、Kaplan-Meier Plotter等分析中的结果均显示GALNT14的高表达与患者的高OS相关,且结果具有统计学意义[图 4: (a)-(d)]。最后,森林图显示GALNT14的表达与OS之间的相关性(图 5)。由上述可知GALNT14与肾透明细胞癌患者的OS显著相关。此外,GEPIA结果显示,GALNT14的高表达与患者的低DFS相关[图 6(a)]。Kaplan-Meier Plotter结果也显示,GALNT14高表达与患者的低DFS相关[(P=0.009 1,图 6(b)]。由此可知,GALNT14表达上调与肾透明细胞癌患者DFS负相关。
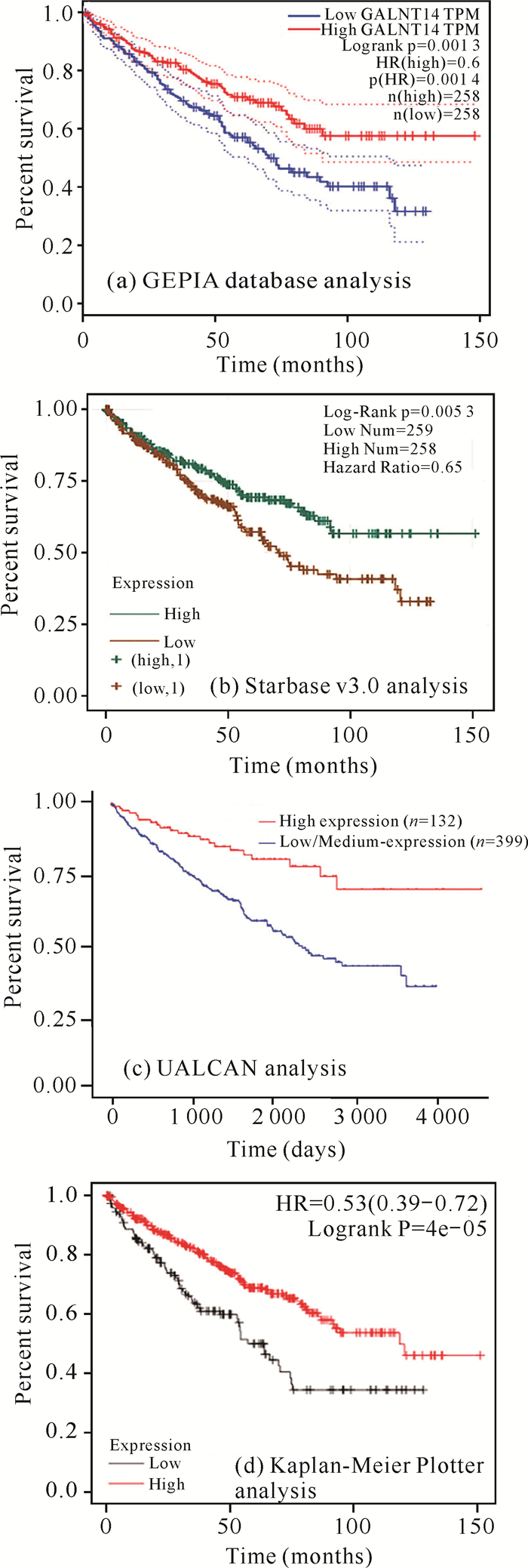
|
| 图 4 GALNT14表达与肾透明细胞癌患者总生存率的相关性 Fig. 4 Correlation between GALNT14 expression and OS in patients with KIRC |
|
| *P < 0.05, **P < 0.01, ***P < 0.001 图 5 GALNT14表达与肾透明细胞癌患者总生存率关系的森林图 Fig. 5 Forest map of relationship between GALNT14 expression and OS in patients with KIRC |
|
| 图 6 GALNT14的表达与肾透明细胞癌患者无病生存率的相关性 Fig. 6 Correlation between GALNT14 expression and DFS in patients with KIRC |
2.5 COX回归分析
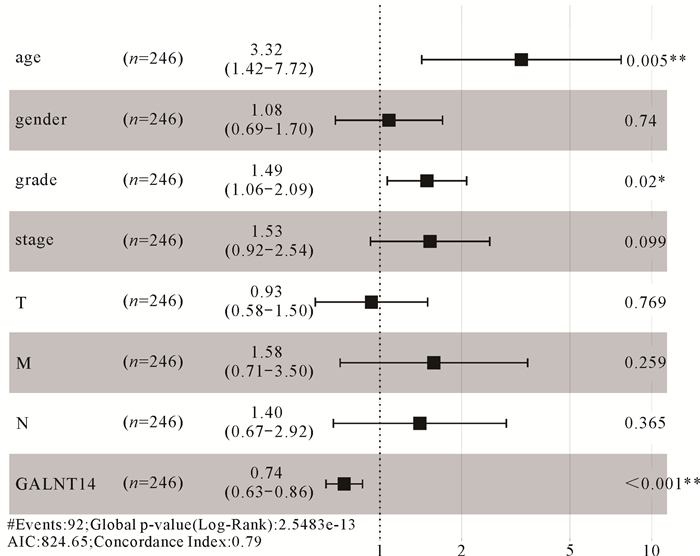
单因素COX分析显示,在肾透明细胞癌中GALNT14表达越高,OS越高[风险比HR=0.75,95%置信区间(CI)为0.66-0.86,P<0.001]。如表 3所示,与OS相关的其他临床病理变量包括临床分期(HR=1.86,95% CI为1.54-2.25,P=1.26e-10)、区域淋巴结受累情况(HR=2.93,95% CI为1.52-5.67,P=0.001)和远处转移(HR=4.07,95% CI为2.63-6.30,P=2.76e-10)。另外,多因素COX分析显示,GALNT14表达与肾透明细胞癌患者的OS显著相关(HR=0.74,95% CI为0.63-0.86,P=0.000 1)。GALNT14表达还与肾透明细胞癌的组织分级(HR=1.49,95% CI为1.06-2.09,P=0.02)、患者年龄(HR=3.32,95% CI为1.42-7.72,P=0.01)相关。由此可知,GALNT14可作为肾透明细胞癌的独立预后因子。
| 参数 Parameter |
单因素分析 Univariate analysis |
多因素分析 Multivariate analysis |
|||||
| 风险比 HR |
95%置信区间 95% CI |
P值 P value |
风险比 HR |
95%置信区间 95% CI |
P值 P value |
||
| Age | 1.02 | 1.00-1.04 | 0.01 | 3.32 | 1.42-7.72 | 0.01 | |
| Grade | 2.24 | 1.68-2.99 | 3.61e-08 | 1.49 | 1.06-2.09 | 0.02 | |
| Stage | 1.86 | 1.54-2.25 | 1.26e-10 | 1.53 | 0.92-2.54 | 0.10 | |
| T stage | 1.94 | 1.54-2.46 | 2.69e-08 | 0.93 | 0.58-1.50 | 0.77 | |
| M stage | 4.07 | 2.63-6.30 | 2.76e-10 | 1.58 | 0.71-3.50 | 0.26 | |
| N stage | 2.93 | 1.52-5.67 | 0.001 | 1.40 | 0.67-2.92 | 0.36 | |
| GALNT14 | 0.75 | 0.66-0.86 | 2.03e-05 | 0.74 | 0.63-0.86 | 0.000 1 | |
| Note: Bold in table indicates statistically significant P value | |||||||
2.6 GALNT14启动子的甲基化结果
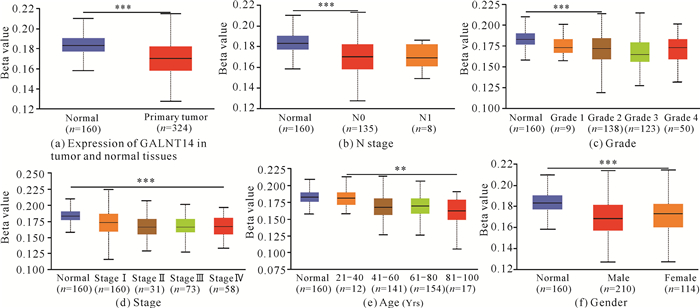
与正常癌旁组织相比,肾透明细胞癌中GALNT14启动子的甲基化水平较低[P<0.001,图 7(a)、表 4]。此外,根据不同的临床特征对GALNT14启动子的甲基化水平进行评估,结果发现DNA甲基化在肿瘤分级和临床分期等指标上也有所不同[图 7: (b)-(f)],其与GALNT14转录、蛋白质的翻译水平呈相反趋势。从上述结果可以推断,提高GALNT14启动子的甲基化水平可能会下调肾透明细胞癌中的GALNT14表达。
|
| *P < 0.05, **P < 0.01, ***P < 0.001 图 7 GALNT14启动子甲基化修饰水平与临床病理特征的相关性 Fig. 7 Correlation between GALNT14 promoter methylation modification level and clinicopathological characteristics |
| 临床特征 Clinical characteristics |
统计意义 Statistical significance |
|
| Normal vs.Tumor | Normal vs.Primary | <1.00e-12 |
| Normal vs.Metastasis status | Normal vs.N0 | 1.87e-12 |
| Normal vs.Grade | Normal vs.Grade 2 | 2.76e-11 |
| Normal vs.Grade 3 | 2.11e-15 | |
| Normal vs.Grade 4 | 7.67e-05 | |
| Normal vs.Stage | Normal vs.Stage Ⅰ | 2.53e-10 |
| Normal vs.Stage Ⅱ | 1.50e-06 | |
| Normal vs.Stage Ⅲ | 1.48e-09 | |
| Normal vs.Stage Ⅳ | 1.12e-09 | |
| Normal vs.Age | Normal vs.Age (41-60 Yrs) | 1.63e-12 |
| Normal vs.Age (61-80 Yrs) | 1.88e-12 | |
| Normal vs.Age (81-100 Yrs) | 1.12e-03 | |
| Age (21-40 Yrs) vs.Age (41-60 Yrs) | 7.24e-03 | |
| Age (21-40 Yrs) vs.Age (61-80 Yrs) | 2.13e-02 | |
| Age (21-40 Yrs) vs.Age (81-100 Yrs) | 6.92e-03 | |
| Normal vs.Gender | Normal vs.Male | <1.00e-12 |
| Normal vs.Female | 4.19e-09 |
2.7 GALNT14作为肾透明细胞癌的独立预后因子
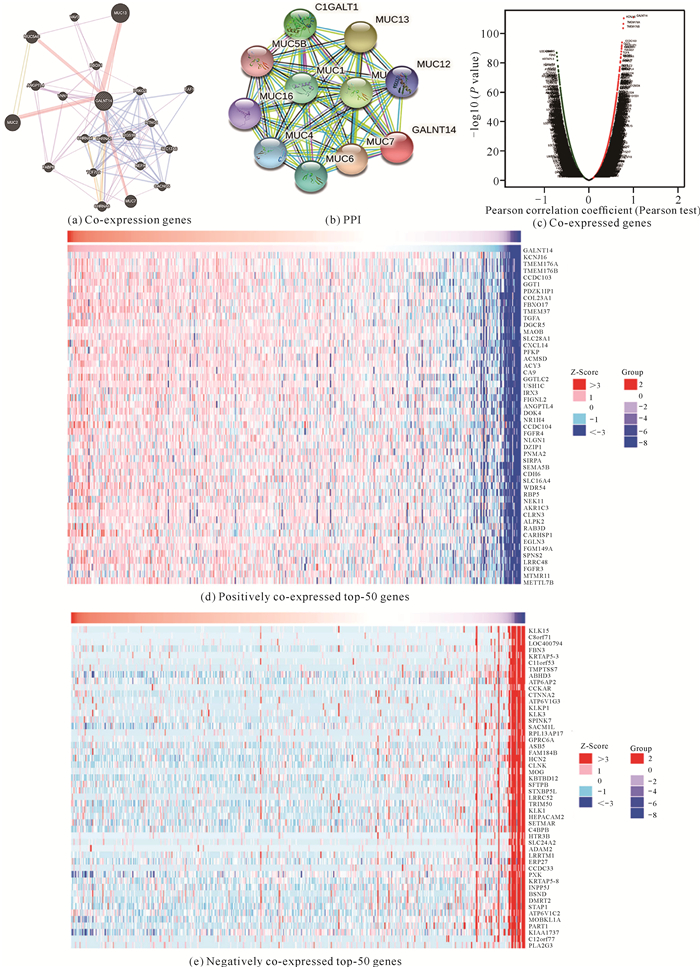
由于GALNT14在肾透明细胞癌的表达中显著上调(图 1),并与患者预后(包括OS和DFS,图 4-6)密切相关,推测GALNT14在肾透明细胞癌中作为独立预后因子存在。考虑到基因间高度相关性[13],利用LinkedOmics和GeneMANIA数据库对GALNT14进行基因共表达分析。GALNT14在肾透明细胞癌中的基因共表达网络分析显示,与肾透明细胞癌发生、发展相关的互作关键基因的核心基因为GALNT14,其中与GALNT14相互作用关系较为显著的基因是MUC13、MUC2及MUC5AC,意味着GALNT14可能会与hub基因相互作用而影响肾透明细胞癌的进展[图 8(a)]。在STRING数据库中获得GALNT14的蛋白质相互作用网络图(Protein-Protein Interaction,PPI)[图 8(b)],从图中可以看出GALNT14表达产物与其他蛋白质在肾透明细胞癌中的相互作用及功能联系,对临床上了解肾透明细胞癌生物信号和能量物质代谢的反应机制有一定帮助。GALNT14在肾透明细胞癌中共表达的基因以火山图显示[图 8(c)],阳性和阴性共表达基因的前50名分别以热图展示[图 8:(d)(e)],这些热图全面展示了肾透明细胞癌中与GALNT14相关的差异表达基因及其在不同样本中的表达。
|
| 图 8 GALNT14的共表达基因及蛋白质相互作用网络图 Fig. 8 Diagram of co-expressed genes and protein interaction network of GALNT14 |
2.8 基于GSEA的GALNT14相关生物信号通路
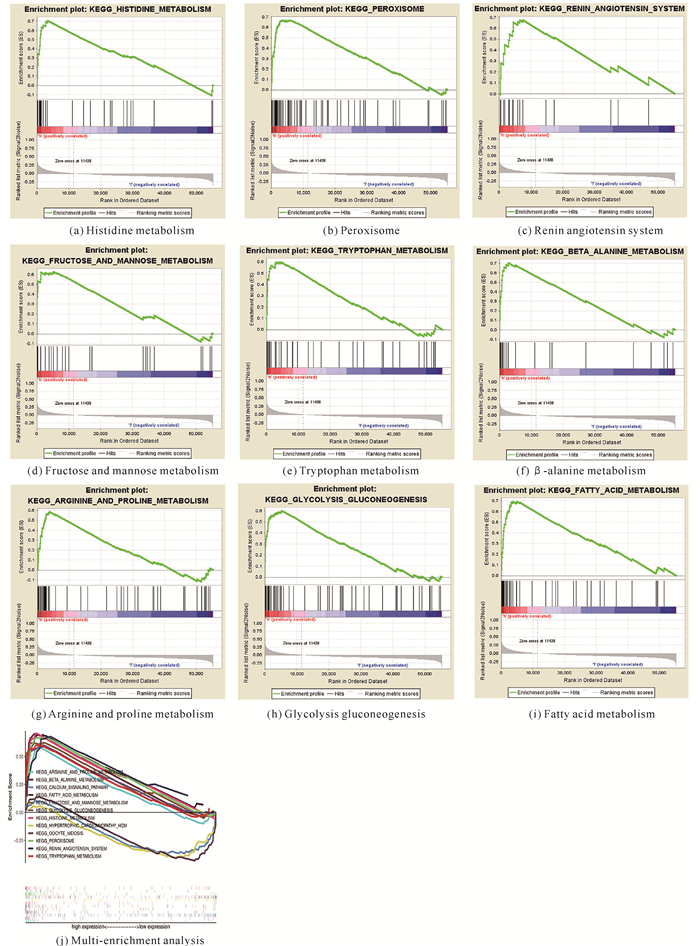
利用从TCGA下载的数据对GALNT14高表达组和低表达组进行基因集富集分析,以探索共调控基因介导的生物信号通路。GSEA显示GALNT14在分子特征数据库(MSigDB)集合的丰富度方面存在显著差异,依其归一化富集评分选择与肾透明细胞癌相关的富集信号通路或生物学相关过程。结果表明,GALNT14的高表达与以下富集通路显著相关:组氨酸代谢[图 9(a)]、过氧物酶体[图 9(b)],肾素-血管紧张素系统[图 9(c)]、果糖和甘露糖代谢[图 9(d)]、色氨酸代谢[图 9(e)]、β-丙氨酸代谢[图 9(f)]、精氨酸和脯氨酸代谢[图 9(g)]、糖酵解糖异生[图 9(h)]、脂肪酸代谢[图 9(i)]。此外,为使基因富集分析的结果显示更清晰,将GALNT14的高表达组与低表达组相结合,结果提示GALNT14在肾透明细胞癌的发生和发展中起重要作用[图 9(j)]。
|
| 图 9 GALNT14在肾透明细胞癌的相关生物信号通路 Fig. 9 Related biological signaling pathways of GALNT14 in KIRC |
3 讨论
本研究首次分析并发现GALNT14在肾透明细胞癌中过表达,且可能是肾透明细胞癌的一个独立预后标志物。差异表达分析和COX回归分析结果显示,GALNT14的表达在肾透明细胞癌的组织分级、T分期和生存状态中存在显著性差异。已有研究表明GALNT14在包括卵巢癌在内的多种癌症中表达,其上调加快高级别卵巢癌的进展[1],其高表达促进卵巢癌细胞侵袭和增殖[1, 14],提高乳腺癌细胞的侵袭和迁移能力[9]。因此,GALNT14过表达可能促进肾透明细胞癌细胞增殖、侵袭、转移和进展,继而影响肾透明细胞癌的分级、T分期和转移。
本研究结果显示,GALNT14的表达与肾透明细胞癌患者的总体生存期OS显著正相关,与无病生存期DFS显著负相关。值得注意的是,GALNT14表达与肾透明细胞癌患者OS从初期至末期一直为正相关,但是与患者的DFS在初期为正相关,至中末期为负相关。结合两者定义(OS是指诊断日期到最后一次随访或死亡日期之间的时间,任何引起死亡的原因均包括在内;DFS指从诊断日期到第一次复发或最后一次随访或死亡日期之间的时间,以先发生者为准[15])可知,DFS比OS多纳入因该疾病第一次复发的患者死亡数据,而OS将一些不明原因导致的死亡数据也纳入;加之肾透明细胞癌极易转移,在进行部分或根治性肾切除术后仍有约30%的患者会出现复发的情况[2],这部分患者的生存率数据也是DFS和OS出现差异的原因之一。因此,DFS对分析肾透明细胞癌的生存率数据更具针对性。GALNT14表达与患者的DFS在初期为正相关,至中、末期为负相关,可见GALNT14高表达在肾透明细胞癌的中、末期是影响患者生存的关键。另外,癌症分级、转移与患者患病时间关系密切,这也与结果中GALNT14的高表达影响肾透明细胞癌的分级、转移相符。已有研究表明具有较低级别、低分期和无淋巴结转移的肾透明细胞癌患者,比具有其他临床特征的患者可能有更长的生存期[16]。因此,GALNT14高表达可能与中、末期肾透明细胞癌患者生存率下降相关。
单因素和多因素COX分析结果提示,GALNT14在肾透明细胞癌中是一种新的生物标志物,且可能是肾透明细胞癌的一个独立预后因子。在其他癌症研究方面,已有研究表明GALNT14可能是肺癌转移的驱动因素,导致肺癌患者生存期较低[17]。GALNT14-rs9679162的TT基因型与肝细胞癌的良好预后有关[18]。GALNT14与胰腺导管腺癌病人胰腺导管腺切除后的进展、生存期,特别是OS相关,且可作为胰腺导管腺癌的预后指标[19]。GALNT14基因型与切除后胆管癌的神经浸润、淋巴结转移和OS相关[20]。此外,GALNT14的表达影响乳腺癌细胞的侵袭能力,且与乳腺癌病人生存期有关[21]。由此可知,GALNT14与多种癌症的转移和预后相关。因此,GALNT14可能通过促进癌细胞的转移影响肾透明细胞癌的进展,且可作为肾透明细胞癌的独立预后因子。
本研究发现肾透明细胞癌中GALNT14启动子的甲基化水平较低。不同的DNA甲基化模式在病理分级、临床分期及其他临床指标上存在差异。癌基因的低甲基化在细胞癌变过程中起着不可或缺的作用,其通常与肿瘤的远处转移有关[22]。基因异常甲基化导致的癌变在所有肿瘤中都很常见,高甲基化通常伴随着肿瘤抑制基因的表观遗传沉默和随之产生的肾组织功能改变,异常增强子高甲基化已被证明是肾透明细胞癌患者生存不良的预测因子[23, 24]。另有研究表明,甲基化的高修饰与肾透明细胞癌的高分期和分级相关[25, 26],这与本研究的结果一致。本研究首次发现GALNT14甲基化与肾透明细胞癌临床特征具有相关性,为后续相关研究提供参考。
通过基因富集分析发现,GALNT14显著富集在氨基酸代谢、脂肪酸代谢和糖代谢等通路上。已有研究表明,糖代谢、氨基酸代谢和脂肪酸降解等过程影响肾透明细胞癌的组织学分级、临床分期、远处转移及预后[27, 28]。在氨基酸代谢方面,已有研究发现赖氨酸代谢增强与肾透明细胞癌较高的病理分期、较差的生存期及肿瘤级别显著相关[29]。此外,丝氨酸/苏氨酸的活性增强能够导致肾透明细胞癌病人预后不良[30]。在脂肪酸代谢方面,肾透明细胞癌是一种以脂质积聚和储存为组织学特征的代谢性疾病,与肿瘤进展有关[31];癌细胞中的脂肪酸代谢紊乱可能是肾透明细胞癌患者肿瘤进展和不良预后的重要机制[32];此外,已有研究发现肾透明细胞癌中脂肪酸减少与肿瘤高T分期、分级和预后不良相关[31, 33]。在糖代谢方面,肾透明细胞癌患者通常会出现糖代谢能力失调的现象[34]。肾透明细胞癌细胞摄取葡萄糖转运体数量增多,导致葡萄糖积累继而促进肿瘤进展[35],这与本研究发现GALNT14过表达影响糖代谢的结果基本一致。另有研究指出,肾透明细胞癌中糖酵解的加速诱导癌细胞代谢重组,为其快速提供能量和营养,维持肾透明细胞癌细胞的高速增殖,这往往预示着患者预后不良[36]。同时,氨基酸代谢、脂肪酸代谢和糖代谢在肾透明细胞癌的进展中起着至关重要的作用。因此,本研究推测GALNT14通过上述代谢相关通路调控肾透明细胞癌的发生发展。然而,GALNT14高表达的预后仅限于Ⅰ期和Ⅳ期肾透明细胞癌,更多有力的证据还需要进一步试验。
4 结论GALNT14在调节肿瘤的发生发展中起着至关重要的作用。本研究发现,与正常癌旁组织样本相比,GALNT14在肾透明细胞癌患者中过表达,且其过表达与肾透明细胞癌患者的不良预后显著相关,说明GALNT14可能是影响肾透明细胞癌预后的潜在关键基因。从GALNT14的基因富集通路来看,GALNT14主要参与调控氨基酸代谢、脂肪酸代谢、糖代谢等与肿瘤代谢密切相关的通路。因此,GALNT14可作为肾透明细胞癌的独立预后因子,并可作为临床诊断和治疗肾透明细胞癌的潜在靶标,对揭示肾透明细胞癌的发病机制和后续的靶向治疗有着积极的作用。
| [1] |
HILLMAN J C, PUGACHEVA E M, BARGER C J, et al. BORIS expression in ovarian cancer precursor cells alters the CTCF cistrome and enhances invasiveness through GALNT14[J]. Molecular Cancer Research, 2019, 17(10): 2051-2062. DOI:10.1158/1541-7786.MCR-19-0310 |
| [2] |
LI X, LI H, YANG C, et al. Comprehensive analysis of ATP6V1s family members in renal clear cell carcinoma with prognostic values[J]. Frontiers in Oncology, 2020, 10: 567970. DOI:10.3389/fonc.2020.567970 |
| [3] |
DETARYA M, SAWANYAWISUTH K, APHIVATANASIRI C, et al. The O-GalNAcylating enzyme GALNT5 mediates carcinogenesis and progression of cholangiocarcinoma via activation of AKT/ERK signaling[J]. Glycobiology, 2020, 30(5): 312-324. DOI:10.1093/glycob/cwz098 |
| [4] |
LIN W R, YEH C T. GALNT14: an emerging marker capable of predicting therapeutic outcomes in multiple cancers[J]. International Journal of Molecular Sciences, 2020, 21(4): 1-12. |
| [5] |
SHAN J S, LIU Y, WANG Y K, et al. GALNT14 involves the regulation of multidrug resistance in breast cancer cells[J]. Translational Oncology, 2018, 11(3): 786-793. DOI:10.1016/j.tranon.2018.04.003 |
| [6] |
HUSSAIN M R M, HOESSLI D C, FANG M. N-acetylgalactosaminyltransferases in cancer[J]. Oncotarget, 2016, 7(33): 54067-54081. DOI:10.18632/oncotarget.10042 |
| [7] |
LIU L, XIONG Y, XI W, et al. Prognostic role of N-acetylgalactosaminyltransferase 10 in metastatic renal cell carcinoma[J]. Oncotarget, 2017, 8(9): 14995-15003. DOI:10.18632/oncotarget.14786 |
| [8] |
TSOU Y K, LIANG K H, LIN W R, et al. GALNT14 genotype as a response predictor for concurrent chemoradiotherapy in advanced esophageal squamous cell carcinoma[J]. Oncotarget, 2017, 8(17): 29151-29160. DOI:10.18632/oncotarget.16253 |
| [9] |
TIAN H N, ZUO T, WANG X F, et al. GALNT14 mediates tumor invasion and migration in breast cancer cell MCF-7[J]. Molecular Carcinogenesis, 2015, 54(10): 1159-1171. DOI:10.1002/mc.22186 |
| [10] |
ESCUDIER B, PORTA B, SCHMIDINGER M, et al. Renal cell carcinoma: ESMO clinical practice guidelines for diagnosis, treatment and follow-up[J]. Annals of Oncology, 2016, 27: 58-68. |
| [11] |
LIU X Y, ZHANG M X, LIU X, et al. Urine metabolomics for renal cell carcinoma (RCC) prediction: tryptophan metabolism as an important pathway in RCC[J]. Frontiers in Oncology, 2019, 9: 663. DOI:10.3389/fonc.2019.00663 |
| [12] |
MEN C, CHAI H, SONG X, et al. Identification of DNA methylation associated gene signatures in endometrial cancer via integrated analysis of DNA methylation and gene expression systematically[J]. Journal of Gynecology Oncology, 2017, 28(6): e83. DOI:10.3802/jgo.2017.28.e83 |
| [13] |
CHEN L, PENG T C, LUO Y W, et al. ACAT1 and metabolism-related pathways are essential for the progression of clear cell renal cell carcinoma (ccRCC), as determined by co-expression network analysis[J]. Frontiers in Oncology, 2019, 9: 957. DOI:10.3389/fonc.2019.00957 |
| [14] |
YANG J, LI G, ZHANG K. MiR-125a regulates ovarian cancer proliferation and invasion by repressing GALNT14 expression[J]. Biomed Pharmacother, 2016, 80: 381-387. DOI:10.1016/j.biopha.2015.12.027 |
| [15] |
SIMONS J M, JACOBS J G, ROIJERS J P, et al. Disease-free and overall survival after neoadjuvant chemotherapy in breast cancer: breast-conserving surgery compared to mastectomy in a large single-centre cohort study[J]. Breast Cancer Research and Treatment, 2020, 185(2): 441-451. |
| [16] |
LYU Q, ZHU W, WEI T, et al. High mutations in fatty acid metabolism contribute to a better prognosis of small-cell lung cancer patients treated with chemotherapy[J]. Cancer Medicine, 2021, 10(21): 7863-7876. DOI:10.1002/cam4.4290 |
| [17] |
KWON O S, LEE H, KONG H J, et al. Connectivity map-based drug repositioning of bortezomib to reverse the metastatic effect of GALNT14 in lung cancer[J]. Oncogene, 2020, 39(23): 4567-4580. DOI:10.1038/s41388-020-1316-2 |
| [18] |
CHEN W T, LIN S M, LEE W C, et al. GALNT14 genotype-guided chemoembolization plus sorafenib therapy in hepatocellular carcinoma: a randomized trial[J]. Hepatology International, 2022, 16(1): 148-158. DOI:10.1007/s12072-021-10283-7 |
| [19] |
CHIANG C C, YEH C T, HWANG T L, et al. The GALNT14 genotype predicts postoperative outcome of pancreatic ductal adenocarcinoma[J]. Journal of Clinical Medicine, 2019, 8(12): 2225. DOI:10.3390/jcm8122225 |
| [20] |
LIANG K H, YEH T S, WU R C, et al. GALNT14 genotype is associated with perineural invasion, lymph node metastasis and overall survival in resected cholangiocarcinoma[J]. Oncology Letters, 2017, 13(6): 4215-4223. DOI:10.3892/ol.2017.5991 |
| [21] |
MILDE-LANGOSCH K, SCHÜTZE D, OLIVEIRA-FERRER L, et al. Relevance of βGal-βGalNAc-containing glycans and the enzymes involved in their synthesis for invasion and survival in breast cancer patients[J]. Breast Cancer Research and Treatment, 2015, 151(3): 515-528. DOI:10.1007/s10549-015-3425-0 |
| [22] |
KLÜMPER N, RALSER D J, BAWDEN E G, et al. LAG3 (LAG-3, CD223) DNA methylation correlates with LAG3 expression by tumor and immune cells, immune cell infiltration, and overall survival in clear cell renal cell carcinoma[J]. Journal for ImmunoTherapy of Cancer, 2020, 8: e000552. DOI:10.1136/jitc-2020-000552 |
| [23] |
KATZENDORN O, PETERS I, DUBROWINSKAJA N, et al. DNA Methylation in INA, NHLH2, and THBS4 is associated with metastatic disease in renal cell carcinoma[J]. Cancers, 2021, 14: 39. DOI:10.3390/cancers14010039 |
| [24] |
KOCH A, JOOSTEN S C, FENG Z, et al. Analysis of DNA methylation in cancer: location revisited[J]. Clinical Oncology, 2018, 15(7): 459-466. |
| [25] |
MENG T, HUANG R Z, ZENG Z W, et al. Identification of prognostic and metastatic alternative splicing signatures in kidney renal clear cell carcinoma[J]. Frontiers in Bioengineering and Biotechnology, 2019, 7(270): 1-14. |
| [26] |
MIAO Y, CAO F, LI P P, et al. DNA methylation of Hugl-2 is a prognostic biomarker in kidney renal clear cell carcinoma[J]. Clinical and Experiental Pharmacology and Physiology, 2020, 48(1): 44-53. |
| [27] |
CUI H, SHAN H J, MIAO M Z, et al. Identification of the key genes and pathways involved in the tumorigenesis and prognosis of kidney renal clear cell carcinoma[J]. Scientific Reports, 2020, 10(1): 4271. DOI:10.1038/s41598-020-61162-4 |
| [28] |
ZHOU J T, ZHU Y T, LIU Y, et al. High PRAS40 mRNA expression and its role in prognosis of clear cell renal cell carcinoma[J]. Translational Andrology and Urology, 2020, 9(4): 1650-1660. DOI:10.21037/tau-20-741 |
| [29] |
LIN S T, ZHENG L L, LU Y C, et al. Comprehensive analysis on the expression levels and prognostic values of LOX family genes in kidney renal clear cell carcinoma[J]. Cancer Medicine, 2020, 9(22): 8624-8638. DOI:10.1002/cam4.3472 |
| [30] |
ZHANG C, YANG W, ZHANG S S, et al. Pan-cancer analysis of osteogenesis imperfecta causing gene SERPINF1[J]. Intractable & Rare Diseases Research, 2022, 11(1): 15-24. |
| [31] |
CHENG G, YU Y, WANG L W, et al. Overexpression of LINC00160 predicts poor outcome and promotes progression of clear cell renal cell carcinoma[J]. Aging, 2020, 12(8): 7448-7464. DOI:10.18632/aging.103091 |
| [32] |
LIU Z, LIU C, XIAO M M, et al. Bioinformatics Analysis of the prognostic and biological significance of ZDHHC-Protein acyltransferases in kidney renal clear cell carcinoma[J]. Frontiers in Oncology, 2020, 10: 565414. DOI:10.3389/fonc.2020.565414 |
| [33] |
WEISS R H. Metabolomics and metabolic reprogramming in kidney cancer[J]. Seminars in Nephrology, 2018, 38(2): 175-182. DOI:10.1016/j.semnephrol.2018.01.006 |
| [34] |
HU F Y, ZENG W Y, LIU X P. A gene signature of survival prediction for kidney renal cell carcinoma by multi-omic data analysis[J]. International Journal of Molecular Sciences, 2019, 20(22): 5720. DOI:10.3390/ijms20225720 |
| [35] |
POPLAWSKI P, TOHGE T, BOGUSLAWSKA J, et al. Integrated transcriptomic and metabolomic analysis shows that disturbances in metabolism of tumor cells contribute to poor survival of RCC patients[J]. Biochimica et Biophysica Acta-Molecular Basis of Disease, 2017, 1863(3): 744-752. |
| [36] |
HE Y, WANG X X, LU W L, et al. PGK1 contributes to tumorigenesis and sorafenib resistance of renal clear cell carcinoma via activating CXCR4/ERK signaling pathway and accelerating glycolysis[J]. Cell Death and Disease, 2022, 13: 118. |



