糖蜜是甘蔗制糖的副产品,被广泛用于酒精生产。巴西是最早使用糖蜜生产乙醇的国家,每年乙醇产量可替代巴西40%以上的汽油消耗[1]。在利用糖蜜生产乙醇的过程中,通常在发酵环节添加25%的稀硫酸溶液营造适合酵母生存的酸性环境[2],导致平均每生产1 t酒精就会产生10-15 t含有溶解性化学需氧量(SCOD)、挥发性脂肪酸(VFAs)以及高硫酸盐含量的高浓度有机废水[3]。对于这种难处理的高浓度有机废水,厌氧消化处理无疑是一种更适合降低废水废物污染、降低成本、有效回收能源的技术。微生物在厌氧条件下将可降解有机物转化为富含甲烷(CH4)的沼气,可减少化石能源消耗,同时这也是实现可持续发展、促进资源循环利用的理想方法[4]。
通常厌氧消化的效果取决于底物种类和混合底物配比,除此之外,接种泥的选择同样重要,这决定了厌氧消化能否成功启动以及稳定运行,从而减少微生物在厌氧消化过程中产生滞后的影响[5]。此外,驯化后的活性污泥具有较高的抗逆性,在稳定的厌氧消化条件下能够处理更高浓度的有机废水。已有许多研究将驯化后的污泥用于处理溶液和废水,如Lin等[6]的研究强调,在厌氧序批式反应器中利用驯化后的污泥在短水力停留时间(HRT)和控制反应期/沉降期比条件下处理蔗糖溶液,可以提高蔗糖产氢气的效率;Liu等[7]利用驯化后的厌氧污泥处理乙草胺除草剂,结果表明厌氧污泥可降解6种重要的乙草胺除草剂,并获得了具有高效降解乙草胺能力的厌氧污泥;Janeczko等[8]在去除2-硝基苯酚(DNP)工艺废水的试验中发现,驯化污泥可以避免在使用非驯化污泥时DNP降解的长滞后性。
动物粪便被认为是一种良好的共消化基质,在与糖蜜酒精废水(MAW)共消化的过程中,除了富含营养元素和微量元素外,自身含有的高碱度和高氨氮可以中和厌氧消化过程中因VFAs积累、pH值下降导致的酸性环境[9],对污泥的驯化起到很好的促进和强化作用,良好的驯化可使消化过程中污泥微生物群落结构和功能向积极的方向变化[10, 11]。猪粪、鸡粪和牛粪是3种常见的动物粪便,为厌氧消化过程中常用的原料。Geng等[12]在如何提高活性污泥厌氧消化过程甲烷产量的研究中发现,接种剂用猪粪、牛粪或食物垃圾进行驯化后,在一定程度上可以提高甲烷产量。肖利萍等[13]利用生活污水、鸡粪和锯末的混合发酵液作为碳源驯化硫酸盐还原菌(SRB),用驯化后的SRB处理矿山废水,硫酸盐的去除率可达到98.2%。但这3种动物粪便作为混合底物对糖蜜酒精废水厌氧消化的污泥在抗高负荷以及抗高硫酸盐浓度的条件下厌氧消化的研究鲜有报道。
本研究旨在评估利用不同动物粪便(猪粪、鸡粪和牛粪)驯化污泥,在厌氧条件下处理具有高有机负荷率和高浓度硫酸盐糖蜜酒精废水的有效性,通过在厌氧消化过程中添加硫酸盐(硫酸钠),以确定最佳动物粪便驯化污泥种类,为利用驯化污泥处理高有机负荷和高浓度硫酸盐废水提供重要的参考依据。
1 材料与方法 1.1 接种污泥与原料在保持进水有机负荷率(OLR)不变的情况下,将猪粪、鸡粪和牛粪分别与糖蜜酒精废水按照溶解性化学需氧量(SCOD)比例为1∶1、1∶3、1∶5、1∶7、1∶9进行混合厌氧消化,即在动物粪便SCOD逐渐减少,糖蜜酒精废水SCOD逐渐增加的驯化方式下产生的3种活性污泥,作为处理糖蜜酒精废水厌氧消化的接种物。其中猪粪(SMS)组、鸡粪(CMS)组和牛粪(BMS)组的污泥接种物以及糖蜜酒精废水的特性如表 1所示。
| 组别 Group |
pH值 pH value |
溶解性化学需氧量(g·L-1) SCOD (g·L-1) |
挥发性脂肪酸(mg·L-1) VFAs (mg·L-1) |
硫酸盐(mg·L-1) SO42- (mg·L-1) |
| SMS | 7.17±0.14 | 3.1±0.8 | 1 816.7±189.7 | 266.7±28.3 |
| CMS | 7.20±0.18 | 3.4±0.1 | 1 163.9±106.4 | 273.3±11.5 |
| BMS | 7.20±0.23 | 2.3±0.1 | 406.9±19.5 | 240.0±20.0 |
| MAW | 4.50±0.11 | 150.7±1.2 | 33 175.3±1 301.7 | 14 933.0±305.5 |
1.2 反应装置
反应装置由总体积为500 mL的厌氧反应瓶和集气袋两部分组成。厌氧反应瓶顶端安装两个钻孔,其中1孔为废水进出水孔,另1孔为出气孔,两孔区别在于进出水孔下端距离污泥面1 cm以上位置连接塑料管,而出气孔下端无连接管。出气孔上端连接集气袋,用于平衡气压;进出水孔上端连接止水夹,隔绝空气。通过恒温水浴锅加热控制反应温度,保证消化温度为(37±1)℃。实验装置如图 1所示。
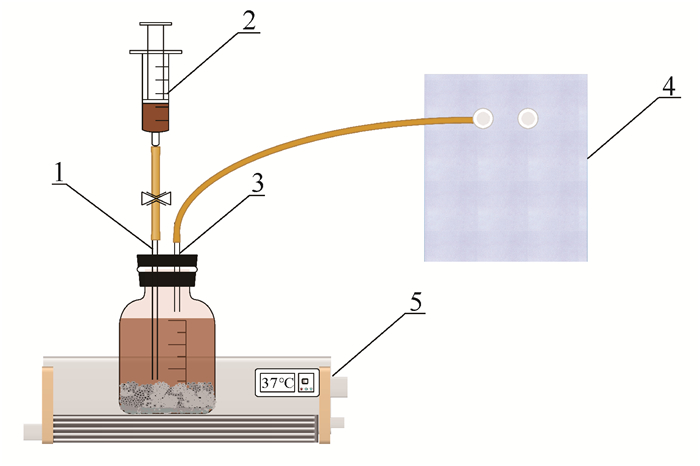
|
| 1:Influent or effluent pores; 2:Syringe; 3:Gas outlet; 4:Gas collecting bag; 5:Constant temperature water bath 图 1 实验装置示意图 Fig. 1 Schematic diagram of experimental device |
1.3 实验设计
设置反应器工作体积为400 mL,其中废水为300 mL,厌氧污泥100 mL,实验做3个重复,共设置9个反应器。为了使驯化污泥适应新的消化环境,将初始进水OLR控制在较低水平,为1.5 gSCOD·L-1·d-1,进水物料为动物粪便SCOD与糖蜜酒精废水SCOD比例1∶9的原始污泥,1个HRT为4 d,每个阶段进行2个HRT。进水前用NaOH将水样的pH值调整至7.0左右。集气袋始终保持打开状态,目的是为了使进出水有足够的气压。出水时,用注射器对准出水孔并抽出100 mL废水,用于后续废水指标的测定;进水时,用注射器抽取按要求配置好的糖蜜酒精废水水样,对准进水孔将水样注射到厌氧消化反应容器中。每天进出水100 mL。在每个阶段进样后的第1天,向进出水孔通入氮气1 min,确保厌氧环境,这个过程称为适应期。
在适应期的基础上,保持OLR为1.5 gSCOD·L-1·d-1,将进水物料调整为纯糖蜜酒精废水,运行2个HRT后,逐步提高进水OLR (每2个HRT提高1次,每次提高OLR=1.0 gSCOD·L-1·d-1),实验操作方法与适应期一致,反应过程定义为Ⅰ时期。
在Ⅰ时期的基础上,保持高浓度的OLR不变,在硫酸钠浓度分别为4.0 g·L-1、5.0 g·L-1和6.0 g·L-1的条件下进行厌氧消化实验,每个阶段进行1个HRT,实验操作方法与适应期一致,反应过程定义为Ⅱ时期。
1.4 方法 1.4.1 测定项目在Ⅰ时期每2个HRT和Ⅱ时期每1个HRT后,采集100 mL出水储存于4℃冰箱中,用于水质测定,根据《水和废水监测分析方法(第四版)》[14]中的重铬酸钾法和氯化钡浊度法分别测定废水SCOD含量以及硫酸盐浓度。使用便携式沼气分析仪(GEM5000,深圳市昂为电子有限公司)测定产生的1 L沼气中CH4和硫化氢(H2S)的体积占比,使用高效气相色谱(GC9720Plus,浙江福立分析仪器股份有限公司)测定VFAs浓度,分析前将样品在离心机上以10 000 r/min转速离心4 min,用0.22 μm过滤器过滤,滴加甲酸酸化至pH值2.0以下,设置仪器进样口温度为250℃,检测器温度为250℃,载气为氮气,在流速为30 mL·min-1下测定。
1.4.2 微生物群落分析采取Ⅰ时期OLR为8.0 gSCOD·L-1·d-1阶段、Ⅱ时期硫酸盐浓度分别为4.0 g·L-1、5.0 g·L-1和6.0 g·L-1阶段的厌氧颗粒污泥,分别命名为X3、X4、X5、X6 (X由SMS、CMS和BMS表示)。颗粒污泥在10 000 r/min离心1 min后,去除上清液,污泥样品储存在-80℃冰箱中,直到提取DNA。用于扩增细菌16S rRNA V3-V4区的引物是5′-CCTACGGRRBGCASCAGKVRVGAAT-3′和5′-CCTAATCTWTGGGVNCATCAGG-3′;用于扩增古细菌16S rRNA V4-V5区域的引物是5′-CCTACGGGNGGCWGCAG-3′和5′-TAATCTATGGGVHCATCAGG-3′。随后使用Illumina Miseq技术对PCR产物进行测序,得到的序列进行操作分类单元(OTU)识别、群落比较和统计分析。
1.4.3 数据分析采用SPSS和Excel对所有原始数据进行统计计算和数学分析,P<0.05时具有统计学意义。所有图形使用Origin 8.0软件生成。此外,采用Shannon指数和Simpson指数对各样本组的微生物群落多样性进行量化。
2 结果与分析 2.1 SCOD去除率的变化适应期3组污泥的SCOD去除率为55.0%-60.3%(图 2)。Ⅰ时期,当进水OLR增加至6.0 gSCOD·L-1·d -1时,SMS组、CMS组和BMS组的SCOD去除率达到最大值,分别为(64.6±0.2)%、(68.1±0.3)%和(65.2±1.4)%,CMS组显著较高(P<0.05)。而在OLR增加至8.0 gSCOD·L-1·d -1的高有机负荷阶段时,这3组污泥的去除率变化差别较小。Ⅱ时期,3组污泥的SCOD去除率随硫酸盐浓度的增加而降低,与其他两组相比,CMS组在抗硫酸盐浓度水平上表现较好。以上结果说明前期添加鸡粪作为糖蜜酒精废水共消化底物驯化的污泥,在后期处理高有机负荷和高浓度硫酸盐的糖蜜酒精废水的过程中表现出较好的SCOD去除效果。
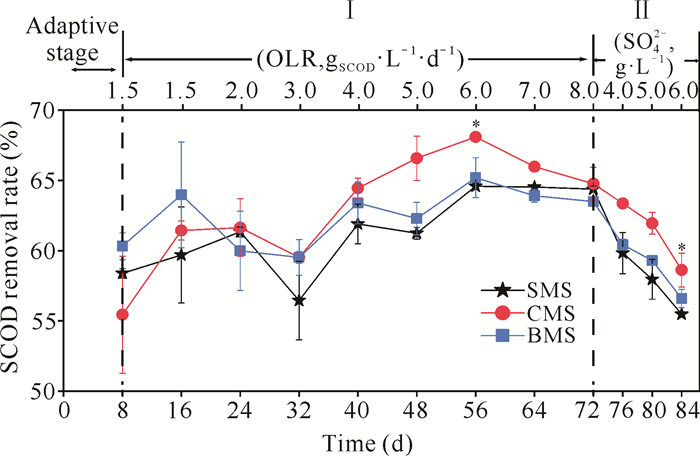
|
| * indicates P < 0.05 compared with other two groups at the same stage 图 2 厌氧消化过程中各反应器SCOD去除率变化 Fig. 2 Changes of SCOD removal rate in each reactor during anaerobic digestion |
2.2 挥发性脂肪酸含量的动态变化
各个反应器VFAs含量变化如图 3所示。与适应期相比,Ⅰ时期OLR为1.5 gSCOD·L-1·d-1的糖蜜酒精废水阶段,3组污泥的VFAs含量较低,其中BMS组的VFAs含量显著小于其他两组(P<0.05)。随着OLR的不断增加,CMS组在同一时期利用VFAs转化效率上有明显的优势,表明在CMS组反应器中VFAs生成和消耗达到平衡状态[15]。与Ⅰ时期OLR为8.0 gSCOD·L-1·d-1的阶段相比,Ⅱ时期硫酸盐浓度为4.0 g·L-1阶段,SMS组、CMS组和BMS组VFAS含量分别增加964.9 mg·L-1、583.0 mg·L-1和987.9 mg·L-1。在硫酸盐浓度为6.0 g·L-1阶段,SMS组、CMS组和BMS组的VFAs含量达到最大值,分别为(4 016.7±191.2) mg·L-1、(1 587.8±60.72) mg·L-1和(3 010.9±17.7) mg·L-1,其中CMS组的VFAs含量显著低于其他两组(P<0.05)。表明在抵抗高有机负荷和高浓度硫酸盐冲击条件下,CMS组在转化VFAs的消化效率上有明显的优势。
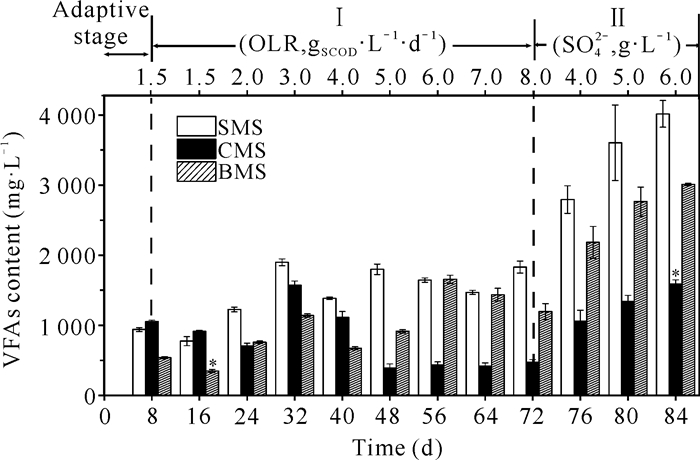
|
| * indicates P < 0.05 compared with other two groups at the same stage 图 3 厌氧消化过程中各个反应器VFAs含量的变化 Fig. 3 Changes of VFAs content in effluent of each reactor during anaerobic digestion |
2.3 硫酸盐去除率以及H2S体积占比的变化
厌氧消化过程中各个反应器硫酸盐去除率和H2S体积占比的变化结果如图 4所示。在适应期和Ⅰ时期前期,3组污泥的硫酸盐去除率保持在83.0%以上,表明驯化污泥在低水平OLR下硫酸盐去除率较高。由于低水平OLR下硫酸盐含量较低,因此在厌氧消化过程中产生的H2S体积占比较低。随着进水OLR的增加,H2S体积占比逐渐增加,而在OLR为8.0 gSCOD·L-1·d-1阶段,SMS组、CMS组和BMS组硫酸盐去除率最低,分别为(60.4±4.7)%、(59.0±4.1)%、(61.7±13.2)%。Ⅱ时期,在硫酸盐浓度为6.0 g·L-1阶段,SMS组、CMS组和BMS组的H2S在沼气中体积占比分别达到(2.0±0.2)%、(1.3±0.04)%和(1.3±0.2)%,SMS组显著高于其他两组(P<0.05)。与此同时,SMS组、CMS组和BMS组的硫酸盐去除率分别达到(83.3±6.1)%、(79.9±4.3)%和(77.6±1.7)%,SMS组的硫酸盐去除率相对较高。
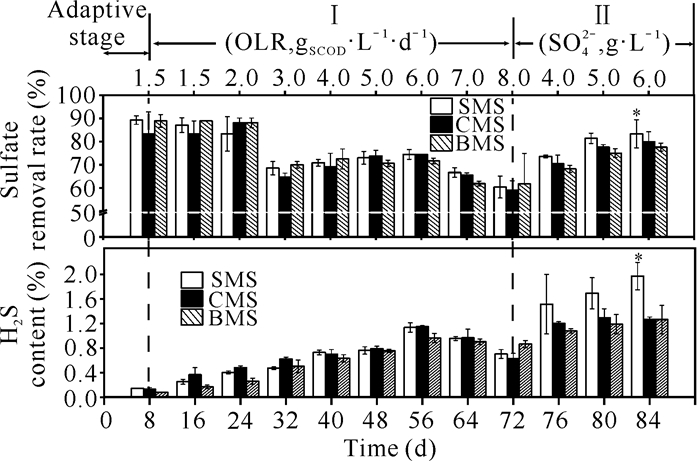
|
| * indicates P < 0.05 compared with other two groups at the same stage 图 4 厌氧消化过程中各个反应器硫酸盐去除率和H2S体积占比的变化 Fig. 4 Changes of sulfate removal rate and H2S volume ratio in each reactor during anaerobic digestion |
2.4 CH4体积占比的变化
适应期期间产生CH4,说明厌氧反应成功启动,各组CH4体积占比的变化如表 2所示。Ⅰ时期OLR=4.0 gSCOD·L-1·d-1阶段,SMS组、CMS组和BMS组的CH4体积占比达到最大,分别为(57.6±0.4)%、(59.3±0.5)%、(58.0±0.7)%。在OLR为6.0 gSCOD·L-1·d-1阶段,CMS组的CH4体积占比显著高于SMS组和BMS组(P<0.05),分别高出5.9%和4.5%,与SCOD去除率的效果相对应。Ⅱ时期,随着硫酸盐浓度的增加,CH4体积占比逐渐降低,但相比于其他两组,CMS组仍较高。
| 时期 Stage |
阶段性条件 Phase conditions |
CH4体积占比(%) CH4 volume ratio (%) |
||
| SMS | CMS | BMS | ||
| Adaptive stage | OLR=1.5 gSCOD·L-1·d-1 | 50.2±0.9 | 44.1±0.4 | 44.9±2.4 |
| Ⅰ | OLR=1.5 gSCOD·L-1·d-1 | 47.8±8.5 | 49.6±1.5 | 53.7±0.7 |
| OLR=2.0 gSCOD·L-1·d-1 | 50.6±1.4 | 50.9±1.2 | 51.4±0.9 | |
| OLR=3.0 gSCOD·L-1·d-1 | 54.1±0.1 | 54.0±2.6 | 52.5±0.8 | |
| OLR=4.0 gSCOD·L-1·d-1 | 57.6±0.4 | 59.3±0.5 | 58.0±0.7 | |
| OLR=5.0 gSCOD·L-1·d-1 | 42.7±0.7 | 45.0±0.5 | 43.8±0.4 | |
| OLR=6.0 gSCOD·L-1·d-1 | 48.1±0.4 | 54.0±0.7* | 49.5±4.4 | |
| OLR=7.0 gSCOD·L-1·d-1 | 41.5±0.1 | 42.5±1.4 | 41.2±1.9 | |
| OLR=8.0 gSCOD·L-1·d-1 | 47.3±3.5 | 49.9±3.1 | 49.5±4.4 | |
| Ⅱ | SO42-=4.0 g·L-1 | 39.8±0.3 | 41.6±0.4 | 37.7±0.6 |
| SO42-=5.0 g·L-1 | 38.0±0.8 | 39.9±0.2 | 36.5±1.6 | |
| SO42-=6.0 g·L-1 | 36.5±0.4 | 38.4±0.6 | 35.3±1.2 | |
| * indicates P<0.05 compared with other two groups at the same stage | ||||
2.5 微生物群落动态变化 2.5.1 微生物多样性
细菌和古细菌微生物群落多样性结果如表 3所示。无论是在细菌还是在古细菌水平上,在Ⅰ时期OLR为8.0 gSCOD·L-1·d-1阶段,SMS组的OTU个数、Shannon指数和Simpson指数均大于BMS组和CMS组,表明猪粪组在该条件下微生物多样性较为丰富。随着反应的进行,Ⅱ时期各组呈现不同的变化趋势,随着硫酸盐浓度的增加,SMS组细菌的OTU个数、Shannon指数和Simpson指数呈下降趋势。Ⅱ时期在硫酸盐浓度为6.0 g·L-1阶段时,CMS组细菌和古菌OTU个数、Shannon指数和Simpson指数达到最高值,推测硫酸盐浓度的增加,促进了微生物种类及数量的增加,使得CMS组OTU个数以及多样性指数最大。
| 时期 Stage |
阶段性条件 Phase conditions |
样品 Sample |
细菌Bacteria | 古细菌Archaea | |||||
| OTU | Shannon指数 Shannon index |
Simpson指数 Simpson index |
OTU | Shannon指数 Shannon index |
Simpson指数 Simpson index |
||||
| I | OLR=8.0 gSCOD·L-1·d-1 | SMS3 | 690 | 5.06 | 0.901 3 | 56 | 2.21 | 0.682 1 | |
| CMS3 | 565 | 4.21 | 0.839 4 | 46 | 1.66 | 0.586 9 | |||
| BMS3 | 617 | 4.73 | 0.897 2 | 44 | 1.49 | 0.558 9 | |||
| Ⅱ | SO42-=4.0 g·L-1 | SMS4 | 620 | 4.82 | 0.929 6 | 46 | 1.42 | 0.519 1 | |
| CMS4 | 601 | 4.72 | 0.910 0 | 46 | 1.15 | 0.428 5 | |||
| BMS4 | 590 | 4.83 | 0.928 9 | 46 | 1.32 | 0.529 9 | |||
| SO42-=5.0 g·L-1 | SMS5 | 612 | 4.79 | 0.927 2 | 45 | 1.36 | 0.555 1 | ||
| CMS5 | 528 | 4.44 | 0.908 0 | 47 | 1.23 | 0.513 8 | |||
| BMS5 | 593 | 4.85 | 0.933 5 | 46 | 1.29 | 0.535 1 | |||
| SO42-=6.0 g·L-1 | SMS6 | 584 | 4.75 | 0.926 4 | 41 | 1.50 | 0.593 1 | ||
| CMS6 | 605 | 4.78 | 0.927 2 | 55 | 1.58 | 0.567 1 | |||
| BMS6 | 577 | 4.74 | 0.930 1 | 50 | 1.28 | 0.518 2 | |||
2.5.2 细菌群落结构变化
各组在门水平和科水平上细菌的相对丰度如图 5所示。各组间优势物种大致相同,优势菌门以厚壁菌门(Firmicutes,15.6%-40.2%)、互养菌门(Synergistetes,9.0%-37.8%)以及拟杆菌门(Bacteroidetes,8.9%-29.6%)为主。随着厌氧消化的进行,各组在不同时期微生物群落结构明显,在Ⅰ时期OLR=8.0 gSCOD·L-1·d-1阶段,SMS3组和BMS3组的Synergistetes相对丰度最高。然而在Ⅱ时期,从整体上来看,SMS组和BMS组的Synergistaceae相对丰度随着硫酸盐浓度的增加逐渐降低,CMS组相对丰度上下波动,表明3组污泥的Synergistaceae受硫酸盐浓度影响较大。
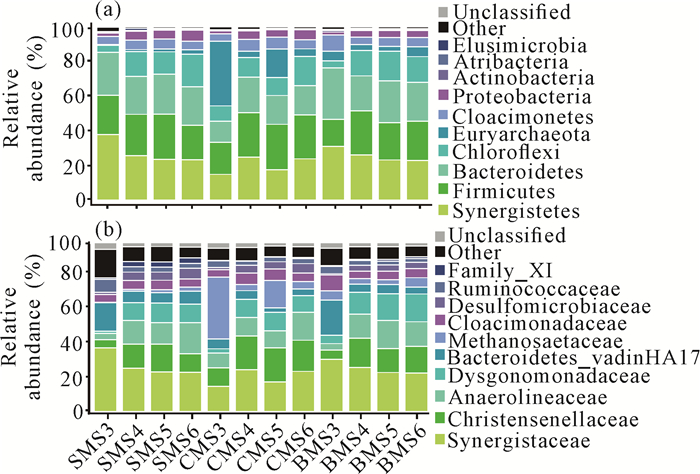
|
| 图 5 门水平(a)和科水平(b)上细菌的群落结构 Fig. 5 Community structure of bacteria at phylum level (a) and family level (b) |
属于厚壁菌门的克里斯滕森菌科(Christensenellaceae)在CMS组中为优势菌群,甚至在硫酸盐含量较高的阶段,丰度值仍保持在较高水平。同样发挥重要作用的还有属于Bacteroidetes的Dysgonomonadaceae,Ⅰ时期SMS3组、CMS3组和BMS3组的Dysgonomonadaceae相对丰度值分别为1.5%、2.5%和4.9%,而在Ⅱ时期SMS5组、CMS5组和BMS6组最大相对丰度值分别达到11.7%、11.0%和16.5%。与此同时,属于变形菌门(Proteobatcteria)的脱硫弧菌科(Desulfomicrobiaceae),与Ⅰ时期OLR=8.0 gSCOD·L-1·d-1阶段相比,各组相对丰度随着硫酸盐浓度的增加而增加,在硫酸盐浓度为6.0 g·L-1阶段各组相对丰度达到最高,SMS6组、CMS6组和BMS6组分别为6.4%、5.6%和3.7%。
2.5.3 古细菌群落结构变化各组在门水平和科水平上古细菌的相对丰度如图 6所示。在门水平上,广古菌门(Euryarchaeota)和泉古菌门(Crenarchaeota)为优势菌门。在科水平上,氢营养型甲烷杆菌科(Methanobacteriaceae)相对丰度值较低,其次是甲烷八叠球菌科(Methanosarcinaceae),表明两者受糖蜜酒精废水极端性质的影响较大。而在同样的厌氧消化条件下,甲烷鬃菌科(Methanosaetaceae)为主要的优势物种。与Ⅰ时期OLR=8.0 gSCOD·L-1·d-1阶段相比,Ⅱ时期各组Methanosaetaceae的相对丰度值较高,整体上以CMS组的Methanosaetaceae相对丰度值最高。
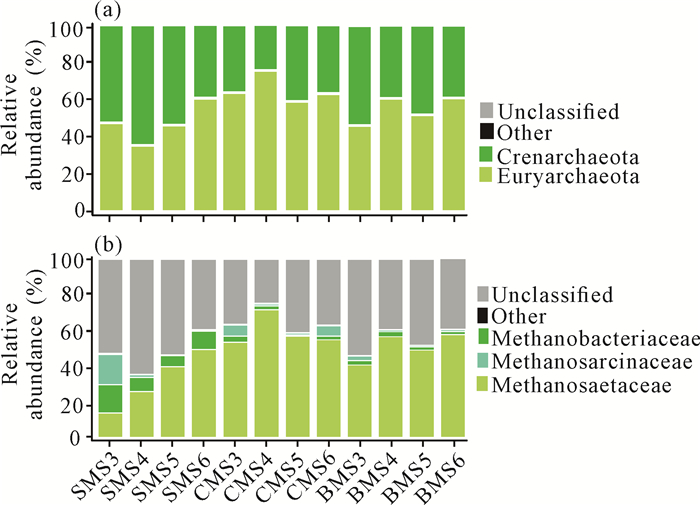
|
| 图 6 门水平(a)和科水平(b)上古细菌的群落结构 Fig. 6 Community structure of archaea at phylum level (a) and family level (b) |
3 讨论
本研究结果表明,各实验组SCOD去除率在适应期为55.0%-60.3%,这与Jiang等[16]和Lu等[17]的研究结果相似,表明利用动物粪便驯化后的污泥在启动初期SCOD去除率能迅速达到较高水平。随着Ⅰ时期糖蜜酒精废水的OLR不断增加,SCOD去除率增加幅度逐渐变小,而在Ⅱ时期各组的SCOD去除率呈下降趋势,抑制作用在硫酸盐浓度达到6.0 g·L-1阶段时表现最明显,且SMS组的SCOD去除率低于其他两组。同样在该阶段发生较大变化的还有H2S的体积占比和硫酸盐去除率,3组污泥H2S的体积占比和硫酸盐去除率均在Ⅱ时期硫酸盐浓度为6.0 g·L-1阶段达到最大值,且SMS组高于其他两组。据文献报道,积累的硫化物会穿过微生物细胞壁,导致细胞内部结构混乱,从而影响SRB和产甲烷菌(MPB)等微生物的正常生长,最终导致厌氧消化反应系统崩溃[18]。本研究发现,与SMS组和BMS组相比,CMS组的厌氧消化性能综合表现最好。据文献报道,鸡粪中的含氮量高于猪粪和牛粪,将富含N元素的动物粪便与富含C元素的糖蜜酒精废水置于厌氧共消化的条件下,可提高厌氧消化效率[19, 20]。
在高OLR和高浓度硫酸盐的糖蜜酒精废水的条件下,厌氧消化过程中微生物主要以Synergistetes、Firmicutes以及Bacteroidetes为优势菌门,这与Laconi等[21]和Zhang等[22]的研究结果类似。Ⅱ时期SMS组和BMS组的Synergistaceae相对丰度随着硫酸盐含量的增加而逐渐降低,且两组间出现了VFAs含量积累和CH4体积占比减少的现象。Synergistaceae是唯一来自Synergistetes的菌科,其主要作用是分解废水中的VFAs,促进氢营养型产甲烷菌利用分解底物生成CH4[23],高OLR和高浓度硫酸盐的厌氧环境影响了Synergistaceae发挥作用。属Firmicutes的Christensenellaceae在Ⅱ时期CMS组中相对丰度较高,且在该时期CMS组的SCOD去除率高于其他两组。Firmicutes中存在着许多可以分解有机物的酸水解微生物,通过分泌多种酶来水解蛋白质、脂肪和糖类等复杂物质[24],将复杂有机物进一步转化为SCOD,产生氢气和乙酸进而被产甲烷菌所利用,即使在OLR逐渐升高的环境中丰度值依旧最高[25, 26]。Christensenellaceae具有较强的碳水化合物、氨基酸和羧酸降解代谢活性,具有水解和产酸的作用[27, 28],这也是CMS组在高OLR和高浓度硫酸盐的糖蜜酒精废水条件下能保持较好的消化性能,呈现出较好厌氧消化效果的原因。发挥相似作用的还有Bacteroidetes[29, 30],与Ⅰ时期相比,Ⅱ时期属Bacteroidetes的Dysgonomonadaceae在3组污泥中的相对丰度较高。Murakami等[31]认为,Bacteroidetes在降解复杂结构的多糖反应中有促进水解的作用,可知硫酸盐浓度的增加对Dysgonomonadaceae有积极影响。与Ⅰ时期相比,Ⅱ时期3组污泥中Desulfomicrobiaceae的相对丰度增加,其中SMS组的相对丰度值大于其他两组, 且SMS组在该时期表现出SCOD去除率较低、VFAs含量相对较高以及厌氧消化效果较差。文献报道称,在高浓度硫酸盐废水的厌氧反应系统中,大量硫酸盐和多种有机硫作为SRB的底物,使得SRB富集,容易与产甲烷菌产生竞争[32]。
与其他厌氧消化研究结果中以Methanobacteriaceae、Methanosarcinaceae和Methanosaetaceae为主的古细菌群落结构[33]不同的是,本研究中Methanosaetaceae成为主要优势菌群,以CMS组相对丰度最高,且CMS组CH4在沼气中的体积占比同样高于其他两组。Methanosaetaceae是典型的乙酸营养型产甲烷菌,能利用乙酸并促进直接种间电子传递(DIET),将二氧化碳还原为CH4[34]。在本研究中Methanobacteriaceae相对丰度值最低,原因可能是在高OLR和高浓度硫酸盐的糖蜜酒精废水冲击条件下,氢营养型Methanobacteriaceae与SRB竞争氢的能力比其他两种产甲烷菌种类更小[35]。因此,优势菌科在高OLR和高浓度硫酸盐的冲击条件下进行水解、消化等过程,相应的功能及作用会受到影响,从而产生不利于消化反应的结果。
4 结论本研究表明,3种活性污泥受高OLR冲击影响明显,其中CMS组的SCOD去除率和CH4体积占比相对较高,累积VFAs含量较低。在高浓度硫酸盐冲击条件下,3组污泥的厌氧消化效果大幅度下降,其中SMS组受影响较大,CMS组受影响较小。微生物多样性结果表明,优势种群几乎不变,其中具有水解或产酸功能的Christensenellaceae和乙酸型产甲烷菌Methanosaetaceae在CMS组中富集。表明鸡粪与糖蜜酒精废水混合驯化的厌氧活性污泥抗逆性最好,为使用厌氧活性污泥处理工业废水提供了参考依据。
| [1] |
BASSO L C, DE AMORIM H V, DE OLIVEIRA A J, et al. Yeast selection for fuel ethanol production in Brazil[J]. Fems Yeast Research, 2008, 8: 1155-1163. DOI:10.1111/j.1567-1364.2008.00428.x |
| [2] |
KŁOSOWSKI G, MIKULSKI D, MACKO D, et al. Influence of various yeast strains and selected starchy raw materials on production of higher alcohols during the alcoholic fermentation process[J]. European Food Research and Technology, 2015, 240: 233-242. DOI:10.1007/s00217-014-2323-8 |
| [3] |
YAN X X, BILAD M R, GERARDS R, et al. Comparison of MBR performance and membrane cleaning in a single-stage activated sludge system and a two-stage anaerobic/aerobic (A/A) system for treating synthetic molasses wastewater[J]. Journal of Membrane Science, 2012, 394/395: 49-56. DOI:10.1016/j.memsci.2011.12.014 |
| [4] |
DUAN N, ZHANG D J, KHOSHNEVISAN B, et al. Human waste anaerobic digestion as a promising low-carbon strategy: operating performance, microbial dynamics and environmental footprint[J]. Journal of Cleaner Production, 2020, 256: 120414. DOI:10.1016/j.jclepro.2020.120414 |
| [5] |
VÁSQUEZ J, NAKASAKI K. Effects of acclimated sludge used as seeding material in the start-up of anaerobic digestion of glycerol[J]. Journal of Material Cycles and Waste Management, 2018, 20(1): 185-192. DOI:10.1007/s10163-016-0560-6 |
| [6] |
LIN C Y, JO C H. Hydrogen production from sucrose using an anaerobic sequencing batch reactor process[J]. Journal of Chemical Technology & Biotechnology, 2003, 78(6): 678-684. |
| [7] |
LIU J W, ZHANG X, XU J Y, et al. Anaerobic biodegradation of acetochlor by acclimated sludge and its anaerobic catabolic pathway[J]. Science of the Total Environment, 2020, 748: 141122. DOI:10.1016/j.scitotenv.2020.141122 |
| [8] |
JANECZKO A, OLESZKIEWICZ J A. Response of acclimated and un-acclimated activated sludge to 2-nitrophenol[J]. Environmental Technology, 1993, 14(4): 351-358. DOI:10.1080/09593339309385299 |
| [9] |
LI L, YANG X, LI X, et al. The influence of inoculum sources on anaerobic biogasification of NaOH-treated corn stover[J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2010, 33(2): 138-144. DOI:10.1080/15567030902937192 |
| [10] |
LI K, LIU R H, SUN C. Comparison of anaerobic digestion characteristics and kinetics of four livestock manures with different substrate concentrations[J]. Bioresource Technology, 2015, 198: 133-140. DOI:10.1016/j.biortech.2015.08.151 |
| [11] |
BOROWSKI S, DOMAŃSKI J, WEATHERLEY L. Anaerobic co-digestion of swine and poultry manure with municipal sewage sludge[J]. Waste Management, 2014, 34(2): 513-521. DOI:10.1016/j.wasman.2013.10.022 |
| [12] |
GENG Y C, ZHANG B, DU L Z, et al. Improving methane production during the anaerobic digestion of waste activated sludge: cao-ultrasonic pretreatment and using different seed sludges[J]. Procedia Environmental Sciences, 2016, 31: 743-752. DOI:10.1016/j.proenv.2016.02.062 |
| [13] |
肖利萍, 栾雪菲, 汪兵兵, 等. 新型碳源驯化SRB生长特性及处理酸性矿山废水研究[J]. 中国给水排水, 2017, 33(9): 40-44. DOI:10.19853/j.zgjsps.1000-4602.2017.09.008 |
| [14] |
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
|
| [15] |
LEI Z F, CHEN J Y, ZHANG Z Y, et al. Methane production from rice straw with acclimated anaerobic sludge: Effect of phosphate supplementation[J]. Bioresource Technology, 2010, 101(12): 4343-4348. DOI:10.1016/j.biortech.2010.01.083 |
| [16] |
JIANG Q, XIN Y, JIANG Y B, et al. Improving the efficiency of anaerobic digestion of molasses alcohol wastewater using cassava alcohol wastewater as a mixed feedstock[J]. Bioresource Technology, 2022, 344: 126179. DOI:10.1016/j.biortech.2021.126179 |
| [17] |
LU F Z, JIANG Q, QIAN F, et al. Semi-continuous feeding combined with traditional domestication improved anaerobic performance during treatment of cassava stillage[J]. Bioresource Technology, 2019, 291: 121807. DOI:10.1016/j.biortech.2019.121807 |
| [18] |
LU X Q, ZHEN G Y, NI J L, et al. Effect of influent COD/SO42- ratios on biodegradation behaviors of starch wastewater in an upflow anaerobic sludge blanket (UASB) reactor[J]. Bioresource Technology, 2016, 214: 175-183. DOI:10.1016/j.biortech.2016.04.100 |
| [19] |
FANG C, BOE K, ANGELIDAKI I. Anaerobic co-digestion of desugared molasses with cow manure; focusing on sodium and potassium inhibition[J]. Bioresource Technology, 2011, 102(2): 1005-1011. DOI:10.1016/j.biortech.2010.09.077 |
| [20] |
TANIMU M I, MOHD GHAZI T I, HARUN M R, et al. Effects of feedstock carbon to nitrogen ratio and organic loading on foaming potential in mesophilic food waste anaerobic digestion[J]. Applied Microbiology and Biotechnology, 2015, 99(10): 4509-4520. DOI:10.1007/s00253-015-6486-4 |
| [21] |
LACONI A, MUGHINI-GRAS L, TOLOSI R, et al. Microbial community composition and antimicrobial resistance in agricultural soils fertilized with livestock manure from conventional farming in Northern Italy[J]. Science of the Total Environment, 2021, 760: 143404. DOI:10.1016/j.scitotenv.2020.143404 |
| [22] |
ZHANG Q F, ZENG L Y, FU X, et al. Comparison of anaerobic co-digestion of pig manure and sludge at different mixing ratios at thermophilic and mesophilic temperatures[J]. Bioresource Technology, 2021, 337: 125425. DOI:10.1016/j.biortech.2021.125425 |
| [23] |
SI B C, LIU Z D, ZHANG Y H, et al. Towards biohythane production from biomass: influence of operational stage on anaerobic fermentation and microbial community[J]. International Journal of Hydrogen Energy, 2016, 41(7): 4429-4438. DOI:10.1016/j.ijhydene.2015.06.045 |
| [24] |
ZHAO X L, LIU J H, LIU J J, et al. Effect of ensiling and silage additives on biogas production and microbial community dynamics during anaerobic digestion of switchgrass[J]. Bioresource Technology, 2017, 241: 349-359. DOI:10.1016/j.biortech.2017.03.183 |
| [25] |
BELLO A, HAN Y, ZHU H F, et al. Microbial community composition, co-occurrence network pattern and nitrogen transformation genera response to biochar addition in cattle manure-maize straw composting[J]. Science of the Total Environment, 2020, 721: 137759. DOI:10.1016/j.scitotenv.2020.137759 |
| [26] |
TIAN W, SUN Q, XU D B, et al. Succession of bacterial communities during composting process as detected by 16S rRNA clone libraries analysis[J]. International Biodeterioration & Biodegradation, 2013, 78: 58-66. |
| [27] |
WU Y Y, WANG C P, LIU X J, et al. A new method of two-phase anaerobic digestion for fruit and vegetable waste treatment[J]. Bioresource Technology, 2016, 211: 16-23. DOI:10.1016/j.biortech.2016.03.050 |
| [28] |
MENG X Y, YUAN X F, REN J W, et al. Methane production and characteristics of the microbial community in a two-stage fixed-bed anaerobic reactor using molasses[J]. Bioresource Technology, 2017, 241: 1050-1059. DOI:10.1016/j.biortech.2017.05.181 |
| [29] |
LI D, YANG J W, LI Y, et al. Research on rapid cultivation of aerobic granular sludge (AGS) with different feast-famine strategies in continuous flow reactor and achieving high-level denitrification via utilization of soluble microbial product (SMP)[J]. Science of the Total Environment, 2021, 786: 147237. DOI:10.1016/j.scitotenv.2021.147237 |
| [30] |
YANG J, WANG D H, LUO Z F, et al. The role of reflux time in a leach bed reactor coupled with a methanogenic reactor for anaerobic digestion of pig manure: Reactor performance and microbial community[J]. Journal of Cleaner Production, 2020, 242: 118367. DOI:10.1016/j.jclepro.2019.118367 |
| [31] |
MURAKAMI T, SEGAWA T, TAKEUCHI N, et al. Metagenomic analyses highlight the symbiotic association between the glacier stonefly Andiperla willinki and its bacterial gut community[J]. Environmental Microbiology, 2018, 20(11): 4170-4183. DOI:10.1111/1462-2920.14420 |
| [32] |
KUMAR M, PAKSHIRAJAN K. Novel insights into mechanism of biometal recovery from wastewater by sulfate reduction and its application in pollutant removal[J]. Environmental Technology & Innovation, 2020, 17: 100542. |
| [33] |
LI D, RAN Y, CHEN L, et al. Instability diagnosis and syntrophic acetate oxidation during thermophilic digestion of vegetable waste[J]. Water Research, 2018, 139: 263-271. DOI:10.1016/j.watres.2018.04.019 |
| [34] |
ZHANG S, CHANG J L, LIN C, et al. Enhancement of methanogenesis via direct interspecies electron transfer between Geobacteraceae and Methanosaetaceae conducted by granular activated carbon[J]. Bioresource Technology, 2017, 245: 132-137. DOI:10.1016/j.biortech.2017.08.111 |
| [35] |
COLLERAN S, PENDER S. Mesophilic and thermophilic anaerobic digestion of sulphate-containing waste-waters[J]. Water Science & Technology, 2002, 45(10): 231-235. |



