2. 广西科学院,广西海洋天然产物与组合生物合成化学重点实验室,广西南宁 530007;
3. 广西科学院,国家非粮生物质能源工程技术研究中心,非粮生物质酶解国家重点实验室,广西生物炼制重点实验室,广西生物质工程技术研究中心,广西南宁 530007;
4. 广西医科大学生命科学研究院,广西南宁 530021
2. Guangxi Key Laboratory of Marine Nature Products and Combinatorial Biosynethesis Chemistry, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
3. National Engineering Research Center for Non-Food Biorefinery, State Key Laboratory of Non-Food Biomass and Enzyme Technology, Guangxi Key Laboratory of Bio-refinery, Guangxi Biomass Engineering Technology Research Center, Guangxi Academy of Sciences, Nanning, Guangxi, 530007, China;
4. Life Science Institute, Guangxi Medical University, Nanning, Guangxi, 530021, China
鼻咽癌(Nasopharyngeal Carcinoma, NPC)起源于鼻咽上皮,是中国南部高发的恶性肿瘤之一。目前,常见的鼻咽癌化疗药物有紫杉醇、顺铂、奈达铂、吉西他滨、多西他赛等,靶向治疗药物有贝伐珠单抗、西妥昔单抗、舒尼替尼等。上述药物对鼻咽癌细胞的控制虽然具有一定效果,但是均有不同程度的毒副作用,长期使用易产生耐药性,影响病人的治疗和康复。因此,寻找高效、低毒、有靶向性的抗癌药物成为现在亟待解决的问题。
广西红树林土壤富含作为微生物物质和能量来源的有机质,微生物资源丰富,而这些微生物为了适应高盐、低温、高湿度和强光照的极端红树林生境,进化出独特的代谢路径和产生具有生物学活性的物质[1]。迄今为止,已从广西红树林生境中分离得到多株新菌,其中包含3个新属和9个新种,分别属于变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)[2]。此外,广西红树林土壤来源的细菌已被证实具有多样的生物学活性。黎芳婷等[3]从广西3种红树植物及其根际土壤中分离得到4株具有抑制鱼类链球菌病的致病菌。李菲等[4-6]研究结果证实了广西红树林土壤、红树植物及其根际土壤来源的细菌能够分泌多种功能酶,生产具有抗血栓活性和抗植物病原菌活性的物质,并使用特殊引物扩增验证了15株内生菌株具有生产聚酮类和非核糖体肽类化合物的潜力。黄媛林等[7]通过活性筛选从一株广西红树林土壤来源的链霉菌MCCG 2008中分离得到一个已知的抗肿瘤化合物放线菌素D,该化合物能够杀死多种肿瘤细胞并已应用于临床治疗[8]。
前人对广西红树林土壤来源的细菌的研究主要集中在多样性分析、新种挖掘以及功能基因分析等,而对其所产活性化合物的报道较少。为从广西北海红树林土壤中筛选出能够产生抗鼻咽癌活性物质的可培养细菌,本研究拟使用鼻咽癌细胞株作为研究对象,采用细胞计数试剂盒(Cell Counting Kit-8, CCK8)法进行活性菌株的筛选,依据基因型和表型完成活性菌株的分类,应用活性测试追踪法和柱层析分离对其所产生的活性次生代谢产物进行分离纯化,评估活性化合物在体外对鼻咽癌细胞增殖的抑制能力,进一步扩展人们对广西红树林细菌活性化合物生产潜力的认知,为开发潜在的抗鼻咽癌药物提供结构模板。
1 材料与方法 1.1 材料 1.1.1 土壤样品样品为广西北海红树林保护区(108°31′25″ E,21°53′15″ N)距离桐花树根5 cm左右的土壤,样品采集后使用密封袋密闭保存,并于72 h内稀释涂布。
1.1.2 测试对象使用的鼻咽癌细胞株TW03和5-8F为广西医科大学鼻咽癌实验室长期保存。
1.1.3 培养基细菌分离培养基参照李菲等[9]的方法进行配置,具体配方如下。添加甘油的酪氨酸琼脂培养基:L-天门冬酰胺1.0 g,酪氨酸0.5 g,甘油10 mL,复合盐母液10 mL,去离子水1 000 mL,琼脂15.0 g,pH值7.2-7.4。淀粉葡萄糖琼脂培养基:可溶性淀粉10.0 g,葡萄糖1.0 g,甘油10 mL,复合盐母液10 mL,去离子水1 000 mL,琼脂15.0 g,pH值7.2-7.4。葡萄糖酪素琼脂培养基:葡萄糖10.0 g,水解酪素0.5 g,复合盐母液10 mL,去离子水1 000 mL,琼脂15.0 g,pH值7.2-7.4。燕麦培养基:粗燕麦粉20.0 g,复合盐母液10 mL,去离子水1 000 mL,琼脂15.0 g,pH值7.2-7.4。链霉菌琼脂培养基2号(ISP2):麦芽提取物2.0 g,葡萄糖2.0 g,酵母提取物2.0 g,去离子水1 000 mL,琼脂15.0 g,pH值7.2-7.4。复合盐母液:MgSO4·7H2O 0.5 g,KNO3 1.0 g,NaCl 0.5 g,K2HPO4 0.5 g,NH4NO3 0.1 g,FeSO4 0.01 g,MnCl2·4H2O 0.001 g,ZnSO4·7H2O 0.001 g,去离子水10 mL。
细菌保藏培养基:含30%(V∶V)甘油的ISP2液体培养基;Reasoner′s 2A (R2A)培养基。鼻咽癌细胞培养基:含10%胎牛血清(美国赛默飞世尔科技公司)以及1%青链霉素混合液(北京索莱宝科技有限公司)的高糖达尔伯克(氏)改良伊格尔(氏)培养基(DMEM, 美国赛默飞世尔科技公司)。
1.1.4 仪器与设备EVOQ液相色谱-质谱联用仪(德国Bruker公司),DD2核磁共振仪(美国安捷伦科技有限公司),LRH-150F生化培养箱(上海齐欣科学仪器有限公司),IS-RDV3立式恒温振荡器(苏州捷美电子有限公司),SW-CJ-2F洁净工作台(苏州佳宝净化工程设备有限公司),WGL-230B热电鼓风干燥箱(天津市泰斯特仪器有限公司),二氧化碳细胞培养箱(美国赛默飞世尔科技公司),Multiskan GO plate reader多功能酶标仪(美国赛默飞世尔科技公司)。
1.2 方法 1.2.1 可培养细菌的分离纯化将新鲜采集的土壤平铺于无菌培养皿中,放置于65℃鼓风干燥箱干燥30 min,称取2.0 g样品用20 mL无菌水稀释制成土壤悬浮液,随后经无菌水稀释获得10-2和10-3稀释度的样液。取200 μL的样液分别接种于5种细菌分离培养基中,并涂布均匀,28℃下恒温培养。待长出单菌落后,挑取菌落采用三区划线法纯化菌株,纯化好的菌株转移至含30% (V∶V)甘油的改良ISP2液体培养基冻存管中,于-80℃冷冻保藏。
1.2.2 筛选活性菌株分离纯化后的菌株分别接种于装有200 mL R2A液体培养基的三角瓶中,在180 r/min、28℃条件下振荡培养7 d。离心去除菌体,发酵上清液使用等体积的乙酸乙酯萃取3次后,减压浓缩获得发酵液粗提物。将粗提物溶解于二甲基亚砜(DMSO)并经无菌过滤器过滤制得1 mg/mL的无菌样液。分别取对数生长期的鼻咽癌细胞株TW03和5-8F,用新鲜DMEM培养基配置成5×104个/mL的细胞悬液后接种于96孔板中,每孔加入细胞悬液100 μL,于37℃、5% CO2培养箱中过夜培养,待细胞贴壁后每孔加入样液1 μL,同时取1 μL DMSO和1 mg/mL多柔比星分别作为阴性和阳性对照。96孔板在37℃ CO2培养箱中孵育24 h后,每孔加入10 μL细胞计数试剂盒(Cell Counting Kit-8, CCK8)溶液,再继续反应1.5 h,使用多功能酶标仪在450 nm处测量吸光值,细胞活力=(OD实验组-OD空白)/(OD对照组-OD空白)×100%。每个样品重复3次。
1.2.3 菌株的分类鉴定使用Chelex-100树脂法提取细菌DNA[10],参照李菲等[11]的方法进行PCR扩增,各基因扩增所需引物见表 1。PCR产物经1.0%琼脂糖凝胶电泳检测合格后,委托北京擎科新业生物技术有限公司进行测序分析,所得序列使用Contigexpress拼接后获得完整的16S rRNA、atpD和rpoB基因序列。为了寻找系统发育关系相近的菌株,将菌株的16S rRNA、atpD和rpoB基因序列以及16S rRNA+atpD+rpoB多基因序列提交至EzBiocloud server[12]和BLAST平台进行匹配比对。选取有效基因序列在MEGA 7.0[13]软件中使用最大似然(Maximum-likelihood)法或邻接(Neighbor-joining)法构建系统发育树,各分支置信值设为1 000次。
1.2.4 菌株的形态学与生理生化鉴定
将菌株接种于ISP2固体培养基上,28℃恒温培养7 d,观察并记录菌体形态特征。参照《链霉菌鉴定手册》[15]和《放线菌的分类和鉴定》[16]中的方法,使用GEN Ⅲ MicroPlateTM测试板检测菌株的碳源利用情况。参考张纪忠等[17]的方法对菌株进行硝酸盐还原、明胶液化、葡萄糖分解实验、产H2S及产酸能力的测试。
1.2.5 活性化合物的分离纯化和结构鉴定将10 mL活性菌株种子液接种至1 L的燕麦液体培养基中,共发酵10 L,在180 r/min、28℃条件下振荡培养7 d。离心去除菌体,发酵上清液使用等体积的乙酸乙酯萃取3次,有机相浓缩干燥后得到发酵液粗提物(125.6 mg)。使用2.5 mL甲醇溶解粗提物后经硅胶柱层析分离,柱层析硅胶为100-200目,以乙酸乙酯∶甲醇(90∶1→0∶100)梯度洗脱,经薄层色谱(Thin Layer Chromatography, TLC)法检识,合并相同组分,共得到19个洗脱组分,即Fr.1-Fr.19。各组分经旋转蒸发浓缩后用DMSO溶解并经0.22 μm无菌微孔滤膜过滤制备样品。使用CCK8法检测各组分的活性,得到具有较强体外细胞毒性的组分,随后使用核磁共振仪分析活性化合物的结构。
1.2.6 活性化合物的抗肿瘤活性评估活性化合物使用DMSO溶解,含肿瘤细胞的96孔板制备及活性检测方法参照1.2.2节,其中活性化合物的浓度梯度设置为0-16.9 μmol/L,以分析其对鼻咽癌细胞株TW03和5-8F的半抑制浓度(Half Inhibitory Concentration, IC50)。
2 结果与分析 2.1 活性菌株的系统发育分析菌株的16S rRNA基因序列长度为1 341 bp,与已知的卡伍尔氏链霉菌Streptomyces cavourensis NBRC 13026T的16S rRNA基因序列具有99.0%的相似性,而与其他链霉菌的相似性均低于98.8%,因此判定该菌株隶属于链霉菌属。由图 1和图 2可知,在以16S rRNA基于最大似然法和多基因序列(16S rRNA+atpD+rpoB)基于邻接法构建的系统发育树中,菌株MCCG 218与链霉菌属的其他菌株聚集在一起,进一步验证了该菌属于链霉菌属,命名为Streptomyces sp.MCCG 218。
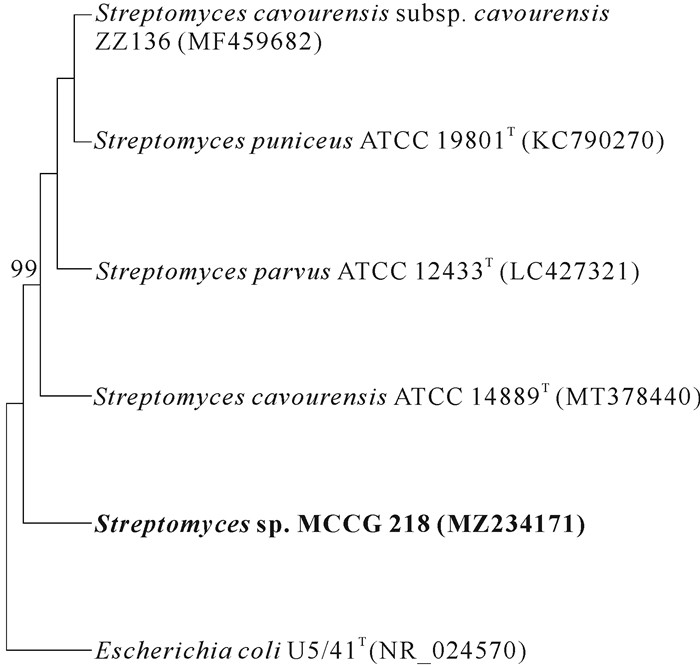
|
| 图 1 菌株MCCG 218基于16S rRNA基因序列的最大似然法系统发育关系分析 Fig. 1 Phylogenetic relationship analysis of strain MCCG 218 based on 16S rRNA gene sequence by maximum likelihood method |
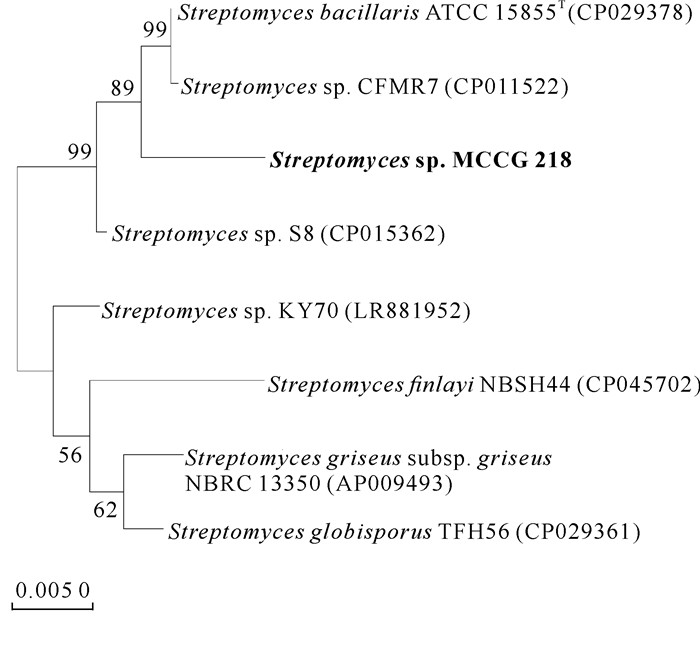
|
| 图 2 菌株MCCG 218基于多序列位点的邻近系统发育关系分析 Fig. 2 Phylogenetic relationship analysis of adjacent system of strain MCCG 218 based on multiple sequence sites |
2.2 菌株MCCG 218的形态和生理生化分析
菌株MCCG 218在改良的ISP2固体培养基上培养5 d后,呈现出与链霉菌相似的形态特征,菌落小而致密,幼时表面光滑、边缘整齐、不易挑起,继而发展成绒毛状,形成浅黄色、圆形的菌落(图 3)。生理生化特征测试表明,菌株MCCG 218能产生H2S,不能分解葡萄糖和液化明胶。菌株MCCG 218能利用果胶、L-乳酸、3-甲酰葡萄糖、D-果糖、L-组胺、黏液酸、乙酸、D-苹果酸、奎宁酸、L-苹果酸、D-甘露醇、β-甲酰-D-葡糖苷、N-乙酰-D-半乳糖胺、D-阿拉伯醇、D-乳酸甲酯、糖质酸、溴-丁二酸、糖质酸、溴-丁二酸和L-焦谷氨酸等作为碳源,其碳源利用能力与其最近亲缘菌株S.cavourensis NBRC 13026T相似,都能利用果糖和葡萄糖作为碳源,但菌株MCCG 218不能分解甘油,而S.cavourensis NBRC 13026T能利用甘油作为碳源。
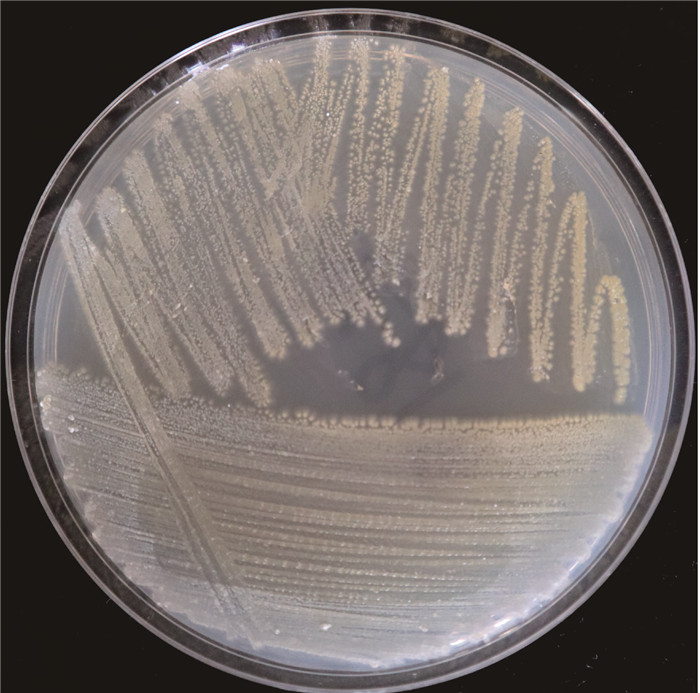
|
| 图 3 菌株MCCG 218在改良的ISP2固体培养基上的菌落形态 Fig. 3 Colony morphology of strain MCCG 218 on the modified ISP2 solid culture medium |
2.3 活性化合物的结构分析
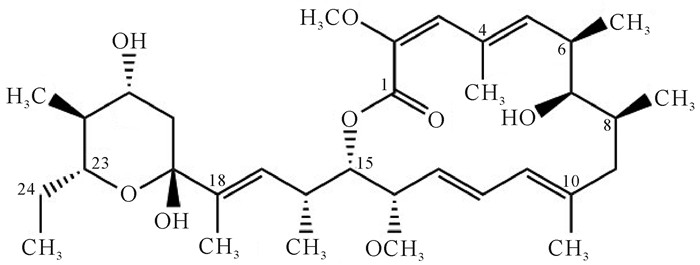
活性化合物使用甲醇溶解后经800 MHz核磁共振波谱检测,其核磁共振1H化学位移如表 2所示。化合物1的同核位移相关谱中,H-12(δH 6.43)、H-11(δH 5.91)和H-13(δH 5.34)显现出相关性, 推测其结构中含有共轭烯烃(图 4)。这些特征谱峰与已知的巴弗洛霉素A1的核磁图谱相似[18]。然而化合物1的1H-NMR图谱比已知巴弗洛霉素A1的图谱多了一个位于δH 6.06(J=10.7 Hz)的双峰,并在COSY谱中显示出了与δH 2.82(m)的相关性,推测巴弗洛霉素A1中的羟基发生了还原反应生成了一个烯基。化合物1的H-24(δH 1.88, 1.26)在COSY谱中仅与CH3-25(δH 0.85)相关,推断为24位的亚甲基可能仅与一个甲基相连。这些特征峰显示了化合物1与巴弗洛霉素A1的差异性,但与已知的巴弗洛霉素A1衍生物(17, 18-dehydro-19, 21-di-O-methyl-24-demethyl-bafilomycin A1)一致[19],然而在该化合物的核磁共振氢谱图中仅出现2个甲氧基的单峰(δH 3.70和δH 3.23),因此推测该化合物应为无19和21位甲氧基取代的巴弗洛霉素A1衍生物(17, 18-dehydro-24-demethyl-bafilomycin A1)。经HRESI-MS分析显示化合物1 m/z 591.3101 [M+H]+, 表明该化合物的分子量为590,而巴弗洛霉素A1 (C35H58O9)的分子量为622.83,进一步验证了化合物1为巴弗洛霉素A1衍生物C34H54O8(图 5)。
| 序号No. | δH (J in Hz) | 序号No. | δH (J in Hz) | |
| 1 | - | 18 | - | |
| 2 | - | 19 | - | |
| 3 | 6.76(s) | 20 | 2.21 (m) | |
| 4 | - | 21 | 3.66 (m) | |
| 5 | 5.87 (d, 9.1) | 22 | 1.69 (m) | |
| 6 | 2.47 (m) | 23 | 3.48 (m) | |
| 7 | 3.48 (m) | 24 | 1.88, 1.26 (m) | |
| 8 | 1.86 (m) | 25 | 0.85 (t, 7.2) | |
| 9 | 2.37 (m) | 2-CH3O | 3.70 (s) | |
| 10 | - | 4-CH3 | 1.97 (s) | |
| 11 | 5.91 (d, 11.2) | 6-CH3 | 1.07 (d, 7.2) | |
| 12 | 6.43 (m) | 8-CH3 | 1.03 (d, 7.04) | |
| 13 | 5.34 (m) | 10-CH3 | 1.65 (s) | |
| 14 | 3.81 | 14-CH3O | 3.23 (s) | |
| 15 | 4.97 (m) | 16-CH3 | 0.99 (d, 6.9) | |
| 16 | 2.82 (m) | 18-CH3 | 1.79 (s) | |
| 17 | 6.06 (d, 10.7) | 22-CH3 | 0.96 (d, 6.6) | |
| Note: "-" indicates no data | ||||
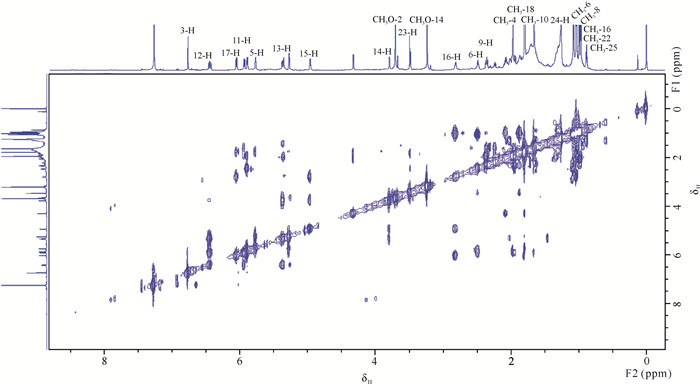
|
| 图 4 化合物1的同核位移相关核磁图(COSY, CD3OD) Fig. 4 Homonuclear displacement-related nuclear magnetic diagram of compound 1 derivative (COSY, CD3OD) |
|
| 图 5 化合物1的化学结构 Fig. 5 Chemical structure of compound 1 derivative |
2.4 活性化合物的抗肿瘤活性
活性化合物使用DMSO溶解后制成不同浓度的样液,经CCK8法检测发现巴弗洛霉素A1衍生物对鼻咽癌细胞株TW03和5-8F表现出较强的细胞毒性,IC50值分别为2.7 μmol/L和9.2 μmol/L。
3 讨论在过去的20多年里,多个研究小组从红树林来源的微生物中分离得到超过1 000种活性化合物,其中有10%来源于细菌,因此红树林微生物也被认为是理想的药源菌[20]。本研究从广西北海红树林土壤中分离筛选得到一株能够产生体外抗鼻咽癌活性化合物的细菌MCCG 218,经以16S rRNA、atpD和rpoB基因序列开展的系统发育分析发现该菌归属于链霉菌属,命名为Streptomyces sp.MCCG 218。基于16S rRNA基因序列的比对发现,该菌株与卡伍尔氏链霉菌S.cavourensis NBRC 13026T具有最近的亲缘关系,已知的卡伍尔氏链霉菌基因组中包含生产多种广谱抗菌化合物的生物合成基因簇,如巴弗洛霉素D、Nonactic acid和Prelactone B等[21]。目前有多个课题组已从卡伍尔氏链霉菌的发酵液中分离得到多个具有抗肿瘤活性和广谱抗菌活性的化合物[22],如巴弗洛霉素B1、巴弗洛霉素C1、巴弗洛霉素D、二酮吡嗪类化合物、无活菌素(Nonactin)、单活菌素(Monactin)和二活菌素(Dinactin)等,推测与其具有高亲缘性的菌株MCCG 218可能也具有生产这些活性次生代谢产物的能力。本研究通过化学分离和活性测试追踪法从菌株MCCG 218的发酵液中分离得到一个活性化合物,经核磁和质谱检测发现该活性化合物为巴弗洛霉素A1衍生物,该化合物的发现证实了MCCG 218与其亲属菌株卡伍尔氏链霉菌都具有生产巴弗洛霉素化合物的能力。
巴弗洛霉素是一类含有16元环骨架的多烯大环内酯类抗生素,迄今已有30多种巴弗洛霉素从链霉菌和北里孢菌(Kitasatospora)中分离得到[23],该类化合物已被证实具有抗细菌、抗真菌、抗肿瘤、抗病毒和抗骨质疏松等活性[24],但其抗鼻咽癌活性还未见报道。本研究明确了巴弗洛霉素A1衍生物对鼻咽癌细胞株TW03和5-8F的细胞毒性,其IC50值分别为2.7 μmol/L和9.2 μmol/L。虽然该类化合物有巨大的临床应用潜力,但是其结构中包含多个手性中心和相似的官能团,化学合成路径烦琐,难以通过化学手段进行大规模生产[25]。而目前已报道的巴弗洛霉素生产菌都存在产量低且发酵生产成本高的缺点,不能满足工业化和研究的需求。巴弗洛霉素生产菌MCCG 218的发现,为研究巴弗洛霉素生物合成相关基因的多样性提供了材料,为进一步调控和优化巴弗洛霉素的生物合成以及鼻咽癌治疗药物的研发奠定了基础。
4 结论红树林孕育了多种新型微生物和植物,是生物活性天然产物的丰富来源。本研究从广西红树林土壤中分离得到一株能够生产具有体外抗鼻咽癌活性物质的链霉菌MCCG 218,并证明了该活性物质为巴弗洛霉素A1衍生物。鉴于巴弗洛霉素的广谱抗菌性和较强的细胞毒性,该活性化合物的发现有望为鼻咽癌治疗药物的研发提供参考和模板。
| [1] |
GOPAL B, CHAUHAN M. Biodiversity and its conservation in the Sundarban Mangrove ecosystem[J]. Aquatic Sciences, 2006, 68(3): 338-354. DOI:10.1007/s00027-006-0868-8 |
| [2] |
PARTE A C, CARBASSE J S, MEIER-KOLTHOFF J P, et al. List of Prokaryotic names with Standing in Nomenclature (LPSN) moves to the DSMZ[J]. International Journal of Systematic and Evolutionary Microbiology, 2020, 70(11): 5607-5612. DOI:10.1099/ijsem.0.004332 |
| [3] |
黎芳婷, 李蜜, 徐淑芬, 等. 广西三种真红树植物可培养细菌多样性及其生物活性初筛[J]. 广西植物, 2022, 42(8): 1294-1303. |
| [4] |
李菲, 李喆, 胡文进, 等. 广西茅尾海红树林土壤放线菌多样性及功能酶活性研究[J]. 海洋学报, 2021, 43(2): 88-97. |
| [5] |
李菲, 黄庶识, 胡文进, 等. 桐花树内生和根际细菌多样性及抗血栓活性研究[J]. 广西植物, 2020, 40(3): 335-344. |
| [6] |
李菲, 黄庶识, 胡文进, 等. 半红树植物海芒果内生与根际细菌多样性及抗农用真菌活性研究[J]. 中国抗生素杂志, 2021, 46(5): 396-405. DOI:10.3969/j.issn.1001-8689.2021.05.006 |
| [7] |
黄媛林, 潘信利, 陆璐, 等. 一株红树林链霉菌所产抑菌活性化合物的分离及其生物合成基因簇的研究[J]. 中国抗生素杂志, 2021, 46(12): 1090-1101. DOI:10.3969/j.issn.1001-8689.2021.12.004 |
| [8] |
LIU X F, XIANG L M, ZHOU Q, et al. Actinomycin D enhances killing of cancer cells by immunotoxin RG7787 through activation of the extrinsic pathway of apoptosis[J]. Proceedings of the National Academy of Sciences, 2016, 113(38): 10666-10671. DOI:10.1073/pnas.1611481113 |
| [9] |
李菲, 李喆, 黄媛林, 等. 角果木树皮来源放线菌多样性及生物活性初探[J]. 中国抗生素杂志, 2021, 46(9): 845-853. DOI:10.3969/j.issn.1001-8689.2021.09.005 |
| [10] |
周双清, 黄小龙, 黄东益, 等. Chelex-100快速提取放线菌DNA作为PCR扩增模板[J]. 生物技术通报, 2010(2): 123-125. |
| [11] |
李菲, 高程海, 余炼, 等. 川蔓藻内生及根际细菌多样性与抑菌活性研究[J]. 广西植物, 2018, 38(7): 924-933. |
| [12] |
YOON S H, HA S M, KWON S, et al. Introducing EzBioCloud: A taxonomically united database of 16S rRNA gene sequences and whole-genome assemblies[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(5): 1613-1617. |
| [13] |
KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology & Evolution, 2016, 33(7): 1870-1874. |
| [14] |
郭银平, 黄英. 链霉菌看家基因引物的设计与验证[J]. 微生物学, 2007, 47(6): 1080-1083. |
| [15] |
中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975.
|
| [16] |
阎逊初. 放线菌的分类和鉴定[M]. 北京: 科学出版社, 1992.
|
| [17] |
张纪忠, 黄静娟, 徐德强, 等. 嗜盐杆菌属一新种[J]. 微生物学报, 1990, 30(2): 87-93. |
| [18] |
KLEINBECK F, FETTES G J, FADER L D, et al. Total synthesis of bafilomycin A1[J]. Chemistry, 2012, 18(12): 3598-3610. |
| [19] |
LI J, LU C H, SHEN Y M. Macrolides of the bafilomycin family produced by Streptomyces sp.CS[J]. The Journal of Antibiotics, 2010, 63(10): 595-599. |
| [20] |
ANCHEEVA E, DALETOS G, PROKSCH P. Lead compounds from mangrove-associated microorganisms[J]. Marine Drugs, 2018, 16(9): 319. |
| [21] |
NGUYEN H Q, VU N T, CHU H H, et al. Draft genome sequence of Streptomyces cavourensis YBQ59, an endophytic producer of antibiotics Bafilomycin D, Nonactic Acid, Prelactone B, and 5, 11-epoxy-10-cadinanol[J]. Microbiology Resource Announcements, 2018, 7(11): e01056-18. |
| [22] |
VU H T, NGUYEN D T, NGUYEN H Q, et al. Antimicrobial and cytotoxic properties of bioactive metabolites produced by Streptomyces cavourensis YBQ59 isolated from Cinnamomum cassia Prels in Yen Bai Province of Vietnam[J]. Current Microbiology, 2018, 75(10): 1247-1255. |
| [23] |
BOWMAN E J, SIEBERS A, ALTENDORF K. Bafilomycins: A class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells[J]. Proceedings of the National Academy of Sciences, 1988, 85(21): 7972-7976. |
| [24] |
XIE X, LU S S, PAN X Y, et al. Antiviral bafilomycins from a feces-inhabiting Streptomyces sp.[J]. Journal of Natural Products, 2021, 84(2): 537-543. |
| [25] |
SCHEIDT K A, BANNISTER T D, TASAKA A, et al. Total synthesis of (-)-bafilomycin A(1)[J]. Journal of the American Chemical Society, 2002, 124(24): 6981-6990. |



