2. 湖北省农业科学研究院,湖北省生物农药工程研究中心,湖北武汉 430064
2. Hubei Biopesticide Engineering Research Center, Hubei Academy of Agricultural Sciences, Wuhan, Hubei, 430064, China
海洋微生物是海洋天然产物的主要来源,海洋来源的真菌逐渐成为发现活性代谢产物的重要目标之一,具有潜在的治疗应用前景。其中丝状真菌因其庞大的元基因组和复杂的遗传背景,成为具有生物活性天然产物的重要来源[1]。与陆生真菌相比,海洋真菌在高压、低温、有限光照和缺乏营养的极端海洋环境中可以产生更多新的次生代谢产物。近年来,已经陆续从海洋来源青霉属(Pencillium)真菌中分离出结构新颖且活性良好的次生代谢产物,具有抑制酶活性[2]、抑菌[3]、抑制氧自由基[4]等功效。因此,青霉菌在药物开发中起着至关重要的作用。
橘青霉(Penicillium citrinum)是一种具有广谱抗菌活性的真菌,其粗提物对人类致病菌嗜水气单胞杆菌(Aeromonas hydrophila)、大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、粪肠球菌(Enterococcus faecalis)、须毛癣菌(Trichophyton mentagrophytes)和白色念珠菌(Candida albicans)均有抑制作用[5, 6],为产生具有生物活性的化合物提供了新的思路。橘青霉次生代谢产物中的橘霉素二聚体衍生物penicitol D和1-epi-citrinin H1具有抗耐甲氧西林金黄色葡萄球菌活性[7],penicitrinone A对乳腺癌细胞MCF-7具有细胞毒作用[8],能抑制黑色素瘤细胞A-375增殖和转移[9],且具有抑制乳腺癌细胞迁移和增殖的作用[10]。
此前,本课题组已从海藻内生真菌Penicillium citrinum SCSIO41402中发现了两个新的化合物Sorbicillfurans A和Sorbicillfurans B,这两个化合物是含双环[2.2.2]辛烷和四氢呋喃结构的山梨素加合物,其中Sorbicillfurans B对人白血病细胞系HL-60有细胞毒作用[11]。为进一步研究该菌株的活性次生代谢产物,本研究对其进行扩大发酵培养及运用色谱、光谱技术对发酵液的乙酸乙酯提取物进行分离纯化,并对所获单体化合物进行抗神经炎症活性、抗菌活性和细胞毒活性测试,从中筛选出活性成分,旨在发现新颖的活性天然产物,为天然产物的研究和开发提供理论基础。
1 材料与方法 1.1 材料 1.1.1 菌株来源腔节藻属(Coelarthroum)海藻采集于南海永兴岛(16°50′ N,112°20′ E)的珊瑚礁,从中分离得到真菌菌株SCSIO41402,根据菌株的形态特征和ITS序列区域,将其鉴定为Penicillium citrinum,该信息已保存于GenBank数据库中,登录号为MK988578。该菌株在MB琼脂培养基(麦芽提取物15 g,人造海盐24.4 g,琼脂15 g,蒸馏水1 L,pH值7.4-7.8)斜面上4℃保存,存放于中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室。
1.1.2 试剂RPMI-1640(Hyclone,SH30809.01B);DMEM培养基(Hyclone,SH30243.01B);胎牛血清(Hyclone;SH30084.03);PBS(Life,C10010500BT);MTT(Sigma,M5655-1G);LPS(Sigma,L2630-10 mg);Donepezil(MCE,HY-14566);Sunfire C18 OBD色谱柱(美国Waters公司);柱色谱用硅胶(200-300目,青岛海洋化工有限公司);Sephadex LH-20凝胶(GE Healthcare Bio-Sciences AB,瑞士);制备级乙腈(湖北弗顿生化科技有限公司);LC-MS级乙腈和甲醇(美国飞世尔科学世界公司);其他试剂均为分析纯(国药集团化学试剂有限公司)。
1.1.3 仪器与设备Centrifuge离心机(德国Eppendorf公司);HGC-36A氮吹仪(天津市恒奥科技发展有限公司);Rotavapor R-200旋转蒸发仪(瑞士BUCHI公司);Bruker AVANCE核磁共振仪(德国Brucker BioSpin公司);Waters 2695超高压液质联用色谱仪(美国Waters公司);Waters 2767制备型高效液相色谱仪(美国Waters公司);MicroBeta2全功能微孔板检测仪(美国PerkinElmer公司);Neofuge 15R冷冻离心机[力新仪器(上海)有限公司];HF160W水套式CO2培养箱[力新仪器(上海)有限公司];IX71倒置相差显微镜(日本Olympus公司)。
1.2 方法 1.2.1 发酵与提取从PDA培养基(马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L)斜面挑取菌株Penicillium citrinum SCSIO41402,接种于100 mL PDB培养基(马铃薯200 g/L,葡萄糖20 g/L),置于恒温摇床上150 r/min、28℃振荡培养2 d,按照5%的接种量转接于发酵培养基(麦芽糖6.25 g/L,麦芽提取物6.25 g/L,酵母提取物1 g/L,蛋白胨0.625 g/L,磷酸二氢钾1.25 g/L,硫酸镁0.625 g/L,琼脂0.3 g/L),28℃静置培养7 d发酵。发酵液中加入等体积的乙酸乙酯进行萃取,提取液40℃减压浓缩,浓缩后获得提取物(2.8 g)。
1.2.2 分离与纯化粗提物经葡聚糖凝胶LH-20柱层析分离,用100%甲醇洗脱,合并相同部分得到6个组分(Fr.A-F)。将Fr.F溶于甲醇后,通过制备型高效液相色谱HPLC以24 mL/min的流速,乙腈-0.2%乙酸水(10%-50%-100%)梯度洗脱得到化合物1 (1.2 mg)。Fr.C经正相硅胶柱层析,以石油醚-乙酸乙酯体积比(10∶1,5∶1,3∶1,2∶1,1∶1,0∶1)梯度洗脱得到8个组分(sFr.C1-C8)。sFr.C1通过制备型HPLC,经OBD柱以乙腈-水(25%-100%)洗脱得到化合物2 (6.22 mg);sFr.C7通过制备型HPLC,经OBD柱以乙腈-水(10%-100%)梯度洗脱分离化合物3 (1.19 mg);sFr.C2通过制备型HPLC,经OBD柱以乙腈-水(25%-100%)梯度洗脱得到化合物4 (4.93 mg);sFr.C4用制备型HPLC,经C18柱以乙腈-水(20%-100%)洗脱分离得到化合物5 (2.2 mg);sFr.C8通过制备型HPLC,经OBD柱以乙腈-水(20%-80%)溶剂梯度洗脱得到化合物6 (1.18 mg)和化合物7 (1.85 mg)。
1.2.3 活性筛选(1) 抗神经炎症活性。
体外培养BV-2小胶质细胞,建立脂多糖(Lipopolysaccharide,LPS)诱导的神经炎症细胞模型。实验组以化合物浓度分别为3 μg/mL、6 μg/mL、12 μg/mL给药处理,以20 μg/mL多奈哌齐作阳性对照,采用噻唑蓝(MTT)法[12]检测细胞存活率。将BV-2细胞悬液以1×104 个/mL的密度接种于96孔板,于37℃培养箱中培养。待细胞贴壁,每孔加入200 μL不同浓度样品预处理4 h,然后加入2 μg/mL LPS处理24 h,再加入20 μL 5 mg/mL的MTT溶液处理4 h,于37℃培养箱中培养,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min至结晶完全溶解后,用酶标仪于490 nm波长处测定吸光度值(OD值)。
(2) 抗菌活性。
化合物在96孔灭菌板上进行抗菌实验,并用微孔稀释法[13]测定最小抑菌浓度(Minimum Inhibitory Concentration,MIC)。将受试化合物溶解于DMSO中,采用二倍串联稀释法将化合物稀释到指定浓度,DMSO的最终浓度不超过5%。病原菌包括动物病原细菌(绿脓杆菌Pseudomonas aeruginosa、大肠杆菌Escherichia coli、金黄色葡萄球菌Staphylococcus aureus、猪丹毒杆菌Erysipelas suis和猪链球菌Streptococcus suis)和植物病原真菌(灰霉菌Botrytis cinerea、小麦颖枯病菌Septoria nodorum、小麦叶枯病菌S.tritici、棉花黄萎病菌Verticilium dahliae)。抑菌活性测定以接种培养液和DMSO作为阴性对照,链霉素和头孢匹罗作为阳性对照。真菌于28℃培养48 h,细菌于37℃培养24 h,观察病原菌的生长状况。
(3) 细胞毒活性。
采用MTT法测定化合物1 - 7对非洲绿猴胚胎肾细胞Marc-145细胞的抗增殖活性,以5-氟尿嘧啶作阳性对照[12]。
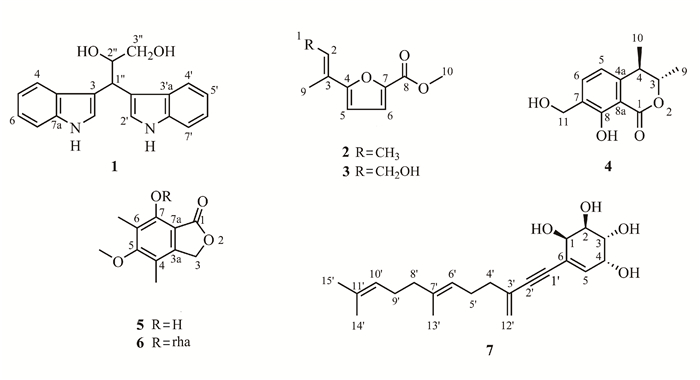
2 结果与分析 2.1 结构鉴定化合物1:黄色油状(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C19H18N2O2。1H-NMR(700 MHz,CD3OD)δ:7.56(2H,ddt,J=7.6,6.46,0.98,H-4,4′),7.30(3H,m,H-7,5′,7′),7.15(1H,s,H-5),7.03(2H,m,H-6, 6′),6.91(2H,m,H-2,2′),4.70(1H,d,J=6.7,H-1″),4.49(1H,td,J=7.0,4.04,H-2″), 3.62(1H,dd,J=11.2,4.2,H-3″),3.49(1H,dd,J=11.2,7.0,H-3′);13C-NMR(175 MHz,CD3OD)δ:124.1(C-2),118.0(C-3),129.3(C-3a),119.4(C-4),122.1(C-5),120.2(C-6),112.1(C-7),138.1(C-7a),123.9(C-2′),116.5(C-3′),128.4(C-3′a),119.3(C-4′),122.0(C-5′),120.0(C-6′),138.0(C-7′a),38.1(C-1″),76.4(C-2″),66.4(C-3″)。以上核磁数据与文献[14]报道基本一致,故鉴定化合物1为3, 3-二吲哚烷基-1, 2-丙二醇。
化合物2:淡黄色无定形固体(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C10H12O3。1H-NMR(500 MHz,CD3OD)δ:1.85(3H,d,J=7.0,H-1),6.62(1H,m,H-2),6.12(1H,d,J=2.0,H-5),5.56(1H,d,J=2.0,H-6),1.87(3H,s,H-9),3.86(3H,s,H-10);13C-NMR(125 MHz,CD3OD)δ:14.3(C-1),131.0(C-2),128.3(C-3),162.7(C-4),98.9(C-5),88.6(C-6),167.0(C-7),174.1(C-8),12.1(C-9),57.0(C-10)。以上核磁数据与文献[15]报道基本一致,故鉴定化合物2为robillafuran。
化合物3:白色粉末(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C10H12O4。1H-NMR(500 MHz,CD3OD)δ:4.31(2H,d,J=6.0,H-1),6.59(1H,td,J=6.0,0.5,H-2),6.21(1H,d,J=2.0,H-5),5.60(1H,d,J=2.0,H-6),1.89(3H,d,J=1.0,H-9),3.86(3H,s,H-10);13C-NMR(125 MHz,CD3OD)δ:59.6(C-1),135.0(C-2),128.1(C-3),161.9(C-4),100.0(C-5),89.2(C-6),166.6(C-7),173.8(C-8),12.5(C-9),57.0(C-10)。以上核磁数据与文献[16]报道基本一致,故鉴定化合物3为asperfuran A。
化合物4:白色固体(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C12H14O4。1H-NMR(500 MHz,CD3OD)δ:4.54(1H,m,H-3),2.93(1H,m,H-4),6.88(1H,d,J=7.0,H-5),7.61(1H,d,J=7.0,H-6),1.41(3H,d,J=6.5,H-9),1.34(3H,d,J=7.0,H-10), 4.64(2H,s,H-11);13C-NMR(125 MHz,CD3OD)δ:171.0(C-1),82.7(C-3),38.4(C-4),144.6(C-4a),117.8(C-5),136.0(C-6),129.3(C-7),160.5(C-8),108.0(C-8a),19.9(C-9),18.0(C-10),59.4(C-11)。以上核磁数据与文献[17]报道基本一致,故鉴定化合物4为gamahorin。
化合物5:无色晶体(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C11H12O4。1H-NMR(500 MHz,CD3OD)δ:5.23(2H,s,H-2),2.13(3H,s,4-CH3),3.75(3H,s,5-OCH3),2.16(3H,s,6-CH3);13C-NMR(125 MHz,CD3OD)δ:173.9(C-1),70.8(C-3),146.2(C-3a),117.5(C-4),155.0(C-5),119.8(C-6),165.0(C-7),107.5(C-7a),11.2(4-CH3),60.3(5-OCH3),8.9(6-CH3)。以上核磁数据与文献[18]报道基本一致,故鉴定化合物5为7-羟基-5-甲氧基-4, 6-二甲基-异苯并呋喃酮。
化合物6:黄色油状(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C17H22O8。1H-NMR(500 MHz,CD3OD)δ:5.53(1H,d,J=2.0,H-1′),5.23(2H,d,J=6.0,H-2),4.47(1H,dd,J=3.5,2.0,H-2′),3.98(1H,m,H-5′),3.87(1H,dd,J=10.0,3.5,H-3′),3.78(3H,s,5-OCH3),3.48(1H,t,J=9.5,H-4′),2.27(3H,s,6-CH3),2.20(3H,s,4-CH3),1.22(3H,d,J=6.0, H-6′);13C-NMR(125 MHz,CD3OD)δ:171.3(C-1),69.8(C-3),148.6(C-3a),122.2(C-4),164.4(C-5),126.6(C-6),154.9(C-7),113.2(C-7a),106.4(C-1′),72.0(C-2′),72.3(C-3′),73.4(C-4′),72.2(C-5′),18.0(C-6′),11.3(4-CH3),60.9(5-OCH3),10.6(6-CH3)。以上核磁数据与文献[19]报道基本一致,故鉴定化合物6为5-甲氧基-4, 6-二甲基-7-氧-α-L-鼠李糖基-异苯并呋喃酮。
化合物7:无色油状(CH3OH),结合1H-NMR和13C-NMR数据推测分子式为C21H30O4。1H-NMR(500 MHz,CD3OD)δ:4.24(1H,d,J=2.0,H-1),3.95(1H,m,H-2),3.93(1H,m,H-3),4.34(1H,dd,J=4.5,2.0,H-4),6.07(1H,d,J=4.5,H-5),2.23(2H,m,H-4′),2.28(2H,m,H-5′),5.17(1H,m,H-6′),2.02(2H,t,J =7.0,C-8′),2.11(2H,q,J=7.0,H-9′),5.13(1H,m,H-10′),5.34(1H,d,J=2.0,H-12′),5.29(1H,d,J=2.0,H-12′), 1.70(3H,s,H-13′),1.66(3H,s,H-14′),1.63(3H,s,H-15′);13C-NMR(125 MHz,CD3OD)δ:70.2(C-1),70.9(C-2),70.5(C-3),67.8(C-4),136.3(C-5),126.1(C-6),89.5(C-1′),90.0(C-2′),132.9(C-3′),38.5(C-4′),27.7(C-5′),124.5(C-6′),136.9(C-7′),40.9(C-8′),27.7(C-9′),125.4(C-10′),132.1(C-11′),121.8(C-12′),16.2(C-13′),25.9(C-14′),17.7(C-15′)。以上核磁数据与文献[20]报道基本一致,故鉴定化合物7为pestynol。
化合物1 - 7的结构如图 1所示。
|
| 图 1 化合物1 - 7的结构 Fig. 1 Structures of compounds 1 - 7 |
2.2 活性筛选结果 2.2.1 抗神经炎症活性
由图 2可知,与空白对照组相比,LPS造模组细胞存活率显著降低(P < 0.001),平均存活率为52.23%,证明LPS模型造模成功。与LPS造模组相比,各给药组对BV-2细胞损伤均有明显的抑制作用。化合物2在3 μg/mL、6 μg/mL和12 μg/mL浓度下BV-2细胞的存活率分别为62.84%、69.44%和76.77%;化合物4在3 μg/mL、6 μg/mL和12 μg/mL浓度下BV-2细胞的存活率分别为59.89%、65.42%和69.69%,以上结果均具有统计学意义。综上所述,在一定的浓度范围内,药物浓度与抗神经炎作用具有一定的量效关系,其中化合物2在12 μg/mL浓度下对LPS损伤的BV-2细胞抑制作用最显著(P < 0.001),与阳性对照组活性接近。

|
| Compared with the blank control group, ###P < 0.001;compared with the LPS group, ***P < 0.001, **P < 0.01, *P < 0.05 图 2 化合物2和4对BV-2细胞存活率的影响(n=5) Fig. 2 Effects of compounds 2 and 4 on the viability of BV-2 cell (n=5) |
2.2.2 抗菌活性
由表 1可知,化合物7对金黄色葡萄球菌、猪丹毒杆菌和猪链球菌显示弱的抑制活性,MIC值均为100 μg/mL;对植物病原真菌灰霉菌以及小麦颖枯病菌具有中等的抑制活性,MIC值均为50 μg/mL。
| 细菌/真菌 Bacteria/Fungi |
MIC值(μg/mL) MIC value (μg/mL) |
|||
| 化合物1-6 Compounds 1-6 |
化合物7 Compound 7 |
链霉素 Streptomycin |
头孢匹罗 Cefpirome |
|
| Escherichia coli | - | - | 50 | < 3.125 |
| Pseudomonas aeruginosa | - | - | 3.125 | < 3.125 |
| Staphylococcus aureus | - | 100 | 25 | < 3.125 |
| Erysipelas suis | - | 100 | 25 | < 3.125 |
| Streptococcus suis | - | 100 | > 100 | < 3.125 |
| Botrytis cinerea | - | 50 | ||
| Septoria nodorum | - | 50 | ||
| Verticiliumdahliae | - | - | ||
| Septoria tritici | - | - | ||
| Note: "-" indicates at the concentration of 100 μg/mL, the bacterial OD630 value did not decrease significantly | ||||
2.2.3 细胞毒活性
化合物1和7对Marc-145细胞表现出一定的细胞毒活性,其LC50值分别为57.397 μg/mL和35.386 μg/mL,其中化合物7的活性相对最强,与阳性对照药5-氟尿嘧啶(28.281 μg/mL)的效果最为接近。化合物2 - 6对Marc-145细胞的LC50都大于80 μg/mL。
3 讨论海洋环境的高压、高盐、低温和营养稀缺等特点决定了海洋真菌独特的代谢机制和适应机制,可以产生结构新颖和良好药理活性的天然产物。青霉属真菌是海洋真菌中研究较多的真菌之一,也是重要的药物产生菌。
本研究结果显示,化合物1 - 7均为首次从青霉属真菌中分离得到。化合物7对5种病原菌(金黄色葡萄球菌、猪丹毒杆菌、猪链球菌、灰霉菌以及小麦颖枯病菌)具有一定的抑制活性。据报道,化合物7对革兰氏阳性菌和革兰氏阴性菌(肺炎克雷伯菌Klebsiella pneumoniae)有微弱的生长抑制作用,且对Jurakat、HL60、THP-1、HT29和A549细胞具有微弱的细胞毒活性[20]。此外,也有文献报道,化合物1对大肠杆菌和污垢分歧杆菌(Mycobacterium smegmatis)有抑制活性[14],具有98.6%的卤虫致死率[21]。化合物1和7具有研发抗菌药物的潜力。
在抗肿瘤方面,化合物1和7对Marc-145细胞显示细胞毒活性,其中化合物7的活性相对最强,与5-氟尿嘧啶药效接近,具有进一步筛选成为抗肿瘤药物的潜力。研究表明,化合物2 - 6对Marc-145细胞显示较弱的抗肿瘤活性。但也有文献报道,化合物5对HeLa肿瘤细胞有明显的抑制作用,其48 h的半抑制浓度(Median Inhibitory Concentration,IC50)值为7.8 μmol/mL,而化合物6对HeLa肿瘤细胞无抑制活性[22]。从结构上来看,化合物5为7-羟基-5-甲氧基-4, 6-二甲基-异苯并呋喃酮,化合物6为5-甲氧基-4, 6-二甲基-7-氧-α-L-鼠李糖基-异苯并呋喃酮,化合物6为化合物5的7-O鼠李糖苷,其构效关系值得后续深入研究。
在神经炎症活性方面,发现化合物2和4具有良好的抑制神经炎症活性的作用,这两个化合物活性筛选研究很少,只有化合物2对小鼠ST-13脂肪细胞的诱导分化作用[15]以及化合物4的抗菌活性有少量研究[23]。化合物4为异香豆素类天然产物。有研究表明,异香豆素化合物在一定的浓度范围内能显著地保护由H2O2诱导引起的SH-SY5Y细胞损伤,并具有良好的剂量依赖性[24]。因此,后续工作将进一步研究化合物对细胞内炎症因子肿瘤坏死因子(TNF-α)、白细胞介素1β (IL-1β)、白细胞介素6(IL-6)以及一氧化氮(NO)的释放情况,并在计算机虚拟筛选技术指导下,观察NF-κB/p65的磷酸化水平以及iNOS的表达。
4 结论橘青霉的次生代谢产物种类丰富,且具有广泛的生物活性。从菌株Penicillium citrinum的发酵液中共分离得到7个已知化合物,均为首次从青霉属中分离得到,其中3, 3-二吲哚烷基-1, 2-丙二醇(1)为首次从真菌中分离得到。活性筛选结果表明,robillafuran (2)和gamahorin (4)具有良好的抑制神经炎症活性;3, 3-二吲哚烷基-1, 2-丙二醇(1)和pestynol (7)对Marc-145细胞具有细胞毒活性,LC50值分别为57.397 μg/mL和35.386 μg/mL;且pestynol (7)具有抗革兰氏阳性菌和植物病原菌活性。以上结果丰富了海洋来源Penicillium citrinum的药效物质基础,为发掘新型神经保护药物、抗菌药物及天然活性产物提供了参考依据。
| [1] |
MA H G, LIU Q, ZHU G L, et al. Marine natural products sourced from marine-derived Penicillium fungi[J]. Journal of Asian Natural Products Research, 2016, 18(1): 92-115. DOI:10.1080/10286020.2015.1127230 |
| [2] |
CHEN M Y, XIE Q Y, KONG F D, et al. Two new indole-diterpenoids from the marine-derived fungus Penicillium sp. KFD28[J]. Journal of Asian Natural Products Research, 2020, 23(11): 1030-1036. |
| [3] |
柳小英, 徐伟峰, 海洋, 等. 1株海洋真菌Penicillium chrysogenum次级代谢产物及其抗菌活性研究[J]. 中国海洋药物, 2020, 39(3): 26-30. |
| [4] |
AFIYATULLOV S S, ZHURAVLEVA O I, ANTONOV A S, et al. Piltunines A-F from the marine-derived fungus Penicillium piltunense KMM 4668[J]. Marine Drugs, 2019, 17(11): 647. DOI:10.3390/md17110647 |
| [5] |
KUMARI P, SINGH A, SINGH D K, et al. Isolation and purification of bioactive metabolites from an endophytic fungus Penicillium citrinum of Azadirachta indica[J]. South African Journal of Botany, 2021, 139: 449-457. DOI:10.1016/j.sajb.2021.02.020 |
| [6] |
MAZUMDER P M, MAZUMDER R, MAZUMDER A, et al. Anti-microbial activity of the mycotoxin citrinin obtained from the fungus Penicillium citrinum[J]. Ancient Science of Life, 2002, 21(3): 191-197. |
| [7] |
WANG W Y, LIAO Y Y, ZHANG B B, et al. Citrinin monomer and dimer derivatives with antibacterial and cytotoxic activities isolated from the deep sea-derived fungus Penicillium citrinum NLG-S01-P1[J]. Marine Drugs, 2019, 17(1): 46. DOI:10.3390/md17010046 |
| [8] |
SALENDRA L, LIN X P, CHEN W H, et al. Cytotoxicity of polyketides and steroids isolated from the sponge-associated fungus Penicillium citrinum SCSIO 41017[J]. Natural Product Research, 2021, 35(6): 900-908. DOI:10.1080/14786419.2019.1610757 |
| [9] |
LIU Q Y, ZHOU T, ZHAO Y Y, et al. Antitumor effects and related mechanisms of penicitrinine A, a novel alkaloid with a unique spiro skeleton from the marine fungus Penicillium citrinum[J]. Marine Drugs, 2015, 13(8): 4733-4753. DOI:10.3390/md13084733 |
| [10] |
MADY M, HOUSSEN W, ABDOU R, et al. Breast cancer migration and proliferation inhibitory and antibiotic secondary metabolites from the Egyptian olive tree endophytic fungus Penicillium citrinum[J]. Journal of Advanced Pharmacy Research, 2017, 1(3): 160-170. |
| [11] |
WANG J J, LI K L, LUO X W, et al. Sorbicillfurans A and B, two novel sorbicillinoid adducts from the fungus Penicillium citrinum SCSIO41402[J]. Organic & Biomolecular Chemistry, 2019, 17(38): 8721-8725. |
| [12] |
SYLVESTER P W. Optimization of the tetrazolium dye (MTT) colorimetric assay for cellular growth and viability[J]. Methods in Molecular Biology, 2011, 716: 157-168. |
| [13] |
FANG Y S, YANG M H, CAI L, et al. New phenylpropanoids from Bulbophyllum retusiusculum[J]. Archives of Pharmacal Research, 2018, 41(11): 1074-1081. DOI:10.1007/s12272-018-1067-6 |
| [14] |
WU L X, ZHAO L X, XU X D, et al. Secondary metabolites of an endophytic actinomycete isolated from Sedum sp.[J]. Chemistry of Natural Compounds, 2017, 53(2): 400-402. DOI:10.1007/s10600-017-2006-3 |
| [15] |
SHIMOYAMA T, MIYOSHI M, NEHIRA T, et al. Two new secondary metabolites from a fungus of the genus Robillarda[J]. The Journal of Antibiotics, 2018, 71(4): 432-437. DOI:10.1038/s41429-017-0015-x |
| [16] |
DENG M Y, LIU Y P, HUANG Y Y, et al. New bioactive secondary metabolites from the Anoectochilus roxburghii endophytic fungus Aspergillus versicolor[J]. Fitoterapia, 2020, 143: 104532. DOI:10.1016/j.fitote.2020.104532 |
| [17] |
KOSHINO H, YOSHIHARA T, OKUNO M, et al. Gamahonolides A, B, and gamahorin, novel antifungal compounds from stromata of Epichloe typhina on Phleum pretense[J]. Bioscience, Biotechnology and Biochemistry, 1992, 56(7): 1096-1099. DOI:10.1271/bbb.56.1096 |
| [18] |
SCHNEIDER G, ANKE H, STERNER O. New Secondary metabolites from a Mycophilic hansfordia species[J]. Natural Product Letters, 1997, 10(2): 133-138. DOI:10.1080/10575639708043728 |
| [19] |
XING J G, DENG H Y, LUO D Q. Two new compounds from an endophytic fungus Pestalotiopsis heterocornis[J]. Journal of Asian Natural Products Research, 2011, 13(12): 1069-1073. DOI:10.1080/10286020.2011.621422 |
| [20] |
SAKAI K, HIROSE T, IWATSUKI M, et al. Pestynol, an antifungal compound discovered using a Saccharomyces cerevisiae 12gene 0HSR-iERG6-based assay[J]. Journal of Natural Products, 2018, 81(7): 1604-1609. DOI:10.1021/acs.jnatprod.8b00200 |
| [21] |
王宏鹏, 谢泽平, 况燚, 等. 海洋链霉菌B170167发酵产物中含氮化合物及其细胞毒活性研究[J]. 天然产物研究与开发, 2016, 8(10): 1557-1561. |
| [22] |
关永强, 曹蒙蒙, 刘亭, 等. Pestalotiopsis adusta次级代谢产物对HeLa细胞抑制作用[J]. 中成药, 2014, 36(2): 325-329. DOI:10.3969/j.issn.1001-1528.2014.02.024 |
| [23] |
LEI H, LIN X P, HAN L, et al. New metabolites and bioactive chlorinated benzophenone derivatives produced by a marine-derived fungus Pestalotiopsis heterocornis[J]. Marine Drugs, 2017, 15(3): 69. DOI:10.3390/md15030069 |
| [24] |
程凡. 宜昌润楠化学成分和生物活性的研究[D]. 北京: 北京林业大学, 2013.
|



