簇花清风藤(Sabia fasciculata)为清风藤科植物,主要分布于云南、广西、广东、福建等地。该植物性温,味甘、微涩,有祛风湿、散淤消肿的功效。传统上主要用于治疗风湿骨痛、肾炎水肿、跌打损伤等疾病[1]。文献报道簇花清风藤中含有五环三萜、黄酮、生物碱、甾体等化合物[2]。慢性肾小球肾炎(Chronic Glomerulonephritis,CGN)是一种以肾小球滤过率下降、蛋白尿等为特征的慢性肾病。有研究表明,肾小球上皮细胞和系膜细胞氧化及炎症损伤,在CGN的发生发展中具有重要作用[3, 4]。研究显示,核转录因子NF-E2相关因子2 (Nuclear factor-erythroid 2-related factor 2, Nrf2)是体内维持氧化还原平衡的重要调节因子,参与调控肾脏疾病中的氧化应激和炎症状态[5]。多项研究也证实,激活Nrf2介导的抗氧化系统具有良好的改善肾病的作用[6, 7]。
有报道称,簇花清风藤醇提取物具有良好的抗炎镇痛活性[8],结合其民间使用经验及相关机制,推测其对慢性肾炎可能具有潜在的药理作用。本研究以簇花清风藤醇提取物为对象,观察其对阿霉素所致慢性肾小球肾炎模型大鼠中肾组织病理变化、氧化应激与炎症损伤的影响,探讨簇花清风藤醇提取物改善CGN大鼠氧化应激和炎症反应的相关机制,为药物开发及临床应用提供药理学依据。
1 材料与方法 1.1 材料 1.1.1 动物及饲料SPF级雄性SD大鼠,体质量180-220 g,购自广西医科大学实验动物中心,动物生产许可证号为SCXK桂2014-0002,普通饲料由北京科澳协力饲料有限公司提供。大鼠饲养室温保持在20-25℃,湿度55%左右,动物自由进食、进水,按每日12 h进行昼夜循环。
1.1.2 药材与试剂簇花清风藤枝叶采自广西壮族自治区来宾市金秀瑶族自治县,经广西中医药研究院中药资源所胡仁传老师鉴定为簇花清风藤Sabia fasciculata Lecomte ex L.Chen。肾炎舒片(吉林市鹿王制药股份有限公司,批号:202000145),注射用阿霉素冻干粉(北京索莱宝科技有限公司,批号:202009123)。尿蛋白定量试剂盒(南京建成生物科技有限公司,批号:20200807),尿素(UREA)血生化试剂盒(批号:141320009),肌酐(CREA)血生化试剂盒(批号:141120017),均购自深圳迈瑞生物医疗电子股份有限公司。肿瘤坏死因子α (TNF-α)ELISA试剂盒(批号:F3056-A),白介素1β (IL-1β) ELISA试剂盒(批号:F8655-A),白介素6 (IL-6) ELISA试剂盒(批号:F8066-A),均购自上海泛柯实业有限公司。BCA蛋白浓度测定试剂盒,购自上海碧云天生物技术有限公司;核因子NFE2相关因子2(Nrf2)单克隆抗体、诱导型一氧化氮合酶(iNOS)单克隆抗体、β-actin单克隆抗体均购自武汉三鹰生物技术有限公司。辣根过氧化物标记山羊抗兔IgG H+L (HRP)、辣根过氧化物标记山羊抗鼠IgG H+L (HRP)均购自艾博抗(上海)贸易有限公司。苏木素伊红染液,购自北京雷根生物技术有限公司。
1.1.3 仪器BS-600血液生化分析仪(深圳迈瑞生物医疗电子股份有限公司);RE100-Pro旋转蒸发仪[大龙兴创实验仪器(北京)股份公司];Universal 320R高速冷冻离心机(德国Hettich科学仪器有限公司);FluorChem R化学发光成像仪(美国ProteinSimple公司);Multiskan GO酶标仪[赛默飞世尔科技(中国)有限公司];EG1150石蜡包埋机、RM2255组织切片机、DM2500光学显微镜均购自德国徕卡仪器有限公司。
1.2 方法 1.2.1 受试药物的制备簇花清风藤枝叶经阴凉处干燥后切碎,称取7 kg药材,经95%乙醇回流提取3次,合并滤液,旋转蒸发仪浓缩至3.5 L,浓度为2 g生药量/mL,该浓度为簇花清风藤醇提取物高剂量给药浓度;用蒸馏水稀释1倍,混匀后,即为簇花清风藤低剂量给药浓度。
1.2.2 慢性肾小球肾炎模型建立70只SD大鼠,经适应性饲养7 d后,一次性尾静脉注射阿霉素(7 mg/kg)制备慢性肾小球肾炎模型,再选取8只SD大鼠作为空白组,注射等量生理盐水。动物造模后每周末收集尿液,检测24 h尿蛋白含量,当尿蛋白含量>100 mg/24 h视为造模成功[9]。
1.2.3 分组及给药两周后,取造模成功的大鼠32只,按体质量随机分为模型组、肾炎舒(SYS,6 g/kg)组、簇花清风藤醇提取物(SF-95E)高剂量(SF-95E-20,20 g生药/kg)组和低剂量(SF-95E-10,10 g生药/kg)组,每组8只。各给药组给予相应药物,按10 mL/kg体质量灌胃给药,每日1次,连续2周,空白组和模型组给予等量的蒸馏水。
1.2.4 尿蛋白含量检测末次给药1 h后,将大鼠置于代谢笼内,收集24 h尿液,按照试剂盒说明书测定尿蛋白含量。
1.2.5 血清UREA和CREA含量的测定末次给药24 h后,大鼠经3%异氟烷麻醉,腹主动脉取血,4℃、3 500 r/min离心10 min,收集血清,采用全自动血液生化分析仪测定血清UREA和CREA的含量。
1.2.6 肾脏脏器指数大鼠断颈椎处死后,剥离双侧肾组织,称取质量,计算脏器指数。大鼠肾脏脏器指数=大鼠双侧肾脏质量(mg)/大鼠体质量(g)。
1.2.7 肾脏TNF-α、IL-1β和IL-6含量的测定取左侧肾脏200 mg,去除血渍后,按1∶9(W∶V)的体积加入冰冷的生理盐水中进行冰浴匀浆,将组织匀浆液于15 000 r/min离心10 min,吸取上清液,按照ELISA试剂盒说明书测定肾脏组织中TNF-α、IL-1β和IL-6炎症因子的含量。
1.2.8 肾组织Nrf2、iNOS蛋白表达水平的测定取左侧肾脏200 mg,去除血渍后,在液氮中研磨碎,加入含RIPA的组织蛋白裂解液冰浴裂解组织,15 000 r/min离心10 min,收集上清液即为总蛋白。采用BCA试剂盒测定蛋白浓度,采用SDS-PAGE凝胶电泳,恒压转膜,5%脱脂奶粉中封闭2 h,TBST洗膜,以Nrf2、iNOS一抗(1∶1 000)4℃孵育过夜,PBST洗膜,加入辣根过氧化物酶标记的二抗(1∶5 000)孵育2 h,PBST洗膜,于化学发光成像仪内曝光。蛋白条带采用Quantity one软件分析灰度值,以β-actin作为内参蛋白,以目的蛋白条带灰度值/β-actin蛋白条带灰度值作为该目的蛋白的相对表达量。
1.2.9 肾组织病理学检查取右侧肾脏组织,轻轻擦除表面血液,以10%中性福尔马林溶液固定,70%-80%-95%-100%梯度乙醇脱水,二甲苯透明40 min,浸蜡3 h,包埋,再进行石蜡切片。HE染色步骤如下:取切片,100%-95%-80%-70%梯度乙醇复水,苏木素染色液染色5 min,盐酸酒精分化5 s,氨水返蓝5 s,伊红染液染色4 min,再于70%-80%-95%-100%梯度乙醇脱水,二甲苯透明5 min,中性树胶封片。将切片置于显微镜下观察肾脏病理形态变化。
1.3 统计方法数据以均值±标准差(x±s)表示,采用SPSS 16.0软件进行统计处理。多组样本均数的两两比较采用单因素方差分析,方差齐性采用Dunnett检验,方差不齐性采用非参数检验。P < 0.05为差异有统计学意义。
2 结果与分析 2.1 SF-95E对CGN大鼠尿蛋白含量的影响由表 1可知,给药前,与空白组相比,模型组大鼠24 h尿蛋白含量显著增加(P < 0.05),提示7 mg/kg阿霉素可诱导大鼠出现慢性肾炎,造模大鼠出现肾小球滤过功能障碍。经过2周给药后,与模型组相比,SF-95E-20组、肾炎舒组大鼠24 h尿蛋白含量显著降低(P < 0.05),而SF-95E-10组尿蛋白含量略降低,但与模型组相比无显著性差异(P>0.05)。与给药前相比,给药2周后肾炎舒、SF-95E各给药组尿蛋白水平均出现明显下调,而模型组和空白组反而升高。综上可知,SF-95E-20具有减轻肾炎损伤、改善肾小球滤过功能的作用。
| 组别 Group |
给药前 Before administration (mg/24 h) |
给药后 After administration(mg/24 h) |
| Blank group | 19.8±0.9 | 21.2±1.1 |
| Model group | 257.4±9.4Δ | 263.8±11.5Δ |
| SYS group | 271.3±15.2 | 197.4±12.7#* |
| SF-95E-20 group | 269.8±16.0 | 220.6±13.1#* |
| SF-95E-10 group | 267.7±13.9 | 249.3±15.5* |
| Note: ΔP < 0.05 compared with blank group; #P < 0.05 compared with model group; *P < 0.05 compared with the same group before administration | ||
2.2 SF-95E对CGN大鼠血清UREA和CREA含量的影响
由图 1可知,7 mg/kg阿霉素静脉注射后可诱导模型组大鼠血清UREA和CREA含量显著增加,与空白组大鼠相比具有显著性差异(P < 0.05)。与模型组相比,经药物干预2周后,肾炎舒、SF-95E-20可显著降低CGN大鼠血清UREA和CREA含量(P < 0.05),说明SF-95E-20和肾炎舒均可以减轻阿霉素诱导的大鼠肾损伤。

|
| *P < 0.05 compared with blank group; #P < 0.05 compared with model group 图 1 SF-95E对CGN大鼠血清UREA和CREA含量的影响 Fig. 1 Effects of SF-95E on serum UREA and CREA content in CGN rats |
2.3 SF-95E对CGN大鼠肾脏TNF-α、IL-1β和IL-6炎性因子水平的影响
如表 2所示,与空白组相比,模型组大鼠肾脏组织中TNF-α、IL-1β和IL-6含量均显著升高(P < 0.05)。与模型组相比,药物干预2周后,SF-95E-20和肾炎舒均可显著降低CGN大鼠肾脏组织中TNF-α、IL-1β和IL-6含量,进而减轻阿霉素诱导的肾炎症反应(P < 0.05);SF-95E-10可显著降低大鼠肾脏组织中IL-1β和IL-6含量(P < 0.05),但对TNF-α的水平不具有显著影响(P>0.05)。
| 组别 Group | TNF-α | IL-6 | IL-1β |
| Blank group | 8.12±0.54 | 6.26±1.02 | 8.33±0.92 |
| Model group | 30.69±1.23* | 22.58±2.74* | 42.67±3.05* |
| SYS group | 19.52±1.23# | 18.47±1.32# | 21.42±2.74# |
| SF-95E-20 group | 16.46±1.05# | 14.42±1.33# | 23.46±2.53# |
| SF-95E-10 group | 20.61±2.05 | 18.52±1.85# | 37.54±4.03# |
| Note: *P < 0.05 compared with blank group; #P < 0.05 compared with model group | |||
2.4 SF-95E对CGN大鼠肾脏Nrf2、iNOS蛋白表达水平的影响
如图 2所示,与空白组相比,模型组大鼠抗氧化相关蛋白Nrf2水平显著降低,氧化应激炎症相关蛋白iNOS水平显著升高(P < 0.05),表明阿霉素通过Nrf2/iNOS体系进一步诱导了肾组织的氧化应激损伤。药物干预2周后,与模型组相比,肾炎舒组、SF-95E-20组可显著升高CGN大鼠肾脏组织Nrf2蛋白水平、下调iNOS蛋白水平(P < 0.05),表明肾炎舒和SF-95E-20可增强肾脏抗氧化应激能力,进而减轻肾损伤。SF-95E-10组对肾脏Nrf2、iNOS蛋白表达无显著性影响。
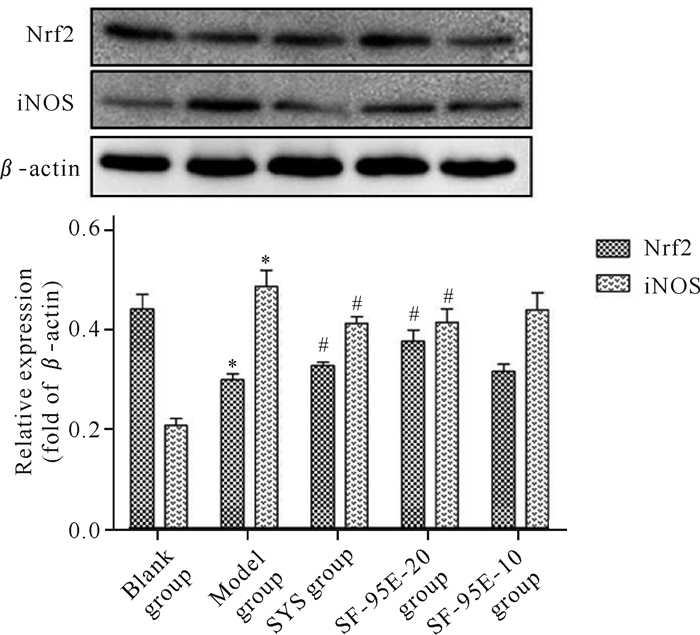
|
| *P < 0.05 compared with blank group; #P < 0.05 compared with model group 图 2 SF-95E对CGN大鼠肾脏Nrf2、iNOS蛋白表达水平的影响(x±s, n=8) Fig. 2 Effects of SF-95E on the expressions of Nrf2 and iNOS in kidney of CGN rats (x±s, n=8) |
2.5 SF-95E对CGN大鼠肾脏脏器指数的影响
由图 3可知,与空白组相比,模型组大鼠肾脏脏器指数显著升高(P < 0.05),表明7 mg/kg阿霉素静脉注射后,大鼠肾脏质量减少,进一步确认了阿霉素对肾脏的损伤作用。SF-95E各给药组的肾脏脏器指数均有不同程度的降低,但与模型组相比,无统计学差异。
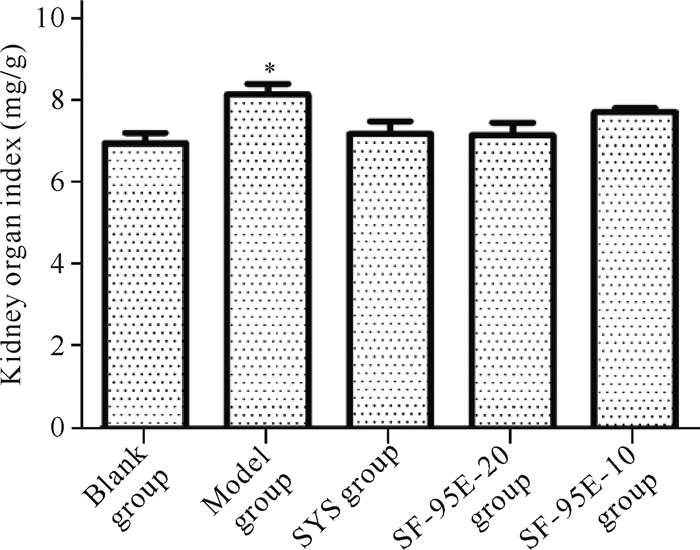
|
| *P < 0.05 compared with blank group; #P < 0.05 compared with model group 图 3 SF-95E对CGN大鼠肾脏脏器指数的影响(x±s, n=8) Fig. 3 Effects of SF-95E on kidney organ index in CGN rats (x±s, n=8) |
2.6 SF-95E对CGN大鼠肾脏组织病理变化的影响
与空白组相比,模型组大鼠肾脏肾小管变性,管腔扩张呈现纺锤状或椭圆形,管腔内上皮细胞胞质核固缩,管腔内偶见脱落上皮细胞和细胞碎片;肾小球内细胞核固缩,明显变小,肾小球囊腔变宽。与模型组相比,肾炎舒组和SF-95E-20组大鼠肾脏肾小管扩张程度减轻,肾小球囊腔出现不同程度减小的现象,表明SF-95E-20通过改善肾小球和肾小管功能,进而减轻阿霉素致大鼠肾损伤的作用,结果见图 4。
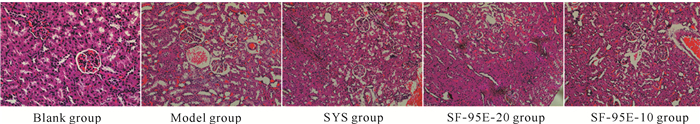
|
| 图 4 SF-95E对CGN大鼠肾脏病理变化的影响(200×,n=8) Fig. 4 Effects of SF-95E on pathological changes of kidney in CGN rats (200×, n=8) |
3 讨论
慢性肾小球肾炎又称为慢性肾炎,是由多种致病因素(如过度疲劳、细菌或病毒感染、异常应激反应、水和电解质紊乱以及药物毒性等)引起的原发性肾小球疾病[10],临床主要表现为蛋白尿、高血压、水肿等,受肾小球滤过率下降的影响,常在患者血液中发现有高水平CREA和UREA[11]。
阿霉素是一类抗肿瘤药物,进入体内后,经肾消除可产生活性氧自由基,从而诱发肾小球上皮细胞脂质过氧化反应,破坏肾小球滤膜结构,提高蛋白滤过从而形成蛋白尿,目前已被广泛应用于动物肾病模型研究[12, 13]。本试验通过给大鼠静脉注射阿霉素(7 mg/kg)2周后,可形成稳定的尿蛋白水平(>100 mg/24 h),并且诱导大鼠肾脏肾小球病理损伤以及炎症反应,表现为iNOS、TNF-α、IL-1β和IL-6等蛋白的上调,以及对Nrf2介导的抗氧化系统的抑制。多项研究认为,Nrf2是治疗慢性肾炎、糖尿病肾炎的关键靶点,通过激活Nrf2可以减轻肾氧化应激反应,平衡氧化还原体系,可有效减轻糖尿病肾病的足细胞损伤[14-17]。
簇花清风藤为瑶族民间用药,含有丰富的药效活性物质,如五环三萜类化合物、黄酮类化合物、生物碱、甾体化合物等。本研究发现,簇花清风藤醇提取物通过激活Nrf2抗氧化应激系统,下调下游炎症相关蛋白iNOS、TNF-α、IL-1β和IL-6的表达,改善肾损伤血清学指标和肾小球病理变化,进而减轻阿霉素引起的肾小球损伤。目前,簇花清风藤醇提取物改善肾炎作用的物质基础仍不太明确,需要结合更多分析技术手段,如HPLC-MS/MS技术,进一步阐明其具体成分以及药物在组织中的作用特点及相应靶点。由于肾小球肾炎与基底膜、足细胞、系膜等因素有关,簇花清风藤醇提取物是否通过Nrf2信号调节系膜细胞、足细胞病变等病理过程,仍需要结合相关实验进一步探究。
4 结论簇花清风藤醇提取物可以激活Nrf2信号通路,平衡氧化还原体系,从抗氧化应激和减轻炎症损伤的角度来减轻肾小球病理损伤,改善慢性肾小球肾炎疾病进展。但本研究目前仍存在作用成分不明确的不足,下阶段将进一步探讨簇花清风藤改善肾小球肾炎疾病的具体药效物质基础及其作用机制,并寻找其中活性较好的药效组分,为其临床相关治疗提供理论依据。
| [1] |
国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海: 上海科学技术出版社, 1998: 4002-4003.
|
| [2] |
黄艳, 李齐修, 刘元, 等. 簇花清风藤的化学成分研究[J]. 中草药, 2014, 45(6): 765-769. |
| [3] |
GORIN Y. The kidney: An organ in the front line of oxidative stress-associated pathologies[J]. Antioxidants & Redox Signaling, 2016, 25(12): 639-641. |
| [4] |
LIU B H, LIN J, BAI L X, et al. Paeoniflorin inhibits mesangial cell proliferation and inflammatory response in rats with mesangial proliferative glomerulonephritis through PI3K/AKT/GSK-3β pathway[J]. Frontiers in Pharmacology, 2019, 10: 978. DOI:10.3389/fphar.2019.00978 |
| [5] |
NEZU M, SUZUKI N, YAMAMOTO M. Targeting the KEAP1-NRF2 system to prevent kidney disease progression[J]. American Journal of Nephrology, 2017, 45(6): 473-483. DOI:10.1159/000475890 |
| [6] |
陈烨, 贾崇高, 唐英骞, 等. 玉泉丸对糖尿病肾病大鼠GSK-3β/Nrf2通路及YKL-40表达的影响[J]. 中成药, 2022, 44(1): 61-66. |
| [7] |
陶春鹤, 张玉笛, 轩晨, 等. 芪精益肾汤对糖尿病肾病大鼠Nrf2/HO-1信号通路的作用及机制研究[J]. 中国中西医结合杂志, 2022, 42(4): 455-463. |
| [8] |
潘照斌, 李棐朝, 廖月娥, 等. 簇花清风藤醇提物镇痛抗炎作用研究[J]. 云南中医中药杂志, 2012, 33(1): 61-62. DOI:10.3969/j.issn.1007-2349.2012.01.036 |
| [9] |
高家荣, 吴溪, 宋俊梅, 等. 芪藤消浊颗粒对慢性肾小球肾炎大鼠Syk/Ras/c-Fos信号通路的调控作用[J]. 中药药理与临床, 2017, 33(5): 143-149. |
| [10] |
ZHAO J, CHAN Y C, HE B, et al. A patent herbal drug Yi-Shen-Hua-Shi granule ameliorates C-BSA-induced chronic glomerulonephritis and inhabits TGFβ signaling in rats[J]. Journal of Ethnopharmacology, 2019, 236: 258-262. DOI:10.1016/j.jep.2019.02.044 |
| [11] |
LI Y H, WANG W, WANG Y J, et al. Fetal risks and maternal renal complications in pregnancy with preexisting chronic glomerulonephritis[J]. Medical Science Monitor, 2018, 24: 1008-1016. DOI:10.12659/MSM.905494 |
| [12] |
马晓红, 何立群. 不同剂量阿霉素致大鼠局灶节段硬化肾病模型的建立比较[J]. 中国比较医学杂志, 2013, 23(1): 37-42. DOI:10.3969/j.issn.1671.7856.2013.001.009 |
| [13] |
陶磊, 李婷婷, 马旖旎, 等. 青蒿琥酯对阿霉素致大鼠肾损伤的保护作用[J]. 中国比较医学杂志, 2020, 30(11): 47-51. DOI:10.3969/j.issn.1671-7856.2020.11.008 |
| [14] |
XING L, GUO H J, MENG S X, et al. Klotho ameliorates diabetic nephropathy by activating Nrf2 signaling pathway in podocytes[J]. Biochemical and Biophysical Research Communications, 2021, 534: 450-456. DOI:10.1016/j.bbrc.2020.11.061 |
| [15] |
ADELUSI T I, DU L, HAO M, et al. Keap1/Nrf2/ ARE signaling unfolds therapeutic targets for redox imbalanced-mediated diseases and diabetic nephropathy[J]. Biomedicine & Pharmacotherapy, 2020, 123: 109732. |
| [16] |
NEZU M, SUZUKI N. Roles of Nrf2 in protecting the kidney from oxidative damage[J]. International Journal of Molecular Sciences, 2020, 21(8): 2951. DOI:10.3390/ijms21082951 |
| [17] |
QIAO S M, LIU R, LV C J, et al. Bergenin impedes the generation of extracellular matrix in glomerular mesangial cells and ameliorates diabetic nephropathy in mice by inhibiting oxidative stress via the mTOR/β-TrcP/Nrf2 pathway[J]. Free Radical Biology & Medicine, 2019, 145: 118-135. |


