2. 广西壮族自治区海洋环境监测中心站, 广西北海 536000;
3. 深圳大学高等研究院, 广东深圳 518000;
4. 厦门大学环境与生态学院, 福建厦门 361102
2. Marine Environmental Monitoring Center of Guangxi, Beihai, Guangxi, 536000, China;
3. Institute for Advanced Study, Shenzhen University, Shenzhen, Guangdong, 518000, China;
4. College of the Environment and Ecological Science, Xiamen University, Xiamen, Fujian, 361102, China
近年来,人类生产、生活,尤其是近海养殖活动过量投饵给水环境带来空前压力,水体富营养化、生态环境恶化已成为一大环境难题[1],其主要原因是氮(N)、磷(P)含量的急剧增加。利用生物滤器大型藻类修复水质成为解决问题的关键,大型海藻不仅能从周围环境中大量吸收N、P营养元素[1-3]及重金属元素,还能提高水体溶解氧水平,调节水体pH值,从而改善水生生境。N、P是初级生产者生长的营养基础[2],在营养盐贫乏水域,加富N、P会显著促进藻体对其吸收,然而N、P对藻类生长的影响较复杂,与藻类生长的环境因子、氮源和磷源种类、生长速率、碳代谢、底物酶活性和N/P等因素有关[3-5]。对限制性营养要素的吸收能力是藻类大量繁殖的关键,适宜的N/P有利于浮游植物的生长繁殖,反之会造成营养结构失调、种群结构改变,甚至引发藻华灾害。大量研究证实,黄海绿潮灾害频发与海水中营养盐过量密切相关[6, 7]。自20世纪60年代国外学者首次提出Redfield比[8](即维系海洋藻类正常生长所需的适宜N/P为16/1)后,关于N、P限制对大型藻类生长影响的研究[9-16]已有不少。研究发现,N、P差异显著会影响大型海藻江蓠属(Gracilaria)的生长状况和生理特征,例如,钱鲁闽等[13]明确了不同形态的N、N/P会影响菊花江蓠(Gracilaria lichenoides)对P的吸收,当N/P为10/1时吸收速率最佳;杨芳[14]发现位于东兴、北海和深圳湾3个海区的细基江蓠(G.tenuistipitata)繁枝变型对不同形态N的富集能力存在差异,当N浓度为20 μmol·L-1时,藻体硝酸还原酶(Nitrate Reductase, NR)、超氧化物歧化酶(Superoxide Dismutase, SOD)活性最高;许忠能等[15]发现细基江蓠繁枝变种吸收的N/P随环境N/P的不同而变化,当N浓度一定时环境N/P对细基江蓠繁枝变种吸收N的速率无显著影响;李恒等[16]研究发现,当N浓度为50 μmol·L-1时,真江蓠(G.asiatica)和脆江蓠(G.chouae)对氮的平均吸收速率最大,且脆江蓠对硝酸盐和磷酸盐有更好的去除效果。
目前N、P对大型海藻江蓠属的胁迫研究仅见菊花江蓠、细基江蓠繁枝变型、脆江蓠[15]、真江蓠[16]等,对细基江蓠的研究主要集中在繁育、生物学特性以及与其他藻类相生相克效应[17]方面,有关细基江蓠在不同N、P水平下的植物营养生理生态研究尚缺乏。本研究以Redfield比[18]为理论依据,研究在不同N、P营养条件下细基江蓠对营养盐的吸收特性及对自身生长的影响,以期为利用大型海藻吸收N、P,降低水体富营养水平,改善近岸海域水环境质量提供科学依据。
1 材料与方法 1.1 藻种细基江蓠(G.tenuistipitata)的采集与保存:实验所用细基江蓠采自广西北海市金海湾潮间带。选择生长状态良好、长势相近的藻体,并用海水冲洗除去杂藻、污泥及其他附着生物,室内暂养。
暂养条件:每1 L海水添加10 mL f/2培养液,海水为经高温(121℃,20 min)消毒且过0.45 μm醋酸纤维滤膜的自然海水(pH值为8.1,盐度为28.3),暂养温度(20±1)℃,光照强度3 000-4 000 lx,光照周期14L∶10D。暂养期间每3 d更换一次海水且24 h充气,以保证营养盐混合均匀并使藻体保持悬浮状态,暂养时间为1周。
实验用细基江蓠的准备:取长势良好的细基江蓠接种至未加N源、P源的f/2营养液中饥饿培养48 h,其他培养条件同上。
1.2 N、P浓度设置不同N/P实验:设置无机氮(NaNO3∶NH4Cl=1∶1,C∶C)浓度分别为0 μmol·L-1(N0)、40 μmol·L-1(N40)、160 μmol·L-1(N160)、320 μmol·L-1(N320)4个处理组,各处理组无机磷(NaH2PO4)浓度均为10 μmol·L-1,每个处理组各设置3个重复,共12组。其余营养元素按照f/2培养基的比例添加。
不同N、P浓度实验:固定Redfield比N/P=16/1,设置5组不同N、P浓度,各处理组设置3个平行,共15组。N源、P源和其他营养盐元素与不同N/P实验设置相同。具体的N、P浓度设置见表 1。
| 组别Group | N (NaNO3∶NH4Cl=1∶1,C∶C,μmol·L-1) | P (NaH2PO4,μmol·L-1) |
| P4 | 64 | 4 |
| P6 | 96 | 6 |
| P10 | 160 | 10 |
| P16 | 256 | 16 |
| P25 | 400 | 25 |
1.3 实验管理
细基江蓠的生长,N、P吸收实验采用静水系统在室内进行,选择暂养一周且饥饿处理48 h的健康藻体作为实验材料。为保证藻体活性,尽量减少实验藻体创口并选择截取部位一致的藻段进行实验。用1 L的培养瓶添加900 mL高温高压(121℃,100 kPa)消毒的不同N、P人工海水培养液,取湿重0.5 g左右的藻段,用干净滤纸吸去藻体表面的水分后称量藻体的初始质量(湿重),置于培养瓶中开始实验。实验共持续8 d,前6 d每天下午17:00取样,藻体需用干净滤纸吸去藻体表面的水分后称量湿重,同时用虹吸法取50 mL实验培养液,经0.45 μm醋酸纤维滤膜过滤后置于-20℃条件下冷冻保存,待测其NH4+-N、NO3--N、PO43--P浓度。第6-8天每2 d取一次样。实验条件同暂养条件。
1.4 测定方法PO43--P浓度使用营养盐自动分析仪(AA3,SEAL Analytical,德国)测定,NO3--N浓度采用锌-镉还原法测定,NH4+-N采用次溴酸钠氧化法测定[12]。
细基江蓠对营养盐的吸收速率v计算公式[14]如下:
| $ v=\frac{C_{t-1} \times V_{t-1}-C_{t} \times V_{t}}{W \times t}, $ | (1) |
式中:v为营养盐的吸收速率(μmol·g-1·h-1),Ct-1、Vt-1为每次取样时间间隔的起始培养液中营养盐的浓度和体积,Ct、Vt为每次取样时间间隔结束时培养液中营养盐的浓度和体积,t为培养时间(h),W为藻体湿重(g)。
细基江蓠对营养盐的去除率r计算公式如下:
| $ r=\frac{C_{0} \times V_{0}-C_{r} \times V_{t}}{C_{0} \times V_{0}} \times 100 \%, $ |
式中:r为营养盐的去除率,C0、V0为实验开始前培养液中营养盐的浓度和体积,Ct、Vt为每次取样时培养液中营养盐的浓度和体积。
称量前先用纸巾吸去藻体表面的水分,再用精确度为0.001 g的电子分析天平称量藻体湿重。藻体相对生长速率(Relative Growth Rate,RGR,以湿重计,%·d-1)计算公式[15]如下:
| $ \mathrm{RGR}=\frac{\ln \left(W_{t} / W_{0}\right)}{t} \times 100, $ | (2) |
式中:W0是藻体初始湿重,Wt是t时刻藻体湿重。
静态培养下的大型海藻对营养盐的吸收过程可以用一级动力学方程来描述[12],公式[19]如下:
| $ \frac{S_{e}}{S_{0}}=\mathrm{e}^{-k t}, $ | (3) |
式中:S0为初始N、P浓度(mg·L-1),Se为t时刻N、P浓度(mg·L-1),t为时间(d),k为N、P去除率常数。
1.5 数据处理实验数据为3个平行样的平均值,用Origin 9.0软件处理拟合,用SPSS 19.0进行数据统计分析、差异性检验,用one-way ANOVA及Duncan多重比较检验组间差异(以P<0.05为差异显著性标准)。
2 结果与分析 2.1 不同N、P组合处理对细基江蓠生长的影响图 1和图 2展示了不同N、P组合条件下细基江蓠的生长情况,不同N、P组合的细基江蓠湿重及其相对生长速率具有明显差异。细基江蓠在各处理组的生长趋势基本一致,藻体湿重在整个实验阶段随着实验时间延长而增加(图 1)。由图 1(a)可知,在不同N/P下N160组(N初始浓度为160 μmol·L-1)藻体湿重增量比最大,达48.3%,显著高于其他3个实验组(P<0.01);N0组(N初始浓度为0)藻体湿重增幅最小,仅为12.7%。由图 2(a)可知,不同N/P条件下各处理组间的藻体平均相对生长速率大小依次为N160>N320>N40>N0,N40组与N320组无显著差异(P>0.05),其他组各组间差异显著(P<0.05)。
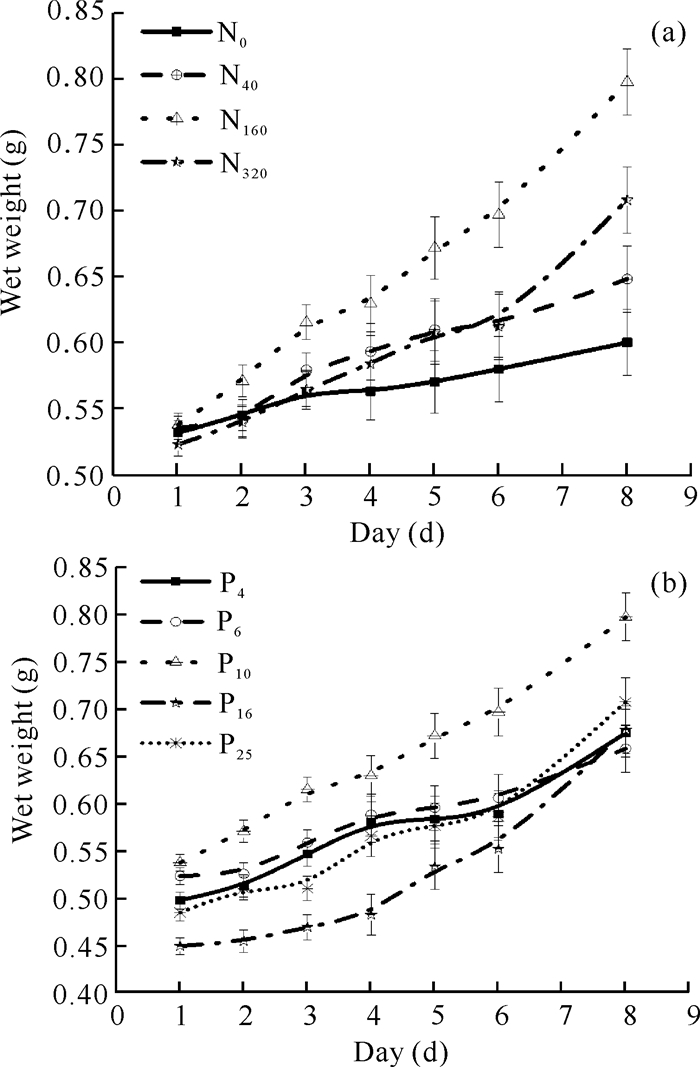
|
| 图 1 不同N、P水平下细基江篱藻体湿重随时间的变化 Fig. 1 Variation of wet weight of G.tenuistipitata with time under different N and P levels |

|
| Different letters indicate significant differences between groups (P < 0.05) 图 2 不同N、P浓度下细基江篱的相对生长速率 Fig. 2 Relative growth rate of G.tenuistipitata under different concentrations of N and P |
由图 1(b)可知,在不同N、P浓度条件下,P10组藻体增重比最高,达50.8%;P6组藻体增重比最低,为25.7%;P4组、P6组、P25组间差异不显著,P16组在培养的整个阶段,藻体湿重增长率持续增加。由图 2(b)可知,不同N、P浓度条件下各组藻体相对生长速率表现为P10>P25>P16>P6>P4,P6组与P16组、P16组与P25组无显著性差异(P>0.05),其他组各组间差异显著(P<0.05)。
2.2 细基江蓠对PO43--P的去除由图 3(a)和图 3(b)可知,不同N/P下随时间变化,各组PO43--P浓度均显著下降;N160组和N320组PO43--P去除率均在85%以上,各组去除率N160(90.7%)>N320(89.2%)>N40(76.5%)>N0(68.7%);实验开始后1 d内各组PO43--P浓度下降显著,N160组对PO43--P去除率就达到54.2%,但中后期细基江蓠对PO43--P的去除较缓和,N320组对PO43--P的去除仍然是一个相对快速的过程,到第8天时两组PO43--P的浓度均下降到0.031 mg·L-1左右;各处理组对PO43--P的去除均表现出0-2 d时去除快,2-6 d时去除平稳,6-8 d时去除加速的特征。
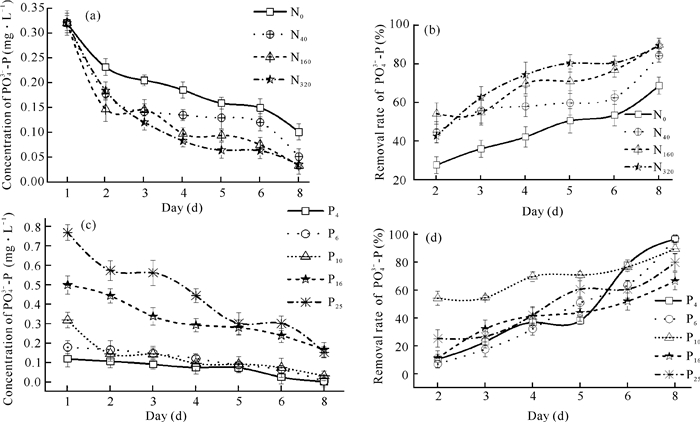
|
| 图 3 不同N、P水平下PO43--P浓度、去除率随时间的变化 Fig. 3 Variation of PO43--P concentration and removal rate with time under different levels of N and P |
由图 3(c)和图 3(d)可知,不同N、P浓度条件下,各处理组细基江蓠对PO43--P的去除率均较高,其中P4组、P6组去除率在95%以上;实验前中期(2-5 d),P10组对PO43--P的去除率显著高于其他各组,实验后期(6-8 d)低PO43--P浓度组P4组、P6组、P10组对PO43--P依然保持着较高的去除率,其中P4组在第8天时去除率高达96.8%。
一级动力学方程模拟细基江蓠对PO43--P去除的拟合结果见表 2,初始PO43--P浓度为10 μmol·L-1时细基江蓠的平均去除率常数k为0.291 3±0.025 (R2=0.818 9),显著高于其他实验组(P<0.01)。其他实验组对PO43--P的去除率较接近,在不同初始PO43--P浓度下波动不大,平均k值为0.14-0.16,无显著性差异。
| 初始PO43--P浓度(μmol·L-1) Initial PO43--P concentration (μmol·L-1) |
去除率常数(x±SD) Removal rate constant (x±SD) |
R2 |
| 4 | 0.155 2±0.038a | 0.669 1 |
| 6 | 0.145 5±0.035a | 0.698 8 |
| 10 | 0.291 3±0.025b | 0.818 9 |
| 16 | 0.135 5±0.017a | 0.825 1 |
| 25 | 0.161 1±0.016a | 0.870 0 |
| Note:Different letters indicate significant differences between groups (P < 0.05) | ||
PO43--P初始浓度对细基江蓠的PO43--P吸收速率影响显著(P<0.01),吸收速率随着初始PO43--P浓度的升高而增大(图 4),在PO43--P水平较低时,PO43--P初始浓度对P吸收速率影响不大(P>0.05)。当PO43--P浓度高于6 μmol·L-1时对P吸收速率的影响较明显(P<0.05),其中PO43--P浓度为25 μmol·L-1时细基江蓠对PO43--P有最大吸收速率为0.41 μmol·g-1·h-1。
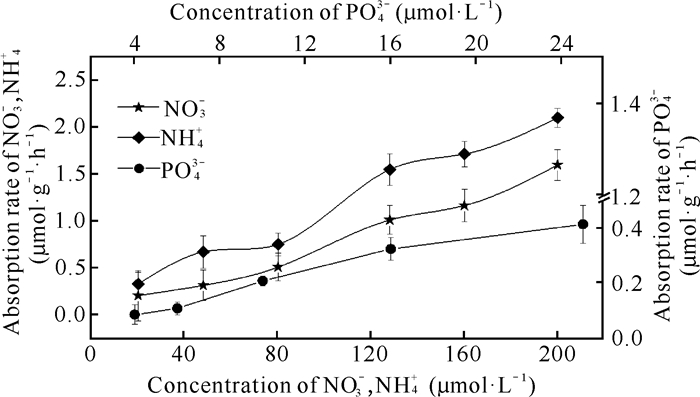
|
| 图 4 不同初始PO43--P、NH4+-N、NO3--N水平下细基江蓠N、P吸收速率 Fig. 4 Uptake rates of G.tenuistipitata under different initial PO43--P, NH4+-N, NO3--N levels |
2.3 细基江蓠对NO3--N的去除
由图 5(a)和图 5(b)可知,不同N/P下第1天内各实验组NO3--N浓度下降幅度有显著差异(P<0.05);N40组、N160组、N320组对NO3-的去除率分别为50.0%、21.5%、37.2%。不同N、P浓度实验中,NO3--N浓度和去除率的变化趋势与不同N/P实验相似。由图 5(c)和图 5(d)可知,实验第1天细基江蓠对NO3--N的去除率表现为P25>P16>P4>P6>P10,前5 d去除率明显增加,第5天之后增加幅度较小,P10组第8天去除率最高达到峰值,为83.9%。
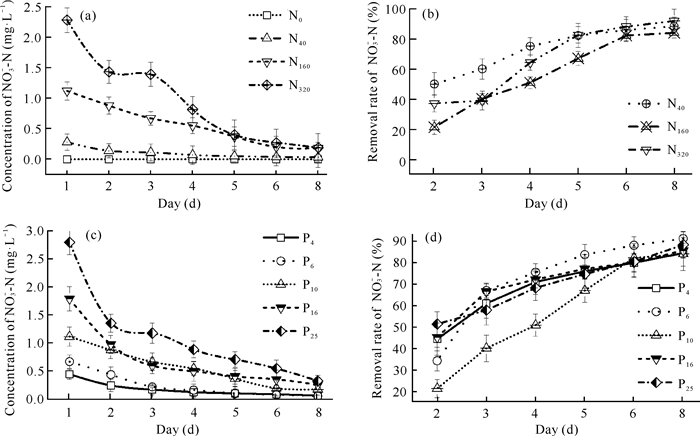
|
| 图 5 不同N、P水平下NO3--N浓度、去除率随时间的变化 Fig. 5 Variation of NO3--N concentration and removal rate with time under different N and P levels |
由表 4可知,当初始NO3--N浓度为128 μmol·L-1、160 μmol·L-1、200 μmol·L-1时k值差异不显著(P>0.05),k值在NO3-浓度为48 μmol·L-1时去除率常数出现拐点,此时对NO3--N的去除率常数最大,为0.389 3±0.025 (R2=0.873 7)。
| 初始NO3--N、NH4+-N浓度(μmol·L-1) Initial NO3--N,NH4+-N concentration (μmol·L-1) |
去除率常数(x±SD) Removal rate constant (x±SD) |
R2 |
| 20 | NO3-: 0.327 4±0.011b NH4+: 0.376 7±0.022a |
0.968 3 0.876 5 |
| 48 | NO3-: 0.389 3±0.025a NH4+: 0.335 1±0.016b |
0.873 7 0.952 8 |
| 80 | NO3-: 0.202 6±0.021c NH4+: 0.364 5±0.024a |
0.883 2 0.952 3 |
| 128 | NO3-: 0.305 6±0.017b NH4+: 0.336 7±0.023a |
0.905 6 0.871 1 |
| 160 | NO3-: 0.263 4±0.029bc NH4+: 0.324 6±0.030a |
0.853 5 0.910 7 |
| 200 | NO3-: 0.292 0±0.033bc NH4+: 0.314 3±0.019b |
0.930 3 0.835 2 |
| Note:Different letters indicate significant differences between groups (P < 0.05) | ||
细基江蓠对NO3--N的吸收速率表现与对PO43--P吸收速率相似,即随着初始NO3--N浓度的升高而增大(图 4)。NO3--N初始浓度在20 μmol·L-1、48 μmol·L-1、80 μmol·L-1组间,以及128 μmol·L-1、160 μmol·L-1组间吸收速率差异不显著(P>0.05),NO3--N浓度为200 μmol·L-1时吸收速率出现峰值1.59 μmol·g-1·h-1(图 4)。
2.4 细基江蓠对NH4+-N的去除各实验组NH4+-N的浓度随着时间延长均大幅下降,见图 6(a)和图 6(b),N40组、N160组和P4组、P6组、P10组在实验结束时NH4+-N浓度基本接近0。由图 6(c)和图 6(d)可知,除P25组外其余实验组的NH4+-N去除率均达到90%以上,整体上各实验组NH4+-N去除率差异不明显;细基江蓠对NH4+-N的去除率变化趋势与NO3--N相似,去除率在第5天之前增加很快,第5天后增加幅度放缓。
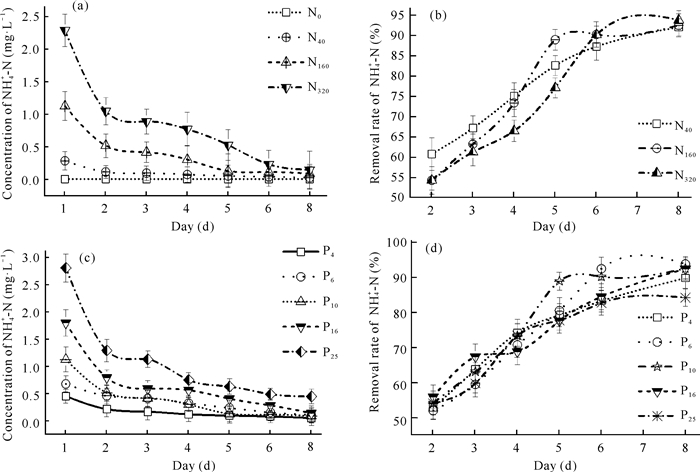
|
| 图 6 不同N、P水平下NH4+-N浓度、去除率随时间的变化 Fig. 6 Variation of NH4+-N concentration and removal rate with time under different initial N and P levels |
由表 4可知,在不同N、P浓度下,除NH4+-N浓度为48 μmol·L-1、200 μmol·L-1组外,其余各组NH4+-N去除率常数差异性不显著(P>0.05),各组间NH4+-N去除率常数k总体波动不明显。
NH4+-N初始浓度在20 μmol·L-1和48 μmol·L-1组间、48 μmol·L-1和80 μmol·L-1组间,以及128 μmol·L-1和160 μmol·L-1组间时对NH4+-N吸收速率差异不显著(图 4,P>0.05)。随着NH4+-N初始浓度增加,细基江蓠在NH4+-N初始浓度为48-80 μmol·L-1时吸收速率变缓,初始浓度为200 μmol·L-1时吸收速率出现峰值,达2.1 μmol·g-1·h-1。
3 讨论 3.1 N、P环境对细基江蓠生长的影响本研究结果表明,在不同的营养盐水平下细基江蓠都能够较好地生长和吸收N、P。在经过2 d饥饿处理后长达8 d的实验过程中,即使在氮缺乏的N0组,细基江蓠仍保持生长,生长率达到2%·d-1。这可能是细基江蓠在获得性外源P的刺激下启动液泡等营养储备库中的N源补充藻体生长对N的需求。如邹定辉等[20]研究发现藻细胞可以大量吸收NO3-并将其存储在液泡或胞质内,使细胞内氮营养盐水平浓缩105倍以上。李枫[11]研究发现低氮高磷可促进龙须菜(Asparagus schoberioides)的生长,并且与低氮低磷相比,低氮高磷处理提高了龙须菜的光化学效率,这表明海藻有适应氮限制的内在机制。本实验结果表明细基江蓠存在营养盐储存机制,并具有较强的储备营养素能力,因此能够在外源性N、P缺乏时利用储备库中的营养盐存活并保持一定的生长率。
本研究结果还显示,在不同N/P下,N160组(N/P为16/1)细基江蓠生长率最高,藻体湿重增幅达48.3%,显著高于其他3个实验组(P<0.01),N/P也与Redfield比值(16/1)[18]一致。对多种藻类的研究[21, 22]表明,不同N/P对藻类的生长影响显著,N/P差异会对藻细胞的生长、胞内物质的合成与积累产生较大影响。对藻类的营养生理研究发现,适应于富营养化水质的硅藻等在Redfield比值附近生长状态最佳,在介质营养盐充足情况下,中肋骨条藻(Skeletonema costatum)和威氏海链藻(Thalassiosira weissflogii)所需的N/P组成接近16/1,而蓝藻、甲藻等适于寡营养环境的微藻更能适应N/P偏离Redfield比值的环境[23],米氏凯伦藻(Karenia mikimotoi)在N/P为80/1的条件下比生长速率最大[24],可见N/P对不同种类海藻的影响还与他们对营养环境长期适应密切相关。细基江蓠主要生长在富含N、P冲淡水汇入的河口等近岸海区,本研究所用的细基江蓠也是采集于富营养化的潮间带海区,能适应富营养的环境,研究结果表明N/P对细基江蓠生长有显著影响,适应富营养环境的细基江蓠倾向于按Redfield比将所吸收N、P用于自身组织生长,偏离Redfield比则对细基江蓠的生长有明显的抑制效应。
3.2 N、P环境对细基江蓠吸收N、P的影响本研究结果显示,无论是在固定P浓度而N浓度不同的实验中,还是在固定N/P的不同N、P浓度实验中,PO43--P、NH4+-N和NO3--N浓度在实验过程中均明显降低,且细基江蓠对PO43--P、NH4+-N和NO3--N的吸收速率均随着初始营养盐浓度的增加而增加,表明细基江蓠对N、P具有较高的吸收效率。在实验初始阶段的第1-2天,细基江蓠对N、P的去除率就已经很高,这可能与在实验前2 d的饥饿处理有关,在饥饿预培养阶段,藻体只能利用胞内N营养库的N源来维持必要的生长,在营养盐的突然刺激下,饥饿藻体转而对介质中的营养要素进行超吸收或过饱和吸收。江蓠属的圆扁江蓠(Gracilaria txetorii)在实验初期的8 h内就可以吸收2倍于其组织总含N量的NH4+-N,6 h内吸收的N可供应其在N限制的海区生活两周[25]。大型藻类能将超吸收的营养素储存在液泡等场所形成营养库以备环境恶劣时利用[26-28]。因此同属江蓠属的细基江蓠对N、P具有高去除率,尤其当介质中N、P含量陡增时,极大地刺激藻体对氮磷的吸收能力,因此可作为富营养化水质修复的潜在理想物种。
在PO43--P浓度为10 μmol·L-1、N初始浓度为0-320 μmol·L-1时,虽然在整个实验过程中,细基江蓠对PO43--P去除率表现出与湿重增长率相似的变化规律:N160>N320>N40>N0,但是在第3-6天,N320组对PO43--P的吸收和去除率高于N160组,细基江蓠对PO43--P的吸收和去除率随着N浓度的升高而升高,与细基江蓠的生长情况却不尽相同,相似的情况也出现在NH4+-N和NO3--N的吸收过程中。通过比较发现,在该组实验中细基江蓠对P的高吸收去除效率主要出现在高N浓度即高N/P组,而对N的吸收去除效率峰值则主要出现在低N浓度即低N/P组。Redfield定律认为N/P超过16/1时P被认为是限制性因素,N/P小于10/1时N为限制性因素[18],因此在N320组(N/P为32/1)因受P胁迫的刺激,细基江蓠可能倾向于吸收储存更多的P,在N40组(N/P为4/1)因受N胁迫的刺激会选择吸收并储存更多的N。这些被藻细胞额外吸收的N、P,可能会优先存储于液泡等场所而不是被立即用于合成组织等的生长[27, 28],从而导致出现对N、P吸收的去除状况与细基江蓠的生长状况不完全一致的现象。由此可见N/P即氮磷胁迫对细基江蓠对营养盐的去除率有显著影响,细基江蓠更倾向于优先吸收受胁迫的营养要素。
3.3 细基江蓠去除N、P的能力N、P营养盐是海水集约化养殖系统中造成水体富营养化、危害养殖对象的主要因子,目前利用大型海藻去除养殖废水中N、P已成为国内外的研究热点,学者们一致认为利用大型海藻进行水质修复是净化水体、延缓水体富营养化的重要措施之一[29-31]。在江蓠属的相关报道中,在25℃条件下菊花江蓠特定生长速率为2.3%·d-1-3.02%·d-1[32],25℃时脆江蓠相对生长速率约为2.6%·d-1[15];但金玉林等[33]发现26℃时脆江蓠相对生长速率在5%以上。分析本研究中细基江蓠的生长数据得知,细基江蓠吸收的营养盐主要用于生长,特定生长率为(5.74±0.42)%·d-1,高于同类报道中的数值。本研究结果显示,在最佳N/P下细基江蓠在培养后期(第8天)对培养液中PO43--P的去除率均可达96.8%,对NO3--N的去除率为83.9%,对NH4+-N的去除率为94.9%,显著高于许忠能等[15]研究中细基江蓠繁枝变种对NH4+-N(40.7%)、和NO3--N(28.5%)的去除率,也高于吴翔宇等[34]关于芋根江蓠在28 d时对NH4+-N(26.5%)和NO3--N(65.7%)的去除率。由此可见,细基江蓠可用于净化水质,具有作为生物滤器的潜在可能性。
| [1] |
CORREDOR J E, HOWARTH R W, TWILLEY R R, et al. Nitrogen cycling and anthropogenic impact in the tropical interamerican seas[J]. Biogeochemistry, 1999, 46(1/3): 163-178. DOI:10.1023/A:1006116501466 |
| [2] |
CRAWFORD N M. Nitrate: Nutrient and signal for plant growth[J]. The Plant Cell, 1995, 7(7): 859-868. |
| [3] |
DORTCH Q. The interaction between ammonium and nitrate uptake in phytoplankton[J]. Marine Ecology Progress Series, 1990, 61: 183-201. DOI:10.3354/meps061183 |
| [4] |
SMAYDA T J. Harmful algal blooms: Their ecophysiology and general relevance to phytoplankton blooms in the sea[J]. Limnology and Oceanography, 1997, 42(5): 1137-1153. |
| [5] |
JOHANSSON N, GRANELI E. Influence of different nutrient conditions on cell density, chemical composition and toxicity of Prymnesium parvum(Haptophyta)in semi-continuous cultures[J]. Journal of Experimental Marine Biology and Ecology, 1999, 239(2): 243-258. DOI:10.1016/S0022-0981(99)00048-9 |
| [6] |
秦传新, 刘长发, 张立勇. 孔石莼和角叉菜对硝酸氮、磷的吸收及其生化组成变化[J]. 水生态学杂志, 2010, 3(6): 41-46. |
| [7] |
吴晓文, 李瑞香, 徐宗军, 等. 营养盐对浒苔生长影响的围隔生态实验[J]. 海洋科学进展, 2010, 28(4): 538-544. DOI:10.3969/j.issn.1671-6647.2010.04.015 |
| [8] |
张欢, 刘德富, 张佳磊, 等. 两种不同氮磷比下的藻类生长曲线[J]. 湖北工业大学学报, 2017, 32(4): 75-79. DOI:10.3969/j.issn.1003-4684.2017.04.019 |
| [9] |
张莹, 李宝珍, 屈建航, 等. 斜生栅藻对低浓度无机磷去除和生长情况的研究[J]. 环境科学, 2010, 31(11): 2661-2665. |
| [10] |
王菁, 裘丽萍, 孟顺龙, 等. 氮磷比对鱼腥藻和普通小球藻生长竞争的影响[J]. 江苏农业科学, 2014, 42(5): 316-320. DOI:10.3969/j.issn.1002-1302.2014.05.104 |
| [11] |
李枫. 营养盐和培养密度对龙须菜的生理影响[D]. 南京: 南京农业大学, 2009.
|
| [12] |
南春容, 王铁杆, 张鹏, 等. 南麂列岛铜藻氮磷吸收特征研究[J]. 上海海洋大学学报, 2014, 23(5): 706-711. |
| [13] |
钱鲁闽, 徐永健, 王永胜. 营养盐因子对龙须菜和菊花江蓠氮磷吸收速率的影响[J]. 台湾海峡, 2005, 24(4): 546-552. DOI:10.3969/j.issn.1000-8160.2005.04.020 |
| [14] |
杨芳. 三个细基江蓠繁枝变种种群的生长和氮营养特征研究[D]. 南宁: 广西大学, 2014.
|
| [15] |
许忠能, 林小涛, 林继辉, 等. 营养盐因子对细基江蓠繁枝变种氮、磷吸收速率的影响[J]. 生态学报, 2002, 22(3): 366-374. DOI:10.3321/j.issn:1000-0933.2002.03.012 |
| [16] |
李恒, 李美真, 徐智广, 等. 不同营养盐浓度对3种大型红藻氮、磷吸收及其生长的影响[J]. 中国水产科学, 2012, 19(3): 462-470. |
| [17] |
李娟, 黄凌风, 郭丰, 等. 细基江蓠对氮、磷营养盐的吸收及其对赤潮发生的抑制作用[J]. 厦门大学学报(自然科学版), 2007, 46(2): 221-225. DOI:10.3321/j.issn:0438-0479.2007.02.017 |
| [18] |
REDFIELD A C. The biological control of chemical factors in the environment[J]. American Scientist, 1958, 46(3): 205-221. |
| [19] |
李秀辰, 张国琛, 崔引安, 等. 孔石莼对养鲍污水的静态净化研究[J]. 农业工程学报, 1998, 14(1): 173-176. |
| [20] |
邹定辉, 夏建荣. 大型海藻的营养盐代谢及其与近岸海域富营养化的关系[J]. 生态学杂志, 2011, 30(3): 589-595. |
| [21] |
丁刚, 于晓清, 詹冬梅, 等. 不同氮、磷浓度及配比对鼠尾藻幼苗生长的影响[J]. 水产科学, 2014, 33(4): 219-222. DOI:10.3969/j.issn.1003-1111.2014.04.004 |
| [22] |
胡绵好, 袁菊红, 向律成, 等. 不同氮磷比对多年生水生植物生长特性影响的研究[J]. 环境工程学报, 2011, 5(11): 2487-2493. |
| [23] |
刘皓, 高永利, 殷克东, 等. 不同氮磷比对中肋骨条藻和威氏海链藻生长特性的影响[J]. 热带海洋学报, 2010, 29(6): 92-97. |
| [24] |
孙军, 刘东艳, 陈宗涛, 等. 不同氮磷比率对青岛大扁藻、新月柱鞘藻和米氏凯伦藻生长影响及其生存策略研究[J]. 应用生态学报, 2004, 15(11): 2122-2126. DOI:10.3321/j.issn:1001-9332.2004.11.027 |
| [25] |
LOMAS M W, GLIBERT P M. Interactions between NH4+ and NO3- uptake and assimilation: Comparison of diatoms and dinoflagellates at several growth temperatures[J]. Marine Biology, 1999, 133(3): 541-551. DOI:10.1007/s002270050494 |
| [26] |
徐智广. 2种大型经济海藻对海水中营养盐供应的生理响应[D]. 汕头: 汕头大学, 2007.
|
| [27] |
金秋, 金则新, 奚立民. 不同N、P营养盐水平对孔石莼克制赤潮异弯藻效果的影响[J]. 科技通报, 2012, 28(3): 32-37. |
| [28] |
李赵嘉, 曾昭春, 贾佩峤, 等. 大型海藻对氮磷吸收能力的初步研究[J]. 河北渔业, 2014(1): 1-4, 11. |
| [29] |
吕冬伟, 刘欢, 田鹏华, 等. 大型海藻孔石莼对海水中不同形态氮盐和磷酸盐的吸收研究[J]. 山东农业科学, 2019, 51(3): 68-72, 76. |
| [30] |
廖秀睿, 李曦, 柳睿杰. 曲褶刚毛藻在对虾养殖尾水无机氮盐净化中的应用[J]. 海南热带海洋学院学报, 2021, 28(2): 1-5. |
| [31] |
杜欣欣, 刘福利, 袁艳敏, 等. 极北海带幼苗对氮、磷和铁营养元素需求的研究[J]. 水产科学, 2021, 40(1): 81-88. |
| [32] |
范皖苏. 菊花江蓠(Gracilaria lichevoides)对环境因子的适应性及其营养体低温保种技术初步研究[D]. 苏州: 苏州大学, 2011.
|
| [33] |
金玉林, 吴文婷, 陈伟洲. 不同温度和盐度培养条件对脆江蓠生长及生化组分影响[J]. 南方水产科学, 2012, 8(2): 51-57. |
| [34] |
吴翔宇, 黄良夫, 杨守国, 等. 芋根江蓠对对虾养殖水体氮磷的去除效果[J]. 现代农业科技, 2021(8): 178-179. |



