2. 广西医科大学第二临床医学院, 广西南宁 530007
2. The Second Clinical Medical College of Guangxi Medical University, Nanning, Guangxi, 530000, China
经颅多普勒超声(Transcranial Doppler Ultrasound,TCD)是一项重要的无创脑监测技术,近年来在各类重症神经损伤患者中已进行了大量研究并被广泛应用,包括重型颅脑创伤、脓毒性脑病、心肺复苏后缺血缺氧性脑病等[1-4]。而接受体外膜肺氧合(Extracorporeal Membrane Oxygenation,ECMO)支持治疗的患者亦存在发生各类急性脑损伤的高危风险[5],特别是接受动脉静脉体外膜肺氧合(Venoarterial Extracorporeal Membrane Oxygenation,VA-ECMO)治疗的患者,因心脏泵血功能下降导致机体血流动力学紊乱,往往表现为平均动脉压(Mean Arterial Pressure,MAP)下降、脉压差(Pulse Pressure,PP)变小,进而导致脑灌注不足。利用TCD在VA-ECMO治疗的患者中进行相关脑血流动力学评估,有助于早期发现该类患者是否发生脑损伤及其病理生理学变化,便于病情判断。本研究拟通过TCD监测VA-ECMO患者脑血流动力学,分析脑血流参数变化与患者脉压、ECMO流量的关系,为指导临床治疗提供依据。
1 对象与方法 1.1 研究对象2020年11月至2022年1月广西医科大学第二附属医院收治的行VA-ECMO支持治疗的成人患者(年龄>18岁),共16例。本研究为前瞻性观察研究,经患方知情同意并经广西医科大学第二附属医院伦理委员会批准。
1.2 方法 1.2.1 临床治疗所有纳入患者均采用股静脉和股动脉置管方式放置ECMO导管;在ECMO转机后,对患者常规进行镇静镇痛、呼吸机辅助通气(保护性通气策略),通过调节呼吸机和ECMO气流使血气二氧化碳分压(PaCO2)维持在35-45 mmHg;当红细胞压积<30%时输注红细胞,血小板计数小于100×103/mm3时输注血小板;通过使用肝素维持活化凝血时间(ACT)目标在180-220 s;同时尽量维持MAP在70-80 mmHg[6],若此时PP≤10 mmHg,予降低后负荷处理使MAP进一步降低至60-75 mmHg[7],并维持ECMO流量在4.0 L/min以上。
1.2.2 观察指标(1) 基础数据。根据转机后脉压差是否大于10 mmHg将纳入观察的VA-ECMO患者分为两组,A组PP>10 mmHg,B组PP≤10 mmHg。记录两组VA-ECMO治疗患者的一般资料特征,急性生理和慢性健康状况评估(APACHE Ⅱ)评分、全面无反应性量表(FOUR)评分、血管活性药物评分(VIS)、ECMO治疗时间、ICU住院时间、出院时脑功能表现分级(Cerebral Performance Category,CPC),其中CPC 1-2级为神经功能预后良好,CPC 3-5级为预后不良。若住院期间颅脑CT证实存在脑梗死、脑出血、脑水肿、缺血缺氧性脑病或有癫痫症状发作, 则认为患者ECMO治疗期间出现神经系统并发症并记录。
(2) 血流动力学管理指标。记录两组患者行TCD检查时的MAP、PP、ECMO血流速度、患者尿量。
(3) 相关生物标志物。记录患者上ECMO 24 h内的红细胞压积、ACT、降钙素原(Procalcitonin,PCT)。
(4) TCD监测。使用TCD(以色列瑞迈德有限公司,Digi-Lite,2.0 MHz探头)在患者ECMO转机后24 h内获取相关脑血流参数,包括双侧大脑中动脉(Middle Cerebral Arterys,MCA)血流频谱形态、收缩期血流速度(Vs)、舒张期血流速度(Vd)、平均血流速度(Vm)、阻力指数(RI)、搏动指数(PI),并计算脑血流指数(Cerebral Blood Flow Index,CBFi,CBFi=10 MAP/1.47 PI)。
(5) 统计学方法。采用SPSS 25.0软件对数据进行统计学处理。正态分布的计量资料以均数±标准差表示,组间比较采用t检验;非正态分布的计量资料以四分位数间距表示,组间比较采用Mann-Whitney U检验。计数资料用例数(%)表示,组间比较采用卡方检验。P<0.05认为差异有统计学意义。
2 结果与分析 2.1 一般临床资料与实验室结果共纳入16例VA-ECMO支持治疗患者,其中男性10例,女性6例。上ECMO的原因有急性心肌梗死6例(37.5%)、心脏术后低心排综合征4例(25%)、暴发性心肌炎2例(12.5%)、心肌病3例(18.75%)及肺栓塞1例(6.25%)。其中,顺利撤除ECMO的患者A组8例(80%),B组2例(33.33%),差异无统计学意义(P>0.05)。出院时表现为CPC 1-2级的患者A组4例(44%),B组1例(20%),差异无统计学意义(P>0.05);16例患者中有2例因家属放弃治疗无法确定其神经功能结局。12例患者在ECMO期间或ECMO撤机后完成了CT检查,其中6例CT有阳性发现,A组和B组各3例。A、B两组MAP及ECMO流量差异均有显著意义,B组MAP低于A组[(59.44±15.54)mmHg vs (77.93±8.68) mmHg,P=0.008],B组ECMO流量高于A组[(4.29±0.88)L/min vs (3.37±0.74) L/min,P=0.041](表 1)。
| 项目 Item |
A组(n=10) A group (n=10) |
B组(n=6) B group (n=6) |
P值 Pvalue |
t值(Z值) t value (Z value) |
| Male [n(%)] | 5(50) | 4(67) | 0.633 | |
| Age (years) | 57.70 | 48.33 | 0.277 | 1.130 |
| FOUR | 3.40±1.35 | 3.00±1.67 | 0.607 | 0.526 |
| APACHE Ⅱ | 28.60±4.12 | 27.67±6.74 | 0.734 | 0.347 |
| MAP (mmHg) | 77.93±8.68 | 59.44±15.54 | 0.008 | 3.085 |
| VIS M (P25, P75) | 50.00 (9.50, 91.25) | 7.50(3.75, 42.00) | 0.092 | -1.686 |
| Urinary output M (P25, P75,mL/h) | 30(0, 105.00) | 52.85(0, 107.50) | 0.823 | -0.224 |
| ECMO flow (L/min) | 3.37±0.74 | 4.29±0.88 | 0.041 | -2.246 |
| ECMO successfully weaned [n(%)] | 8(80) | 2(33) | 0.118 | |
| CT positive [n(%)] | 3(43)* | 3(60)** | 1.00 | |
| CPC 1-2 [n(%)] | 4(44)Δ | 1(20)ΔΔ | 0.580 | |
| CPC 3-5 [n(%)] | 5(55)Δ | 4(80)ΔΔ | 0.580 | |
| Duration of ECMO M (P25, P75,d) | 5.00(3.00, 5.50) | 4.50(3.00, 9.50) | 0.911 | -0.112 |
| ICU length of stay M (P25, P75,d) | 14.00(10.50, 18.25) | 9.50(3.00, 16.25) | 0.210 | -1.253 |
| PaCO2 (mmHg) | 33.76±5.08 | 39.01±8.81 | 0.148 | -1.529 |
| HCT (%) | 21.34±6.10 | 28.12±9.70 | 0.105 | -1.731 |
| ACT (s) | 206(180, 266) | 212(195, 233) | 0.913 | -0.109 |
| PCT M (P25, P75,ng/mL) | 7.25(2.64, 22.88) | 33.32(7.43, 91.68) | 0.239 | -1.179 |
| Note: *A group only have 7 patients performed CT scan,**B group only have 5 patients performed CT scan; Δ There is 1 patient in A group whose family members abandoning treatment that neurological function can not be observed and CPC was not performed, ΔΔThere is also 1 patient in B group whose family members abandoning treatment, and CPC score is not performed | ||||
2.2 TCD脑血流动力学监测结果
两组患者脑血流动力学结果如表 2所示,相较于PP>10 mmHg组(A组),PP≤10 mmHg组(B组)患者MCA的Vs、Vm有所下降,但差异无统计学意义,两组患者两侧MCA的CBFi差异亦无统计学意义。B组患者右侧MCA的PI值[0.32(0.14,0.48)]较A组[0.68(0.33,0.82)]明显下降(P=0.039),右侧MCA的RI值[0.26(0.12,0.37)]较A组[0.47(0.27,0.52)]也明显下降(P=0.039),二者差异均有统计学意义。
| 脑血流动力学参数 Cerebral hemodynamic parameters |
A组(n=10) A group (n=10) |
B组(n=6) B group (n=6) |
P值 P value |
Z值 Z value |
| LVm M (P25, P75,cm/s) | 42.85(35.90, 66.80) | 37.85(21.28, 70.45) | 0.515 | -0.651 |
| RVm M (P25, P75,cm/s) | 45.10(35.85, 72.60) | 49.75(32.90, 64.53) | 0.664 | -0.434 |
| LVs M (P25, P75,cm/s) | 64.10(43.45, 91.63) | 44.30(29.80, 75.28) | 0.278 | -1.085 |
| RVs M (P25 , P75,cm/s) | 63.65(55.85, 94.55) | 58.50(39.13, 76.30) | 0.386 | -0.868 |
| LVd M (P25, P75,cm/s) | 35.11(27.39, 43.49) | 34.63(17.02, 68.10) | 0.828 | -0.217 |
| RVd M (P25, P75,cm/s) | 36.71(30.45, 57.37) | 42.94(29.81, 60.72) | 0.828 | -0.217 |
| LPI M (P25, P75) | 0.54(0.31, 0.94) | 0.26(0.11, 0.97) | 0.129 | -1.519 |
| RPI M (P25, P75) | 0.68(0.33, 0.82) | 0.32(0.14, 0.48) | 0.039 | -2.061 |
| LRI M (P25, P75) | 0.40(0.26, 0.58) | 0.22(0.10, 0.49) | 0.116 | -1.574 |
| RRI M (P25, P75) | 0.47(0.27, 0.52) | 0.26(0.12, 0.37) | 0.039 | -2.062 |
| LCBFi M (P25, P75,mL/min) | 627(525, 705) | 507(387, 704) | 0.329 | -0.976 |
| RCBFi M (P25, P75,mL/min) | 635(525, 682) | 505(427, 680) | 0.278 | -1.085 |
| Note: L for the left MCA, R for the right MCA | ||||
3 讨论
危重患者的血流动力学紊乱会导致包括大脑在内的器官灌注不足。有研究报道VA-ECMO辅助治疗期间患者神经系统并发症的发生率为15%,主要有脑死亡、脑梗死、脑出血和癫痫四大类[8]。大脑作为人体的生命中枢,保证脑灌注是诊疗过程的重中之重,临床上判断机体器官灌注常用的指标有神志、尿量、乳酸,但是在危重患者中镇静镇痛药物的使用、急性肾损伤所致无尿等使上述项目判断受到限制,脑灌注及脑功能的评估则需要更客观、可视的检测手段辅助判断。TCD具有无创、安全、操作简单、可重复监测的优点,大量研究证实了TCD在脑灌注、脑血管调节能力以及是否发生脑血管痉挛、颅内高压、脑死亡等脑损伤方面有预判作用[3, 9-11]。而ECMO是一种需要精细管理且费用昂贵的支持治疗手段,在治疗的过程中更需要实时动态评估各重要器官的灌注,特别是评估大脑中枢的灌注是否充足,有无发生严重脑损伤。利用TCD可直观了解ECMO患者的脑血流变化并判断脑灌注情况。有学者认为VA-ECMO期间脑血流减少和非搏动性血流可能在脑损伤的发病机制中起作用[12],因此本研究的主要对象为接受VA-ECMO治疗的患者,观察分析其出现脉压大于10 mmHg以及脉压下降甚至平流时的脑血流参数特点。
影响脑血流的首要因素是血压,而在VA-ECMO时ECMO流量也是重要影响因素。脉压差小于10 mmHg时可认为心肌顿抑、心脏泵功能衰竭,可能反映了左室扩张的发生[7, 13]。本研究发现,当脉压差明显小于10 mmHg时,MCA血流频谱形态也和外周动脉血流压力波形一样表现为平流或者趋向平流[图 1(a)],MCA血流下降,其中Vs、Vm下降,同时右侧MCA的PI值也明显下降,这与Kavi等[14]的研究一致,此时低PI受心功能影响,不应误认为是脑血管扩张或脑血流停滞。当心肌顿抑或心脏骤停时,脑灌注只能依靠提高ECMO流量来维持[15],当患者血流形态为非搏动血流时,其脑血流形态与正常生理状态及心泵功能尚存的其他疾病状态均不同,此时多少血流量能保证脑灌注,又该使用何种脑血流指标判断病情及预后仍未明确,这也是笔者开展此研究的原因。在一项儿童VA-ECMO的研究中发现,PI的增高可能提示患儿存在急性神经损伤[16]。本研究中有6例患者颅脑CT发现存在脑出血或脑梗死,但其PI普遍偏低或正常,仅有1例PI高于正常,但本研究例数较少,无法证实PI与脑血管事件的相关性,能否使用PI预判成人VA-ECMO患者发生急性神经系统并发症仍待进一步研究。另外还发现1例急性心肌梗死导致心脏骤停后行VA-ECMO治疗的患者的脉压差低于10 mmHg时ECMO流量为4.7 L/min,此时大脑中动脉Vs、PI值均较低[图 1(a)],但该患者仍获得良好神经功能结局,原因可能是充足的ECMO流量维持了大脑平均脑血流速度,使血氧输送得以保证,而随着心功能的好转,PI逐渐恢复至正常生理水平[图 1(b)]。下一步可能需要进一步分析这类患者PI的动态变化与预后的相关性。
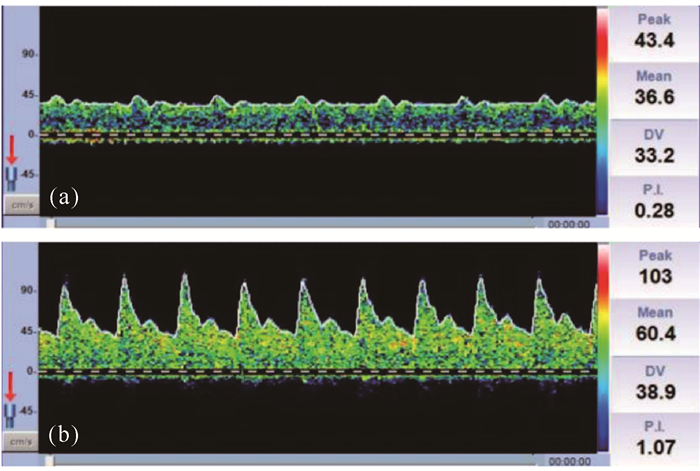
|
| 图 1 急性心肌梗死患者行VA-ECMO治疗时其脑血流变化情况 Fig. 1 Changes of cerebral blood flow in patients with acute myocardial infarction treated with VA-ECMO |
VA-ECMO治疗心功能衰竭病人时往往会面临左心超载的问题,较高的流量及压力可加重心脏后负荷,而较低的压力可能又无法保证患者脑血流灌注,因此MAP往往需要控制在相对较低但又能保证器官基本灌注的水平,通过优化ECMO流量、血管活性药物和液体疗法改善左室扩张。但如何寻找VA-ECMO最佳MAP仍悬而未决。有研究通过回顾性分析寻找最佳灌注压,发现VA-ECMO患者的MAP低于70 mmHg时无一存活[6],但该研究并未观察及收集患者脑血流的情况,无法了解当时的脑灌注。在本研究中,脉压差≤10 mmHg的7例VA-ECMO患者均面临左心超载的问题,均给予了降低后负荷的处理,同时提高了ECMO血流。笔者动态观察了1例患者从非搏动血流到恢复搏动血流时的脑血流(图 2),为减轻左室超载使用了硝酸甘油,患者MAP曾低至55 mmHg,但其ECMO流量基本维持在4 L/min以上,停用镇静镇痛后该患者苏醒,且其脑电图、脑局部组织氧饱和度均未见明显异常。说明利用TCD动态监测ECMO患者脑血流或许可指导调整最佳MAP及ECMO流量,但仍需设计合理的大样本临床对照研究进一步证实。
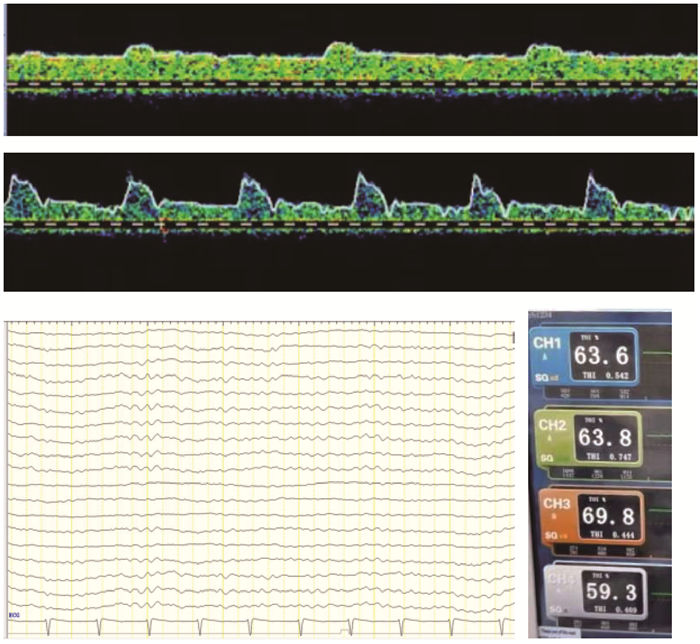
|
| 图 2 心脏术后低心排综合征患者的MCA血流频谱及其脑电图、局部组织氧饱和度 Fig. 2 MCA blood flow spectrum, EEG and local tissue oxygen saturation in patients with low cardiac drainage after cardiac surgery |
本研究存在局限性。首先,未能对患者ECMO上机前进行颅脑CT检查,无法确定其脑血管病变是否发生于ECMO治疗前,部分患者因为病情不稳定无法完成CT检查。其次,由于家属自动放弃等原因,未能追踪到这类患者的神经功能结局。最后,因为研究的样本量较小,结果可能会受影响,且研究仅纳入了VA-ECMO患者,不能反映其他人群情况,而VV-ECMO患者也可能存在脑血流动力学异常,未来还需要进一步验证。
4 结论在VA-ECMO治疗的过程中利用TCD监测该类患者的脑血流动力学具有可行性,TCD在ECMO患者脑功能评估中具有重要指导意义。但利用TCD在早期发现患者神经系统并发症的证据仍不充分,今后将继续开展该方向的临床研究。
| [1] |
ROBBA C, POZZEBON S, MORO B, et al. Multimodal non-invasive assessment of intracranial hypertension: An observational study[J]. Critical Care, 2020, 24(1): 379. DOI:10.1186/s13054-020-03105-z |
| [2] |
冯清, 艾美林, 黄立, 等. 脑血流动力学及脑氧饱和度变化与感染性休克患者预后的相关性: 前瞻性队列研究[J]. 协和医学杂志, 2019, 10(5): 481-488. DOI:10.3969/j.issn.1674-9081.2019.05.010 |
| [3] |
BONOW R H, YOUNG C C, BASS D I, et al. Transcranial Doppler ultrasonography in neurological surgery and neurocritical care[J]. Neurosurgical Focus, 2019, 47(6): E2. DOI:10.3171/2019.9.FOCUS19611 |
| [4] |
RASULO F A, TOGNI T, ROMAGNOLI S. Essential noninvasive multimodality neuromonitoring for the critically ill patient[J]. Critical Care, 2020, 24(1): 100. DOI:10.1186/s13054-020-2781-2 |
| [5] |
SUTTER R, TISLJAR K, MARSCH S. Acute neurologic complications during extracorporeal membrane oxygenation: A systematic review[J]. Critical Care Medicine, 2018, 46(9): 1506-1513. DOI:10.1097/CCM.0000000000003223 |
| [6] |
TANAKA D, SHIMADA S, MULLIN M, et al. What is the optimal blood pressure on veno-arterial extracorporeal membrane oxygenation? Impact of mean arterial pressure on survival[J]. ASAIO Journal, 2019, 65(4): 336-341. DOI:10.1097/MAT.0000000000000824 |
| [7] |
BRATTI J P R, CAVAYAS Y A, NOLY P E, et al. Modalities of left ventricle decompression during VA-ECMO therapy[J]. Membranes, 2021, 11(3): 209. DOI:10.3390/membranes11030209 |
| [8] |
LORUSSO R, BARILI F, MAURO M D, et al. In-hospital neurologic complications in adult patients undergoing venoarterial extracorporeal membrane oxygenation: Results from the extracorporeal life support organization registry[J]. Critical Care Medicine, 2016, 44(10): e964-672. DOI:10.1097/CCM.0000000000001865 |
| [9] |
GREER D M, SHEMIE S D, LEWIS A, et al. Determination of brain death/death by neurologic criteria: The world brain death project[J]. The Journal of the American Medical Association, 2020, 324(11): 1078-1097. |
| [10] |
BERTUETTI R, GRITTI P, PELOSI P, et al. How to use cerebral ultrasound in the ICU[J]. Minerva Anestesiologica, 2020, 86(3): 327-340. |
| [11] |
PIERRAKOS C, ATTOU R, DECORTE L, et al. Transcranial Doppler to assess sepsis-associated encephalopathy in critically ill patients[J]. BMC Anesthesiology, 2014, 14: 45. DOI:10.1186/1471-2253-14-45 |
| [12] |
RISNES I, WAGNER K, NOME T, et al. Cerebral outcome in adult patients treated with extracorporeal membrane oxygenation[J]. The Annals of Thoracic Surgery, 2006, 81(4): 1401-1406. |
| [13] |
YANG F, JIA Z S, XING J L, et al. Effects of intra-aortic balloon pump on cerebral blood flow during peripheral venoarterial extracorporeal membrane oxygenation support[J]. Journal of Translational Medicine, 2014, 12: 106. DOI:10.1186/1479-5876-12-106 |
| [14] |
KAVI T, ESCH M, RINSKY B, et al. Transcranial Doppler changes in patients treated with extracorporeal membrane oxygenation[J]. Journal of Stroke and Cerebrovascular Diseases, 2016, 25(12): 2882-2885. DOI:10.1016/j.jstrokecerebrovasdis.2016.07.050 |
| [15] |
INOUE A, HIFUMI T, SAKAMOTO T, et al. Extracorporeal cardiopulmonary resuscitation for out-of-hospital cardiac arrest in adult patients[J]. Journal of the American Heart Association, 2020, 9(7): e015291. DOI:10.1161/JAHA.119.015291 |
| [16] |
O'BRIEN N F, BUTTRAM S D W, MAA T, et al. Cerebrovascular physiology during pediatric extracorporeal membrane oxygenation: A multicenter study using transcranial doppler ultrasonography[J]. Pediatric Critical Care Medicine, 2019, 20(2): 178-186. |



