柑橘溃疡病是由柑橘黄单胞菌柑橘亚种(Xanthomonas citri subsp.citri)引起的影响全球柑橘种植产业的细菌性溃疡病[1-3]。柑橘溃疡病会影响柑橘的生产,从而导致产量损失、果实质量下降和贸易壁垒[4]。近年来, 中国柑橘产业发展迅速,栽培面积和年产量已超过美国和巴西,成为世界第一大柑橘生产国。中国各主要柑橘产区几乎皆有柑橘溃疡病发生,对柑橘尤其是橙类产业造成了严重损失[5]。目前田间常用的防治药剂主要有铜制剂、农用抗生素、噻唑类和微生物制剂等。其中铜制剂因杀菌效果显著,作用时间长,成为防治柑橘溃疡病的首选药剂。但铜制剂的过度使用会造成溃疡病菌抗性增强,同时会造成环境污染,从而导致防治难度加大[5, 6];抗生素类药剂的长期施用会在人体内不断蓄积,对人体肝肾、淋巴细胞等造成伤害,还会危害农作物的生长,对植物的生长产生抑制作用,降低微生物的多样性和活性,并产生抗生素抗性基因,抗生素的肆意使用已导致病菌产生耐药性甚至产生超级细菌[7, 8];噻唑类化合物会引起人体眼睛、皮肤和呼吸道刺激等,甚至会对人体产生致癌作用[9]。因此,防治药剂的减量化施用,减小防治药剂对环境产生的污染,具有重要的意义。韦文添等[10]研究表明,“唑酮·乙蒜素”和“春雷霉素”的防效达90%以上;赵洪涛等[11]研究表明,200亿活芽孢/g枯草芽孢杆菌可湿性粉剂和1.6%噻霉酮涂抹剂对沃柑溃疡病有较好的防治效果,防效分别为73.45%和71.07%。虽然前人已经对柑橘溃疡病的化学防治防效进行了研究,但针对防治药剂减量化施用,防止药剂滥用的研究却鲜有报道。本研究对病原菌纯化分离,结合形态学观察、生理生化特征及分子生物学方法对病原菌进行系统性鉴定。通过浑浊度法测定不同防治药剂对病原菌的毒力,采用分光光度法测定病原菌在防治药剂作用下的生长变化情况,探究防治药剂的联合施用方式,旨在为柑橘溃疡病的防治及防治药剂减量化施用提供科学依据。
1 材料与方法 1.1 试验药剂铜类:20%噻菌铜悬浮剂(浙江龙湾化工有限公司)、20%松脂酸铜悬浮剂(青岛中达农业科技有限公司),农用抗生素类:12%中生菌素可湿性粉剂(福建凯立生物制品有限公司),生物制剂:0.5%靓果安水剂(河北万特生物化学有限公司)、80%乙蒜素乳油(开封大地农化生物科技有限公司),铜锌制剂:78%波尔·锰锌可湿性粉剂(美国仙农有限公司)。
1.2 病原菌分离及生物学特征 1.2.1 病原菌的分离及形态学观察柑橘溃疡病病叶来自广西南宁市武鸣区双桥镇下渌村不同果园的沃柑果树。剪取病健交界处的组织,用75%乙醇消毒30 s,再用无菌水清洗3次后,将消毒后的叶片置于装有无菌水的离心管中捣碎。然后用接种环蘸取菌悬液,采用平板划线法在NA培养基上进行划线分离后,置于恒温培养箱中,30℃条件下倒置培养48 h,挑取单菌落分离纯化培养,观察平板上的菌落形态,将病原菌梯度酒精脱水、冷冻干燥、喷金后通过扫描电子显微镜观察细菌形态[11, 12]。
1.2.2 生理生化特征生理生化特征鉴定实验方法参照《伯杰氏细菌鉴定手册》[13]。
1.2.3 温度对病原菌生长的影响将病原菌用无菌水配置成1×107 CFU/mL浓度的菌悬液,接种100 μL菌悬液于100 mL NB培养基中,分别将各NB培养基置于21℃、24℃、27℃、30℃、33℃、36℃,120 r/min条件下恒温振荡培养48 h后,在600 nm处测定其吸光度,每个处理设4次重复。
1.2.4 pH对病原菌生长的影响用磷酸盐缓冲液将NB液体培养基pH值调至5.00,6.00,7.00,8.00,9.00,10.00。将100 μL菌悬液接入100 mL pH值不同的培养基中,在30℃、120 r/min条件下培养48 h后测定其吸光度,每个处理设4次重复。
1.3 病原菌分子生物学鉴定合成3对柑橘溃疡病菌特异性引物以及1对通用引物(表 1)(引物1/引物2和引物3/引物4为柑橘溃疡病菌A菌系特异性引物,引物5/引物6为柑橘溃疡病菌致病因子pthA特异性引物,引物7/引物8为通用引物)对纯化菌株进行分子生物学鉴定。采用CTAB法提取病原菌DNA,进行PCR扩增。PCR扩增体系及扩增程序如下:DNA 2 μL、Premix Taq 25 μL、上下游引物各2.5 μL、用灭菌双蒸水补足至50 μL;94℃预变性5 min后,以94℃变性30 s,55℃退火30 s,72℃延伸30 s为1个循环,进行30个循环,再72℃延伸10 min,4℃保存。PCR产物经1%琼脂糖凝胶电泳检测后,送至金唯智生物科技有限公司测序。
| 序号 Serial number |
引物序列(5′-3′) Primer sequence (5′-3′) |
目标片段(bp) Target frag- ment (bp) |
| 1 | CTTCAACTCAAACGCCGGAC[14-16] | |
| 2 | CATCGCGCTGTTCGGGAG | 197 |
| 3 | TTCGGCGTCAACAACCTG[17] | |
| 4 | AACTCCAGCACATACGGGTC | 413 |
| 5 | CGCCATCCCCACCACCACCACGAC[18] | |
| 6 | AACCGCTCAATGCCATCCACTTCA | 582 |
| 7 | ATGTCGACAGGCCTAACACATGCAAGTC | |
| 8 | ATGTCGACGGGCGGTGTGTACAAGGC | 1 060 |
1.4 不同防治药剂对病原菌的室内毒力测定 1.4.1 药剂配置
通过预实验确定各防治药剂的抑菌浓度范围,将20%噻菌铜悬浮剂稀释成4 000 μg/mL、3 000 μg/mL、2 500 μg/mL、2 000 μg/mL、1 500 μg/mL溶液;将20%松脂酸铜悬浮剂稀释成4 000 μg/mL、3 000 μg/mL、2 000 μg/mL、1 500 μg/mL、750 μg/mL溶液;将12%中生菌素可湿性粉剂稀释成4 000 μg/mL、3 000 μg/mL、2 000 μg/mL、1 500 μg/mL、1 000 μg/mL溶液;将0.5%靓果安水剂稀释成0.800 μg/mL、0.500 μg/mL、0.250 μg/mL、0.200 μg/mL、0.125 μg/mL溶液;将80%乙蒜素乳油稀释成40 μg/mL、30 μg/mL、20 μg/mL、15 μg/mL、10 μg/mL溶液;将78%波尔·锰锌可湿性粉剂稀释成780 μg/mL、520 μg/mL、390 μg/mL、260 μg/mL、195 μg/mL溶液。
1.4.2 防治药剂室内毒力测定用浑浊度法[19, 20]测定柑橘溃疡病菌对防治药剂的敏感性。在100 mL NB培养基中分别加入1.4.1节中配置的药剂,以不含药培养基为对照,每个处理设4次重复。在配置好的培养基中均加入100 μL菌悬液,置于30℃、120 r/min条件下振荡培养。待对照处理到对数生长期后,测定并记录各处理的浑浊度,计算生长抑制率,利用SPSS软件对药剂质量浓度对数值和防效几率值进行回归分析,求得各防治药剂的毒力回归方程及半数有效浓度(EC50)。
1.5 病原菌在防治药剂作用下的生长变化将防治药剂分别稀释至半数有效浓度,取1 mL加入100 mL NB液体培养基中,设不含药培养基为空白对照,接入100 μL菌液后置于30℃、120 r/min条件下振荡培养,每个处理设4次重复。每12 h测定1次吸光度,观察细菌96 h内的生长变化情况。
1.6 80%乙蒜素乳油与0.5%靓果安水剂的联合防治在100mL NB培养基中加入1 mL 0.41 μg/mL 0.5%靓果安水剂,接入100 μL菌液后置于30℃、120 r/min条件下振荡培养48 h后,再加入1 mL 32.0 μg/mL 80%乙蒜素乳油,每个处理设4次重复,观察其96 h内吸光度的变化情况。
在100 mL NB培养基中同时加入等质量浓度的0.5%靓果安水剂和80%乙蒜素乳油,置于30℃、120 r/min条件下振荡培养,每个处理设3次重复,观察其96 h内吸光度的变化情况。
2 结果与分析 2.1 病原菌生物学特征 2.1.1 病原菌形态学特征观察菌株在电子显微镜下和在NA培养基上的形态特征,该菌为黄色长杆菌,菌落呈圆形,黄色,全缘,表面光滑,有光泽,微隆起,黏稠,与之前报道的柑橘溃疡病菌相似[11, 21](图 1)。
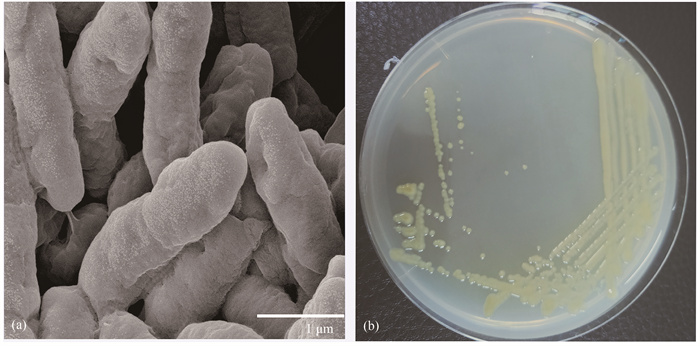
|
| (a)电子显微镜(×20 000)下细菌形态;(b)平板上菌落形态 (a) Bacterial morphology under electron microscope (×20 000);(b) Colony morphology on medium 图 1 病原菌形态特征 Fig. 1 Morphological characteristics of pathogens |
2.1.2 生理生化特征
经过生理生化特征分析,发现病原菌革兰氏染色结果、M-R试验、硝酸盐实验、硫化氢实验呈阴性,V-P试验、吲哚实验、柠檬酸盐实验、过氧化氢酶呈阳性,病原菌能水解明胶、淀粉和七叶苷,与Xanthomonas的生理生化特性基本一致。
2.2 温度和pH对病原菌生长的影响在21-30℃,OD600值随着温度升高逐渐增加,细菌生长速率变快;在30-36℃,OD600值随着温度升高逐渐增加,细菌生长速率受到抑制;30℃时OD600值最大,为病原菌最适宜生长温度;pH值在5.00-7.00,OD600值随着pH值增大而增加;pH值在7.00-10.00,OD600值随着pH值增大而减小;pH值为7.00时OD600值最大,为病原菌最适合生长pH值。综上,温度为30℃、pH值为7.00为病原菌最适宜生长条件(表 2、表 3)。
| 温度(℃) Temperature (℃) |
OD600值 OD600 value |
| 21 | 0.90±0.05c |
| 24 | 0.95±0.02b |
| 27 | 0.97±0.03ab |
| 30 | 1.00±0.01a |
| 33 | 0.95±0.05b |
| 36 | 0.86±0.04c |
| 注:不同小写字母表示差异显著(P < 0.05) Note: Different lowercase letters indicate significant difference (P < 0.05) | |
| pH值 pH value |
OD600值 OD600 value |
| 5.00 | 0.80±0.05d |
| 6.00 | 0.95±0.02b |
| 7.00 | 1.00±0.03a |
| 8.00 | 0.90±0.06bc |
| 9.00 | 0.86±0.02c |
| 10.00 | 0.72±0.04e |
| 注:不同小写字母表示差异显著(P < 0.05) Note: Different lowercase letters indicate significant difference (P < 0.05) | |
2.3 病原菌分子生物学鉴定
利用引物1/引物2、引物3/引物4、引物5/引物6以及细菌16S rDNA通用引物7/引物8检测病原菌DNA(图 2)并结合测序结果,分别得到符合预期大小的197 bp、413 bp、582 bp和1 060 bp的目的条带。将PCR产物测序后得到的序列在Genbank中进行Nucleotide BLAST分析。结果显示,引物1/引物2扩增的序列与X.citri subsp. citri strain Xcc49(登录号CP024 030.1)相似度为98.96%;引物3/引物4扩增的序列与X.citri subsp. citri strain Xcc49(登录号CP023 662.1)相似度为98.81%;引物5/引物6扩增的序列与X.citri subsp.citri strain Xcc49(登录号CP023 662.1)相似度为99.81%,引物7/引物8扩增的序列与X.axonopodis strain THKL1(登录号MT328 603.1)相似度为99.81%。结合4对不同引物的扩增结果,证明病原菌为柑橘溃疡病菌(X.citri subsp.citri),A菌系。
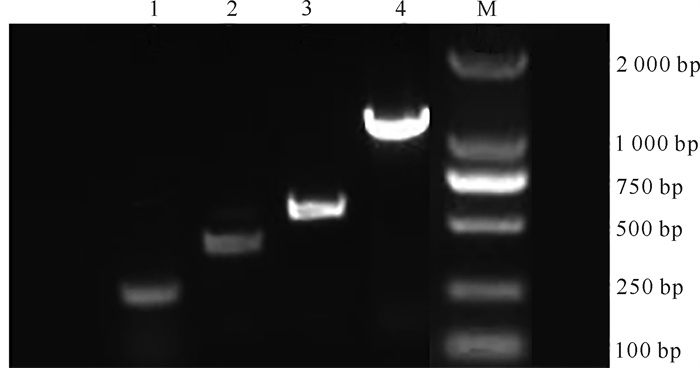
|
| 1,2,3,4,M依次代表引物1/引物2、引物3/引物4、引物5/引物6、引物7/引物8及DNA Marker 1, 2, 3, 4, M represent primer 1/ primer 2, primer 3/ primer 4, primer 5/ primer 6, primer 7/ primer 8 and DNA Marker 图 2 特异性引物PCR扩增结果 Fig. 2 Results of PCR amplification with specific primers |
2.4 防治药剂毒力测定结果
从表 4可知,20%噻菌铜悬浮剂、20%松脂酸铜悬浮剂、78%波尔·锰锌可湿性粉剂、12%中生菌素可湿性粉剂、80%乙蒜素乳油、0.5%靓果安水剂的EC50值从大到小依次为26.60 μg/mL、18.80 μg/mL、3.39 μg/mL、3.01 μg/mL、0.32 μg/mL、0.004 1 μg/mL。0.5%靓果安水剂EC50值最小,防治效果最佳。
| 防治药剂 Bactericide |
稀释质量浓度(μg/mL) Dilution mass concentration (μg/mL) |
毒力回归方程 Virulence regression equation |
回归系数(R2) Regression coefficient (R2) |
EC50值(μg/mL) EC50 value (μg/mL) |
| 20%噻菌铜悬浮剂20% Thiodiazole copper SA |
4 000 3 000 2 500 2 000 1 500 |
y=5.6455x-3.0440 | 0.995 7 | 26.60 |
| 20%松脂酸铜悬浮剂20% Resin acid copper salt SA |
4 000 3 000 2 000 1 500 750 |
y=2.0748x+2.3863 | 0.990 5 | 18.80 |
| 80%乙蒜素乳油80% Ethylicin EC |
40 30 20 15 10 |
y=4.3218x+7.1346 | 0.995 4 | 0.32 |
| 0.5%靓果安水剂0.5% Berberine AS |
0.8 0.5 0.25 0.2 0.125 |
y=2.4016x+10.7350 | 0.990 8 | 0.004 1 |
| 78%波尔·锰锌可湿性粉剂78% Boer manganese zinc WP |
780 520 390 260 195 |
y=7.7044x+0.9113 | 0.990 8 | 3.39 |
| 12%中生菌素可湿性粉剂12% Zhongshengmycin WP |
4 000 3 000 2 000 1 500 1 000 |
y=2.1122x+3.9881 | 0.994 6 | 3.01 |
2.5 柑橘溃疡病菌在防治药剂作用下生长变化
由图 3可知,36 h时,OD600值依次为20%噻菌铜悬浮剂>20%松脂酸铜悬浮剂>78%波尔·锰锌可湿性粉剂>12%中生菌素可湿性粉剂>80%乙蒜素乳油>0.5%靓果安水剂;48 h时,OD600值依次为20%噻菌铜悬浮剂>20%松脂酸铜悬浮剂>80%乙蒜素乳油>78%波尔锰锌可湿性粉剂>12%中生菌素可湿性粉剂>0.5%靓果安水剂;60-72 h,OD600值依次为20%噻菌铜悬浮剂>20%松脂酸铜悬浮剂>0.5%靓果安水剂>12%中生菌素可湿性粉剂>78%波尔锰锌可湿性粉剂>80%乙蒜素乳油;84 h后,只有80%乙蒜素乳油表现出明显的防治效果。
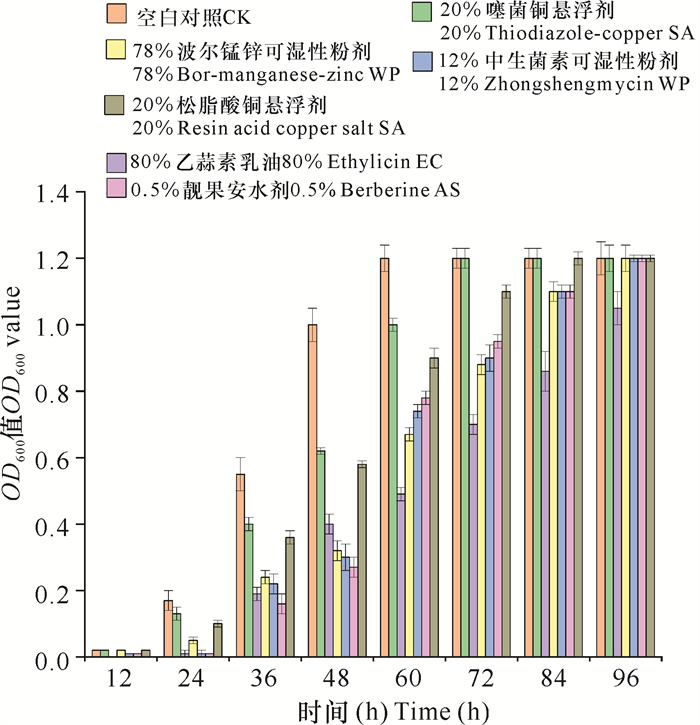
|
| 图 3 柑橘溃疡病菌在不同防治药剂EC50值下的生长变化 Fig. 3 Growth changes of X.citri subsp.citri under different bactericides EC50 values |
2.6 0.5%靓果安水剂和80%乙蒜素乳油的联合防治
由图 4可知,在48 h时加入80%乙蒜素乳油后,OD600值变化明显低于单一药剂;先施用0.5%靓果安水剂,后施用80%乙蒜素乳油的防治效果在72 h前略低于同时加入两种药剂的防治效果;72-96 h先施用0.5%靓果安水剂,后施用80%乙蒜素乳油的防治效果略高于同时加入两种药剂。

|
| 图 4 联合防治下柑橘溃疡病菌的生长变化 Fig. 4 Growth changes of X.citri subsp.citri under combined control |
3 讨论
研究表明,根据地理分布和对寄主植物的致病性差异将柑橘溃疡病菌分为A、B、C、D、E 5个菌系。其中,致病力最强的亚洲菌系为A菌系;B、C、D、E菌系分别发现于南美洲、巴西、墨西哥和美国佛罗里达州[5]。根据16s rDNA测序的差异,又将柑橘溃疡病菌分为3个亚种,即柑橘黄单胞柑橘亚种(X.citri subsp.citri,Xcc)、棕色黄单胞莱檬亚种(X.fuscans subsp.aurantifolii,Xfa)和苜蓿黄单胞枳柚亚种(X.alfalfae subsp.citrumelonis,Xac)。其中,柑橘黄单胞柑橘亚种为原A菌系和地毯黄单胞柑橘亚种(X.axonopodis subsp. citri)[22]。本研究结合病原菌生物学观察、生理生化特征和16 s rDNA鉴定确定分离出的病原菌为株柑橘黄单胞柑橘亚种A菌系,是中国柑橘溃疡病菌的主要类型,与赵洪涛等[11]的研究结果一致。
室内毒力是衡量药剂对有害生物毒力作用大小的指标之一[11]。本研究中防治药剂毒力测定结果表明,6种供试防治药剂中0.5%靓果安水剂的EC50值最小,为0.004 1 μg/mL,对柑橘溃疡病菌的防治效果更强;80%乙蒜素乳油次之;EC50值较大的是20%松脂酸铜悬浮剂和20%噻菌铜悬浮剂两种铜制剂,分别为18.80 μg/mL和26.60 μg/mL。覃旭[23]发现在14种药剂中,甲霜·锰锌对柑橘溃疡病菌的最小抑制浓度为0.039 1 mg/mL,抑菌效果最强;余沁涵[24]实验表明枯草芽孢杆菌的EC50值为5.28 g/L,抑菌活性更强,且对环境破坏较小;宋晓兵等[25]研究发现噻霉酮和氢氧化铜在室内毒力测定及田间施用试验中均具有较好的抑菌水平。此外,唑酮·乙蒜素等[10]防治药剂也具有较强的抑制柑橘溃疡病生长的作用,对柑橘溃疡病的防治有着重要的参考意义。为了进一步探究柑橘溃疡病菌防治药剂减量化施用,通过不同类型防治药剂的防治效果动态变化可以看出,48 h之前施用0.5%靓果安水剂防治效果更佳,80%乙蒜素乳油在48-96 h内防治效果更为显著。将两种防治药剂按顺序施用后,防治效果明显优于单一药剂,且在72 h前略低于同时加入两种药剂的防治效果,72 h后略高于同时加入两种药剂的防治效果,推断同时加入两种药剂处理72 h后80%乙蒜素乳油药效降低,需重新施加药剂。由于田间施用防治药剂的连续性,同时施加药剂会导致72 h后80%乙蒜素乳油药效降低,如果重新施加药剂,就会增加药剂的施用量,从而造成污染,因此本研究认为优先施用0.5%靓果安水剂,48 h后再施用80%乙蒜素乳油,120 h后重新施用0.5%靓果安水剂的施药方式更有利于实现防治药剂减量化。
已有研究表明,防治药剂的使用除少部分作用于目标病虫害外,其余大部分流失于土壤、水体和大气中,致使耕地和周边环境受到不同程度的污染,造成农药残留污染的农作物面积将近100%[26]。但在相当长一段时期内,化学防治依然是防治农作物病虫害、减少产量损失的重要手段。近年来,通过改良施药方式[27]、复配施药[28, 29]、添加辅助药剂[30]等多种防治药剂减量化方式,对水稻、玉米等作物的相关病害进行防控,实现降低污染、稳产增效的目标,因此探究防治药剂减量化方式将成为未来防治病虫害的发展趋势之一。
柑橘溃疡病一年有3个发病高峰期,春梢发病高峰在5月上中旬,夏梢发病高峰在6月中下旬,秋梢发病高峰在9月下旬至10月初,以6-7月的夏梢和晚夏梢受害最重,在发病高峰期采用轮流施药的方式,既可以有效防治柑橘溃疡病的发生,又可以减少防治药剂对土壤等环境的污染,降低对人体的危害,更符合绿色农业环境保护的要求, 对合理施用化学药剂防治病害具有现实意义。
| [1] |
MIRZAEI-NAJAFGHOLI H, AEINI M, TARIGHI S, et al. Comparing bacterial properties in relation to the virulence factors of Xanthomonas citri subsp. citri strains and evaluating resistance of subtribe Citrinae cultivars to the most virulent strain[J]. Journal of Plant Pathology, 2021, 103(2): 1-12. |
| [2] |
SUDYOUNG N, TOKUYAMA S, KRAJANGSANG S, et al. Bacterial antagonists and their cell-free cultures efficiently suppress canker disease in citrus lime[J]. Journal of Plant Diseases and Protection, 2020, 127(2): 173-181. DOI:10.1007/s41348-019-00295-9 |
| [3] |
LI Q, JIA R R, DOU W F, et al. CsBZIP40, a BZIP transcription factor in sweet orange, plays a positive regulatory role in citrus bacterial canker response and tolerance[J]. PLoS ONE, 2019, 14(10): e0223498. DOI:10.1371/journal.pone.0223498 |
| [4] |
SUN L F, NASRULLAH, KE F Z, et al. Citrus genetic engineering for disease resistance: Past, present and future[J]. International Journal of Molecular Sciences, 2019, 20(21): 5256. DOI:10.3390/ijms20215256 |
| [5] |
姚廷山, 周彦, 周常勇. 应用铜制剂防治柑橘溃疡病的研究进展[J]. 园艺学报, 2016, 43(9): 1711-1718. |
| [6] |
杨贵兵, 韩健, 李文星, 等. 柑橘溃疡病菌的侵染过程及噻森铜对溃疡病的防治效果[J]. 植物保护学报, 2021, 48(2): 322-331. |
| [7] |
王强锋, 朱彭玲, 夏中梅, 等. 三种农用抗生素降解真菌的筛选及其降解性能[J]. 农业资源与环境学报, 2018, 35(6): 533-539. |
| [8] |
郑绍军, 杨丹丹, 朱瑞, 等. 二氢噻唑类化合物的合成及其抑菌活性研究[J]. 江苏科技大学学报(自然科学版), 2018, 32(2): 277-284. |
| [9] |
张静, 王婷, 门正宇, 等. 颗粒物中苯并噻唑及其衍生物的污染特征及暴露评价[J]. 中国环境科学, 2020, 40(2): 851-856. DOI:10.3969/j.issn.1000-6923.2020.02.046 |
| [10] |
韦文添, 关明. 几种药剂对柑桔溃疡病菌的毒力和防治效果[J]. 广西农学报, 2017, 32(1): 21-24, 46. DOI:10.3969/j.issn.1003-4374.2017.01.005 |
| [11] |
赵洪涛, 陈东奎, 陈香玲, 等. 沃柑溃疡病病原菌分离鉴定及防治药剂筛选[J]. 南方农业学报, 2019, 50(12): 2703-2712. DOI:10.3969/j.issn.2095-1191.2019.12.11 |
| [12] |
李文, 何月秋, 王佳莹, 等. 百日草炭疽病病原菌的分离鉴定及防治药剂筛选[J]. 农药学学报, 2021, 23(2): 341-347. |
| [13] |
HOT J G, BERGEY D, H. Bergey's manual of determinative bacteriology[M]. Baltimore: Williams & Wilkins, 1994.
|
| [14] |
钱俊婷, 田茜, 陈青, 等. 进境柠檬样品上柑桔溃疡病菌的检测[J]. 植物检疫, 2015, 29(2): 48-51. |
| [15] |
CUBERO J, GRAHAM J H. Genetic relationship a- mong worldwide strains of Xanthomonas causing canker in citrus species and design of new primers for their identification by PCR[J]. Applied and Environmental Microbiology, 2002, 68(3): 1257-1264. DOI:10.1128/AEM.68.3.1257-1264.2002 |
| [16] |
刘利平. 柑橘溃疡病菌致病性影响因素的研究[D]. 长沙: 湖南农业大学, 2013.
|
| [17] |
PARKINSON N, COWIE C, HEENEY J, et al. Phylogenetic structure of Xanthomonas determined by comparison of gyrB sequences[J]. International Journal of Systematic & Evolutionary Microbiology, 2009, 59(Pt 2): 264-274. |
| [18] |
王中康, 孙宪昀, 夏玉先, 等. 柑桔溃疡病菌PCR快速检验检疫技术研究[J]. 植物病理学报, 2004, 34(1): 14-20. |
| [19] |
朱春雨, 吴新平, 袁善奎, 等. 农药室内生物测定试验准则杀菌剂第16部分: 抑制细菌生长量试验浑浊度法: NY/T 1156.16-2008[S]. 北京: 中华人民共和国农业部, 2008.
|
| [20] |
郑文君. 申嗪霉素对水稻白叶枯病菌和油菜菌核病菌的生物学活性及抗性风险评估[D]. 南京: 南京农业大学, 2010.
|
| [21] |
陈先锋, 张慧丽, 赵雷. 台湾柠檬上柑橘溃疡病菌的分离鉴定[J]. 浙江农业学报, 2017, 29(1): 101-105. |
| [22] |
SCHAAD N W, POSTNIKOVA E, LACY G, et al. Emended classification of Xanthomonas on citrus[J]. Systematic and Applied Microbiology, 2006, 29(8): 690-695. DOI:10.1016/j.syapm.2006.08.001 |
| [23] |
覃旭. 柑橘溃疡病防治药剂的研究[D]. 桂林: 广西师范大学, 2010.
|
| [24] |
余沁涵. 柑橘溃疡病菌分离鉴定、全基因组测序及防治药剂筛选[D]. 湛江: 广东海洋大学, 2020.
|
| [25] |
宋晓兵, 彭埃天, 崔一平, 等. 6种杀菌剂对柑橘溃疡病的室内毒力测定及田间防治效果评价[J]. 中国热带农业, 2020(2): 26-30. |
| [26] |
王宝义. 食品安全、消费者收入与高效生态农业发展[J]. 当代经济管理, 2016, 38(1): 23-30. |
| [27] |
易军, 符慧娟, 李星月, 等. 化学农药减量化措施对水稻病虫草害发生及产量的影响[J]. 中国生态农业学报, 2020, 28(12): 1913-1923. |
| [28] |
黄慧婧, 罗坤. 芽孢杆菌与杀菌剂复配防治植物病害的研究进展[J]. 微生物学通报, 2021, 48(3): 938-947. |
| [29] |
徐翔, 杨淞杰, 李维强, 等. 绿僵菌油悬浮剂与减量化学农药联用对冬玉米草地贪夜蛾的防控效果[J]. 中国生物防治学报, 2020, 36(4): 530-533. |
| [30] |
封云涛, 郭晓君, 李娅, 等. 三种助剂在减量化防治苹果黄蚜中的应用研究[J]. 果树学报, 2020, 37(3): 397-403. |



