2. 广西医科大学附属武鸣医院消化内科, 广西南宁 530199
2. Department of Gastroenterology, Wuming Hospital Affiliated to Guangxi Medical University, Nanning, Guangxi, 530199, China
肝癌是全世界常见的恶性肿瘤之一,是癌症患者死亡相关的第二大原因[1]。放射治疗是中晚期肝癌有效的治疗方式之一,因此,提高放射治疗的效果对于控制肝癌的进展具有重要意义。自噬是真核生物体内的一种促活机制,与肿瘤的发生发展密切相关。在恶劣的生存条件下自噬可促进肿瘤生长,也可在肿瘤发生时自噬诱导细胞死亡而发挥抑制肿瘤的作用[2]。研究表明,上皮-间充质转化(Epithelial-Mesenchymal Transition, EMT)在肿瘤的进展、侵袭转移和放化疗耐受中发挥着重要作用[3]。但目前自噬与EMT在肝癌细胞中的作用以及具体机制还不清晰。故本研究拟探讨自噬和EMT对照射过程中肝癌细胞侵袭迁移能力的影响及内在的分子机制,为提高肝癌放射治疗的效果提供新思路。
1 材料与方法 1.1 主要试剂人肝癌SMMC-7721细胞购自中南大学湘雅医学院;自噬激活剂雷帕霉素(Rapamycin)购自美国Sigma公司,自噬抑制剂3-甲基腺(3-MA)购自上海爱必信生物公司;抗体LC3B购自美国Abcam公司,N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)购自Cell signaling technology公司;β-actin购自美国Santa Cruz公司;DMEM高糖培养基、FBS购自美国GIBCO公司;青霉素和链霉素混合液、PBS缓冲液和DMSO购自北京Solarbio公司;ECL试剂盒购自美国Thermo Scientific公司。
1.2 细胞培养与处理肝癌SMMC-7721细胞用含有1%双抗和10%胎牛血清的DMEM培养基,在含有5% CO2、37℃恒温培养箱中培养。将肝癌SMMC-7721细胞分为6组,分别为阴性对照(NC)组、8 Gy X-线照射(IR)组、自噬激活剂雷帕霉素(Rapa)组、自噬抑制剂三甲基腺嘌呤(3-MA)组、照射+雷帕霉素(IR+Rapa)组和照射+甲基腺嘌呤(IR+3-MA)组。照射组SMMC-7721细胞给予直线加速器6MV-X 8 Gy照射剂量,照射视野40 cm×40 cm,X射线辐射装置(瑞典Elekta公司)。雷帕霉素药物浓度为20 nmol/L,3-MA药物浓度为8 mmol/L。
1.3 划痕实验取对数生长期细胞,用胰酶消化重悬,取适量细胞接种划痕插件小孔中,待细胞贴壁,加入不同的药物,预处理6 h,更换新鲜低血清培养基。将照射组细胞给予8 Gy照射,照射后与NC组细胞垂直拔掉划痕插件,在0 h、12 h和24 h时显微镜观察拍照,记录细胞划痕愈合面积。运用ImageJ软件计算各处理组不同时间点的划痕面积,并做统计分析。
1.4 Transwell实验取照射后的肝癌SMMC-7721细胞,随后用胰酶消化细胞,无血清培养基将细胞制成单细胞悬液,将800 μL含有10%血清的培养基加入24孔板中放入下室,随后将Transwell小室放入孔中。在上室中加入细胞悬液。将24孔板放置培养箱中静置24 h后取出小室,PBS清洗,用棉签擦掉上室未迁移的细胞。用4%的多聚甲醛固定膜上的细胞,固定结束后,PBS洗涤小室2次。结晶紫染色15 min,PBS清洗2次。用显微镜观察并拍照,随机选择3个视野,计算迁移细胞的个数,做统计分析。
1.5 CCK8实验取对数生长期细胞,制成细胞悬液,取100 μL/孔(每孔2 000个细胞)均匀种在96孔板中,每组5个复孔。待细胞贴壁后每孔加入不同的药物,处理6 h后或给予8 Gy的放射剂量照射,去掉上清液,每孔加入100 μL新鲜的培养基,在培养箱中继续培养24 h。每孔加10 μL的CCK8溶液,避免出现气泡,放置培养箱避光孵育1 h。孵育结束放置酶标仪检测450 nm波长下细胞的吸光度(OD)值。重复3次实验结果。根据公式计算细胞存活率:细胞存活率(%)=(实验组OD/对照组OD)×100%。
1.6 蛋白免疫印迹(Western blot)取处理后的肝癌SMMC-7721细胞,用RIPA裂解液裂解细胞,离心收集蛋白,测量蛋白浓度,用SDS-PAGE(12%)电泳分离蛋白,将蛋白转移到PVDF膜上,用TBST清洗PVDF膜3次,用快速封闭液封闭20 min,封闭清洗后加入一抗LC3B(1∶2 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、β-actin(1∶1 000)孵育4℃过夜,加入对应二抗后室温孵育1 h,使用增强型化学发光试剂(ECL)显色,用ImageJ进行定量分析。
1.7 统计学方法每个实验重复至少3次,采用SPSS17.0和GraphPad Prism 5.0进行统计分析作图。采用单因素方差分析,或独立性t检验进行数据组间分析。P < 0.05有统计学意义。
2 结果与分析 2.1 自噬对肝癌SMMC-7721细胞迁移能力的影响本课题组前期研究表明照射能诱导自噬激活[4]。划痕实验结果表明,与NC组相比,照射可促进肝癌细胞划痕面积愈合(P < 0.001);使用自噬激活剂和抑制剂处理肝癌细胞,与NC组相比,Rapa组可促进肝癌细胞划痕面积的愈合(P < 0.05),3-MA组可抑制肝癌细胞划痕面积的愈合(P < 0.001)。用自噬激活剂和抑制剂联合照射检测对细胞划痕愈合的影响,结果表明,与IR组相比,IR+Rapa组可促进细胞划痕面积的愈合(P < 0.05),IR+3-MA组可抑制细胞划痕面积的愈合(P < 0.001)(图 1)。

|
| 与对照组相比,*P < 0.05;**P < 0.005;***P < 0.001 *P < 0.05;**P < 0.005;***P < 0.001 compared with the control group 图 1 激活或抑制自噬对肝癌SMMC-7721细胞迁移能力的影响 Fig. 1 Effect of activation or inhibition of autophagy on migration of HCC SMMC-7721 cells |
2.2 自噬对肝癌SMMC-7721细胞侵袭能力的影响
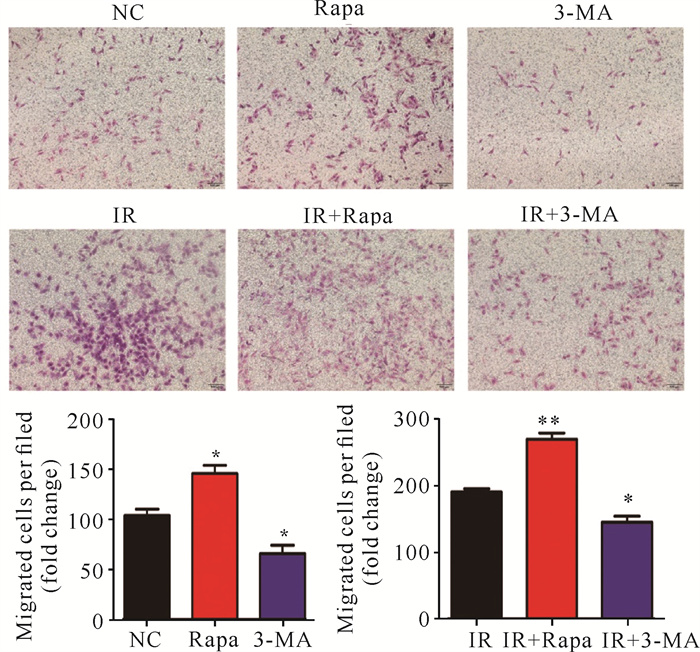
Transwell实验结果表明,与NC组相比,IR组可以增加细胞穿膜的数目(P < 0.05);使用自噬激活剂和抑制剂处理肝癌细胞,与NC组相比,Rapa组细胞穿膜数目增多(P < 0.05),3-MA组细胞穿膜数目显著降低(P < 0.05)。用自噬激活剂和抑制剂联合照射检测自噬对细胞侵袭能力的影响,结果表明,IR+Rapa可增加细胞穿膜的数目(P < 0.005),IR+3-MA可抑制细胞穿膜的数目(P < 0.05)(图 2)。
|
| 与对照组相比,*P < 0.05;**P < 0.005;***P < 0.001 *P < 0.05;**P < 0.005;***P < 0.001 compared with the control group 图 2 激活或抑制自噬对肝癌SMMC-7721细胞侵袭能力的影响 Fig. 2 Effect of activating or inhibiting autophagy on the invasive ability of HCC SMMC-7721 cells |
2.3 自噬激活剂和抑制剂对细胞增殖能力的影响
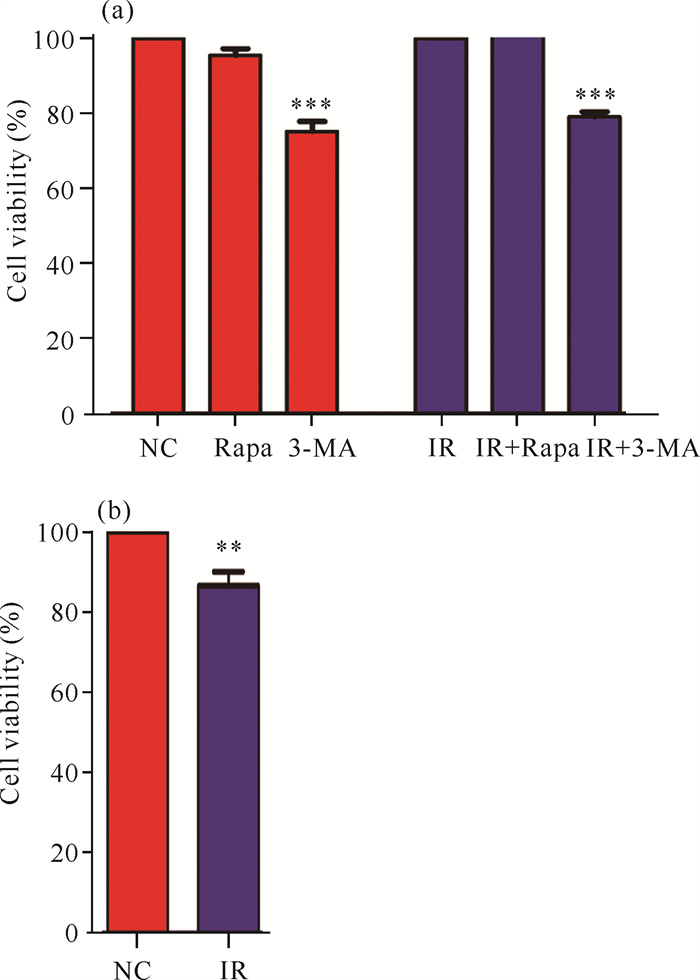
CCK8实验结果显示,NC组与Rapa组细胞存活率没有差异,可排除细胞增殖抑制对侵袭的影响。3-MA组出现轻微的增殖抑制情况(图 3)。照射组与未照射组相比,有细胞增殖抑制现象,而2.1节的实验结果提示照射可以增强细胞侵袭的能力,这种差异可能是放射诱导自噬激活引起的。
|
| 与对照组相比,*P < 0.05;**P < 0.005;***P < 0.001 *P < 0.05;**P < 0.005;***P < 0.001 compared with the control group 图 3 Rapamycin和3-MA对肝癌SMMC-7721细胞增殖活力的影响 Fig. 3 Effects of Rapamycin and 3-MA on the proliferation activity of hepatoma SMMC-7721 cells |
2.4 自噬对肝癌细胞侵袭迁移相关蛋白的影响
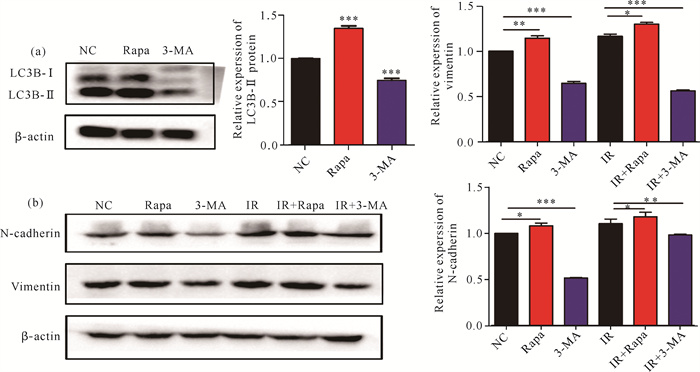
Western blot实验检测自噬标志蛋白LC3B,当用3-MA抑制自噬时,LC3B-Ⅱ蛋白表达明显下降(P < 0.005),雷帕霉素激活自噬时LC3B-Ⅱ蛋白表达增加(P < 0.005)。检测EMT相关标志物N-cadherin、Vimentin表达水平,与NC组相比,IR组N-cadherin、Vimentin表达增加(P < 0.05)。使用自噬激活剂和抑制剂分别处理肝癌SMMC-7721细胞,与NC组相比,Rapa组N-cadherin、Vimentin表达水平增加(P < 0.05),3-MA组N-cadherin、Vimentin表达水平下降(P < 0.05)。自噬激活剂和抑制剂联合照射,结果表明,与单纯照射组相比,IR+Rapa组可增加N-cadherin、Vimentin表达水平(P < 0.05),IR+3-MA组可抑制N-cadherin、Vimentin表达水平(P < 0.05)(图 4)。
|
| 与对照组相比,*P < 0.05;**P < 0.005;***P < 0.001 *P < 0.05;**P < 0.005;***P < 0.001 compared with the control group 图 4 激活或抑制自噬对肝癌SMMC-7721细胞EMT相关蛋白的影响 Fig. 4 Effects of activating or inhibiting autophagy on EMT related proteins in HCC SMMC-7721 cells |
3 讨论
手术切除是肝癌治疗的有效手段,然而大约70%的肝癌患者在诊断时已经是中晚期,失去了手术的机会[5]。放射治疗是中晚期肝癌有效的治疗方式,但是局部复发和远处转移是限制肝癌治疗效果的重要因素。因此,研究肝癌转移的分子生物学机制以及探寻能够提高肝癌细胞放射敏感性的方法,是目前肝癌的重要研究方向之一。
放射治疗是癌症治疗的常见手段,被广泛应用于多种恶性实体肿瘤。放射治疗直接通过电离辐射或产生活性氧间接造成DNA损伤,导致肿瘤细胞死亡[6]。然而,放射治疗可通过诱导EMT来增强癌细胞(如乳腺癌、肺癌和胶质瘤癌细胞[7])的转移和侵袭能力。EMT是一种上皮细胞极性消失、细胞间黏附下降、细胞获得间充质干细胞表型,从而促进细胞向周围及远处转移的过程。过程中伴随着上皮标志物, 如角蛋白丝、E-钙黏素(E-cadherin),表达降低; 同时,间质细胞相关标志物, 如波形蛋白(Vimentin)、纤维连接蛋白、N-钙黏蛋白(N-cadherin)和a-SMA等表达上调,这些标志物是检测EMT进程的重要指标[8]。有研究表明,EMT有利于肿瘤细胞向远处侵袭转移和抵抗肿瘤治疗[9]。信号转导和转录激活因子3 (STAT3)激活转化生长因子-β1(TGF-β1)诱导的EMT促进肝癌细胞迁移[10]。微小核糖核酸-183 (miR-183)介导EMT增加肺腺癌细胞放射抗拒[11]。
自噬是真核细胞内存在的一种分解代谢的过程,在维持细胞内稳态和预防多种疾病方面发挥作用[12]。以往研究表明自噬对肿瘤细胞的侵袭转移起重要作用,这与自噬和EMT之间的关系密切相关[13]。一方面,肿瘤细胞在EMT过程中依赖自噬激活生存;另一方面,自噬作为肿瘤抑制信号,阻碍了EMT转化和激活的早期阶段。因此,通过靶向自噬调节EMT对治疗肿瘤具有重要的意义[14]。通过调节自噬抑制非小细胞肺癌的EMT和转移[15];Cadherin-6通过抑制自噬促进EMT和甲状腺癌转移[16];Beclin-1是自噬相关蛋白,抑制Beclin-1表达可抑制自噬,进而显著降低结肠癌细胞的EMT和侵袭行为[17]。此外,饥饿诱导的自噬可以促进口腔鳞状细胞癌的上皮间质转换[18];miRNA-30a-3p下调ATG3介导的自噬,从而抑制肝癌细胞侵袭和转移[19]。以上研究表明,自噬和EMT在肿瘤细胞的侵袭转移和治疗中发挥重要作用,因此,探究肝癌细胞照射过程中自噬与EMT的关系,对提高肝癌细胞的放射敏感性具有重要意义。
本研究通过使用自噬激活剂Rapamycin和自噬抑制剂3-MA处理肝癌细胞,观察自噬对肝癌细胞侵袭转移能力的影响,结果表明3-MA抑制自噬时,肝癌细胞侵袭迁移的能力受到阻碍,抑制EMT转换;当自噬被Rapamycin激活时可增强肝癌细胞侵袭迁移的能力,促进EMT转化。X-线照射可抑制细胞增殖能力,同时增强肝癌细胞侵袭迁移的能力,诱导EMT转化。本研究前期实验结果表明,照射可激活自噬,照射联合自噬抑制剂能够抑制肝癌细胞侵袭迁移的能力;照射联合自噬激活剂时,肝癌细胞EMT进一步被诱导,说明自噬在照射诱导的EMT转化过程中起促进作用。因此,照射联合自噬抑制剂可以增加肝癌细胞的放射敏感性。
4 结论本研究通过Rapamycin和3-MA激活或抑制自噬,在照射或不照射的情况下观察肝癌SMMC-7721细胞侵袭迁移能力。结果表明,照射可激活肝癌细胞自噬,激活自噬能够增强细胞侵袭和迁移能力,促进肝癌细胞EMT转化;抑制自噬可抑制肝癌细胞侵袭和迁移能力,抑制EMT转化。因此,在肝癌的放射治疗过程中联合自噬抑制剂可抑制EMT形成,提高肝癌照射治疗的效果。
| [1] |
YANG JD, HAINAUT P, GORES G J, et al. A global view of hepatocellular carcinoma: Trends, risk, prevention and management[J]. Nature Reviews Gastroenterology & Hepatology, 2019, 16(10): 589-604. |
| [2] |
AMARAVADI R K, KIMMELMAN A C, DEBNATH J. Targeting autophagy in cancer: Recent advances and future directions[J]. Cancer Discovery, 2019, 9(9): 1167-1181. DOI:10.1158/2159-8290.CD-19-0292 |
| [3] |
PASTUSHENKO I, BLANPAIN C. EMT transition states during tumor progression and metastasis[J]. Trends in Cell Biology, 2019, 29(3): 212-226. DOI:10.1016/j.tcb.2018.12.001 |
| [4] |
张华颖, 刘鑫, 赵伟, 等. 自噬在肝癌SMMC-7721细胞DNA放射损伤修复中的影响[J]. 广西医科大学学报, 2021, 38(10): 1882-1886. |
| [5] |
FORNER A, REIG M, BRUIX J. Hepatocellular carcinoma[J]. Lancet (London, England), 2018, 391(10127): 1301-1314. DOI:10.1016/S0140-6736(18)30010-2 |
| [6] |
HUANG R X, ZHOU P K. DNA damage response signaling pathways and targets for radiotherapy sensitization in cancer[J]. Signal Transduction and Targeted Therapy, 2020(1): 1925-1951. |
| [7] |
LEE S Y, JEONG E K, JU M K, et al. Induction of metastasis, cancer stem cell phenotype, and oncogenic metabolism in cancer cells by ionizing radiation[J]. Molecular Cancer, 2017, 16(1): 10. DOI:10.1186/s12943-016-0577-4 |
| [8] |
卢镇宇, 温炬, 秦思, 等. 上皮-间质转化在皮肤肿瘤中的研究进展[J/OL]. 中国皮肤性病学杂志, 2022, 36: 1-7[2021-12-10]. https://kns.cnki.net/kcms/detail/detail.aspx?FileName=ZBFX20210721005&DbName=DKFX2021.DOI: 10.13735/j.cjdv.1001-7089.202103021.
|
| [9] |
吴诗熳, 姚振威. EMT和肿瘤干细胞对鼻咽癌放射治疗抵抗的机制探讨[J]. 影像研究与医学应用, 2018, 2(23): 1-3. DOI:10.3969/j.issn.2096-3807.2018.23.001 |
| [10] |
WANG B, LIU T, WU J C, et al. STAT3 aggravates TGF-β1-induced hepatic epithelial-to-mesenchymal transition and migration[J]. Biomedicine & Pharmacotherapy=Biomedicine & Pharmacotherapie, 2018, 98: 214-221. |
| [11] |
杨泽. miR-183介导EMT在肺腺癌细胞放射抗拒中的作用探讨[D]. 贵州: 遵义医学院, 2017.
|
| [12] |
WHITE E. The role for autophagy in cancer[J]. The Journal of Clinical Investigation, 2015, 125(1): 42-46. DOI:10.1172/JCI73941 |
| [13] |
GBA B, GGA A, NZZJ A. EMT, cancer stem cells and autophagy; The three main axes of metastasis[J]. Biomedicine & Pharmacotherapy=Biomedicine & Pharmacotherapie, 2021, 133: 110909. DOI:10.1016/j.biopha.2020.110909 |
| [14] |
CHEN H T, LIU H, MAO M J, et al. Crosstalk between autophagy and epithelial-mesenchymal transition and its application in cancer therapy[J]. Molecular Cancer, 2019, 18(1): 101. DOI:10.1186/s12943-019-1030-2 |
| [15] |
XU C X, CAO H X, SUI Y, et al. CDCA4 suppresses epithelial-mesenchymal transtion (EMT) and metastasis in non-small cell lung cancer through modulating autophagy[J]. Cancer Cell International, 2021, 21(1): 48. DOI:10.1186/s12935-021-01754-w |
| [16] |
GUGNONI M, SANCISI V, GANDOLFI G, et al. Cad- herin-6 promotes EMT and cancer metastasis by restraining autophagy[J]. Oncogene, 2017, 36(5): 667-677. DOI:10.1038/onc.2016.237 |
| [17] |
SHEN H, YIN L, DENG G, et al. Knockdown of Be- clin-1 impairs epithelial-mesenchymal transition of colon cancer cells[J]. Journal of Cellular Biochemistry, 2018, 119(8): 7022-7031. DOI:10.1002/jcb.26912 |
| [18] |
陈洋, 尚政军. 自噬促进口腔鳞状细胞癌的上皮间质转化[J]. 口腔颌面外科杂志, 2020, 30(5): 285-287. DOI:10.3969/j.issn.1005-4979.2020.05.004 |
| [19] |
杜晨阳, 张建军, 王振, 等. miRNA-30a-3p下调Atg3介导的自噬抑制肝癌细胞侵袭和转移[J]. 中华普通外科杂志, 2018, 33(4): 334-337. DOI:10.3760/cma.j.issn.1007-631X.2018.04.017 |



